基于登革病毒prME序列mRNA候选疫苗的构建与评价
2022-12-14侯宝华范东瀛
侯宝华,范东瀛,高 娜,陈 辉,2,安 静,3
登革病毒(Dengue virus,DENV)隶属于黄病毒科黄病毒属,主要由埃及伊蚊和白纹伊蚊进行传播,在热带和亚热带地区广泛分布。DENV包含4种血清型(DENV1-4),每种血清型均可导致严重的临床疾病,其引起的登革热被WHO列为疾病负担增长最快的病种之一,因而亟需安全有效的疫苗用于登革热的特异性防控[1]。
DENV为有包膜的单股正链RNA病毒,基因组全长约11 kb,可编码衣壳蛋白(capcid protein,C)、前膜蛋白(precursor membrane protein, prM)、包膜蛋白(envelope protein,E)3种结构蛋白和7种非结构蛋白(non-structural protein,NS)。其中E蛋白为病毒吸附蛋白,在病毒入侵宿主细胞的过程中发挥着重要作用,prM蛋白为E蛋白成熟所必需。prM和E蛋白经抗原递呈细胞(antigen-presenting cell,APC)摄取加工并由MHC-Ⅱ分子递呈给B细胞后,可诱导机体产生抗体;另外,E蛋白含有T细胞表位,可诱导产生特异性细胞毒性T细胞(cytotoxic T lymphocyte,CTL),清除胞内病毒。因此,prM和E蛋白是登革热疫苗研发的主要靶抗原[2-3]。
mRNA疫苗是一种相对新型的疫苗研发技术,与传统疫苗相比,具有很多独特的优点:首先,没有外源性DNA整合于宿主细胞基因组的潜在风险,安全性好;其次,制备方法通用且与靶标无关,单一的 mRNA 疫苗可编码多种抗原,能以单一配方靶向多种微生物或病毒变体;再次,以无细胞方式制造,生产快速、可扩展,具有成本效益。
由于mRNA稳定性差、极易被降解,且引起细胞过度的免疫反应,早期其应用未得到推广[4]。近年来,随着对mRNA药理学、递送载体和免疫原性的控制等方面的深入研究,基于mRNA的治疗手段日趋成熟[5]。目前已有2种mRNA疫苗获得FDA紧急授权使用。其中,新冠肺炎BNT162b2 mRNA疫苗免疫2剂后4个月内的保护效力保持在90%以上,表明其高效性[6]。我国艾博生物、军科院、沃森生物共同研制的新冠肺炎mRNA疫苗也已处于三期临床试验阶段[7]。
mRNA疫苗采用多种技术手段提升免疫效力。在体外合成mRNA的过程中,模拟天然真核mRNA结构在mRNA序列内引入5′端帽结构、5′端非编码区(5′UTR)、3′UTR、多聚腺苷酸(poly(A))尾、修饰核苷等元素,是防止mRNA疫苗降解、提高转译效果的重要手段[8]。此外,mRNA无法以自由扩散的方式穿过细胞膜,因而高效的递送载体是降低mRNA降解、提高转染效率的重要技术保障。mRNA的递送载体有脂质纳米颗粒(lipid nanoparticle,LNP)、聚合物纳米颗粒、富含精氨酸的蛋白肽、病毒样复制子颗粒和阳离子纳米乳液等[9]。其中,LNP中的亲水基团将mRNA包裹于核心位置,保护其不被核酸酶降解;同时,其脂质成分易与宿主细胞膜融合,进而以内吞的方式将mRNA传递至胞内,提高转染效率,因此在临床上的应用最广泛[10]。
本研究选择DENV1的prM、E序列作为靶基因,探索设计登革热mRNA候选疫苗;利用LNP作为递送载体,通过免疫C57BL/6小鼠,评价其免疫原性,并通过DENV1攻毒实验评价其特异性保护效应,以期为登革热疫苗研发提供实验依据和新的技术参考。
1 材料与方法
1.1 材 料
1.1.1 毒株 DENV1 Hawaii株(GenBank序列号:EU848545)由广东省疾病预防控制中心惠赠,以C6/36细胞增殖,空斑法利用Vero细胞检测病毒滴度。
1.1.2 动物 6~8周龄雌性近交系C57BL/ 6小鼠(SPF级)购自北京维通利华实验动物技术有限公司,饲养于感染动物实验室独立通气笼。所有动物实验均遵从《实验动物管理条例》,并由首都医科大学动物实验及实验动物福利委员会批准(伦理编号:AEEI-2019-050)。
1.1.3 质粒 含DENV1目的基因prME的重组质粒pVAX1-D1ME由本实验室构建,目的基因D1ME为EU848545的438 bp到2 420 bp,长度1 983 bp。
1.2 方 法
1.2.1 mRNA体外合成
1.2.1.1 体外合成mRNA模板质粒制备 选用pUC57-Kan克隆质粒为载体,用EcoRI和BamHI限制性内切酶将体外合成mRNA所需元件克隆至其lacZa操纵子内,依次为T7 RNA聚合酶启动子、5′UTR、kozak序列、IgE信号肽、3′UTR(源自α1珠蛋白基因)。随后,用引物对1(引物序列见表1)在IgE信号肽和3′UTR之间将质粒载体线性化,用引物对2将pVAX1重组质粒中的目的基因D1ME线性化,并在其两端引入线性化载体末端同源序列。最后,在一步法快速克隆试剂盒(Yeasen Biotech,中国)的重组酶催化下重组目的片段和载体,完成目的基因到IgE信号肽和3′UTR之间的克隆,将携带目的基因的重组质粒命名为pUCK-D1ME(图1)。用通用引物M13-F、M13-R对重组质粒进行测序鉴定。

表1 构建pUCK-D1ME及体外合成mRNA所用引物Tab.1 Sequences of primers used in the construction of the pUCK-D1ME plasmid and in vitro synthesis of mRNA
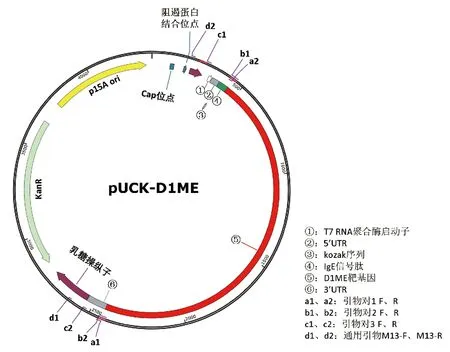
注:①~⑥为体外合成mRNA所需元件;a1a2~d1d2为各引物序列所处位置。图1 pUCK-D1ME克隆质粒组成元件Fig.1 Components of the pUCK-D1ME plasmid
1.2.1.2 模板质粒扩增、提取 以42 ℃热激法将pUCK-D1ME质粒转化至DH5α感受态,以卡那霉素筛选阳性菌落,以引物对3进行PCR鉴定后,用NucleoBond Xtra Maxi试剂盒(MACHEREY-NAGEL,德国)以碱裂解法提取、纯化菌液中的重组质粒,以进行mRNA的后续制备。
1.2.1.3 体外合成mRNA 以pUCK-D1ME质粒为模板,用高保真DNA聚合酶(TaKaRa,日本)、引物对3扩增体外转录(invitrotranscription,IVT)所需的线性化模板。琼脂糖凝胶电泳后,用硅胶膜胶回收试剂盒(promega,美国)回收线性化模板,用20 μL无核酸酶水洗脱。在IVT试剂盒(NEB,美国)中的T7 RNA聚合酶作用下将此模板转录为RNA,其中UTP全部用假尿嘧啶核苷酸(TriLink Biotechnologies,美国)替代,以降低RNA自身的免疫原性,37 ℃温育2 h;用DNaseⅠ(NEB,美国)将转录产物中的DNA模板降解,37 ℃温育15 min;向转录产物中加入LiCl,使其终浓度为2.5 mol/L,-30 ℃沉淀1 h,4 ℃、16 000× g离心30 min使RNA沉淀,用1 mL 70%乙醇将RNA清洗1次,4 ℃、16 000×g离心4 min,最后用DEPC处理水溶解RNA,将产物命名为IVT-D1ME。
用牛痘病毒加帽酶(NEB,美国)、mRNA帽结构2′-O-甲基转移酶(NEB,美国)在RNA 5′端加入cap1帽结构(m7Gpppm2′NpNp),37 ℃温育1 h,经LiCl沉淀后用DEPC处理水溶解。用E.colipoly(A)聚合酶(NEB,美国)在RNA 3′端加入100个左右的腺嘌呤核糖核苷酸以形成poly(A)尾,37 ℃温育30 min,经LiCl沉淀后用DEPC处理水溶解。将体外合成的mRNA命名为D1ME-mRNA。
1.2.2 LNP制备及mRNA包裹 以无水乙醇作为乳化剂,按照50∶10∶38.5∶1.5的浓度比溶解阳离子脂质体D-Lin-MC3-DMA(Medchemexpress,美国)、二硬脂酰基磷脂酰胆碱(DSPC,Avanti Polar Lipids,美国)、胆固醇(Sigma,美国)、二肉豆蔻酰甘油-聚乙二醇2000(DMG-PEG2000,Avanti Polar Lipids,美国)4种脂质,混匀后以10 μL/次的速度将其缓慢加入50 mmol、pH=4.0的柠檬酸盐缓冲液中,充分搅拌使其自然乳化,至乳化液中乙醇的体积分数为30%。随后在密闭的挤出器(Avestin LF1,Canada)中用80 nm的滤膜反复挤出水合后的脂质溶液约20次,使其纳米化,制备LNP。
同样方法将D1ME-mRNA加入含乙醇的柠檬酸盐缓冲液,并加入LNP中充分搅拌,至mRNA与脂质的质量比为0.05。42 ℃温育1 h,使mRNA与LNP中的D-Lin-MC3-DMA通过电荷间的相互作用力充分结合,从而被包裹进LNP中,命名为D1ME mRNA-LNP。PBS中透析过夜,用超滤管浓缩,经0.45 μm的滤膜除菌后储存于4 ℃备用。
1.2.3 流式细胞术检测mRNA表达 利用2 μL lipo2000(invitrogen,美国)将500 ng mRNA转染至2×105个HEK293T细胞,37 ℃培养18~24 h。PBS清洗转染后的细胞,用破膜固定剂固定、通透;1∶3稀释的4G2杂交瘤细胞培养上清作为一抗,4 ℃孵育30 min;洗液清洗后,1∶1 000稀释的AF488标记的驴抗鼠IgG(Abcam,英国)作为二抗,4 ℃避光孵育30 min,PBS清洗及重悬,在DxFLEX流式细胞仪(Beckman,美国)中计数阳性细胞。
1.2.4 免疫荧光检测mRNA表达 利用2 μL lipo2000将500 ng mRNA转染至24孔板内的Vero细胞,37 ℃培养18~24 h。PBS清洗细胞后,4%多聚甲醛室温固定15 min;清洗后,0.3% Triton X-100室温通透5 min;清洗后,3%牛血清白蛋白液室温封闭1 h;清洗后,1∶3稀释的4G2杂交瘤细胞培养上清作为一抗,4 ℃孵育过夜;PBS清洗后,1∶1 000稀释AF488标记的驴抗鼠IgG作为二抗,室温避光孵育1 h;PBS清洗后,1∶1 000稀释DAPI荧光封片剂(中杉金桥,中国),室温避光孵育5 min,置荧光显微镜下观察。
1.2.5 LNP粒径分析 使用经0.22 μm滤器抽滤的0.1 mmol/L PBS稀释LNP,加入四通光的石英比色皿中,终浓度最低为0.1 mg/mL,在Zeta电位及粒度分析仪(Brookhaven PALS 90plus,美国)中用动态光散射的方法检测室温时90°检测角上的流体力学直径。同一样本重复测量3次。
1.2.6 包封率检测 用含有1% Triton X-100的TE缓冲液破坏含有0.5 μg D1ME-mRNA的LNP,RNA浓度为1 μg/mL,42 ℃温育15 min,作为A组;取同剂量D1ME-mRNA LNP用TE缓冲液稀释至1 μg/mL,42 ℃温育15 min,作为B组。在96孔板中梯度稀释1 μg/mL、500 ng/mL及100 ng/mL 3个稀释度,每孔加入100 μL 200倍稀释的RiboGreen RNA染料(invitrogen,美国),混匀,室温避光孵育5 min。在化学发光仪上检测各稀释度的样本经480 nm激发光激发后在520 nm波长下的荧光强度,根据标准曲线计算各孔对应的mRNA浓度,包封率(%)=(mRNAA-mRNAB)/mRNAA×100%。
1.2.7 小鼠免疫及取材 免疫时,向小鼠双后肢股四头肌注射(Intramuscular,i.m.)共10 μg D1ME mRNA-LNP候选疫苗,对照组小鼠注射同剂量LNP;于首次免疫后3周进行加强免疫,于末次免疫后2周取脾、末次免疫后3周取血以评价疫苗免疫原性,于末次免疫后3周进行动物保护实验以评价疫苗保护性。
1.2.8 噬斑减少中和试验(plaque reduction neutralization test,PRNT)检测血清DENV1中和抗体(neutralizing antibody,NAb) 将Vero细胞传代至24孔板,37 ℃、5% CO2培养过夜。血清经56 ℃温育30 min灭活补体后,用含2%胎牛血清的MEM维持液进行2倍比稀释;向血清稀释液中加入等体积DENV1稀释液,每孔150噬斑形成单位(plaque-forming unit,PFU),37 ℃温育1 h;用MEM维持液清洗细胞后,每孔加入200 μL血清病毒混合液,37 ℃感染1 h;每孔加入3 mL 1.05%甲基纤维素-MEM覆盖培养基,37 ℃、5% CO2继续培养至噬斑形成;拍净培养基后,以饱和结晶紫染液室温染色30 min,流水洗净后自然干燥。计数噬斑数目,以样本孔比37 ℃孔噬斑数量减少50%的最大稀释度计算效价,将每个样本的原孔及复孔效价的几何平均滴度记为该样本的NAb效价,即PRNT50。
1.2.9 酶联免疫斑点法(enzyme-linked immunospot assay,ELISPOT)检测脾细胞分泌细胞因子 根据试剂说明书,将捕获抗体加入已润湿ELISPOT板(BD,美国)中,4 ℃包被过夜;脱椎处死小鼠后,无菌取小鼠脾脏,分离脾淋巴细胞(达科为,中国)、裂解红细胞(BD,美国)以制备脾淋巴细胞悬液;用含10%胎牛血清的RPMI-1640培养基封闭非特异位点后,每孔加入4×105~1×106个细胞,以DENV1 Hawaii株prME区域细胞表位的相应肽段为刺激物,每条肽段的终浓度为5 μg/mL,以不加刺激物的细胞为阴性对照,37 ℃、5% CO2、99%湿度孵育48 h。充分清洗后,加入生物素化检测抗体(BD,美国),室温孵育2 h;充分清洗后,加入HRP酶标亲和素(BD,美国),室温孵育1 h;充分清洗后,加入底物3-氨基-9-乙基咔唑(BD,美国),室温孵育至出现肉眼可见斑点后吸出显色液,终止显色过程;充分清洗、自然晾干后,使用自动酶联斑点图像分析仪(Cellular Technology Ltd.,美国)进行计数,以每2×105个脾细胞产生的斑点形成单位(spot forming unit,SFU)表示。
1.2.10 保护性实验 末次免疫C57BL/6小鼠后3周,用二段针于小鼠颅骨骨缝处向颅内注射(Intracerebral,i.c.)1×106PFU的DENV1液,连续观察攻毒后21 d小鼠的发病情况,并记录体重,以其占初始体重的百分比计算体重变化幅度。
1.2.11 统计学方法 采用SPSS 21.0软件进行统计学分析。体重变化数据采用重复测量方差分析,疫苗免疫与时间变量之间无交互效应;PRNT及ELISPOT实验数据采用两独立样本t检验分析,检验水准α=0.05。
2 结 果
2.1 体外合成D1ME-mRNA 将重组质粒pUCK-D1ME进行测序,结果表明,目的片段基因序列正确且插入方向无误。将重组质粒转化至E.coliDH5α菌株内,在菌株内扩增并提取重组质粒后,使用PCR法制备IVT的线性化模板。琼脂糖凝胶电泳检测结果显示,PCR扩增片段长度在(2~3) kb,与预期(2.256 kb)相符(图2a)。经体外转录将线性化模板转录为IVT-D1ME,并给RNA加帽及加尾后合成D1ME-mRNA。经琼脂糖凝胶电泳鉴定mRNA完整性,结果显示,大部分mRNA在(2~3) kb,与预期(2.297 kb)相符(图2b)。

a. 电泳分离PCR扩增的体外转录模板;b.电泳鉴定D1ME-mRNA完整性。a、b均为普通琼脂糖凝胶电泳,浓度分别为1%、3%。图2 琼脂糖凝胶电泳鉴定体外合成的D1ME-mRNAFig.2 Identification of D1ME-mRNA by agarose gel electrophoresis
2.2 D1ME-mRNA的表达鉴定
2.2.1 流式细胞术鉴定D1ME-mRNA在HEK293T细胞中的表达 为检测D1ME-mRNA在真核细胞中的表达情况,利用流式细胞术检测D1ME-mRNA在HEK293T细胞胞内的瞬时表达情况。结果如图3a,D1ME-mRNA转染组有49%的阳性细胞,证明D1ME-mRNA可正常表达目的蛋白prME,并可被4G2抗体识别并结合。
2.2.2 间接免疫荧光染色鉴定mRNA在Vero细胞中的表达 利用间接免疫荧光染色检测D1ME-mRNA在Vero细胞胞内的瞬时表达情况,结果如图3b,D1ME-mRNA组的胞质呈现广泛的绿色荧光,而阴性对照则无绿色荧光,进一步证明D1ME-mRNA可正常表达目的蛋白prME,并可被4G2抗体识别并结合。
2.3 LNP制备及D1ME mRNA-LNP疫苗理化性质检测 用D-Lin-MC3-DMA、DSPC、胆固醇、C14-PEG-2000 4种脂质构建LNP后,在粒度及Zeta电位分析仪中用动态光散射的方法检测室温时90°检测角上的流体力学直径,采用CONTIN分析模型将数据转化为LNP粒径正态分布曲线,结果显示,3次检测的LNP流体力学直径在135.85 ~136.64 nm,多分散度(polydispersity)为0.198~0.207(图3c)。
Triton X-100破坏D1ME mRNA-LNP候选疫苗后,用RNA荧光染料检测破坏前和破坏后mRNA的含量。经计算可知,LNP包裹D1ME-mRNA的效率为60%。

注:a为流式细胞术鉴定D1ME-mRNA在HEK293T细胞中的表达;b为间接免疫荧光染色鉴定D1ME-mRNA在Vero细胞中的表达;c为粒度及Zeta电位分析仪检测LNP流体力学直径,同一样本检测3次。图3 D1ME-mRNA的表达鉴定及LNP粒径检测Fig.3 Identification of D1ME-mRNA expression and detection of LNP particle size
2.4 D1ME mRNA-LNP候选疫苗的保护性及免疫原性评价
2.4.1 动物保护实验结果 小鼠免疫程序如图4a,于首次免疫后3周进行加强免疫。二次免疫后3周,颅内注射攻毒,检测之后21 d小鼠的体重变化(图4b)。攻毒后,LNP对照组小鼠逐渐出现弓背、耸毛、行动迟缓等发病症状,随着时间延长症状逐渐恢复;疫苗组小鼠无明显发病症状。LNP对照组小鼠平均体重在DENV1攻毒后第7 d出现较为明显下降,第12 d时平均体重达到最低值,为攻毒前的88%,个别小鼠下降幅度达15%。而D1ME mRNA-LNP候选疫苗组小鼠体重呈现下降趋势,平均体重为攻毒前的91%,显著小于对照组。经重复测量方差分析,疫苗组的体重变化与对照组相比,差异有统计学意义(F=6.716,P=0.049),说明D1ME mRNA-LNP候选疫苗经2剂次10 μg免疫后,可保护小鼠抵抗DENV1的感染。
2.4.2 血清NAb水平 2次免疫后3周,小鼠血清中抗DENV1 NAb的检测结果如图4c。结果表明,D1ME mRNA-LNP候选疫苗组小鼠的NAb几何平均效价为1∶20,高于对照组(t=7.319,P<0.001),说明疫苗可诱导小鼠产生一定水平的NAb。
2.4.3 脾淋巴细胞分泌IFN-γ、TNF-α、IL-4、IL-5的水平 2次免疫后2周,小鼠脾淋巴细胞经肽段刺激后产生IFN-γ、TNF-α、IL-4、IL-5的水平如图4 d。结果表明,D1ME mRNA-LNP候选疫苗组小鼠每2×105个脾细胞分泌的IFN-γ平均斑点数为181,TNF-α平均斑点数为45.2,IL-4平均斑点数为14.4,IL-5平均斑点数为0.36。与对照组相比,疫苗组IFN-γ(t=5.689,P=0.000 5)、TNF-α的水平明显升高(t=4.932,P=0.001 1),而IL-4(t=1.590,P=0.150 6)、IL-5(t=0.057 3,P=0.955 7)的差异无统计学意义。由于IFN-γ和TNF-α主要由Th1型细胞产生,参与诱导适应性免疫应答中的细胞免疫应答,IL-4和IL-5主要由Th2型细胞产生,参与诱导适应性免疫应答中的体液免疫应答[11],结合中和抗体检测结果,提示2次免疫D1ME mRNA-LNP候选疫苗更倾向于诱导高水平的细胞免疫应答。

注:a为小鼠免疫、取材及攻毒流程示意图;b为攻毒后21 d小鼠体重变化情况(n=6);c为二次免疫后小鼠血清中抗DENV1 NAb水平(n=5);d为二次免疫后小鼠脾淋巴细胞经抗原刺激产生IFN-γ、TNF-α、IL-4、IL-5的水平(n=5)。*:P<0.05;**:P<0.01;***:P<0.001。图4 D1ME-LNP候选疫苗在C57BL/6小鼠体内实验流程及保护性、免疫原性评价Fig.4 In vivo evaluation of immunogenicity and protective effects of the D1ME-LNP vaccine candidate in a C57BL/6 mouse model
3 讨 论
目前,已处于临床试验阶段的登革热疫苗包括灭活疫苗、减毒活疫苗、DNA疫苗及亚单位疫苗等[12]。其中,以黄热病毒-17D减毒株为骨架、DENV1-4型prM、E序列为靶标的嵌合体减毒活疫苗Dengvaxia○R已于2015年在墨西哥上市,并在多个国家取得许可,但它仅能对9岁及以上年龄的人群产生较好的保护效应,并且可导致在接种疫苗前DENV血清抗体为阴性的志愿者在感染DENV时的住院率增高[13-14]。登革热DNA疫苗TVDV的一期临床试验表明,其免疫原性不理想,与DNA疫苗免疫原性较低的特性一致[15]。DENV独特的抗体依赖性感染增强现象也使登革热疫苗的研发处于瓶颈[16-17]。因而仍需开发更安全、有效的新型登革热疫苗。
本研究以DENV1 Hawaii株的prM、E序列为靶基因,搭建了非复制型mRNA疫苗在实验室规模上的制造平台,通过IVT、加帽及加尾3歩流程在体外合成mRNA,并经流式细胞术和间接免疫荧光验证了其在细胞内的高效表达能力;同时通过LNP递送系统,在C57BL/6小鼠模型中评价了其2次免疫时的免疫原性及保护性。
本研究所搭建的mRNA疫苗制造平台较简单,适合大部分实验室开展相关实验。首先,在mRNA疫苗的制备过程中,由于mRNA为单链且极易被降解,所以在IVT、加帽、加尾过程中应尽量减少其冻融,并将制备好的mRNA或中间产物冻存于-80 ℃,以降低可能存在的RNase的活性。另外,在体外合成mRNA时需严格防范RNase污染,例如在各反应体系中加入RNase抑制剂,在超净台等密闭环境中进行操作,使用RNase去污剂去除操作环境中的RNase以及使用无核酸酶水等。在LNP的制备过程中,按照正确比例配制各脂质组分至关重要,否则将难以形成澄清的脂质纳米液。
免疫评价结果表明,二次免疫10 μg条件下,D1ME mRNA-LNP候选疫苗可保护小鼠抵抗DENV1的感染,并诱导有限的体液免疫应答、高水平的细胞免疫应答,说明该疫苗提供的免疫保护作用主要由特异性细胞免疫应答介导。类似的低体液免疫应答也同样出现在基于RBD-T4f的mRNA疫苗免疫效果中,高或低剂量的复制型mRNA疫苗和非复制型mRNA疫苗均没能诱导高水平的体液免疫,仅聚合物脂质纳米颗粒包裹的mRNA疫苗以30 μg免疫3次,才诱导滴度为1∶100的中和抗体活性[18]。有研究表明,mRNA疫苗可诱导较强的细胞免疫应答[19]。mRNA经LNP递送后,以内吞形式进入胞内,表达的蛋白经细胞内的蛋白酶体降解后形成内源性抗原,由MHCⅠ类分子递呈给CTL,可诱导更强的CD8+T细胞应答[20-21]。与我们的实验结论相符,一项同样以DENV1prM、E序列为靶基因的mRNA疫苗研究表明,二剂次10 μg该疫苗免疫后可使免疫缺陷小鼠抵抗DENV1的致死性攻击[22]。
本研究完成了一种新型登革热mRNA候选疫苗的构建和效果的初步评估,在未来研究中可在LNP组分中引入甘露糖基团等靶向修饰以提高mRNA转染效率[23],进一步优化这一技术路线;另外,探究细胞免疫应答在保护性实验中的作用也是mRNA疫苗保护机制研究中不可缺少的组成部分。我们期望本研究能为登革热疫苗的研发提供参考。
本研究获得上海市公共卫生临床中心转化条线技术研发部金侠研究员和张梦玲博士提供的技术指导,在此致以诚挚的谢意。
利益冲突:无
引用本文格式:侯宝华,范东瀛,高娜,等. 基于登革病毒prME序列mRNA候选疫苗的构建与评价[J]. 中国人兽共患病学报,2022,38(11):947-955. DOI:10.3969/j.issn.1002-2694.2022.00.150
