紫贻贝粗多糖免疫活性研究
2022-12-13韩莹曲有乐
韩莹 曲有乐
1(山西药科职业学院,山西太原 030000)
2(浙江海洋大学,浙江舟山 316000)
将紫贻贝粗多糖以不同剂量浓度给小鼠灌胃,以环磷酰胺模型组和正常组小鼠为对照,比较不同组间小鼠的免疫器官重量、小鼠血常规、IL-2、IL-4、IL-10、TNF-α 的差别,分析紫贻贝多糖对不同免疫因子的影响。
1 材料和设备
1.1 材料
Balb/c 小鼠,体重在18 g~22 g,雄性,购于浙江省医学科学院。饲养条件:25 ℃左右,每12 h昼夜间断性照明。
紫贻贝粗多糖,由本课题组提取,除去蛋白总糖含量为62.8%。
1.2 试剂
环磷酰胺、白细胞介素2(IL-2)ELISA 试剂盒、白细胞介素4(IL-4)ELISA 试剂盒、白细胞介素10(IL-10)ELISA 试剂盒、肿瘤坏死因子(TNF-α)ELISA 试剂盒,北京四正柏生物科技有限公司。
1.3 仪器与设备
BT125D 电子天平,塞利多斯科学仪器有限公司;THERMO酶标仪,上海辅泽商贸有限公司。
2 试验方法
2.1 免疫抑制模型的建立
2.1.1 小鼠分组
将Balb/c 小鼠在清洁安静温度适宜的动物房适应性饲养3 天后取50 只,雄性,体重在18 g~22 g,随机分成5 组,每组10 只,即为空白对照组、紫贻贝粗多糖低剂量、紫贻贝粗多糖中剂量、紫贻贝粗多糖高剂量和环磷酰胺模型。
2.1.2 给药方法
用左手抓紧小鼠背部和头部的皮毛,使其固定,并使其头部后仰,与身体成水平直线,将针头自口腔右侧沿上颚垂直缓慢下行,灌药0.2 mL,观察小鼠呼吸正常与否。
2.1.3 造模
空白组小鼠每只每天注射0.2 mL 0.9%的生理盐水,模型组小鼠前11 天每天每只注射0.2 mL 0.9%生理盐水。低剂量多糖组每天注射125 mg/kg紫贻贝粗多糖溶液,中剂量组多糖组每天注射250 mg/kg紫贻贝粗多糖溶液,高剂量多糖组每天注射500 mg/kg紫贻贝粗多糖溶液。第12 天,采用皮下注射方式,给多糖组和模型组每只小鼠每天注射0.1 mL 50 mg/kg的环磷酰胺,连续注射3天。
2.2 紫贻贝粗多糖对免疫抑制小鼠血液中白细胞数的影响
2.2.1 采血
采血前12 h 禁食,采血1 h 前禁水,每组任意选3 只小鼠采血,选用眼球摘除采血法采血。摘除小鼠眼球后,小鼠血液应立即放入抗凝管中,混匀后,4 h内完成检测。
2.2.2 血样检测
选用血液自动分析仪对小鼠血液样本进行检测。每组任意选3只小鼠的血液样本做重复性试验。
2.3 紫贻贝粗多糖对免疫抑制小鼠免疫功能的影响
2.3.1 采血
在解剖前一晚断粮,不断水。第2 天,称重,活体摘除眼球取血,每只取1 mL,在4 ℃冰箱低温保存,静置24 h,4 000 r/min 离心10 min,收集血清。放于-20 ℃冰箱备用。
2.3.2 小鼠血清的IL-2、IL-4、IL-10 和TNF-α 检测方法
试验前将小鼠血清和试剂盒取出解冻,温度恢复至室温。加入1 mL 标准品稀释液至冻干标准品中,待完成溶解后,静置15 min 混匀,之后按1 000μL、500μL、250μL、125μL、62.5μL、31.25μL、15.625μL 进行稀释。根据待测样品数量和标准品数量决定所需的板条数,并增加1 孔作为空白对照孔。将标准品对应放入孔中,用封板胶纸封住反应孔,37 ℃烘箱孵育90 h。加入相应试剂,于450 nm处测吸光度值。
2.4 数据分析
用SPSS17.0进行统计分析,结果用()x±s表示。当P<0.05,统计学显著,当P<0.01,统计学极显著;P>0.05,组间差异无统计学意义。
3 结果与讨论
3.1 对免疫抑制小鼠血液中白细胞数的影响
通过血液检测,对正常组、低剂量粗多糖组、中剂量粗多糖组、高剂量粗多糖组和环磷酰胺模型组小鼠血液中血红蛋白数进行分析比较,测定结果如图1所示。
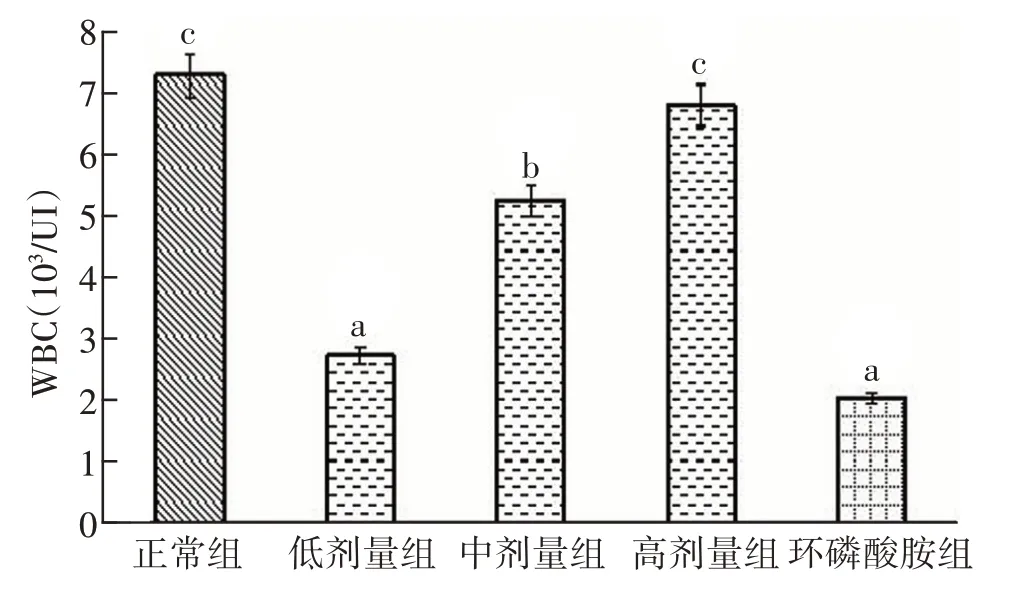
图1 紫贻贝粗多糖对免疫抑制小鼠白细胞数量的影响
免疫抑制造模后,环磷酰胺模型组白细胞数量显著小于正常组。低剂量组与中剂量组小鼠白细胞数量比环磷酰胺模型组多,但均无统计学意义。与模型组相比,高剂量组可大大促进小鼠白细胞的产生;与正常组相比,高剂量组小鼠白细胞虽比正常组多,但无统计学意义。低剂量组极其显著低于中剂量组和高剂量组,有统计学意义。
结果表明,紫贻贝粗多糖可刺激小鼠血液中白细胞的产生,对小鼠的免疫调节作用明显。紫贻贝粗多糖含量越高,免疫调节作用越好,但低剂量、中剂量多糖对免疫调节的作用有限。
3.2 对小鼠血清IL-2、IL-4、IL-10 和TNF-α 的影响
3.2.1 给药14天小鼠血清IL-2的水平变化
3.2.1.1 IL-2标准曲线的制定
标准品按原液1∶2∶4∶8∶16∶32 比例用50μL、100μL 微量加样器加入标准品稀释液,空白孔加入50μL原始浓度空白对照液,以IL-2标准溶液质量浓度为横坐标,吸光度值为纵坐标绘制标准曲线(图略)。得出线性方程为y=0.004x+0.018,R2=0.993 4。
3.2.1.2 小鼠血清IL-2的水平变化
采用白细胞介素2(IL-2)ELISA 试剂盒对正常组、低剂量粗多糖组、中剂量粗多糖组、高剂量粗多糖组和环磷酰胺模型组小鼠血清中IL-2含量进行分析比较,测定结果见图2。

图2 紫贻贝多糖对小鼠血清IL-2水平的影响
免疫抑制造模后,环磷酰胺模型组血清IL-2含量显著低于正常组。低剂量组比模型组高,但无统计学意义。中剂量和高剂量组与模型组相比,均可大大增加小鼠血清中IL-2含量。高剂量组与正常组相比,含量大于正常组。低剂量组极其显著低于中剂量组和高剂量组,有统计学意义。由图2 可以看出,小鼠血清IL-2水平随着粗多糖含量的增高而增高,且中剂量和高剂量组小鼠血清IL-2水平高于正常组。而只注射环磷酰胺的模型组明显低于正常组和多糖组。
结果表明,低剂量粗多糖对免疫调节的作用有限。紫贻贝粗多糖在250 mg/kg 和500 mg/kg 可明显提高小鼠血清IL-2含量,提高小鼠免疫力,且紫贻贝粗多糖调节作用与多糖含量成正比。
3.2.2 给药14天小鼠血清IL-4的水平变化
3.2.2.1 IL-4标准曲线的制定
IL-4 标准曲线的制定同3.2.1.1,根据测定结果得出标准曲线的线性方程为y=0.002x+0.078 6,R2=0.999 4。
3.2.2.2 小鼠血清IL-4的水平变化
采用白细胞介素4(IL-4)ELISA 试剂盒对正常组、低剂量粗多糖组、中剂量粗多糖组、高剂量粗多糖组和环磷酰胺模型组小鼠血清中IL-4 含量进行分析比较,测定结果见图3。

图3 紫贻贝多糖对小鼠血清IL-4水平的影响
免疫抑制造模后,环磷酰胺模型组血清IL-4含量显著低于正常组。低剂量组小鼠血清IL-4比模型组高,但无统计学意义。与模型组相比,中剂量和高剂量紫贻贝粗多糖可大大增加小鼠血清IL-4 含量。高剂量组与模型组和正常组相比,小鼠血清IL-4 含量大于正常组和模型组。低剂量组与中剂量组和高剂量组相比含量极其显著低,有统计学意义。由图3 可以看出,小鼠血清IL-4 水平随着粗多糖含量的增高而增高,且中剂量和高剂量组小鼠血清IL-4水平高于正常组,而只注射环磷酰胺的模型组明显低于正常组和粗多糖组。
结果表明,低剂量粗多糖对免疫调节的作用有限。紫贻贝粗多糖为250 mg/kg 和500 mg/kg 时可明显提高小鼠血清IL-4含量,具有提高小鼠免疫力的作用,且调节作用与粗多糖含量成正比。
3.2.3 给药14天小鼠血清IL-10的水平变化
3.2.3.1 IL-10标准曲线的制定
IL-10标准线曲线的制定同3.2.1.1,根据测定结果得出标准曲线线性方程为y=0.003 4x+0.039 4,R2=0.999 4。
3.2.3.2 小鼠血清IL-10的水平变化
采用白细胞介素10(IL-10)ELISA 试剂盒对正常组、低剂量粗多糖组、中剂量粗多糖组、高剂量粗多糖组和环磷酰胺模型组小鼠血清中IL-10 含量进行分析比较,测定结果如图4所示。
免疫抑制造模后,环磷酰胺模型组血清IL-10含量显著低于正常组和粗多糖组。低剂量组小鼠血清IL-10 含量显著比模型组高。中剂量组和高剂量组与模型组相比,均可大大增加小鼠血清IL-10 的含量。高剂量多糖组小鼠血清IL-10 含量大于正常组。低剂量组极其显著低于中剂量组和高剂量组,有统计学意义。由图4 可以看出,小鼠血清IL-10水平随着粗多糖含量的增高而增高,而只注射环磷酰胺的模型组,小鼠血清IL-10 水平明显低于正常组和粗多糖组。
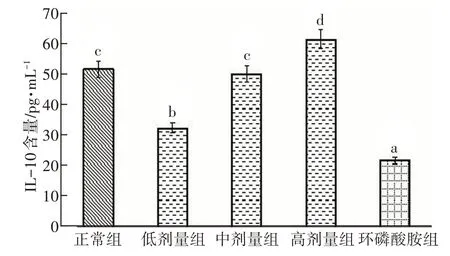
图4 紫贻贝多糖对小鼠血清IL-10水平的影响
结果表明,低剂量多糖对免疫调节的作用有限。紫贻贝粗多糖在250 mg/kg 和500 mg/kg 浓度下可明显提高小鼠血清IL-10 含量,具有提高小鼠免疫力的作用,且调节作用与粗多糖含量成正比。
3.2.4 给药14天小鼠血清TNF-α的水平变化
3.2.4.1 TNF-α标准曲线的制定
TNF-α 标准线曲线的制定同3.2.1.1,根据测定结果得出标准曲线的线性方程为y=0.004x+0.018,R2=0.993 4。
3.2.4.2 小鼠血清TNF-α的水平变化
采用肿瘤坏死因子(TNF-α)ELISA 试剂盒对正常组、低剂量粗多糖组、中剂量粗多糖组、高剂量粗多糖组和环磷酰胺模型组小鼠血清中TNF-α含量进行分析比较,测定结果如图5所示。
免疫抑制造模后,模型组血清TNF-α 含量显著低于正常组。低剂量组小鼠血清TNF-α 含量显著比模型组高。与模型组相比,中剂量和高剂量组可大大增加小鼠血清TNF-α 含量。高剂量组与正常组相比,高剂量粗多糖组小鼠血清TNF-α 含量高于正常组。低剂量组极其显著低于中剂量组和高剂量组,有统计学意义。
由图5 可以看出,小鼠血清TNF-α 水平随着粗多糖含量的增高而增高,而只注射环磷酰胺的模型组,小鼠血清TNF-α 水平明显低于正常组和粗多糖组。

图5 紫贻贝多糖对小鼠血清TNF-α水平的影响
结果表明,低剂量多糖对免疫调节的作用有限。紫贻贝粗多糖在250 mg/kg 和500 mg/kg 时可明显提高小鼠免疫力的作用,紫贻贝粗多糖调节作用与粗多糖含量成正比。
4 结论
白细胞是具有防御和免疫功能的无色有核球形细胞,免疫低下造模对小鼠血液中的白细胞影响显著,也会影响小鼠自身的防御和免疫功能。IL-2 最重要的作用是诱导T 淋细胞的分化,从而达到免疫调节作用。IL-4 可增强B 细胞抗原提呈能力,使免疫系统对小量抗原刺激发生免疫应答。IL-10 可促进肥大细胞和胸腺细胞增殖,IL-10 也是淋巴结、脾脏细胞生长的复合因子,从而提高发挥免疫抑制或免疫刺激作用。TNF-α 可以增强IL-2 依赖的胸腺细胞、T细胞增殖能力,从而起到免疫抑制作用。由试验结果可知,中高剂量粗多糖可增加免疫抑制小鼠血清中的IL-2、IL-4、IL-10、TNF-α 含量。紫贻贝多糖对小鼠的具有免疫调节作用,且紫贻贝粗多糖的免疫调节力随着粗多糖含量的增加而增加。综上所述,紫贻贝粗多糖对免疫抑制小鼠具有免疫调节作用,粗多糖含量越高,免疫调节作用越好。
