腹腔热灌注化疗治疗进展期胃癌疗效及安全性分析
2022-12-12王浩南
王浩南,曹 军
(1.西安交通大学第一附属医院肿瘤外科,陕西 西安 710061;2.西安医学院第三附属医院肿瘤科,陕西 西安 710068)
根据国家癌症中心统计,2016年全国胃癌(Gastric cancer,GC)新发病例约39.6万例,病死数约28.8万例,均位列第3位,仅次于肺癌和肝癌[1]。我国的胃癌患者具有发现晚、诊断晚、治疗晚的特点,尽管新发病例逐年下降,病死数仍在升高,其中初次就诊的胃癌患者已发生腹膜转移者约占15%~50%,经手术切除后出现腹膜转移者约占35%~50%[2]。对于已经发生腹膜转移的患者,传统观念认为已不符合手术适应证,推荐根治性化疗、姑息治疗等治疗方法。
近年来,随着对恶性肿瘤腹膜转移认识的逐渐深入,研究[3-4]认为腹膜转移属于局域性病变,适用于肿瘤细胞减灭术(Cytoreductive surgery,CRS)联合术中和(或)术后腹腔热灌注化疗(Hyperthermic intraperitoneal chemotherapy,HIPEC)。根据肿瘤细胞与正常细胞对温度耐受的敏感度不同以及肿瘤热化疗协同效应的原理,HIPEC技术最早由Spratt等在1980年提出。HIPEC能有效增加肿瘤细胞的凋亡,抑制其增殖和迁移,更彻底地清除术后残留微小病灶[5],有效降低了胃癌的腹膜复发率。因此,HIPEC治疗已逐渐成为胃肠道肿瘤腹腔转移综合治疗的一项新的选择策略。
尽管HIPEC在腹膜转移癌的治疗中已获得相当广泛的认可和临床应用,围绕该技术的安全性和有效性的临床试验仍在进行,部分研究者的回顾性研究支持HIPEC治疗可显著降低患者1年内肿瘤复发率[6-8]的观点。而国际腹膜表面恶性肿瘤协作组的数项研究阶段性成果[9-11]表明,经HIPEC治疗的患者的总体生存获益、并发症发生率与未经HIPEC治疗者相比无统计学差异。对于HIPEC治疗是否可为胃癌患者带来生存获益,目前尚无确定性结论[12]。因此,本研究通过分析79例进展期胃癌患者的临床资料,研究胃癌根治术后联合HIPEC综合治疗的安全性和有效性,为进展期胃癌的治疗提供新的循证医学证据。
1 资料与方法
1.1 一般资料 选取自2017年7月至2018年12月就诊于西安交通大学第一附属医院肿瘤外科并接受手术治疗的进展期胃癌患者79例为研究对象,均已经病理检查确诊,随机分为观察组(36例)和对照组(43例)。两组患者一般资料比较差异无统计学意义(均P>0.05),见表1。病例纳入标准:病理确诊为胃癌;年龄18~75岁;影像分期在ⅡB期以上,或术中探查可见肿瘤原发灶分期为T4以上,同时存在区域淋巴结转移;接受胃癌根治术或CRS术,达到R0或R1切除者;术中腹膜肿瘤指数(PCI)小于15;患者及家属对本研究知情同意。排除标准:既往患有严重心血管慢性疾病或身体不耐受化疗者;已发生肝、肺、脑等远处转移者;卡氏(KPS)评分小于70分者;术前已行新辅助化疗者。本研究经本院伦理委员会审查通过。
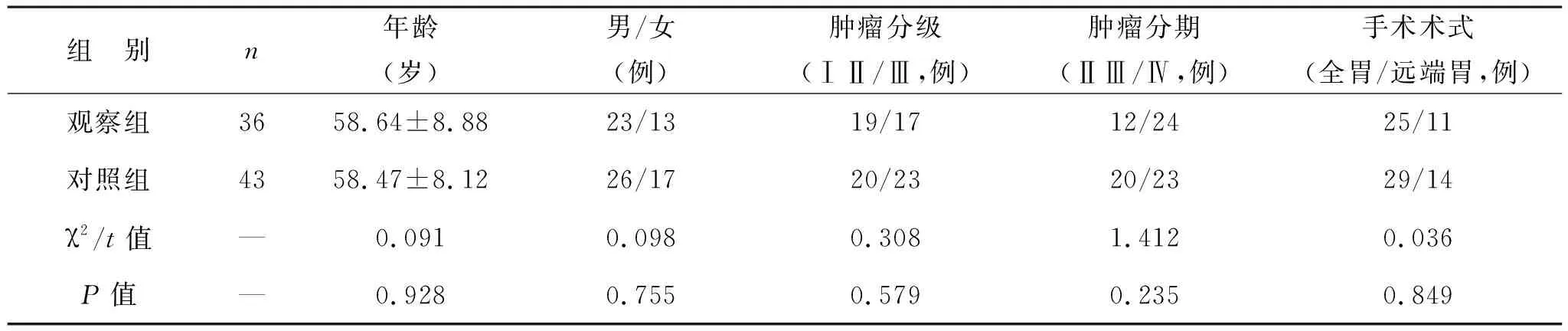
表1 两组患者一般资料比较
1.2 治疗方法 所有患者手术关腹前置入热灌注管,一般放置 4 根管交叉置管,盆底的2根引流管自上腹部穿刺而出,肝肾隐窝与肝脾隐窝的2根引流管自下腹部穿刺而出,从而完成置管。
1.2.1 观察组:根据患者意愿使用BRTRGⅡ型热灌注治疗系统或RLH2000B型热化疗灌输机。从术后第1天起,每天或隔天给予热灌注治疗1次,每次给予43 ℃ 0.9%氯化钠溶液4000 ml,共热灌注治疗4~5次。第2次热灌注治疗加用奥沙利铂(国药准字J201150117)200 mg,第4次治疗加用多西他赛(国药准字H220103)80~120 mg。灌注速度600 ml/min,持续1 h。治疗期间密切关注患者心率、血压、氧合等生命体征指标。
1.2.2 对照组:术后不进行腹腔热灌注治疗。所有患者术后3~4周开始均按指南规律化疗6~8周期。
1.3 观察指标
1.3.1 围手术期指标:包括术后首次排气时间、住院天数、手术并发症(如梗阻、吻合口瘘、切口感染等)、化疗相关不良反应(如消化道症状、骨髓抑制等)
1.3.2 肿瘤标志物:术前及化疗6周期后分别检测胃肠肿瘤标志物癌胚抗原(CEA)和糖类抗原199(CA199)。
1.3.3 胃癌复发转移及患者生存情况:术后1年内,通过门诊复查及电话随访,结合影像学检查(胸部、上腹部CT等),统计肿瘤复发转移及患者生存情况。
2 结 果
2.1 两组患者围手术期指标比较 见表2。观察组腹痛、骨髓抑制、消化道症状占比高于对照组(均P<0.05)。

表2 两组患者围手术期指标比较
2.2 两组患者CEA、CA199水平比较 见表3。两组患者术前CEA、CA199水平比较差异无统计学意义(均P>0.05)。化疗6周期后,观察组CEA水平低于对照组(P<0.05),CA199水平与对照组比较差异无统计学意义(P>0.05)。
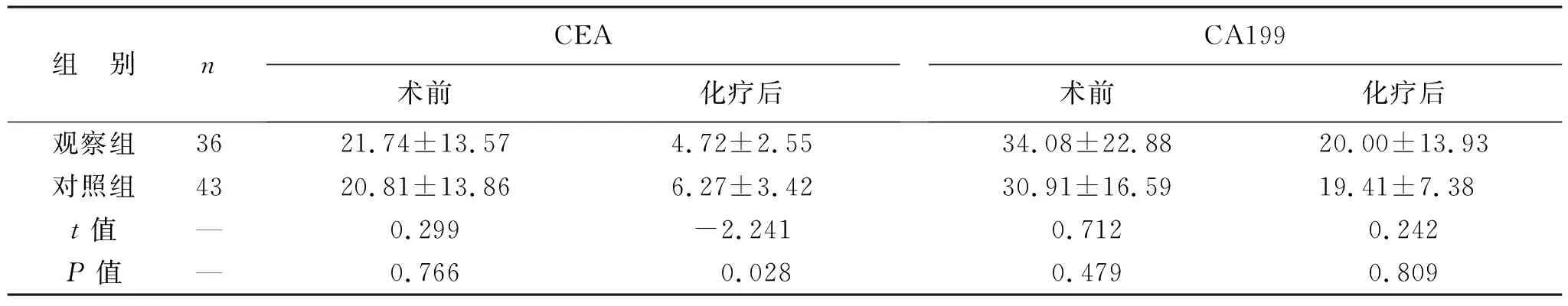
表3 两组患者CEA、CA199水平比较(U/ml)
2.3 两组患者胃癌复发转移及生存情况比较 见表4。术后1年内,观察组患者吻合口、原发灶、腹腔内复发占比低于对照组(P<0.05),肝、肺等远处转移以及病死率与对照组比较差异无统计学意义(均P>0.05)。

表4 两组患者胃癌复发转移及生存情况比较[例(%)]
3 讨 论
单纯的胃癌D2根治术或CRS术无法彻底清除局部晚期患者腹腔内可能存在的微小转移病灶,而HIPEC将靶病灶微环境温度升高至42 ℃左右的有效治疗温度,能引起肿瘤细胞凋亡,减少对体细胞的损伤[11],同时将含有化疗药物的热灌注液注入患者体内并进行热循环,以实现腹腔局部病灶直接与药物接触的目的,通过化疗药物的吸收和渗透,清除组织间残存的脱落肿瘤细胞,并通过门脉系统和腹膜腔淋巴系统回流,降低肝脏及淋巴系统肿瘤细胞转移的可能[12]。
本研究中,术后观察组患者骨髓抑制、腹痛、消化道症状占比显著高于对照组,但对围手术期手术相关并发症的发生率并无显著影响。奥沙利铂常见不良反应为神经毒性、胃肠道症状,而多西他赛常见的不良反应为骨髓抑制,提示这些并发症症状差异主要来源于奥沙利铂和多西他赛的不良反应。经对症处理后,HIPEC引起的不良反应均可有效缓解。与对照组相比,HIPEC并未显著影响两组患者的首次通气时间和平均住院天数,客观说明了该技术具有相当的临床安全性,并未引起3级或以上的临床不良反应,且不增加吻合口瘘、切口感染、肠梗阻等术后并发症的发生率,并未对患者的术后恢复产生明显的不良影响。
经HIPEC治疗后,化疗结束时观察组CEA水平显著低于对照组。CEA作为具有人类胚胎抗原特性的酸性糖蛋白,主要存在于癌细胞膜表面及胞质内蛋白合成转运的细胞器,与肿瘤细胞恶性程度相关[13-14],在胃癌中阳性率约85%,这表明HIPEC可能对于进展期胃癌患者的化疗具有一定协同增益作用,有效控制和降低了癌细胞的增殖。而CA199与对照组相比无统计学差异,可能与其在胃癌患者中阳性率较低(仅为30%)有关[15]。CA199主要表达于细胞膜,通常与消化道炎症、梗阻因素有关,在胰腺癌的表达和预后评估中具有重要意义。CEA和CA199的术前、化疗后变化暗示了HIPEC治疗可能在一定程度上对细胞水平癌症细胞合成、增殖、分化能力具有抑制作用。肿瘤切除后,总体而言,解除了肿瘤局部梗阻、炎症因素,两组患者CA199的血清水平比较差异无统计学意义。
术后1年内,观察组肿瘤局部复发率显著低于对照组,说明经手术联合HIPEC治疗后,原发灶及腹膜转移灶均得到了有效的控制,但远处转移、病死率与对照组相比无统计学差异。研究[16]表明,约40%的胃癌患者术后会出现肝、肺等远处转移,HIPEC治疗作为局部治疗,对于已发生的远处转移微小病灶并无确切有效的治疗效果。结合国内外多项研究的Meta分析[17]提示HIPEC对进展期胃癌患者的远期生存率可能影响不大,但短期内接受HIPEC治疗者的无进展生存时间可获得显著收益。欧洲的PROGIGE7试验[18]对结直肠癌合并腹膜转移的病例进行了CRS联合HIPEC治疗,热灌注期间合并使用奥沙利铂和氟尿嘧啶,患者1年生存率和5年生存率比较并无统计学差异,但PCI亚组是独立的预后不良相关因素[19],在PCI为11~15分的亚组分析中,HEPIC治疗具有显著的生存获益,提示腹膜转移的病灶数量、主治医师的减瘤操作对患者的预后具有一定影响,中度腹膜转移的病例可能通过HIPEC技术获得生存收益[20],这也与本研究中所观察到的临床现象相符。
综上所述,本研究提示了胃癌根治术联合HIPEC技术,协同术后辅助化疗可在不引起严重并发症的情况下,安全、有效地改善进展期胃癌患者的术后生存状态,降低血清CEA水平,减少术区局部复发率。由于本研究存在单中心研究、样本量较小、观察时间较短等不足之处,结论可能存在偏倚,有待更进一步的前瞻性、多中心、长时间、随机对照临床研究的验证。
