外周血中性粒细胞与淋巴细胞比值、淋巴细胞与单核细胞比值对患儿急性髓系白血病疗效及预后的评估价值
2022-12-12张合成王国锋范朋凯
李 妍,张合成,王国锋,范朋凯
(1.郑州大学附属儿童医院血液病研究室,河南 郑州 450002;2.郑州大学附属儿童医院烧伤整形科,河南 郑州 450002)
急性髓系白血病(Acute myeloid leukemia,AML)是髓系原始细胞恶性增殖的疾病,受环境因素及细胞遗传因素的影响[1-3]。儿童抵抗能力弱,易受环境因素影响,急性髓系白血病中约一半为儿童,患儿克隆性白血病细胞大量增殖,抑制造血功能,并侵袭其他非造血器官,临床可出现出血、感染、器官损伤等症状,严重威胁患儿生存[4-5]。患儿预后转归受耐药、并发症的影响,目前临床上缺乏灵敏的预后标志物,因此寻找预后标志物对指导AML患儿的治疗具有重要意义。机体炎症与免疫状态也可影响AML患儿的预后[6],中性粒细胞与淋巴细胞比值(Neutrophil to lymphocyte ratio,NLR)是评估炎症的常见指标,在多种肿瘤的预后中具有判定价值[7-8]。淋巴细胞与单核细胞比值(Lymphocyte to monocyte ratio,LMR)可反映肿瘤微环境状态[9]。本研究猜测NLR、LMR可反映AML患儿的预后状态,据此展开研究,以期为AML患儿的预后指导提供帮助。
1 对象与方法
1.1 研究对象 选取2017年1月至2019年5月期间在本院接受治疗的AML患儿97例为AML组,其中男性45例,女性52例;年龄9~12岁,平均(10.52±0.51)岁。病例纳入标准:符合AML诊断标准[10];均为初治患儿;监护人知情同意。排除标准:合并其他器官恶性肿瘤;术前3个月接受免疫抑制剂治疗;存在严重感染。另选取同期体检健康儿童90例为对照组,其中男性46例,女性44例;年龄9~12岁,平均(10.44±0.59)岁。两组性别、年龄比较差异无统计学意义(均P>0.05)。本研究经医院伦理委员会审批通过。
1.2 研究方法 患儿均参照文献[10]中方案进行治疗,初诊时及治疗1个疗程后采集空腹静脉血,记录中性粒细胞计数、淋巴细胞计数和单核细胞计数,并计算NLR和LMR。对照组儿童取体检时空腹静脉血进行血常规检测并进行相应记录与计算。其中,NLR=中性粒细胞计数/淋巴细胞计数×100%,LMR=淋巴细胞计数/单核细胞计数×100%。治疗后随访患儿3年(截至2022年5月31日),记录患儿此期间无复发生存时间,即患儿经治疗1个疗程后疗效为完全缓解(CR)(疗效标准参照文献[11])至缓和复发或任何原因致患儿死亡时间,统计无复发生存率。
1.3 观察指标 比较两组初诊时实验室指标,包括白细胞计数(WBC)、NLR、LMR、血红蛋白和血小板计数;比较AML患儿初诊时与治疗1个疗程后NLR、LMR水平;分析NLR、LMR水平与AML患儿临床特征及实验室指标的相关性;比较不同NLR、LMR水平AML患儿短期疗效;分析治疗1个疗程后NLR、LMR水平与AML患儿预后的关系。
2 结 果
2.1 两组初诊时实验室指标比较 见表1。与对照组相比,AML组患儿WBC、NLR水平升高,LMR、血红蛋白、血小板计数水平降低(均P<0.05)。
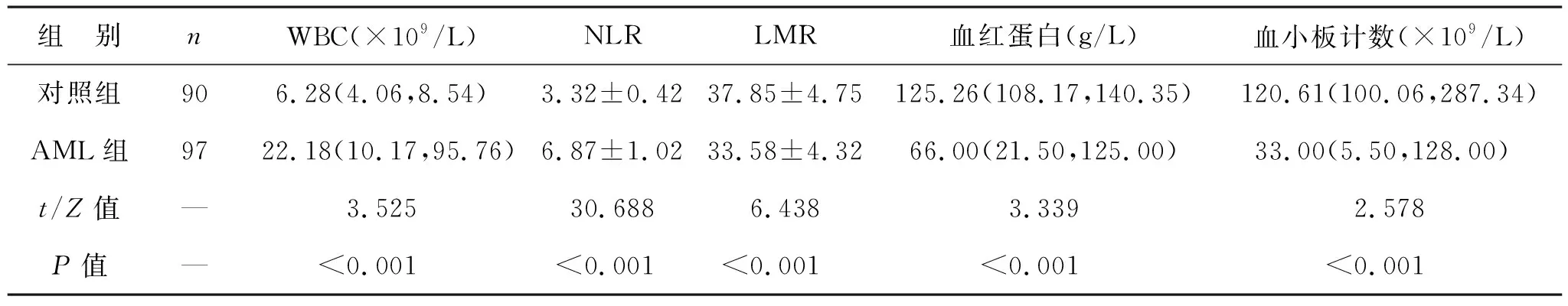
表1 两组初诊时实验室指标比较
2.2 AML患儿初诊时与治疗1个疗程后NLR、LMR水平比较 见表2。与初诊时相比,治疗1个疗程后AML患儿NLR水平降低,LMR水平升高(均P<0.05)。
表2 AML患儿初诊时与治疗1个疗程后NLR、LMR比较
2.3 NLR、LMR水平与AML患儿临床特征及实验室指标相关性分析 见表3。以初诊时NLR平均值6.87将AML患儿分为NLR高表达组与NLR低表达组,以初诊时LMR表达平均值33.58将患儿分为LMR高表达组与LMR低表达组,分析结果表明NLR、LMR水平与AML患儿性别、年龄、WBC、血红蛋白、血小板计数无相关性(均P>0.05)。

表3 NLR、LMR水平与AML患儿临床特征及实验室指标的相关性
2.4 不同NLR、LMR水平AML患儿短期疗效比较 见表4。97例患儿治疗1个疗程后CR者78例,CR率80.4%。NLR低表达组CR率高于NLR高表达组,LMR高表达组CR率高于LMR低表达组(χ2=4.178、5.070,均P<0.05)。

表4 不同NLR、LMR水平AML患儿短期疗效比较[例(%)]
2.5 NLR、LMR水平与AML患儿预后关系分析 治疗1个疗程后,对CR患儿随访结果显示,3年无复发生存率为39.74%(31/78)。其中,NLR高表达组无复发生存率为21.21 %(7/33),NLR低表达组无复发生存率为53.33 %(24/45),前者低于后者(Log-Rank χ2=19.647,P<0.05);LMR高表达组无复发生存率为53.19 %(25/47),LMR低表达组无复发生存率为13.35%(6/31),前者高于后者(Log-Rank χ2=28.762,P<0.05)。
3 讨 论
AML患儿以化疗为主,但经化疗获得缓解的患儿仍会部分复发并难以治疗,预后较差,且缺乏明确的预后标志物,因此寻找AML预后标志物,对患儿进行合理的预后评估,有助于及时预警,延长患儿预后生存期。
影响AML患儿的预后因素较多,机体炎症反应与免疫状态的不同与恶性肿瘤的发展密切相关[12],可影响患儿预后情况。史丽峰等[13]研究显示,感染性肺炎新生儿血清IL-6水平升高,且有预测患儿预后情况的潜能。易志钢等[14]研究显示,狼疮性肾炎合并肺部感染患者血清miR-155水平与患者预后密切相关,miR-155是与免疫相关的miRNA。
中性粒细胞来源于骨髓,具有趋化作用和吞噬作用,其水平升高可提示急性感染,可反映肿瘤的炎症反应[15]。淋巴细胞是机体免疫系统的重要组成,执行几乎全部机体免疫功能,对肿瘤细胞具有免疫监视能力,淋巴细胞减少会导致及时监控并清除肿瘤细胞的能力减弱,影响患儿预后,增加患儿复发风险[16]。NLR可反映肿瘤炎性反应与机体抗肿瘤免疫之间的平衡状态,在上尿路上皮癌[7]、上皮性卵巢癌[17]等癌症中可作为预后评估因子。本研究中,与对照组相比,AML组患儿NLR水平升高,经治疗1个疗程后,其水平降低,提示NLR水平与患儿发病及治疗反应有一定联系,能反映患儿治疗状态。治疗前NLR水平与治疗1个疗程后的CR率具有相关性,NLR低表达组CR率较NLR高表达组高,3年预后随访发现NLR高表达组无复发生存率低于NLR低表达组,提示高NLR预示着患儿预后差,检测NLR水平有助于患儿疗效评估及预后判断。
单核细胞是骨髓来源抑制细胞,在肿瘤的免疫逃逸中发挥关键作用,可通过巨噬细胞释放的血管内皮生长因子促进肿瘤血管生长,可反映肿瘤细胞存活的微环境[18]。LMR反映患者免疫状态,在肿瘤患者预后评估中发挥作用。朱太岗等[19]研究显示,LMR与骨髓瘤患者多发性骨髓瘤骨病分级呈负相关,LMR低表达患者3年生存率低于LMR高表达患者,是患者预后的影响因素,可为患者个性化治疗及预后评估提供帮助。林樟萍等[20]研究显示,LMR低水平是影响淋巴瘤患者预后的独立危险因素。本研究中,AML患儿LMR水平低于对照组,提示AML患儿免疫水平失常,促肿瘤生长因素增强,肿瘤抑制因素减弱,因此LMR水平降低。经1个疗程治疗后,AML患儿LMR水平升高,提示LMR水平可反映患儿治疗疗效。以患儿初诊时LMR水平的平均值33.58为截断值,并以此作为短期疗效、长期预后的分层依据进行分析,结果发现LMR高表达组CR率高,LMR低表达组3年无复发生存率低于LMR高表达组,即LMR表达水平低者易复发及死亡,需按时复查,及早治疗,其有望成为AML患儿评估预后的生物标志物。
综上所述,AML患儿外周血NLR高表达,LMR低表达。它们对患儿疗效及长期预后具有良好的评估价值。但本研究由于样本量的限制,可能造成结果偏倚,下一步将扩大样本量进行验证。
