重组胶原蛋白在表皮修复中的作用机理研究∗
2022-12-12赵健烽冯丽萍黄建民马德蓉
李 滨 赵健烽 冯丽萍 黄建民 马德蓉
(1江苏海洋大学食品科学工程学院 江苏连云港 222000 2江苏江山聚源生物技术有限公司 江苏泰州 214500)
胶原蛋白是利用酸、酶等提取介质从动物组织中提取的大分子蛋白质,因其具有无毒、易降解、易吸收、低抗原性等特性,深受生物医学及日用化学领域青睐,被广泛用作手术缝合线、止血海绵、人工皮肤、人工血管、人角膜、药物载体等[1]。但动物来源的大分子胶原蛋白仍存在一些问题[2]:1)存在潜在的传染病危险,包括动物源及人源性传染病(例如,艾滋病等);2)存在引起机体排斥反应炎症的风险;3)排斥反应导致的高吸收率使治疗频次增加,成本增加。此外,动物源胶原蛋白的提取过程还存在高成本、重污染、获取率低等缺陷,因此,利用基因工程技术生产的重组胶原蛋白(recombinant human collagen,RHC)受到广泛关注[3]。
重组胶原蛋白的生产工艺为:将来自人体胶原蛋白的mRNA经逆转录合成cDNA,随后进行酶切,再通过特定序列的整理缝合、与特定表达载体连接,转入大肠杆菌(Escherichia coli)或毕赤酵母(Pichia pastoris)中[1-2],获得相对较高的表达量;通过发酵、分离、纯化手段生产生物重组胶原蛋白[3-8]。因其具有良好的生物学相容性、细胞黏附性、促进新细胞形成和止血功能[3],对重组胶原蛋白在创伤修护类化妆品中的作用机理研究,有助于将此类蛋白质推广至日用化妆品领域乃至生物医学应用领域。
1 材料与方法
1.1 实验试剂与仪器
实验试剂:血清培养基、无血清培养基、磷酸氢二钠(分析纯)、磷酸二氢钾(分析纯)、氯化钠(分析纯)、氯化钾(分析纯)、EDTA(≥99.5%)、DMSO(≥99.9%)、Weigert铁苏木素染色液、天狼星红染色液、MTT试剂盒(碧云天生物)、细胞黏附检测试剂盒(上海康朗生物)、成纤维细胞(原代培养)、表皮细胞(原代培养)、重组胶原蛋白、市售胶原蛋白样品1(简称“市售1”)、市售胶原蛋白样品2(简称“市售2”)、动物胶原蛋白、RGD肽(Arg-Gly-Asp多肽,一种已被报道的细胞粘附序列,可明显增加细胞黏附性)。
仪器:96孔板(Nunc-96,赛默飞世尔,中国)、Franz扩散池(Permergear,世联博研,美国)、酶标仪(MR-96A,贝登医疗,南京)、低速冷冻离心机(RC3B PLUS,SORVALL,美国)、光学显微镜(DM3000 LED,徕卡,德国)、石蜡包埋机(EG1150H,徕卡,德国)、切片机(KD-3368AM,世纪科信,北京)、移液器(F1 Clip Tip,赛默飞世尔,中国)。
1.2 实验方法
1.2.1 促细胞生长实验 将活性好的细胞制作成单细胞悬浮液并统计数量,使细胞密度为104个/mL,接种于96孔板,每孔中加入细胞悬浮液200 μL,生长至细胞贴壁后,加入不同浓度的待测样品(0.0001%、0.0005%、0.0025%、0.0125%、0.0625%、0.3125%,注:如果有效,可继续下调浓度),每个样品设置5个重复,置于37℃、5%CO2培养箱中连续培养 24 h、48 h、72 h、96 h、120 h、144 h、168 h(每72 h更换一次含胶原蛋白样品的培养液)。
至每个时间点,向对应的孔中加入20 μL MTT溶液(用pH=7.4的PBS配制),再培养4 h,停止。
快速翻转培养板,弃去上清液,每孔添加150 μL DMSO,振荡10 min溶解MTT结晶。
用酶联检测仪检测各孔在490 nm处的吸光值(OD490值),同时设置无细胞孔作为对照组进行调零,取6孔平均值。
以培养时间与吸光值为坐标轴绘制细胞生长曲线。
1.2.2 细胞迁移实验
1)细胞铺板:以记号笔均匀地分割6孔板,中间间隔0.5~1 cm,每个孔至少横穿3条线。每孔中大约加入5×105个/mL细胞,过夜后可将孔铺满。
2)划痕实验:第2天使用移液器吸头垂直于横线进行划痕,用PBS清洗细胞3次,洗脱被划下的细胞,加入至含有RHC的无血清培养基中,作为对照组;加入至含有实验样品(市售1和市售2)的培养基中,作为实验组,最终浓度为0.05%。在37℃,5%CO2培养箱中进行培养,取样时间分别为0 h、6 h、24 h。
3)数据处理:计算不同时间段之间细胞整体迁移的距离,得出平均数与标准差,建立直角坐标系,以时间为横轴,迁移距离为纵轴作图,计算公式如下:
式中:Si表示每个时间长度细胞整体迁移的距离;S0表示0时距离长度;St表示每个时间点的距离长度。
1.2.3 细胞黏附实验
1)包被:将100 μL包被液加入96孔板,2~8℃条件下过夜。移除包被液,用洗涤液洗涤2~3次。
2)细胞接种:胰酶消化处理的待测细胞,经PBS洗涤后,用相应培养基重悬制成细胞悬液,按5×104个/mL细胞,接种于96孔板;同时加入含胶原蛋白样品,RHC终浓度为0.05%和0.01%,设置5个重复。设立对照组,即未加样品的细胞悬液组;设置含有RGD肽的阳性对照组。放置于37℃、5%CO2培养箱培养1 h。取出培养板,弃培养基,洗涤2~3次,每孔加入100 μL新鲜培养基。
3)黏附率检测:96孔板每孔加入10 μL细胞染色液B,在37℃孵育2 h。使用酶标仪测定450 nm各孔的吸光值(OD450值)。各重复孔的OD450值取平均数,计算细胞黏附率的公式如下:
1.2.4 透皮性实验
1)制样:取制备好的离体猪皮,用扩散池进行透皮实验。供给液分为对照组和实验组。
2)组织切片:用4%多聚甲醛固定上述猪皮24 h,用自来水高流速冲洗12 h,后依次浸泡在75%、85%、95%Ⅰ、95%Ⅱ的乙醇中各1 h,进行脱水处理。然后浸泡于1∶1的无水乙醇及二甲苯混合液中30 min,二甲苯Ⅰ中15 min,二甲苯Ⅱ中15 min,进行透明化处理。再进行浸蜡处理,分别浸泡于石蜡Ⅰ中1 h,石蜡Ⅱ中过夜,石蜡Ⅲ中1 h。用石蜡包埋机进行包埋,修蜡后,在-20℃的冰箱中过夜保存。最后,用切片机将切片横向及纵向切成5 mm切片,40℃展片,62℃烤片。
3)天狼星红染色:
①染色前先脱蜡:水,二甲苯Ⅰ中10 min,二甲苯Ⅱ中10 min,无水乙醇Ⅰ中2 min,无水乙醇Ⅱ中2 min,95%乙醇2 min,85%乙醇2 min,75%乙醇2 min,流水冲洗。
②染色时用weigert铁苏木素染色液将组织切片染色10~20 min,自来水冲洗5~10 min,用蒸馏水清洗1次。随后使用天狼星红染液染色1 h,流水冲洗后,去除染液。
③染色后脱水,浸泡于95%Ⅰ、95%Ⅱ的乙醇中各5 min,无水乙醇Ⅰ中5 min,无水乙醇Ⅱ中5 min,二甲苯Ⅰ中5 min,二甲苯Ⅱ中5 min透明。
④将中性树胶滴于载玻片组织上,用盖玻片覆盖,覆盖时应先接触一边,后逐渐覆盖,可有效避免产生气泡。
4)显微镜观察拍照:在普通光学显微镜下,观察分析实验组和对照组在显微镜下的组织切片,并拍照。红色为胶原纤维,蓝色为细胞核,黄色为肌纤维。
2 结果与分析
2.1 细胞生长实验
2.1.1 RHC促进细胞生长的起效量实验 对比各组细胞生长,分析RHC促进成纤维细胞、表皮细胞生长的最低起效量浓度。图1结果显示,成纤维细胞和表皮细胞的生长趋势相似。与对照组相比,当RHC浓度≥0.0025%时,实验组均可促进细胞的生长;而当RHC浓度<0.0025%时,其生长情况与对照组大致相同。这证明RHC促进细胞(成纤维细胞和表皮细胞)生长的起效量为0.0025%。
2.1.2 RHC与市售普通胶原蛋白1、2对比实验本文选用RHC浓度为0.01%,该浓度可促进细胞生长,采用实验方法1.1.2得到实验结果如图2所示,RHC组的细胞生长速率明显快于市售普通胶原蛋白1、2组,表明RHC促进细胞生长的性能优于市售普通胶原蛋白1、2。
2.1.3 表皮细胞生长形态学变化 如图3所示,在倒置显微镜下,接种1 d,各组表皮细胞呈球形,大小均匀,边界清晰;在接种2~4 d内,细胞逐渐贴壁生长,形状呈眼球形,可观察到细胞核,细胞数量快速增长并连接成片状,各组细胞形态无明显差异;与空白对照组比,其他各组细胞增长量明显,其中RHC组表皮细胞密度最大,分布均匀。
2.2 细胞迁移实验 根据实验组和对照组不同时间点细胞整体迁移距离,分析RHC及其他样品促进细胞迁移的能力。
本实验主要为划痕实验,通过显微镜观察不同时间内“伤口”的愈合程度,即细胞的迁移(图4)。图5统计数据显示,RHC组在6 h的细胞迁移距离大于其他组在24 h的迁移距离,而24 h后,RHC组的细胞迁移距离远高于其他对照组,证明RHC促进细胞迁移能力优于市售普通胶原蛋白。
此外,本研究还采用以人皮肤角质形成细胞为代表的单层体外实验模型(实验方法中未体现这部分),测定了2种化妆品原料(海洋胶原蛋白)体外促进创面愈合的能力。在体外系统中,通过产品促进损伤组织愈合的能力评价修复效果。
以0.1%浓度为例,在相同时间内,RHC的细胞修复能力比海洋胶原蛋白更加突出。图6数据显示,经过t检验,2 h后RHC组细胞迁移变化率呈显著性差异,且24 h后RHC的细胞修复比海洋胶原蛋白高21.1%。因此,RHC在细胞修复方面的效果比海洋胶原蛋白更加显著,且起效速度更快,2 h内即有显著效果。
2.3 细胞黏附实验 根据各组的黏附率,分析并比较RHC与市售普通胶原蛋白1、2及RGD肽的细胞黏附能力。
如表1所示,RHC的促细胞黏附性能明显优于市售普通胶原蛋白,且RHC促细胞黏附性能与浓度相关,RHC浓度越大,细胞黏附增强,这一性质对不同种类的细胞无较大差异。当RHC浓度达到0.05%时,细胞黏附率已高达45%,根据已报导文献[9]:细胞黏附率大于40%说明材料已具有优良的细胞黏附性能。
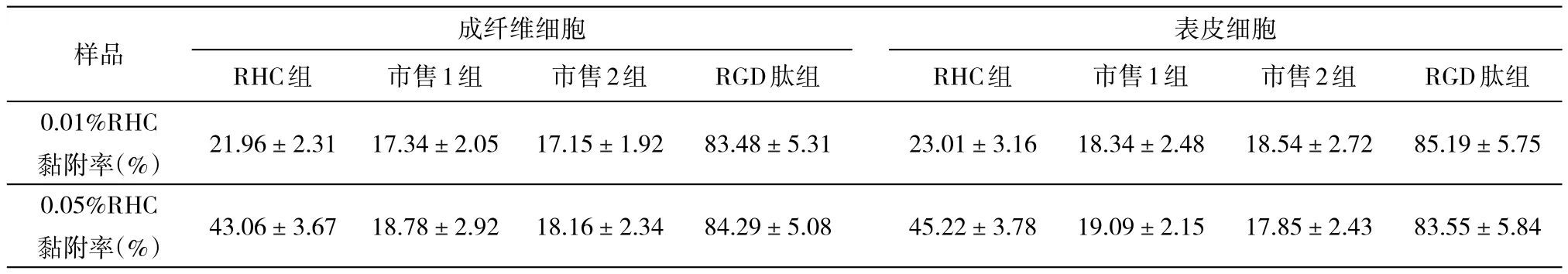
表1 不同浓度RHC的细胞黏附情况汇总(平均值±标准差)
2.4 透皮性实验
2.4.1 皮肤中RHC的吸收利用情况 通过对照组与实验组的染色,比较2组内表皮RHC含量。由内表皮RHC含量差异,得出皮肤中RHC的吸收利用量。
在显微镜下观察对照组和实验组的切片并拍照(图7),可发现实验组中红色所占面积更大,表明涂抹过RHC溶液的猪皮中胶原蛋白含量更多,即猪皮吸收了一定的RHC溶液,使其胶原蛋白含量上升,高于动物胶原蛋白对照组。
2.4.2 RHC在皮肤深度方向上的吸收量分布由实验组与对照组不同深度处的染色显色差异,可分析皮肤不同深度对于胶原蛋白的吸收情况。
实验组中不同深度的组织切片,红色分布较为一致,颜色不随深度的变化而变化(图8)。对照组中,颜色亦不随深度的变化而改变。但在不同深度下,实验组的红色分布多于对照组,这说明在一定时间后,猪皮在吸收RHC后可达到一个平衡的状态,其吸收的胶原蛋白分布均匀。
图9显示,实验组纵向红色分布较为均匀,颜色不随纵向位置的不同而发生较大变化,结果与图7一致。而对照组(10倍浓度动物胶原)中,颜色随纵向位置的不同有较大的变化,证明动物胶原在皮肤中渗透是不均一的;随着浓度增加(100倍浓度动物胶原),染料颜色加深,说明动物胶原透过皮肤的量增加。但同实验组比(从纵向及横向2个方面),动物胶原的渗透性能是弱于RHC的。本实验证明,RHC具有更强的透皮性能,且在皮肤的分散性更均匀。
3 讨论
细胞生长实验中,RHC促进细胞生长的起效量为0.0025%,优于市售普通胶原蛋白。重组胶原蛋白比普通胶原蛋白在分子量方面具有一定优势,有研究表明,胶原蛋白分子量为1 500~3 000 Da时,更容易被人体吸收利用。重组胶原蛋白在基因构建时,可通过控制氨基酸含量实现小分子量重组胶原蛋白的生产。本研究所用重组胶原蛋白分子量约2 000 Da,相比于市售的大分子胶原蛋白,重组胶原蛋白在促进细胞生长方面具有明显优势。
促细胞迁移实验结果显示,24 h内,RHC促进细胞迁移能力优于市售普通胶原蛋白;细胞黏附性方面,RHC浓度越高,黏附性越强;与动物胶原蛋白相比,RHC具有更优异的透皮性能。重组胶原蛋白具有与普通胶原蛋白相同的三螺旋结构。在此基础上,本研究所用重组胶原蛋白在构建过程中加入了更多的亲水性基团与活性基团,这些基团有效提高了重组胶原蛋白的亲水性与生物活性。亲水性基团可与皮肤中的水分结合达到保湿效果,也有效增强了细胞黏附性。同时强活性使得重组胶原蛋白具有强渗透性,可透过角质层与皮肤上层细胞结合,参与和改善皮肤细胞的代谢,增强皮肤中原有胶原蛋白的活性。因此,重组胶原蛋白在促细胞迁移、促细胞黏附与透皮性方面都展现出优于普通胶原蛋白的性能。综上,从生物相容性方面分析,RHC展现出的优良性能,为其在表皮修复领域的应用提供了可能性。
总体上,重组胶原蛋白应用前景广阔,其高稳定性、易扩大生产、高生物相容性等特点均是其作为组织工程医疗器械产品的实施基础,研究者也将重组胶原蛋白用于创面修复、角膜替代物等再生医疗领域,已取得了一定的临床效果[10-14],故对重组胶原蛋白的开发研究在未来依然是生物材料领域热点研究方向之一。
