晚期卵巢癌行肿瘤细胞减灭术的预后情况及影响因素分析
2022-12-10谢佐莲陈瓅林亮李玲林安
谢佐莲 陈瓅 林亮 李玲 林安
卵巢癌是常见妇科恶性肿瘤,患病率仅低于宫颈癌,死亡率居妇科恶性肿瘤第1位,严重危害女性健康及生命安全[1]。女性卵巢组织解剖、胚胎发育、内分泌功能复杂,卵巢癌发病早期无典型症状,故初诊时晚期卵巢癌患者可达70%[2]。肿瘤细胞减灭术(cytoreductive surgery,CRS)是晚期卵巢癌重要治疗手段,为达到理想减瘤效果,通常会尽量扩大手术范围,甚至可涉及全部腹腔,从而会增加CRS 术后死亡及并发症发生风险[3]。因此积极探讨晚期卵巢癌CRS 术后预后的影响因素,完善后续诊疗计划一直是临床重点研究课题。本研究选取福建省肿瘤医院收治的50 例晚期卵巢癌患者,通过分析其CRS 术后预后的相关影响因素,旨在为临床完善后续诊疗方案提供理论依据,现报道如下。
1 资料与方法
1.1 一般资料 选取2007 年6 月-2017 年12 月福建省肿瘤医院收治的50 例晚期卵巢癌患者。纳入标准:(1)细胞学、病理学及影像学检查确诊为卵巢癌,符合文献[4]《卵巢恶性肿瘤诊断与治疗指南(2021 年版)》中卵巢癌诊断标准;(2)均拟行CRS术,术前无分子靶向治疗或放化疗史;(3)术前KPS 评分>60分,可耐受手术;(4)预计生存期>3 个月。排除标准:(1)复发性卵巢癌;(2)放弃治疗或失访;(3)有手术禁忌证、家族遗传史;(4)心、肺、脑等脏器功能不全;(5)合并免疫性疾病、全身感染、结核感染等影响免疫系统疾病;(6)其他原因造成死亡或合并其他类型恶性肿瘤。年龄35~68岁,平均(51.67±8.05)岁,病理类型:16 例黏液性,19 例子宫内膜样,15 例浆液性。本研究经本院伦理委员会审核批准,患者或家属知情研究,签署同意书。
1.2 方法
1.2.1 治疗方法 所有患者均给予CRS术,消毒铺巾,留取术中腹腔冲洗液,CRS 术包括全子宫、大网膜、双附件、腹腔盆腔病灶及腹主动脉或盆腔淋巴结切除,黏液性卵巢癌同时切除阑尾。术后两周均给予一线化疗(卡铂+紫杉醇),21 d 为一个周期,共化疗6~8 个周期。
1.2.2 资料收集 通过病案室收集患者一般资料,包括手术时间、术中出血量、年龄、残留病灶直径、病理类型、FIGO 分期、体重指数(BMI)、腰围身高比(WHtR)、分化程度、淋巴结转移、有无腹水、分娩次数、妊娠次数、饮酒/吸烟、术前血清人附睾蛋白4(HE4)及糖类抗原125(CA125)、血清白蛋白(ALB)水平等。
1.2.3 随访及分组 CRS 术后至临床症状完全缓解,开展门诊随访,3 个月随访一次,随访结束时间2022 年3 月。统计患者生存情况,死亡患者纳入死亡组,存活者纳入存活组。
1.3 观察指标(1)统计患者生存情况。(2)分析晚期卵巢癌行CRS 术预后情况的影响因素。
1.4 统计学处理 采用统计学软件SPSS 22.0 处理数据,计数资料用率(%)表示,比较采用χ2检验;影响因素采用logistic 回归分析。以P<0.05 为差异有统计学意义。
2 结果
2.1 生存情况 本组50 例患者至随访截止共22 例死亡,死亡率为44.00%(22/50)。
2.2 晚期卵巢癌行CRS 术预后情况的单因素分析 两组年龄、病理类型、FIGO 分期、BMI、WHtR、分化程度、淋巴结转移、分娩次数、妊娠次数、手术时间、饮酒/吸烟、术中出血量比较,差异均无统计学意义(P>0.05)。两组腹水、残留病灶直径、血清HE4、CA125、ALB 水平比较,差异均有统计学意义(P<0.05),见表1。

表1 晚期卵巢癌行CRS术预后情况的单因素分析

表1(续)

表1(续)

表1(续)
2.3 晚期卵巢癌行CRS 术预后情况的多因素分析 以晚期卵巢癌CRS 术后生存情况为应变量(存活=0,死亡=1),腹水(无=0,有=1)、残留病灶直径(≤1 cm=0,>1 cm=1)、血 清HE4(<200 pmol/L=0,≥200 pmol/L=1)、CA125(<200 U/mL=0,≥200 U/mL=1)、ALB 水平(≤35 g/L=0,>35 g/L=1)为自变量,纳入logistic 回归模型,结果显示,有腹水、残留病灶直径>1 cm、血清HE4、CA125水平升高是晚期卵巢癌CRS 术后死亡的独立危险因素(P<0.05),ALB 水平升高是保护因素(P<0.05),见表2。
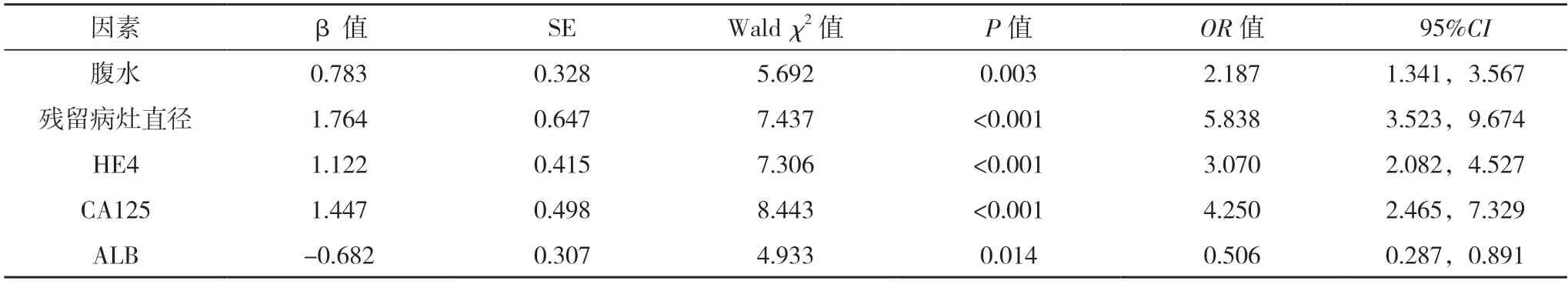
表2 晚期卵巢癌行CRS术预后情况的多因素分析
3 讨论
卵巢癌发病隐匿,预后较差,确诊时病情大多已处于中晚期,失去最佳根治性手术时机[5]。随着治疗技术的进步,CRS 成为治疗晚期卵巢癌的主要手段。但长期临床研究发现,即使患者积极配合,接受标准治疗,术后复发率、死亡率仍较高[6-7]。故积极寻找影响晚期卵巢癌CRS 术后预后的相关因素有积极意义。
晚期卵巢癌术后预后情况受多种因素影响。王秋宇等[8]通过logistic 回归分析证实,腹水、残余病灶是卵巢癌初次CRS 术后复发的危险因素。本研究支持上述研究,死亡组中有腹水、残留病灶直径>1 cm 者占比分别为59.09%、63.64%,明显高于存活组。分析原因在于腹水量过多提示肿瘤细胞数量多,更易向其他部位转移,若术中忽略转移部位,术后随着转移肿瘤细胞生长、增殖,可增加卵巢癌复发风险,影响预后[9]。而残留病灶大,表明术后患者体内残留较多肿瘤细胞,随其增殖、生长,可再次复发并进展为更严重的状态[10]。故残留病灶直径>1 cm 预后较差。肿瘤分期是病情程度的有效指标,Ⅲ、Ⅳ期患者肿瘤增长更快,数量更多,扩散范围更广,故治疗效果较差,一般预后不佳[11-12]。另外临床大量研究证实,肿瘤预后及复发与其分期关系密切,临床分期越高,其预后越差,复发风险越高[13-14]。而本研究表明,FIGO 分期不同患者预
后无明显差异,与上述研究不同。分析原因可能与本文纳入对象均为晚期卵巢癌有关,FIGO 分期为Ⅲ期或Ⅳ期。
CA125 是卵巢癌常用诊断指标,正常情况分泌极少或不分泌,而一旦出现卵巢恶性病变,其水平可明显升高[15]。已有研究证实,CA125 能辅助诊断卵巢癌,评价复发及预后[16]。而本研究也表明,CA125 水平升高是晚期卵巢癌死亡的独立危险因素(P<0.05),进一步证实CA125 水平与卵巢癌预后的相关性。另外本研究还显示,血清HE4 及ALB 水平是晚期卵巢癌死亡的影响因素(P<0.05)。分析相关机制:(1)HE4 是新型卵巢癌血清标志物,能诱导肿瘤细胞分裂,促进肿瘤增殖,并抑制其凋亡,同时该过程HE4 能激活ERK、AKT 信号通路,促使组织耐药,反映肿瘤存活率[17-18]。(2)ALB 是人体血清蛋白主要成分,占比为50%~65%,具有抗炎、解毒、抗氧化、转运、储存等生理功能。随肿瘤进展,微血管通透性升高,ALB 渗透随之增加,可进一步减少ALB 含量,而术前ALB 水平过低易造成腹腔或胸腔积液,积液量越大,含瘤风险越高,其所含癌细胞越多,癌细胞更易向其他部位转移,从而会增加术后复发、转移风险[19-20]。
综上所述,晚期卵巢癌患者CRS 术后预后情况受残留病灶直径、有无腹水、血清HE4、CA125、ALB 水平影响,临床上应结合上述影响因素,尽早采取针对性干预措施,有助于进一步延长患者生存期,改善预后。
