原发性高血压患者血压变异性及Lp-PLA2、sdLDL-C与颈动脉硬化程度的相关性*
2022-12-10梁营营张娟秦瑞丹
梁营营 张娟 秦瑞丹
原发性高血压(primary hypertension,PH)是以体循环动脉压升高为主要临床表现的循环系统疾病,可引起多个靶器官损害,对人类的生命健康构成巨大威胁,加重社会经济负担[1]。相关研究表明,血压变异性(blood pressure vari-ability,BPV)是心血管事件和死亡的可靠独立预测因子,高BPV 进一步加重靶器官损伤[2]。动脉血管壁改变是高血压最重要和致命的并发症之一[3]。研究报道显示,动脉硬化是一种慢性炎症性疾病,脂质代谢异常加速动脉内膜增厚或斑块形成的进程[4]。脂蛋白相关磷脂酶A2(lipoprotein-associated phospholipase A2,Lp-PLA2)由巨噬细胞高度表达,被认为可能是血管炎症的特异性标记物,与斑块的形成和发展密切相关[5]。小而密低密度脂蛋白胆固醇(small and dense low density lipoprotein cholesterol,sdLDL-C)是低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)的亚组分之一,有研究证明sdLDL-C 比LDL-C 更容易致动脉硬化,与冠心病严重程度相关[6]。综合以上背景,本研究分析了原发性高血压患者BPV、Lp-PLA2、sdLDL-C 与颈动脉硬化的关系,旨在为高血压患者早期临床干预提供更多的依据。
1 资料与方法
1.1 一般资料 回顾性分析2021 年1 月-2022 年5 月郑州大学第二附属医院收治的151 例高血压患者的临床资料为高血压组,根据颈动脉内膜中层厚度(IMT)将高血压组分为单纯高血压组54 例、高血压颈动脉硬化组97 例两个亚组;另随机选择同期体检的64 例健康人为对照组。纳入标准:(1)年龄≥18岁,临床资料完整;(2)观察组符合文献[1]《中国高血压防治指南(2018 年修订版)》中PH 诊断标准:①在未使用降压药物的情况下,非同日3 次测量诊室血压(OBPM),收缩压(SBP)≥140 mmHg(1 mmHg=0.133 kPa)和/或舒张压(DBP)≥90 mmHg;②SBP≥140 mmHg和DBP<90 mmHg 为单纯收缩期高血压;既往有高血压史,目前正在使用降压药物,血压虽然低于140/90 mmHg,仍应诊断为高血压;③动态血压监测(ABPM)的高血压诊断标准为平均24 h SBP/DBP≥130/80 mmHg;白天≥135/85 mmHg;夜间≥120/70 mmHg;④家庭血压监测(HBPM)的高血压诊断标准为≥135/85 mmHg,与OBPM 的140/90 mmHg 相对应。排除标准:(1)合并急慢性感染、严重心肝肾功能受损;血液系统疾病、自身免疫病、罹患恶性肿瘤或肿瘤待排;(2)处于妊娠期或哺乳期妇女。高血压组男90例,女61例,年龄35~87岁,平均(63.15±9.61)岁。对照组男38例,女26例,年龄42~85岁,平均(61.34±9.90)岁。本研究经本院伦理委员会审核通过,入组者均签署知情同意书。
1.2 方法
1.2.1 临床资料采集 入组对象完善姓名、性别、年龄、身高、体重、体重指数(BMI)、吸烟史等基本资料;所有对象空腹至少8 h 采集肘静脉血3 mL,利用全自动生化分析仪测定空腹血糖(FPG)、糖化血红蛋白(HbA1c)、甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、尿酸(UA)、同型半胱氨酸(Hcy)、肌酐(Scr)等生化指标。
1.2.2 血浆Lp-PLA2、sdLDL-C 水平检测 利用全自动生化分析仪测定sdLDL-C 水平。另采集3 mL静脉血采用ELISA 检测循环Lp-PLA2 水平。
1.2.3 24 h 动态血压监测 入选患者均佩带24 h 美高仪动态血压仪(MGY-ABPL 型)监测动态血压,监测期间禁烟酒,设定6:00~22:00 为白天,每30 min 自动充气测量并记录血压1 次;22:00~次日6:00 为夜间,每60 min 自动充气测量并记录血压1 次。并嘱患者当测量血压时保持袖带绑定侧上肢静止。24 h 血压监测期间每小时至少有1 次血压读数,确保有效读数应占总读数次数的70%以上[1]。记录24 h 平均收缩压(24 h systolic blood pressure,24 h SBP)、24 h 平均舒张压(24 h diastolic blood pressure,24 h DBP)、白天平均收缩压(daytime systolic blood pressure,dSBP)、白天平均舒张压(daytime diastolic blood pressure,dDBP)、夜间平均收缩压(nighttime systolic blood pressure,nSBP)、夜间舒张压均值(nighttime diastolic blood pressure,nDBP)、24 h 收缩压标准差(the standard deviation of 24 h systolic blood pressure,24 h SSD)、24 h 舒张压标准差(the standard deviation of 24 h diastolic blood pressure,24 h DSD)、白天收缩压标准差(the standard deviation of daytime systolic blood pressure,dSSD)、白天舒张压标准差(the standard deviation of daytime diastolic blood pressure,dDSD)、夜间收缩压标准差(the standard deviation of nighttime systolic blood pressure,nSSD)、夜间舒张压标准差(the standard deviation of nighttime diastolic blood pressure,nDSD)等指标。
1.2.4 颈动脉超声检查 由本院彩超室同一有经验的医师应用三MOODEL-WS80A 超声诊断仪检查入组对象颈动脉粥样硬化情况,探头的频率为8~12 MHz,取颈总动脉远端即分叉前2、1.0~1.5 cm范围内观察颈总动脉,测量颈动脉内膜中层厚度(IMT),记录IMT 最厚处;颈动脉分叉IMT 亦选取分叉处前、后壁IMT 最厚处;在舒张末期测定IMT值,记录3 个心动周期取平均值。IMT<1.0 mm 为正常;IMT 在1.0~1.5 mm 为增厚;IMT>1.5 mm 表示斑块形成,IMT 增厚和斑块形成标记为颈动脉硬化[1]。
1.3 统计学处理 使用统计软件SPSS 26.0 进行所有数据的统计分析,呈正态分布或近似正态分布的计量资料以()表示,组间比较采用单因素方差分析,若方差齐,两两间采用LSD 法;若方差不齐,则采用Tamhane’s 法;呈偏态分布的计量资料则以M(P25,P75)表示,组间比较采用秩和检验;而计数资料用率(%)表示,组间比较采用χ2检验;高血压患者颈动脉IMT 的影响因素采用Spearman相关分析和二元logistic 回归分析。以P<0.05 表示差异有统计学意义。
2 结果
2.1 三组一般资料比较 三组年龄、性别、吸烟史、TG、HDL-C、FPG、UA、BMI、Hcy、Scr、HbA1c比较,差异均无统计学意义(P>0.05)。高血压颈动脉硬化组TC、LDL-C 均高于对照组和单纯高血压组(P<0.05)。单纯高血压组和对照组的TC、LDL-C 比较,差异均无统计学意义(P>0.05)。见表1。
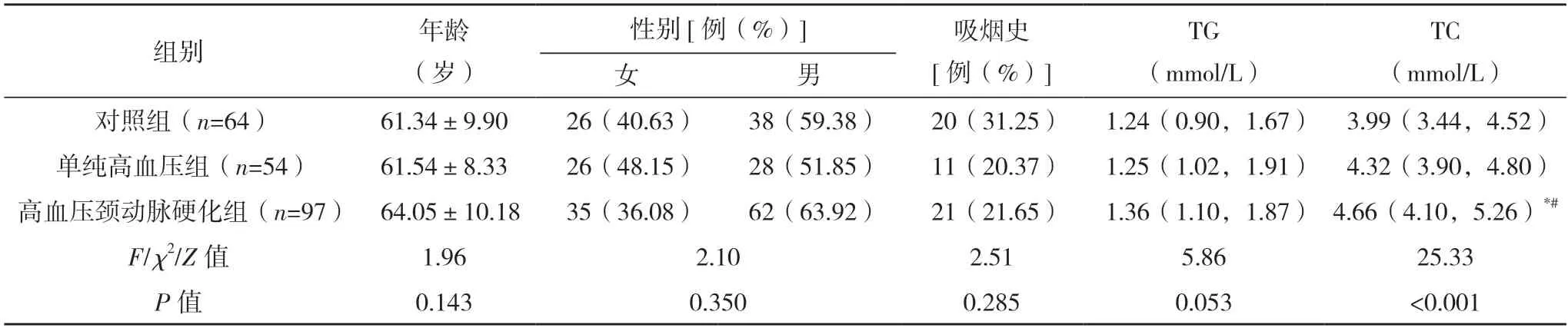
表1 三组一般资料比较

表1(续)

表1(续)
2.2 三组动态血压水平比较 单纯高血压组和高血压颈动脉硬化 组24 h SBP、24 h DBP、dSBP、dDBP、nSBP、nDBP 均高于对照组,差异均有统计学意义(P<0.05)。高血压颈动脉硬化组24 h SBP、dSBP、nSBP 水平均高于单纯高血压组,差异均有统计学意义(P<0.05)。见表2。
表2 三组动态血压水平比较[mmHg,()]

表2 三组动态血压水平比较[mmHg,()]
*与对照组比较,P<0.05;#与单纯高血压组比较,P<0.05。
2.3 三组血压变异性指标比较 高血压颈动脉硬化组24 h SSD、24 h DSD、dSSD、nSSD、nDSD 均高于对照组,差异均有统计学意义(P<0.05)。高血压颈动脉硬化组24 h SSD、dSSD、nSSD 均高于单纯高血压组,差异均有统计学意义(P<0.05)。见表3。
表3 三组血压变异性指标比较[mmHg,()]

表3 三组血压变异性指标比较[mmHg,()]
*与对照组比较,P<0.05;#与单纯高血压组比较,P<0.05。
2.4 三组Lp-PLA2、sdLDL-C 水平比较 高血压颈动脉硬化组Lp-PLA2、sdLDL-C 水平均高于对照组和单纯高血压组,且单纯高血压组均高于对照组,差异均有统计学意义(P<0.05),见表4。
表4 三组Lp-PLA2、sdLDL-C水平比较()
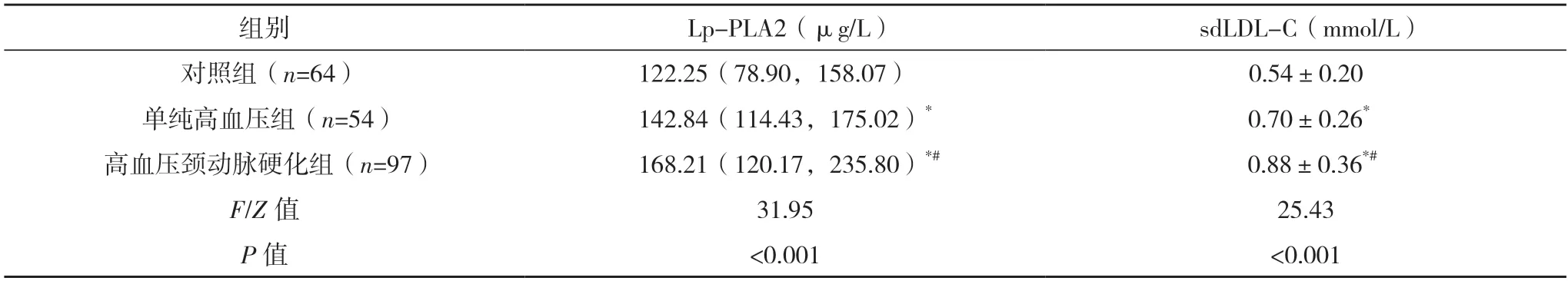
表4 三组Lp-PLA2、sdLDL-C水平比较()
*与对照组比较,P<0.05;#与单纯高血压组比较,P<0.05。
2.5 高血压组颈动脉硬化程度与Lp-PLA2、sdLDL-C、动态血压及BPV 参数的相关性分析 Spearman 相关分析可得,高血压组患者的颈动脉硬化程度与Lp-PLA2、sdLDL-C、24 h SBP、dSBP、nSBP、24 h SSD、dSSD、nSSD 均呈正相关(P<0.05),见表5。

表5 颈动脉硬化程度与Lp-PLA2、sdLDL-C、动态血压及BPV相关性分析
2.6 Lp-PLA2、sdLDL-C、动态血压及BPV 对高血压患者IMT 影响的logistic 回归分析 高血压组以是否动脉粥样硬化为应变量,以Lp-PLA2、sdLDL-C、BPV 及动态血压的各个指标为协变量,依次进行二元logistic 回归分析,结果显示:β 值为2.752,P值为0.022,OR值为15.672,95%CI(1.487,165.179),提示sdLDL-C 是高血压患者颈动脉硬化的独立危险因素(P<0.05)。
3 讨论
研究发现颈动脉硬化程度可间接反映冠脉、脑等全身大、中血管动脉粥样硬化的程度,被认为是心脑血管事件的独立危险因素[7],临床上经常通过超声测量IMT 以早期发现动脉血管硬化情况[3]。高血压、糖尿病、高脂血症、吸烟等易引发动脉粥样硬化,具体机制如下:脂质浸润学说、损伤反应学说、炎症学说、神经体液调节。这些学说的基础主要源于血管内皮损伤,血压增高导致血流速度和冲击力增加,造成了血管壁的机械性损伤,使脂质、血小板等血管内物质易于沉积在动脉内膜[8-9],从而导致了动脉硬化的发生。目前,高血压患者BPV与Lp-PLA2、sdLDL-C 及颈动脉硬化的关系鲜有报道。本研究将高血压患者作为研究对象,根据彩超结果将高血压患者分为单纯高血压组、高血压颈动脉硬化组,拟探寻高血压患者BPV 与Lp-PLA2、sdLDL-C 及颈动脉硬化的关系。
正常人24 h 血压节律呈“双峰双谷”或“双峰一谷”的曲线变化。在一定时间内血压变异的程度称为BPV,可以用动态血压标准差(SD)和变异系数(CV)表示。本研究通过对151 例高血压患者和64 例正常人进行分析发现:与单纯高血压组比较,高血压颈动脉硬化组在24 h SBP、dSBP、nSBP、24 h SSD、dSSD、nSSD 水平升高,而在舒张压水平则无明显差异,提示收缩压及收缩压变异性可能在老年高血压人群颈动脉硬化过程中发挥了更重要的作用。相关性分析显示颈动脉硬化程度与24 h SSD、dSSD、nSSD、24 h SBP、dSBP、nSBP 均呈正相关,由此推测收缩压及收缩压变异性可能与高血压患者靶器官损伤的关系更为密切,与国内外研究基本一致[10]。BPV 对动脉粥样硬化的影响主要表现在血压昼夜节律改变加大了对血管壁的压力,导致了血管内皮损伤,另一方面也可以直接诱发炎症反应。Li 等[11]观察了80 例高血压患者24 h SBPV 与靶器官损害的关系,结果亦发现高血压组患者24 h SBPV和dSBPV 明显高于对照组,高BPV 组的冠心病、动脉粥样硬化斑块、IMT 等发生率均高于低BPV 组。因此在老年患者降压过程中,不仅要根据血压变化特点合理选择降压药将血压控制在合适的水平,而且要尽量保持正常血压节律,以减少靶器官损伤。
Lp-PLA2 又称血小板活化因子乙酰水解酶(PAF-AH),是磷脂酶A2 家族的一个50 kD、Ca2+独立成员,血液中大约80%的Lp-PLA2 与LDL-C结合,只有约20%与HDL-C 或其他循环脂蛋白结合,其分解氧化低密度脂蛋白(ox-LDL)产生溶血磷脂酰胆碱和氧化自由脂肪酸等物质可促进动脉粥样硬化的形成[12],被认为是一种新出现的与动脉粥样硬化相关的炎症生物标志物[13]。地里夏提·吾斯曼等[14]认为随着高血压的分级增高,Lp-PLA2 水平较对照组明显升高,差异具有统计学意义。一项关于顽固性高血压患者的研究显示,高血压病情越重,血浆Lp-PLA2 水平越高[15]。本研究发现高血压组血浆Lp-PLA2 水平均明显高于对照组,高血压亚组分析时高血压颈动脉硬化组Lp-PLA2 水平高于单纯高血压组,Spearman 相关性分析显示Lp-PLA2与颈动脉硬化程度正相关。分析其原因可能为Lp-PLA2 的水平越高,氧化及诱导炎症反应的能力越强,促进了动脉硬化的形成;而随着动脉硬化程度的加重,机体通过复杂的生物反应刺激大量Lp-PLA2 的产生,进一步加重了血管内皮的损伤,从而加速了动脉硬化的进展,二者互为因果关系。但回归分析尚未发现Lp-PLA2 与颈动脉硬化的关系,原因可能是少量患者应用了调脂药物,会对结果产生影响,未来需大样本研究进一步证实Lp-PLA2 是否是高血压颈动脉硬化的独立危险因素。
研究显示根据LDL-C 颗粒的异质性、脂蛋白直径、密度和氧化等特点,可将其分为两大类,其中LDL-3-7 颗粒较小,称为sdLDL-C[16-17]。指南中指出LDL-C 在动脉粥样硬化性心血管疾病(ASCVD)中起着关键性作用,LDL-C 水平降低是ASCVD 一级和二级预防的主要治疗目标[18]。但在临床工作中,发现许多LDL-C 水平正常或低于正常范围的患者仍可检出动脉粥样硬化斑块[16],提示亚组分可能影响动脉粥样硬化的进展。一项关于sdLDL-C与冠心病风险的前瞻性、大样本的研究显示:血清sdLDL-C 水平是未来冠心病发展的相关生物标志物,它提供了除血清LDL-C 水平之外的益处[19]。Hanlu 等[20]临床研究结果表明,sdLDL-C 是高危卒中患者心脑血管事件的危险因素,与心脑血管事件呈正相关。但在高血压患者的研究中目前相对较少,有部分小样本研究显示:与对照组相比,sdLDL-C水平在高血压患者中更高[21-22]。本研究发现,高血压组sdLDL-C 水平高于对照组,差异有统计学意义(P<0.05);进一步对高血压组分析,高血压颈动脉硬化组sdLDL-C 水平高于单纯高血压组,差异仍有统计学意义(P<0.05),说明sdLDL-C 可能致高血压患者颈动脉硬化形成的能力更强,在高血压治疗过程中,降低sdLDL-C 水平有望成为新的方向;logistic 回归分析表明sdLDL-C 是高血压患者颈动脉硬化的独立危险因素。这一观点可解释为:(1)sdLDL 颗粒较小,与肝脏LDL 受体的亲和力较低,清除缓慢,在血液中滞留时间长;(2)sdLDL 增加氧化修饰,抗氧化能力减低;(3)sdLDL 对动脉蛋白多糖氧化亲和力和敏感性增加等[21,23]。
本研究的局限性:为小样本、单中心,未来需完善大样本、多中心研究;其次影响动脉硬化的因素众多,尚未对混杂因素校正。
综上所述,本文明确了Lp-PLA2、sdLDL-C、BPV 对高血压患者颈动脉硬化的影响,有助于在临床上早期识别危险因素,从而早期干预,使高血压患早期临床获益,对预防高血压患者心脑血管疾病具有重要意义。
