DCE-MRI在脑胶质瘤病理分级诊断及病变范围界定中的应用价值分析
2022-12-10陈彩美夏桂芳
陈彩美 夏桂芳
脑胶质瘤是较为常见的神经系统恶性肿瘤,根据组织病理学特征对脑胶质瘤进行分级,是评估肿瘤恶性程度、明确治疗方案、提高患者生存率的关键[1-2]。脑组织活检是诊断脑胶质瘤分级的“金标准”,但该检查方法属于有创操作,在肿瘤的立体定位、术前诊断中的应用有一定局限性[3]。动态对比增强磁共振成像(DCE-MRI)可通过分析病灶组织的血流动力学特征,提高肿瘤疾病的诊断准确率,是近年来发展较快的恶性肿瘤诊断方法[4]。当前,有关DCE-MRI 在脑胶质瘤诊断中的应用较多[5],但其在脑胶质瘤病变范围界定中的报道较少。本研究主要分析了DCE-MRI 在脑胶质瘤病理分级诊断及病变范围界定中的应用。
1 资料与方法
1.1 一般资料 回顾性分析2019 年6 月-2021 年12 月中国人民解放军联勤保障部队第九〇八医院收治的经手术病理证实的72 例脑胶质瘤患者的临床资料。纳入标准:(1)术中组织学病理检查符合脑胶质瘤的诊断标准[6];(2)患者性别不限,年龄≥18 岁;(3)术前接受MRI 扫描,相关资料完整。排除标准:(1)在接受MRI 检查前进行过放化疗、手术或穿刺等有创操作;(2)存在其他颅内病变。根据术中组织学病理检查结果将患者分为低级别组(Ⅱ级,n=29)和高级别组(Ⅲ、Ⅳ级,n=43)。本研究经医院伦理委员会批准。
1.2 方法
1.2.1 MRI 扫描 采用Philips Achieva 3.0T TX 型磁共振扫描仪、8 通道头部线圈进行扫描,扫描中心位置为胼胝体下缘,扫描范围为自头顶至颅底。检查时取仰卧位,头先进,扫描过程中嘱患者自然呼吸。扫描序列,(1)横轴位T1WI:TR 1 750 ms,TE 25.2 ms,层厚4 mm,矩阵320×256;(2)横轴位T2WI:TR 4 080 ms,TE 91 ms,层厚5 mm,矩阵512×512;(3)T2FLAIR:TR 8 400 ms,TE 147 ms,层厚5 mm,矩阵256×160;(4)DCE-MRI:采用3D肝脏容积快速采集技术,扫描参数:TR 4.1 ms,TE 2.0 ms,矩阵256×192,激励次数0.68。扫描1 期后,依次以2 mL/s 注射速度于肘静脉注射0.1 mmol/kg钆喷酸葡胺注射液(生产厂家:上海旭东海普药业有限公司,批准文号:国药准字H19991368,规格:20 mL∶9.38 g)、20 mL 生理盐水;扫描50期,采集时间共7 min 18 s。
1.2.2 图像分析 采用Omnikinetics 软件进行图像分析,于对比剂强化区画出感兴趣区(ROI),注意避开坏死、出血、囊变及钙化部位;生成个ROI 的容积转移常数(Ktrans)、血管外细胞外空间容积分数(Ve)、速率常数(Kep)、脑血容量(CBV),计算相对血容量(rCBV)=肿瘤CBV/对侧正常脑组织CBV。每个肿瘤实质中心区和水肿区(仅瘤周1 cm内)进行3 次测量,以3 次测量结果的平均值为最终结果。
1.3 统计学处理 采用SPSS 20.0 软件进行数据分析。计量资料以()表示,比较采用t检验;计数资料以率(%)表示,行χ2检验或Fisher 确切概率检验;应用MedCalc15.1 统计学软件绘制受试者工作特征曲线(ROC),评价DCE-MRI 定量参数对脑胶质瘤病理分级的诊断价值。以P<0.05 为差异有统计学意义。
2 结果
2.1 两组一般资料比较 两组一般资料比较,差异均无统计学意义(P>0.05),见表1。

表1 两组一般资料比较
表1(续)
2.2 高、低级别脑胶质瘤患者MRI 图像特征分析 29 例低级别脑胶质瘤(Ⅱ级)患者MRI 显示肿瘤边界不清,T1WI、T2WI 呈不均匀高信号,瘤周轻度水肿,局部轻度占位,伴随囊变、出血,增强后强化不明显或呈轻度不均匀强化,见图1。43 例高级别脑胶质瘤(Ⅲ、Ⅳ级)患者MRI 显示T1WI 呈不均匀高信号,T2WI 可见明显指状水肿影,占位征象明显,伴瘤体坏死或囊变、出血,增强后呈明显花环状、结节样强化,见图2、3。
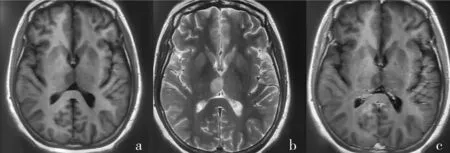
图1 低级别脑胶质瘤(Ⅱ级)患者DCE-MRI图像
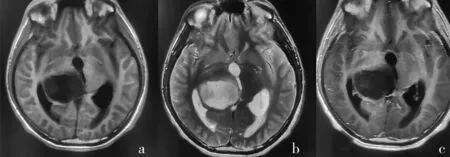
图2 高级别脑胶质瘤患者(Ⅲ级)DCE-MRI图像。

图3 高级别脑胶质瘤患者(Ⅳ级)DCE-MRI图像
2.3 高、低级别组实质中心区DCE-MRI 定量参数比较 低级别组患者实质中心区的Ktrans、Ve、Kep和rCBV 值均小于高级别组患者(P<0.05),见表2。
表2 两组实质中心区DCE-MRI定量参数比较()

表2 两组实质中心区DCE-MRI定量参数比较()
2.4 高、低级别组水肿区DCE-MRI 定量参数比较 低级别组水肿区的rCBV 值小于高级别组患者(P<0.05)。两组水肿区Ktrans、Ve、Kep值比较,差异均无统计学意义(P>0.05),见表3。
表3 两组水肿区DCE-MRI定量参数比较()

表3 两组水肿区DCE-MRI定量参数比较()
2.5 DCE-MRI 定量参数对脑胶质瘤病理分级的诊断价值分析 ROC 曲线分析结果显示,DCE-MRI定量参数Ktrans、Ve、Kep和rCBV 诊断不同病理分级脑胶质瘤的AUC 值分别为0.795、0.840、0.881;当Ktrans、Ve、Kep和rCBV 的值分别为0.410/min、0.184、0.946/min、3.395时,Younden’s 指数最大。各指标的敏感度和特异度见表4、图4。
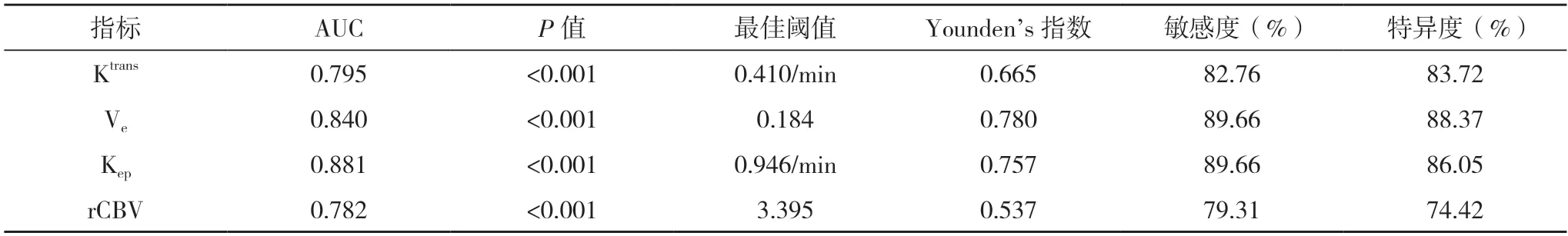
表4 DCE-MRI定量参数在脑胶质瘤病理分级诊断中的价值分析
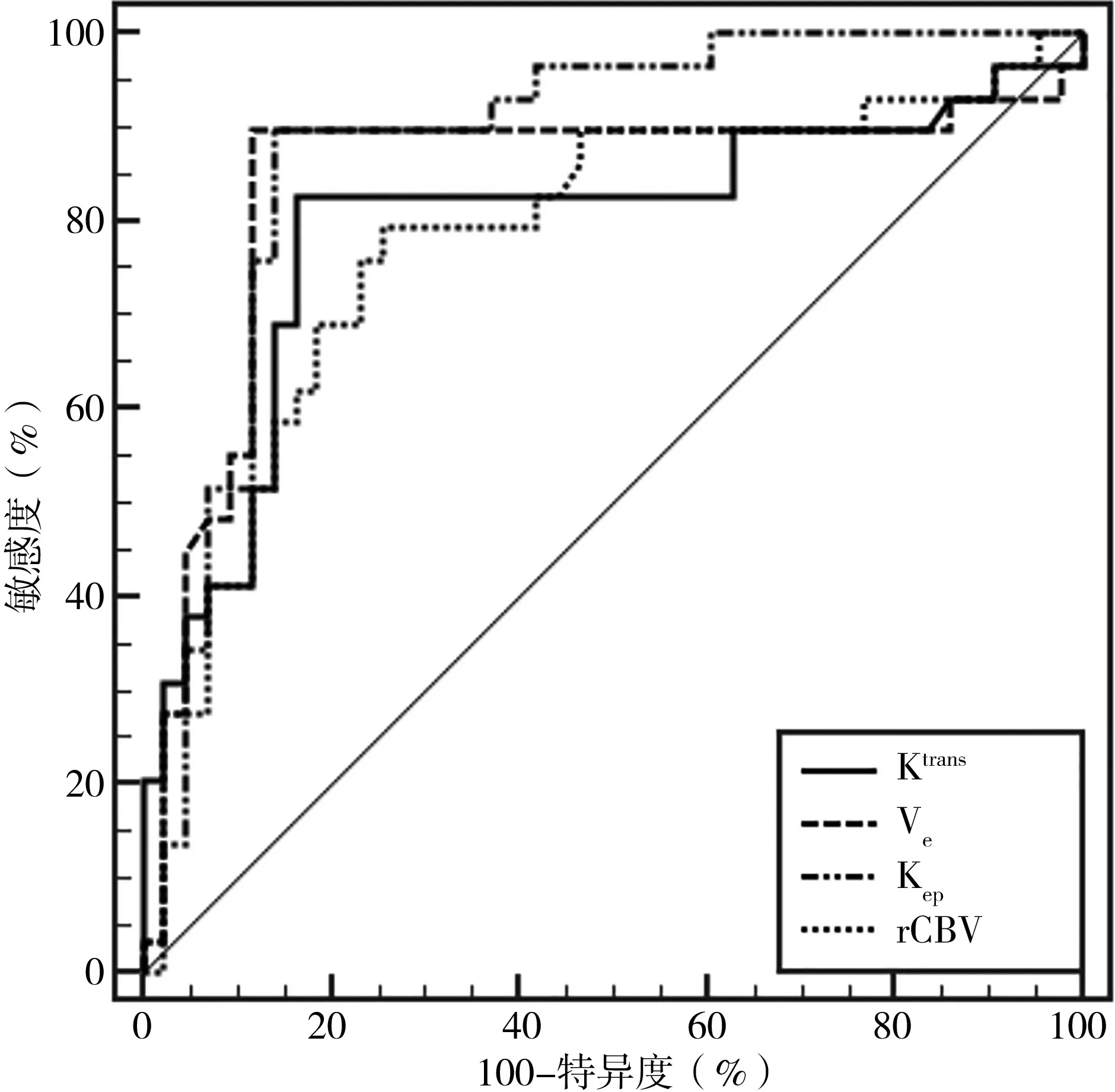
图4 DCE-MRI定量参数诊断脑胶质瘤病理分级的ROC曲线
3 讨论
脑胶质瘤病理分级的不同,其病情进展、治疗方案及患者预后也存在差异。对于低级别脑胶质瘤,手术治疗即可获得良好的预后,而单纯的手术切除无法明显改善高级别胶质瘤患者的生存率,术后需辅以放化疗。因此,术前诊断脑胶质瘤的分级,对术后治疗方案的选择具有重要意义。DCE-MRI 主要依据对比剂在病灶组织中的浓度变化,量化分析其血流动力学特征,从而实现对肿瘤恶性程度的鉴别诊断[7]。一项有关DCE-MRI 诊断脑胶质瘤的研究发现,DCE-MRI 定量参数对于脑胶质瘤的分级诊断具有重要的诊断价值,联合细胞增殖相关核蛋白抗原检测可进一步提高诊断的敏感度[8]。
本研究发现,不同病理等级的脑胶质瘤,其MRI 特征存在明显差异,具体表现为:低级别脑胶质瘤瘤周水肿、占位情况较轻,增强后强化不明显或呈轻度不均匀强化;高级别脑胶质瘤可见明显水肿影,占位征象明显,与既往研究结论一致[9],证实脑胶质瘤病理分级不同会导致MRI 表现存在差异。随着脑胶质瘤病理分级的增加,瘤周水肿及坏死囊变程度加重,微血管密度发生变化,使得T1、T2信号影发生改变,强化程度不同。
本研究发现,低级别组实质中心区的Ktrans、Ve、Kep和rCBV 均小于高级别组(P<0.05)。细胞学研究发现,新生血管数量增加是肿瘤细胞生长过程中的重要改变,这一变化会导致血管密度增加,并在血管内皮生长因子的过表达、肿瘤细胞的异构性等的影响下,使血管通透性发生改变,进而引起血管渗漏[10]。脑胶质瘤病理分级越高,微血管密度与血管通透性越高,导致血管外细胞外间隙的对比剂浓度差进一步增大,进而影响对比剂的交换速度[11]。此外,肿瘤细胞往往存在细胞间隙偏大、排列混乱等情况,从而使得Ktrans、Ve、Kep、rCBV 值较高[12]。ROC 曲线分析结果显示,Ktrans、Ve、Kep和rCBV 诊断不同病理分级脑胶质瘤的AUC 分别为0.795、0.840、0.881,提示DCE-MRI 定量参数在脑胶质瘤病理分级方面具有较高的诊断价值,临床可通过对脑胶质瘤患者DCE-MRI 定量参数的检查进行病情评估和分级诊断。
既往研究表明,脑胶质瘤的周围往往伴有不同程度的水肿。本研究发现,低级别组水肿区的rCBV 小于高级别组(P<0.05)[13]。新生肿瘤血管血脑屏障不规则、破坏等会导致局部形成血管源性水肿;高级别肿瘤细胞生长时,瘤周水肿区可能部分或全部浸润至肿瘤组织,使水肿区新生血管的数量显著增多,血管渗透性改变后导致rCBV 继发性升高[14-15]。而对于瘤周1 cm 以外的水肿区来说,该区域以细胞毒性水肿为主,因此不同级别脑胶质瘤患者水肿区的rCBV 值无明显差异,rCBV 在脑胶质瘤病变范围的界定方面具有一定的应用价值[16-20]。本研究中,两组患者水肿区的Ktrans、Ve、Kep无明显差异,考虑与两种级别胶质瘤患者瘤周水肿区毛细血管相对完整有关。
综上所述,DCE-MRI 在脑胶质瘤病理分级诊断及病变范围界定中均具有良好的应用价值,定量参数Ktrans、Ve、Kep和rCBV 是鉴别高、低级别脑胶质瘤的可靠指标,rCBV 在病变范围的界定方面更具有诊断价值。
