风湿性心脏病伴左房血栓患者围术期凝血-纤溶系统标志物水平的变化及临床意义▲
2022-12-09宋仁义
宋仁义 黄 晖 孔 勇
(广西壮族自治区桂东人民医院心内科,广西梧州市 543001)
风湿性心脏病(rheumatic heart disease,RHD)主要是指因免疫性炎症累及心脏瓣膜所致的心脏瓣膜病变,可表现为主动脉瓣、二尖瓣、三尖瓣中的一个或多个瓣膜发生狭窄、关闭不全[1-2]。RHD患者在发病初期常无明显症状,后期可表现为乏力、心慌气短、下肢水肿、咳粉红色泡沫痰等心功能失代偿的表现[3-4]。根据《中国心血管病报告2018》的统计结果,我国约有250万例RHD患者[5]。近年来随着人们健康意识的提高,RHD患病率的增速有所下降,但我国RHD患者数量仍较为庞大[6]。临床研究显示,由于存在血流动力学障碍或心房颤动,部分RHD患者还可能伴有左心房血栓形成,若血栓脱落可导致下肢、肾及脑等部位的动脉栓塞,给患者的生命健康带来极大威胁[7]。有学者认为,左房血栓患者的血液呈血栓前状态,其机体存在一定程度的凝血-纤溶系统紊乱[8]。目前,瓣膜置换术是治疗RHD的有效手段之一,而术中体外循环、手术操作、药物等多种因素均可能影响患者的凝血-纤溶系统,从而影响患者预后[9]。然而,对于RHD伴左房血栓患者术后是否会出现更严重的凝血-纤溶系统功能障碍而增加不良预后风险,目前仍未有明确定论。凝血酶-抗凝血酶复合物(thrombin-antithrombin complex,TAT)、凝血酶调节蛋白(thrombomodulin,TM)、纤溶酶-α2-抗纤溶酶复合物(plasmin-α2-antiplasmin complex,PAP)、组织型纤溶酶原激活剂-纤溶酶原激活物抑制剂-1复合物(tissue plasminogen activator-plasminogen activator inhibitor-1 complex,t-PAI-C)是临床常用的4种凝血-纤溶系统标志物,可用于监测凝血-纤溶系统的变化情况[10-11]。本研究通过分析RHD伴左房血栓患者围术期凝血-纤溶系统标志物的变化情况,初步探讨手术对RHD伴左房血栓患者凝血-纤溶系统功能的影响,现报告如下。
1 资料与方法
1.1 临床资料 选取2017年1月至2019年6月我院收治的90例RHD伴左房血栓患者作为血栓组,另纳入同期于我院治疗的90例无左房血栓的RHD患者作为无血栓组。纳入标准:(1)均符合2004年WHO制订的RHD诊断标准[12];(2)纽约心脏协会(New York Heart Association,NYHA)心功能分级[13]为Ⅱ~Ⅳ级;(3)年龄30~75周岁;(4)血栓组根据心脏超声等检查结果及术中观察确定存在左房血栓;(5)患者配合度高,愿意接受本研究相关指标的检测及随访。排除标准:(1)存在肝肾功能障碍或急、慢性感染;(2)合并急性心肌梗死、不稳定性心绞痛、心力衰竭;(3)合并糖尿病、血友病、恶性肿瘤;(4)既往有酒精滥用史;(5)入组前6个月内接受过外科手术治疗或有严重外伤史。本研究经我院医学伦理委员会批准,患者及其家属均对本研究知情同意并签署知情同意书。
1.2 研究方法
1.2.1 收集一般资料:收集患者的性别、年龄、病程、NYHA心功能分级等资料。
1.2.2 超声心动图检查:患者入院时完成超声心动图检查。采用美国惠普公司生产的HP2500型超声显像仪进行检查,调整胸部探头频率为3.5 MHz,常规测量左室收缩末期内径(left ventricular end-systolic dimension,LVESD)、左房内径,并通过压差减半时间法[14]计算二尖瓣口面积(mitral valve orifice area,MVO),同时观察左心房血栓形成情况。
1.2.3 手术方法:血栓组接受心脏瓣膜置换术及左心房血栓清除术治疗。患者入院立即常规给予皮下注射低分子肝素钠5 000 U抗凝治疗,每12 h一次,至术前12~24 h停用。于患者进入手术室后常规建立外周静脉通道,持续监测患者的心率、血压、血氧饱和度、中心静脉压、平均动脉压等指标。采用静吸复合麻醉,采用德国Stockert Ⅲ型体外循环机进行体外循环,根据主动脉瓣反流情况,选择经脉根部插针顺行灌注或阻断升主动脉后经冠状静脉窦持续逆行灌注浅低温体外循环下温氧合血以保护心肌。体外循环建立后,经房间沟或右房-房间隔将二尖瓣显露,探查二尖瓣和左心房血栓,对于新鲜的血栓使用海绵钳钳夹去除,对于与房壁粘连较为紧密的陈旧性血栓使用刮匙小心刮除,检查心耳处有无隐藏残留的血栓,如有血栓则予以清除。确认血栓完全清除后,使用海绵钳夹持纱布轻拭心房内粗糙面,将附着于房壁的血栓碎屑予以清除。随后加压膨肺,吸出部分肺静脉血液,操作时应小心避免血栓碎屑脱落至肺静脉。以生理盐水反复冲洗左心房、左心室,常规置换二尖瓣,扎闭左心耳,结束手术。术后常规给予皮下注射低分子肝素钠5 000 U抗凝治疗,每12 h一次,同时口服华法林,待抗凝达标(凝血酶原时间国际标准化比值为2.0~3.0)后停用低分子肝素钠,继续长期服用华法林。无血栓组只接受心脏瓣膜置换术,方法同血栓组。
1.2.4 凝血-纤溶系统标志物水平的检测:采集两组患者入院时,以及血栓组患者术毕、术后7 d时的肘静脉血3 mL,将血标本置于真空采血管中,使用枸橼酸钠抗凝后以3 000 r/min离心15 min,分离血浆。采用日本Sysmex公司生产的HISCL-800自动化学发光免疫分析仪及配套试剂盒(批号:160908、160710、161102、160910)检测患者血浆TAT、TM、PAP、t-PAI-C水平。
1.2.5 随访:对血栓组患者进行为期2年的随访,随访方式为门诊复查、电话随访等,随访内容为患者预后情况。根据患者预后情况将血栓组患者分为预后不良组和预后良好组,预后不良定义为患者术后2年内因RHD伴发血栓而死亡、发生脑梗死或血栓复发。
1.3 统计学分析 采用SPSS 24.0软件进行统计学分析。计量资料以(x±s)表示,组间比较采用t检验;血栓组内入院时、术毕、术后7 d 3个时间点的总体比较采用单因素方差分析,其中两两比较采用SNK-q检验;计数资料以例数(百分比)表示,组间比较采用χ2检验;等级资料的比较采用秩和检验。以P<0.05为差异具有统计学意义。
2 结 果
2.1 两组患者一般资料的比较 两组患者的性别、年龄、病程及NYHA心功能分级比较,差异均无统计学意义(均P>0.05)。见表1。
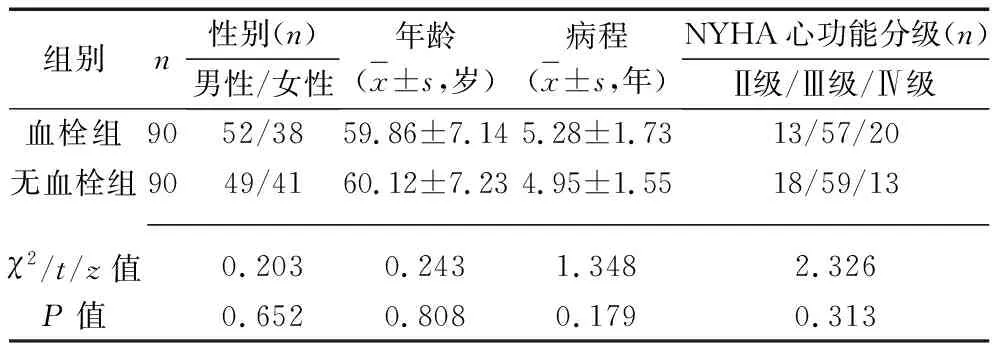
表1 两组患者一般资料的比较
2.2 两组患者超声心动图检查指标的比较 入院时,血栓组患者的LVESD、左房内径大于无血栓组,而MVO小于无血栓组(P<0.05)。见表2。
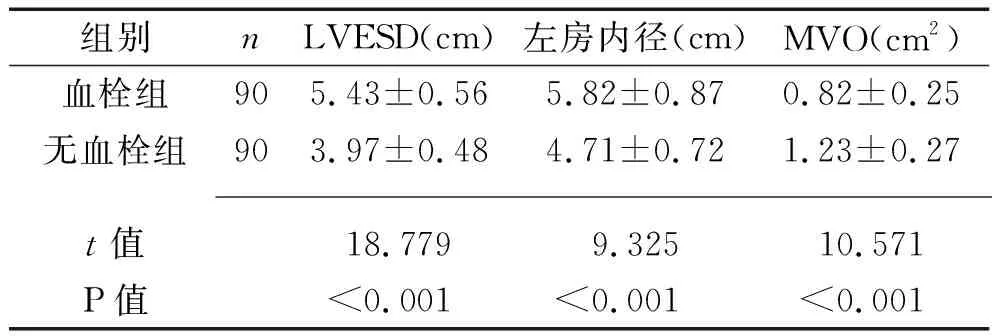
表2 两组患者超声心动图检查指标的比较(x±s)
2.3 两组患者凝血-纤溶系统标志物水平的比较 入院时,血栓组患者血浆TAT、TM、PAP及t-PAI-C水平均高于无血栓组(均P<0.05)。见表3。

表3 两组患者凝血-纤溶系统标志物水平的比较(x±s)
2.4 血栓组患者围术期凝血-纤溶系统标志物水平的变化情况 术毕,血栓组患者血浆TAT、TM、PAP及t-PAI-C的水平高于入院时(均P<0.05);术后7 d,血栓组患者上述指标水平均较术毕时降低(均P<0.05)。见表4。
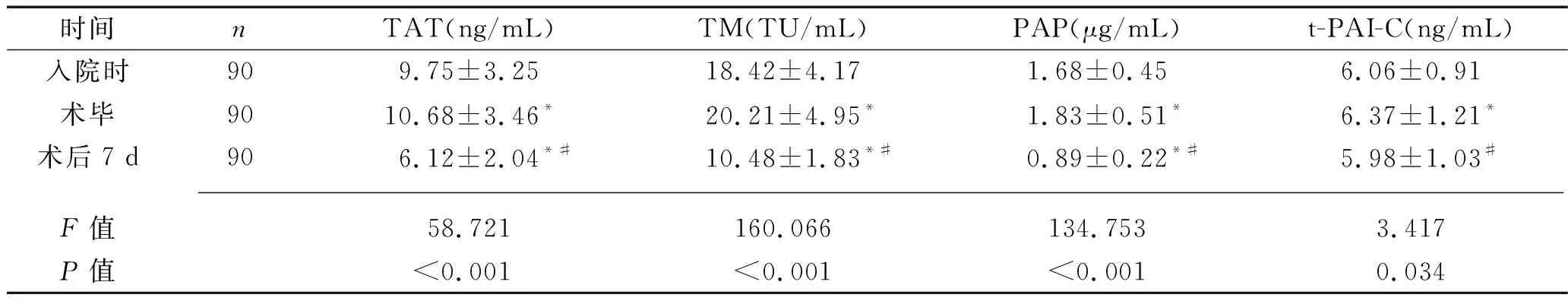
表4 血栓组患者围术期凝血-纤溶系统标志物水平的变化情况(x±s)
2.5 血栓组患者的预后情况 血栓组90例患者中,有89例获得随访,随访率为98.89%。随访期间有8例患者预后不良,其中左心房血栓形成(复发)2例,脑梗死3例,死亡3例,死因为左心室破裂、心力衰竭或抗凝相关的出血。
2.6 血栓组不同预后患者凝血-纤溶系统标志物水平的比较 术后7 d时,预后不良组患者的血浆TAT、TM、PAP水平均高于预后良好组(均P<0.05),而两组间血浆t-PAI-C水平的差异无统计学意义(P>0.05)。见表5。
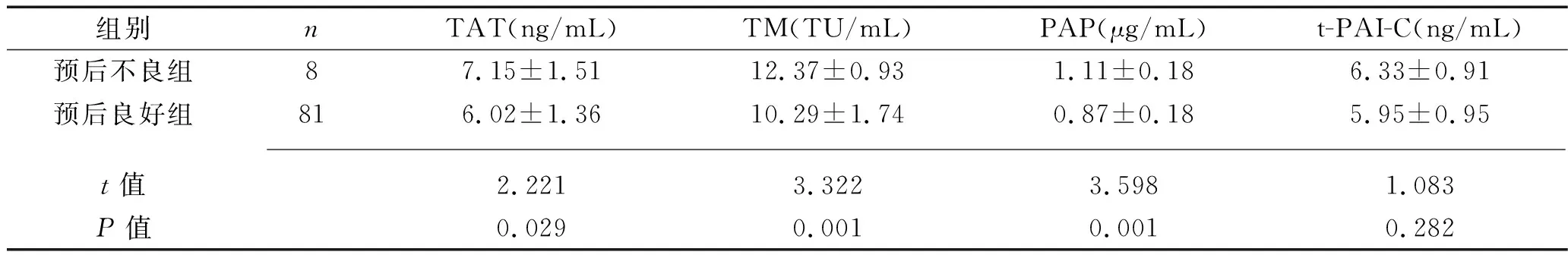
表5 血栓组不同预后患者凝血-纤溶系统标志物水平的比较(x±s)
3 讨 论
心脏作为血液循环的泵器官,能为人体血液循环系统提供充足动力,对于维持机体正常血液循环具有极其重要的作用[15]。RHD是一种较为严重的自身免疫性心脏疾病,其病因主要是溶血性链球菌感染,患者感染溶血性链球菌后心脏瓣膜基底及边缘部位可出现水肿、渗出,使瓣膜交界区域的腱索和瓣叶发生融合,并导致瓣叶出现卷曲、钙化、纤维化等,最终引发瓣膜开口关闭不全或者狭窄[16-17]。
受风湿性疾病影响后MVO逐渐缩小,甚至出现二尖瓣狭窄,这导致局部血液循环受阻,血液淤积于血管内部,并聚集形成血栓导致血管阻塞,使得心肌受损进一步加剧,心功能恶化[18-19]。RHD患者由于血管壁、血液流变学改变及血流瘀滞,容易伴发左房血栓,尤其是二尖瓣狭窄的患者,其伴发左房血栓的概率更高。原因可能是二尖瓣口出现机械性狭窄的同时,心房存在一定的规律性收缩,容易使房内血液形成涡流,增加血栓形成风险;而二尖瓣发生关闭不全时,血流在快速返回左房时会经过瓣口,搅动瘀滞的血液,因此血栓形成的概率较低[20]。本研究结果显示,血栓组患者的LVESD、左房内径均大于无血栓组,而MVO小于无血栓组(P<0.05),提示RHD伴左房血栓患者的二尖瓣狭窄程度更严重,心功能更差。
大量研究表明,凝血-纤溶系统紊乱在血栓疾病的形成中扮演了十分重要的角色[21-22]。在血栓的形成过程中,凝血酶发挥了至关重要的作用,但凝血酶的半衰期较短,不易检测。TAT是组织因子激活凝血因子Ⅶ形成凝血酶后,与抗凝血酶以1 ∶1比例结合形成的复合物,是凝血系统激活的重要标志物之一,临床上经常通过检测TAT水平来评估凝血酶水平,血浆TAT水平升高常提示凝血酶大量生成[23]。TM是一种跨膜糖蛋白,主要分布于血管内皮细胞表面,其作为凝血酶受体可与凝血酶结合并激活蛋白C系统,形成激活的蛋白C,并灭活活性凝血因子Ⅴ和Ⅷ,从而发挥抗凝、促纤溶等生物学效应[24]。纤溶过程是指纤溶酶原的激活和纤维蛋白的溶解,在纤维蛋白的溶解过程中,纤溶酶可以与肝脏产生的α2-抗纤溶酶以1 ∶1比例结合形成复合物,即PAP,进而使纤溶酶失活,临床上常通过测定血浆PAP水平来了解体内纤溶系统激活程度,而血栓性疾病患者PAP水平一般较高[25]。在纤溶酶原的激活过程中,产生于血管内皮细胞的纤溶系统生理性激动剂—组织型纤溶酶原激活剂(tissue plasminogen activator,t-PA)也扮演了重要角色,t-PAI-C则是由t-PA与生理性抑制因子纤溶酶原激活物抑制剂-1以1 ∶1比例结合形成的复合物,其在纤溶过程中起到了关键的调节作用,可作为纤溶系统激活的标志物之一[26]。本研究结果显示,入院时血栓组患者的血浆TAT、TM、PAP及t-PAI-C水平均高于无血栓组(均P<0.05),提示RHD伴左房血栓患者血液处于高凝及继发性纤溶亢进的状态。同时,与入院时相比,血栓组患者术毕的各凝血-纤溶系统标志物指标水平均有所升高,但术后7 d的各凝血-纤溶系统标志物指标水平又均较术毕时降低(均P<0.05)。这提示在手术结束后短时间内RHD伴左房血栓患者的血液仍处于相对高凝状态。原因可能是患者经历体外循环、手术操作创伤、低温等事件,内源和外源凝血途径被激活,引发继发性纤溶亢进。因此,此时应注意加强凝血功能监测,及时进行抗凝治疗,预防栓塞等并发症的发生。此外,本研究发现血栓组有少数患者因出现左心室破裂、心力衰竭或抗凝相关的出血而死亡,且有部分患者术后再次出现左心房血栓形成或脑梗死,进一步比较血栓组不同预后患者凝血-纤溶系统标志物水平后发现,预后不良组患者术后7 d时的血浆TAT、TM、PAP水平均高于预后良好组(P<0.05),而两组间血浆t-PAI-C水平差异无统计学意义(P>0.05)。这提示患者术后凝血-纤溶系统状态可能与预后有关,临床上可通过监测患者凝血-纤溶系统标志物来辅助评估患者预后情况。
综上所述,伴左房血栓的RHD患者血浆TAT、TM、PAP及t-PAI-C水平较无左房血栓患者高,且术后短时间内凝血-纤溶系统标志物仍处于高水平,患者预后可能与术后凝血-纤溶系统状态有关。但本研究纳入的样本量较少,仅初步分析了凝血-纤溶系统标志物的变化情况,后续仍需进一步扩大样本量并检测炎症标志物水平,以进一步探讨可用于评估患者预后的分子标志物。
