基于血清外异蛋白A水平构建的2型糖尿病患者合并糖尿病视网膜病变诊断模型▲
2022-12-09王银玲朱琳玲
王 月 王银玲 杜 姝 梁 娟 刘 璐 孔 雪 朱琳玲
(苏州市第五人民医院1 肝病科,2 感染科,江苏省苏州市 215000;3 苏州大学附属理想眼科医院眼底病科,江苏省苏州市 215000)
糖尿病视网膜病变(diabetic retinopathy,DR)是最常见且患病率较高的糖尿病微血管并发症之一,其主要病理改变是视网膜血管闭塞性循环障碍[1]。DR严重威胁糖尿病患者的生存质量,同时给社会带来严重的经济负担。早期筛查和防治DR,对于改善糖尿病患者的远期预后至关重要[2]。越来越多的研究显示,肝脏不仅是人体能量代谢的主要脏器,其还可以通过生成多种肝脏因子对机体的代谢稳态进行调控[3]。外异蛋白A(ectodysplasin A,EDA)是新发现的肝脏因子,属于肿瘤坏死因子超家族的Ⅱ型跨膜蛋白[4]。近年来,EDA被证实具有促进炎症反应、加重机体胰岛素抵抗等作用,与代谢综合征及脂肪肝等代谢性疾病的发生密切相关[5]。本研究通过收集合并和未合并DR的2型糖尿病患者的临床资料,检测其血清EDA水平,探讨2型糖尿病患者合并DR的影响因素,并建立诊断模型,旨在为诊断2型糖尿病患者合并DR提供新思路。
1 资料与方法
1.1 临床资料 收集2019年1月至2020年6月期间在苏州大学附属理想眼科医院就诊的2型糖尿病患者的电子病历资料。纳入标准:符合《中国2型糖尿病防治指南(2017年版)》[2]中的2型糖尿病诊断标准。排除标准:(1)其他原因导致的高血糖;(2)合并2型糖尿病相关急性并发症;(3)妊娠期或哺乳期女性;(4)合并严重肝肾功能异常、心脑血管疾病或恶性肿瘤等。参照《糖尿病视网膜病变防治专家共识》[1]中关于DR的诊断标准,根据眼底检查结果将患者分为无糖尿病视网膜病变(non-diabetic retinopathy,NDR)组及DR组。同时采用基于年龄-性别的最近邻匹配法进行倾向性评分匹配,匹配后两组的年龄及性别的标准化偏差(卡钳值设为0.200)分别为0.127及0.048。 最终NDR组纳入107例患者,DR组纳入83例患者。所有患者均签署知情同意书。本研究获得苏州大学附属理想眼科医院医学伦理委员会批准(批准号:SLER2018112)。
1.2 眼底检查方法 患者进入暗室休息5 min,待视觉适应后,由技师应用免散瞳眼底数码照相机(TOPCON公司,型号:TRC-NW300),以黄斑为中心拍摄视网膜彩色图像,每只眼睛拍摄一张照片。由无法获得患者病情资料的眼科医生进行阅片和诊断。
1.3 一般资料的收集 测量所有患者的身高、体重、血压、臀围和腰围,并计算体质指数和腰臀比。记录患者的糖尿病病程、服药史(半年内服用影响机体糖脂代谢的药物)、吸烟史(半年内是否吸过烟)、饮酒史(饮酒次数≥3次/周)等资料。通过调查患者每周的工作、生活、休闲等活动量,获得每周体力活动量,单位为MET-h/w,其中MET(metabolic equivalent of task)为代谢当量,是表示相对能量代谢水平和运动强度的重要指标,通常以静息代谢的能耗水平为基础单位参考值。
1.4 血清学指标的检测 抽取所有受试者的清晨空腹静脉血10 mL,4 ℃下12 000 r/min离心15 min,储存于-80 ℃冰箱中待检。采用全自动生化分析仪(深圳迈瑞生物医疗电子股份有限公司,型号:BS-800)检测空腹血糖、ALT、AST、γ-谷氨酰转肽酶(gamma-glutamyl transpeptidase,GGT)、三酰甘油、HDL-C及LDL-C水平。采用化学发光法,通过全自动流式荧光发光免疫分析仪(上海透景生命科技股份有限公司,型号:TESMI F4000)检测空腹胰岛素(fasting insulin,FINS);采用高效液相离子交换色谱法,通过全自动糖化血红蛋白分析仪(TOSOH公司,型号:G8)检测HbA1c;计算稳态模型胰岛素抵抗(homeostasis model assessment of insulin resistance,HOMA-IR)指数,HOMA-IR指数=空腹血糖(mmol/L)× FINS(μU/mL)/22.5。采用ELISA试剂盒(Cloud-Clone公司,编号SEB406Hu)检测血清EDA水平,严格按照试剂盒说明书进行操作。
1.5 统计学分析 采用SPSS 26.0和R 4.0.4软件进行统计学分析。符合正态分布的计量资料以(x±s)表示,组间比较采用两独立样本t检验,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验;不符合正态分布的计量资料以[M(P25,P75)]表示,两组间比较采用Mann-WhitneyU检验,多组间比较采用Kruskal-WallisH检验;计数资料以例数和百分比表示,组间比较采用χ2检验。采用二分类Logistic回归模型进行单因素及多因素分析,根据多因素分析结果建立诊断模型;绘制受试者工作特征(receiver operating characteristic,ROC)曲线和校正曲线分别评估诊断模型的区分度和校准度,当ROC曲线下面积>0.800时认为模型区分度良好,当校正曲线U指数<1.0、P值>0.05时表示模型校准度可接受。以P<0.05为差异有统计学意义。
2 结 果
2.1 两组患者一般资料及血清学指标的比较 与NDR组相比,DR组患者的糖尿病病程更长,每周体力活动量更少,腰臀比、体质指数、HOMA-IR指数及空腹血糖、HbA1c、FINS、AST、EDA水平均更高,HDL-C水平更低(均P<0.05),见表1。

表1 两组患者一般资料和血清学指标的比较
2.2 2型糖尿病患者合并DR影响因素的单因素及多因素分析 将糖尿病病程、每周体力活动量、腰臀比、体质指数、HOMA-IR指数及空腹血糖、HbA1c、 FINS、AST、EDA、HDL-C水平作为自变量,将2型糖尿病患者合并DR的情况作为因变量,纳入二分类Logistic回归模型(变量赋值见表2)进行单因素分析。结果显示,糖尿病病程、每周体力活动量、腰臀比、体质指数、HOMA-IR指数及空腹血糖、FINS、HbA1c、EDA、HDL-C水平均与2型糖尿病患者合并DR有关(均P<0.05),见表3。将以上单因素分析中具有统计学意义的变量纳入二分类Logistic回归模型进行多因素分析。结果显示,糖尿病病程、腰臀比、空腹血糖及EDA水平均是2型糖尿病患者合并DR的影响因素(均P<0.05),见表4。

表2 变量赋值情况

表3 单因素分析结果

表4 多因素分析结果
2.3 诊断模型的建立及验证 根据多因素分析结果,建立2型糖尿病患者合并DR的诊断模型,其方程如下logitP=0.316×糖尿病病程+0.066×腰臀比+0.195×空腹血糖+0.011×EDA-13.752。ROC曲线分析结果显示,该模型用于诊断2型糖尿病患者合并DR的曲线下面积为0.911(95%CI:0.872,0.951),灵敏度为0.904,特异度0.785,准确度为0.837,阳性预测值、阴性预测值分别为0.765、0.913,见图1A。其校正曲线的U指数为-0.011(P=0.914),见图1B。
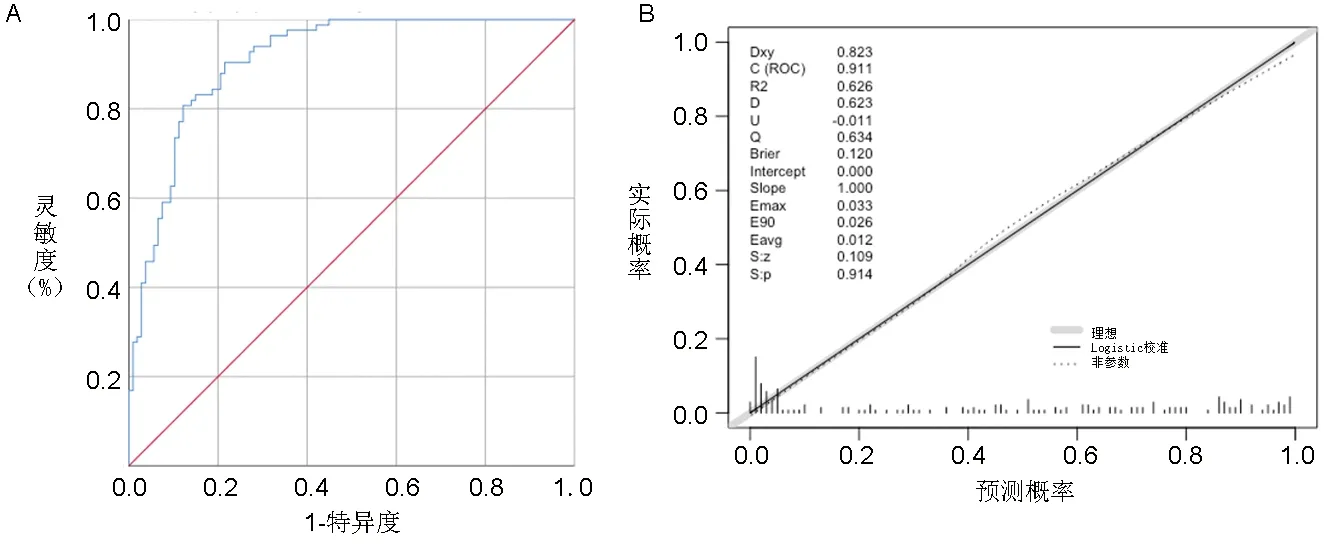
图1 ROC曲线和校正曲线
3 讨 论
DR的发生和发展是一个较为复杂的病理生理过程,其具体的机制尚不明确[6]。目前的观点认为糖尿病患者机体的能量代谢障碍,特别是胰岛素抵抗和糖脂代谢紊乱可诱发视网膜病变[7]。在病程10年以上的糖尿病患者中,DR的患病率高达80%,DR是全球中老年人视力丧失的首要病因[8]。近30年来,受人们饮食结构改变、人口老龄化等因素的影响,我国糖尿病患病率大幅增加。流行病学调查显示,在我国糖尿病患者中,约有23%的患者合并视网膜病变,其中大部分患者为非增殖型DR[9]。由于DR具有早期隐蔽性、慢性进展性、不可逆性等特点,目前早期筛查工作仍然面临诸多困难,应用合适的血清生物标志物或者无创性工具进行筛查是DR防治工作的重点[10]。
近年有研究显示,肝脏在机体代谢中占有核心地位,其不仅是三大代谢完成的主要场所,还可通过生成一系列蛋白对机体代谢稳态产生重要影响[3,11-15]。这一系列蛋白被称为肝脏因子,如胰岛素样生长因子1、成纤维细胞生长因子、血管生成素样蛋白等,可以对机体糖脂能量代谢发挥各种复杂而精细的调节作用。肝脏因子的分泌异常往往会导致代谢性疾病的发生,而代谢性疾病的疾病进程也伴随着肝脏因子的异常[16-18]。肝脏因子是否与DR发病相关,是否可以作为DR的生物标志物或者成为无创筛查工具的一部分,针对这些问题目前国内外尚未有报告,这也将是我们研究的重点。
既往研究证实,EDA可通过与EDA受体结合,胞内激活外异蛋白受体相关的死亡结构域,进而对细胞的代谢、免疫、炎症、凋亡及应激等生理或病理过程进行调控[4,19-20]。Awazawa等[5]报告,通过筛选肥胖小鼠肝脏中表达失调的内含子miRNA发现,EDA基因在肥胖小鼠肝脏中的表达增加;随后通过人体试验再次验证,肥胖人群肝脏中的EDA表达增加,而减肥后EDA表达下调,且EDA在肝脏中的表达与胰岛素抵抗情况密切相关。Awazawa等[5]还发现,在肥胖的情况下,EDA在外周循环中含量上升,并可促进骨骼肌中c-Jun氨基末端激酶激活,同时抑制胰岛素受体底物1的丝氨酸磷酸化,其认为EDA作为一个新发现的肝脏因子,在肥胖情况下可降低机体的胰岛素敏感性。2019年,Yang等[21]发现,肝细胞脂肪变性可上调肝脏的EDA合成及分泌量,而EDA可通过打破脂质合成/氧化平衡,加重肝脏脂肪变性。随后,Yang等[21]开展了一项病例对照研究,报告了人体血清EDA水平与非酒精性脂肪性肝病发生风险之间的关系,提示EDA可作为临床脂肪肝筛查的潜在血清标记物。上述研究提示,EDA作为新发现的肝脏因子,可通过调节胰岛素敏感性,参与肥胖和脂肪肝的病理生理变化。而肥胖、脂肪肝及糖尿病都是以机体胰岛素抵抗为基础的能量代谢性疾病,因此推测EDA可能参与糖尿病及其并发症的发生、发展。故本研究基于血清EDA水平建立2型糖尿病合并DR的诊断模型。
本研究结果显示,DR患者的血清EDA水平高于NDR组(P<0.05);校正相关混杂因素后,糖尿病病程、腰臀比、空腹血糖及EDA水平均是2型糖尿病患者合并DR的影响因素(均P<0.05)。糖尿病病程长、空腹血糖水平升高的2型糖尿病患者合并DR的风险增加,这与既往研究[9]相似。机体长期处于高血糖状态,可导致蛋白质发生非酶糖基化,进而引起基底膜增厚、微血管堵塞、削弱血红蛋白携氧能力、影响局部组织氧扩散,引起视网膜缺氧,从而推动DR发生和发展[22]。另外,腰臀比作为反映机体代谢综合征的重要指标,与脂代谢密切相关,而脂代谢紊乱可通过脂质过氧化,引起血管壁损伤,促使脂质在微血管壁的沉积和渗漏,改变细胞膜脂质结构,甚至诱发微血栓形成,从而加重视网膜的渗出和水肿,破坏视网膜屏障功能[23]。EDA对DR发生与发展的影响,可能与其水平升高引起胰岛素抵抗、脂代谢紊乱有关[19-21]。本研究通过上述4个重要变量,建立了2型糖尿病合并DR的诊断模型,验证结果显示该模型具有较好的区分度和校准度。该模型有助于在2型糖尿病患者中筛查出DR患者或DR高风险人群,特别是基层医院,该模型有助于快速识别DR高风险人群,进而有针对性地进行分流,解决了基层医院缺少专业眼科医生的问题,节约了眼科专业设备和检查的医疗资源,并可减少因误诊、漏诊导致的DR相关性致盲、致残。
综上所述,血清EDA水平是2型糖尿病患者合并DR的影响因素之一。基于血清EDA水平及其他变量(包含空腹血糖、腰臀比、糖尿病病程)构建的模型,对2型糖尿病合并DR具有较好的诊断效能,可为糖尿病患者的DR筛查提供潜在的无创性工具。本研究的样本是基于我院电子病历库获得的真实世界数据,具有较高的参考价值。但仍需多中心的外部验证进一步探讨该诊断模型在DR诊断中的作用。
