坎地沙坦酯P123/F127混合胶束给药系统的构建及表征*
2022-12-09莫一燕孙敬蒙房辰晨贾珍珍张鑫张炜煜
莫一燕,孙敬蒙,房辰晨,贾珍珍,张鑫,张炜煜
(1.长春中医药大学药学院,长春 130117;2.吉林大学第一医院临床药学部,长春 130021)
坎地沙坦酯(candesartan cilexetil,CC)是一种选择性阻断血管紧张肽Ⅱ受体拮抗药[1],与AT1受体结合能力强,解离速度慢,从而抑制AT1的作用,用于治疗高血压,并其对患者的肾功能有一定的维护和改善作用,且能减少糖尿病患者和轻度蛋白尿患者的尿蛋白排泄。但CC为水难溶性药物,其生物利用度低,仅约为15%[2]。近年来,CC的国内用药量逐步增加,市售剂型包括片剂、分散片等,然而市售片剂普遍存在口服生物利用度低的缺点,需要改善吸收,提高生物利用度[3]。KAMALAKKANNAN等[4]将其制备成脂质微球,但体外释放实验表明药物非匀速释放,且脂质微球给药系统容易产生突释现象,易造成血药浓度剧烈波动,损伤人体器官。将CC制备成固体脂质纳米粒[5]、纳米乳[6]、自微乳[7]等新剂型的制备工艺较繁琐或制剂不稳定,不易于工业化生产,而聚合物胶束易于制备、易于载药、易于载到病灶部位。
近年来,聚合物胶束作为纳米药物载体成为研究热点而备受关注。目前,相关制剂已被批准使用或进入临床试验阶段[8-10],HOU等[11]研究证明了聚合物胶束具有提高紫杉醇口服生物利用度的巨大潜力。聚合物胶束是由两亲嵌段共聚物自组装形成纳米级壳-核结构,疏水的PPO链段形成胶束的内核,疏水内核能够通过疏水相互作用和π-π键相互作用与难溶性药物结合,将难溶性药物增溶与内核中,从而提高药物的溶解度,同时还可以避免在生物环境中药物失活。亲水的PEO链段形成胶束的外壳,能避免被吞噬和被蛋白质和细胞吸附[12]。聚合物胶束粒径小(10~100 nm),可以增强疏水性药物分子的稳定性,在药物的增溶方面表现出非常好的应用前景[13]。而混合胶束能通过协同不同嵌段共聚物发挥各自特点和作用,很好地解决由于单一聚合物形成的聚合物胶束通常面临载药量低、稳定性差等问题[10]。笔者选用了具有两亲性三嵌段共聚物的泊洛沙姆P123(Pluronic P123)和F127(Pluronic F127)作为载体材料,具有生物相容性好、毒副作用弱、低免疫原性、低抗原性和良好的药物增溶能力等优点[14]。本研究通过优化处方制备坎地沙坦酯P123/F127混合胶束,增加CC的溶解度,促进CC的吸收。
1 仪器与材料
1.1仪器 1200型高效液相色谱仪(美国Agilent公司);TGL-18C高速台式离心机(上海安亭科学仪器厂);RE-52AA旋转蒸发器(上海亚荣生化仪器厂);Zetasizer Nano ZS型动态光散射仪(英国Malvern公司);DSC3差示扫描量热仪(梅特勒-托利多仪器有限公司);H-7650透射电子显微镜(HITACHI公司);VECTOR-33型傅立叶变换红外光谱仪(德国Bruker公司)。
1.2材料与试剂 坎地沙坦酯原料药(珠海润都股份有限公司,批号:56713040205,含量:≥99%);坎地沙坦酯对照品(中国食品药品检定研究院,批号:100685-201602,含量:99.8%);Pluronic F127(Sigma公司,批号:101856315);Pluronic P123(Sigma公司,批号:102142834);甲醇、乙腈(色谱纯,Sigma公司);无水乙醇(化学分析纯,北京化工厂)。
2 方法与结果
2.1坎地沙坦酯混合胶束的制备 采用薄膜水化法制备坎地沙坦酯混合胶束(CC-MMs)[15]。精密称取处方量的CC原料药、Pluronic P123和F127,加入无水乙醇,超声溶解,置于250 mL圆底烧瓶中,在一定温度下减压旋转蒸发除去有机溶剂,形成透明均匀的药膜,真空干燥过夜。加入适量纯化水,在一定温度下水化45 min,过孔径0.22 μm有机微孔滤膜,即得澄清透明并带有蓝色乳光的CC-MMs溶液。
2.2坎地沙坦酯含量测定方法的建立
2.2.1色谱条件 以Agilent XDB-C18(250 mm×4.6 mm,5 μm)为色谱柱,甲醇-水-磷酸(体积比85:15:0.01)为流动相,检测波长为254 nm,柱温为30 ℃,流速为1 mg·mL-1,进样量为20 μL。
2.2.2标准曲线的建立 精密称取坎地沙坦酯对照品6.4 mg,置于10 mL的量瓶中,加甲醇定容,制得浓度为0.64 mg·mL-1的坎地沙坦酯对照品溶液。精密量取对照品溶液,加甲醇稀释成坎地沙坦酯质量浓度分别为0.01,0.02,0.04,0.08,0.16,0.32,0.64 mg·mL-1的对照品溶液,注入液相色谱仪进行测定。以峰面积为纵坐标,质量浓度为横坐标,得出回归方程:Y=34 940X+35.838,r=0.999 9,表明坎地沙坦酯在0.01~0.64 mg·mL-1范围内线性关系良好。
2.2.3重复性、精密度、稳定性、回收率 按相关方法操作,得重复性实验中样品含量的RSD为0.50%(n=6);精密度实验中低、中、高质量浓度对照品溶液的日内RSD分别为0.45%,0.77%,0.55%(n=5),日间RSD分别为1.30%,1.40%,0.70%(n=5);稳定性实验(24 h)中含量的RSD为0.96%(n=8);回收率实验中低、中、高质量浓度的加样回收率分别为99.03%,100.6%,99.3%,RSD分别为2.05%,0.4%,1.47%(n=3)。经考察,所建立的检测方法准确可靠。
2.3包封率、载药量和沉降率的测定 包封率和载药量的测定:参照文献[16]介绍的方法测定包封率和载药量。取适量CC-MMs溶液,12 000 r·min-1下离心20 min(r=4 cm)。取上清液滤过,以除去杂质和未被包封的药物,得到纯化的CC-MMs溶液。精密量取纯化的CC-MMs溶液1 mL,置于10 mL量瓶中,加入适量甲醇,超声10 min以破坏胶束结构,甲醇定容,经孔径0.22 μm微孔滤膜滤过,高效液相色谱(HPLC)法测定CC含量,计算CC-MMs的包封率(EE):EE(%)=m1/m2×100%,载药量(DL):DL(%)=m1/(m1+m3)×100%。式中m1为载药胶束溶液中药物的含量,m2为投药量,m3为载体材料总质量。
沉降率的测定:胶束体系在一定时间内的药物析出量能够反映胶束的稳定性,所以将药物沉降率作为考察指标之一。将新鲜制备的CC-MMs溶液置于4 ℃下48 h[17-20],12 000 r·min-1下进行离心20 min(r=4 cm),分离胶束和析出结晶药物,精密量取上清液1 mL,加甲醇破乳,超声10 min破坏胶束结构,定容,0.22 μm微孔滤膜滤过并测定48 h后胶束中所含药量,计算CC-MMs沉降率。沉降率=(m0-m48)/m0×100%。式中m0为新鲜制备的CC-MMs中药物的含量,m48为4 ℃环境下放置48 h后CC-MMs中药物含量。
2.4单因素实验 按“2.1”项下的制备方法,以EE、DL及沉降率为考察指标,通过单因素实验考察载体Pluronic 123质量百分比(25%,33.3%,50%,66.7%,75%)、Pluronic P123/F127混合载体用量(90,120,150,180,210 mg)、水化温度(30,35,40,50,60 ℃)、水相体积(3,6,9,12,15 mL)、旋转蒸发温度(25,35,45,55,65 ℃)、有机溶剂用量(1,2,3,4,5 mL)的影响。经单因素实验,综合考虑,最终确定无水乙醇用量为3 mL、旋转蒸发温度为45 ℃、水化温度为40 ℃。而载体Pluronic 123与F127的比例、Pluronic P123/F127混合载体用量和水相体积对EE、DL及沉降率均有明显的影响,因此将它们作为待优化项进行星点设计-效应面法实验。
2.5星点设计-效应面法优化
2.5.1星点实验设计 根据预单因素实验考察结果,选择载体Pluronic 123质量百分比(A)、P123/F127混合载体用量(B)、水相体积(C)3个显著因素作为自变量,以EE%(Y1)、DL%(Y2)及沉降率(Y3)为考察指标,因素水平见表1。应用Design Expert 8.0.5b软件,进行试验设计,见表2。采用以下公式求得总评归一值(OD),进行各指标的综合评价:

表1 因素水平 Tab.1 Factor level

OD=(d1×d2×d3)1/3
式中,d1、d2、d3分别为EE、DL及沉降率的归一值,Yi为实测值,Ymin和Ymax为实验中各因变量的最小值和最大值。
2.5.2模型拟合及方差分析 应用Design Expert 8.0.5b软件分析表2数据,进行线性回归、拟合并进行方差分析,得到回归方程:OD=0.68+0.13A+0.11B-0.074C-0.057AB-0.075AC-0.040BC-0.030A2-0.16B2-0.14C2(R2=0.904 1)。

表2 试验设计与结果 Tab.2 Experimental design and results
方差分析结果如表3所示。结果表明该回归模型差异有统计学意义(P=0.000 5),F值为10.47,失拟值无显著性,表明建立的模型可靠,拟合情况良好。结果表明A、B、C、B2、C2对OD值的影响均显著,二次项A2及交互项AB、AC、BC对OD值的影响均不显著。根据上述回归模型绘制三维效应面图和二维等高线图,如图1—3所示。软件分析优化得到CC-MMs的最优处方:Pluronic P123质量百分比为66.7%,P123/F127混合载体用量为158.2 mg,水相体积为8.40 mL。
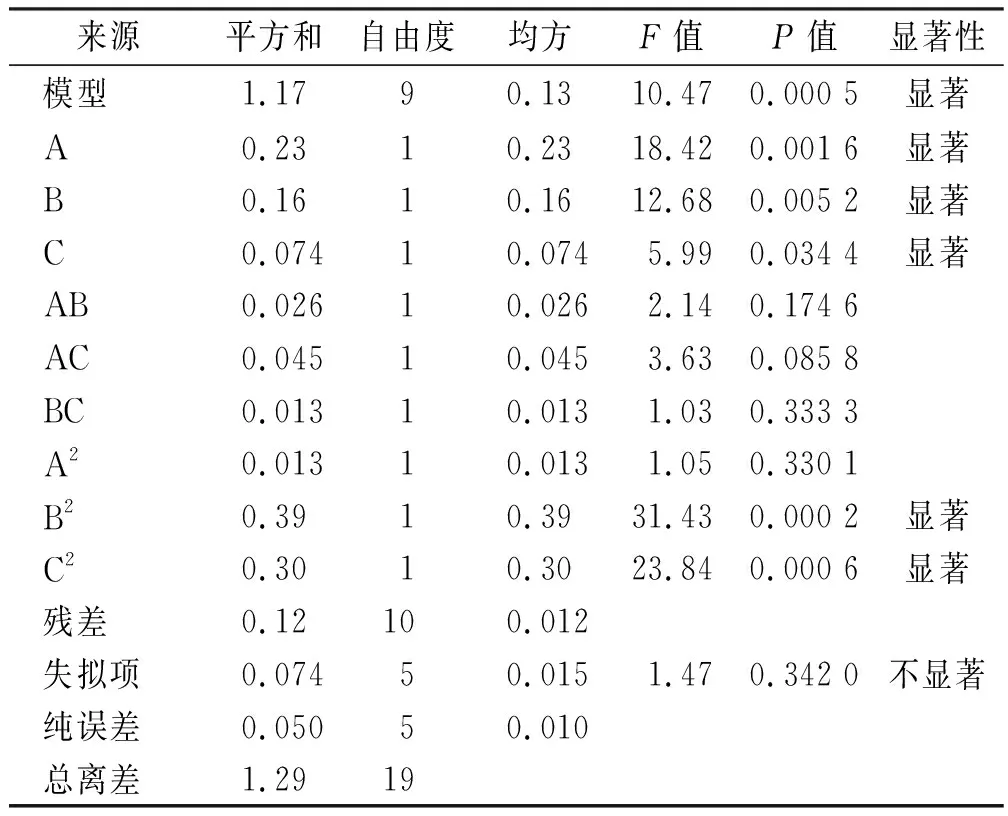
表3 方差分析 Tab.3 Analysis of variance

图1 P123质量百分比及P123/F127混合载体用量对OD值的影响 Fig.1 P123 mass percentage and the amount of P123/F127 mixed carrier on OD value

图2 水相体积及P123质量百分比对OD值的影响 Fig.2 Effect of water phase volume and P123 mass percentage on OD value
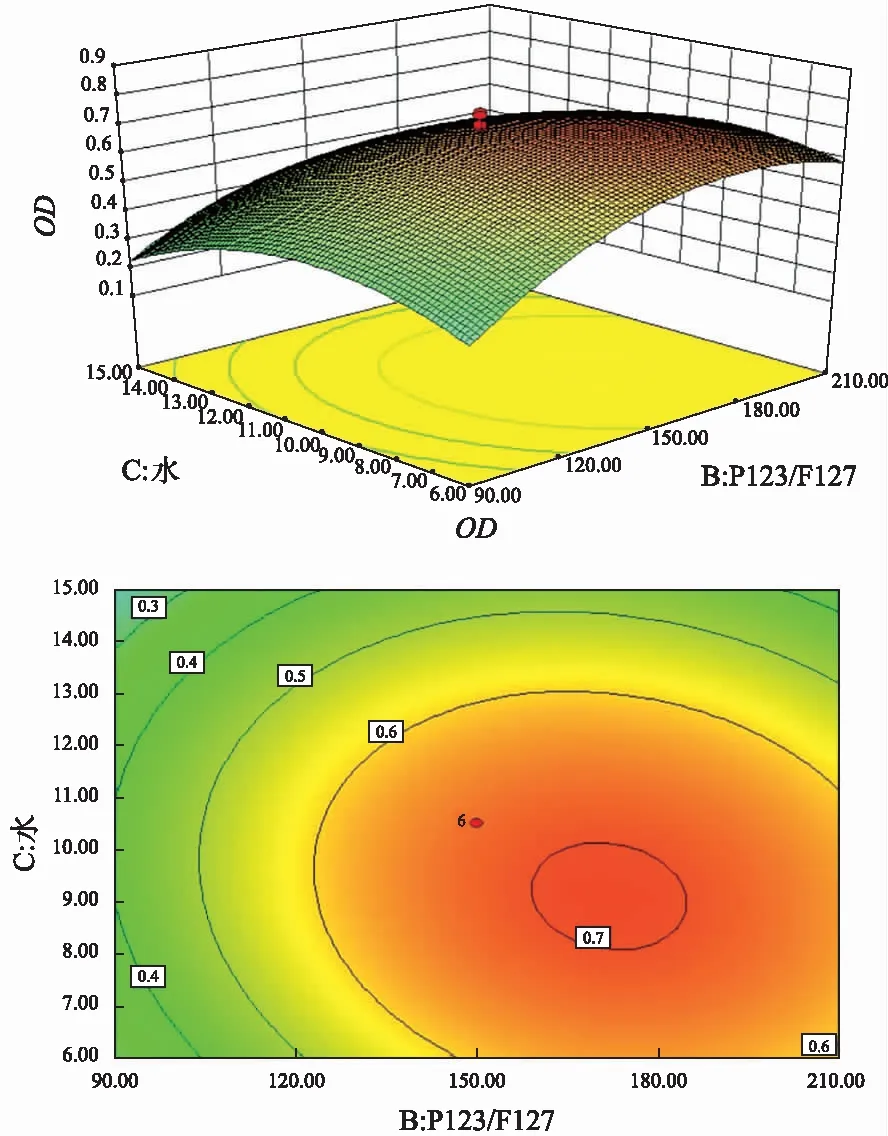
图3 水相体积及P123/F127混合载体用量对OD值的影响 Fig.3 Effects of aqueous phase volume and amount of P123/F127 mixed carrier on OD value
2.5.3优化处方工艺的验证 在预测的最佳工艺条件下制备3批CC-MMs溶液,取平均值与预测值进行比较。测得包封率为(94.79±1.48)%,载药量为(5.76±0.08)%,沉降率为(2.34±0.09)%(n=3),OD值(0.74±0.02%)(n=3),实测值与预测值的偏差较小且工艺重复性好,说明所建立的模型合理可靠性。
2.6坎地沙坦酯混合胶束的表征
2.6.1临界胶束浓度的测定 将碘(I2)100 mg和碘化钾(KI)200 mg溶解在10 mL纯化水中,混匀,制得KI/I2标准溶液,避光备用。分别将P123/F127混合载体(P123质量百分比为66.7%)、F127和P123制备成浓度为0.000 01~0.1 g·(100 mL)-1的系列浓度的水溶液。取制备好的不同浓度的样品4 mL,分别向其中加入配备好的KI/I2标准溶液20 μL,摇匀,在测量之前,将混合物置于室温下在避光处放置24 h,使碘的分配达到平衡。在366 nm波长处测定不同浓度的P123/F127混合载体、F127和P123水溶液的吸光度,绘制曲线,见图4所示,P123/F127混合载体、单一P123和单一F127胶束的临界胶束浓度(CMC)值分别为0.005 9,0.007 0和0.003 7 g·(100 mL)-1,其中F127胶束和P123胶束的CMC值与文献[21]中先前测定的CMC值一致,P123/F127混合胶束的CMC介于F127和P123胶束之间。P123/F127混合胶束相较于P123胶束具有更低的CMC值,表现出较高的稳定性和较好的抗稀释能力,在进入体内后能较长时间保持胶束结构的完整性。

图4 碘的吸光度值与P123(A)、F127(B)及P123/F127(C)胶束浓度对数(logC)的关系曲线图 Fig.4 The relationship between the absorbance value of iodine and the logarithm of micelle concentration (logC) of P123 (A),F127 (B) and P123/F127 (C)
2.6.2形态、粒径、PDI与 Zeta 电位的测定 取优化工艺制备的CC-MMs溶液一滴,于铜网上吸附3 min后,用2%磷钨酸负染5 min,自然挥干,加速电压90 kV,置透射电镜下观察微观形态,结果见图5可见CC-MMs的形态规整,呈球形,分布均一,无聚集。

图5 CC-MMs(×40 000)的透射电镜图 Fig.5 CC-MMS(×40 000)transmission electron microscopy
取优化工艺制备的CC-MMs溶液,于动态光散射仪样品池中,采用动态光散射法进行测量CC-MMs的粒径、PDI及Zeta电位,结果见图6,7。CC-MMs的平均粒径、PDI和Zeta电位分别为(26.39±0.22) nm、0.210±1.49和(-21.57±0.71) mV。动态光散射法测得的是CC-MMs的水合径,而透射电镜测的是CC-MMs在干燥状态下的粒径,因此所测结果有略微的差异。

图6 CC-MMs的粒径分布 Fig.6 Particle size distribution of CC-MMs

图7 CC-MMs的Zeta电位图 Fig.7 Zeta potential diagram of CC-MMS
2.6.3差示扫描量热分析(DSC) 分别取Pluronic P123、Pluronic F127、Pluronic P123/F127物理混合物、CC原料药、空白胶束冻干粉及CC-MMs冻干粉进行DSC分析。工作条件:以空铝坩为空白参考池,样品约3~5 mg,置于机器中进行图谱扫描,N2作为吹扫气,流速为50 mL·min-1,扫描范围5~220 ℃,升温10 ℃·min-1,结果见图8和9。

A.P123;B.F127;C.P123/F127物理混合物;D.空白胶束。图8 差示扫描量热分析的DSC曲线测定结果 A.Pluronic P123;B.Pluronic F127;C.Pluronic P123/F127 physical mixture;D.Blank micelles.Fig.8 DSC curve of differential scanning calorimetry

A.CC原料药;B.空白胶束;C.混合胶束冻干粉。图9 差示扫描量热分析的DSC曲线测定结果 A.CC API;B.Blank micelles;C.Mixed micellar lyophilized powder.Fig.9 DSC curve of differential scanning calorimetry
由图8和9可知,Pluronic P123在19.23 ℃和41.92 ℃处有两个吸热峰,Pluronic F127在59.31 ℃存在一个较大的吸热峰,分别对应了Pluronic P123和F127的熔点。在P123/F127物理混合物的DSC曲线中,Pluronic P123和F127的熔点峰仍然存在,而空白胶束冻干粉DSC谱图中只存在一个吸热峰为54.20 ℃,呈现单峰分布,并且介于P123与F127的熔点峰之间。说明混合的Pluronic P123/F127系统表现出协同结合作用,形成了稳定的混合胶束结构。CC在171.56 ℃处有一个较大的吸热峰,为CC的熔点峰,而在载药胶束的DSC图谱中CC特征熔点峰消失,且峰值发生变化,表明药物完全被嵌入到胶束内核中,表明CC-MMs制备成功。
2.6.4傅里叶-红外光谱(FT-IR)分析 用FT-IR测定CC原料药、空白胶束和CC-MMs的红外吸收光谱。采用溴化钾(1:100比例)制备样品,将制备好的样品置于样品架上,在4000~400 cm-1区间内扫描,结果见图10。图10显示,2940,1475 cm-1为CC原料药的-CH3的特征吸收峰,1753 cm-1为-C=O的特征吸收峰,990 cm-1为坎地沙坦酯结构中环己氧基的伸缩振动峰,3028,1475,750 cm-1为苯环的特征吸收峰,1242 cm-1为-C-N-的伸缩振动峰。在空白胶束谱图中,3420 cm-1为Pluronic P123和F127结构中-OH的伸缩振动峰,2871,1374 cm-1为-CH2的特征吸收峰,2958,1455 cm-1为-CH3的特征吸收峰,1105 cm-1为-C-O-的伸缩振动峰,939 cm-1为-CH-CH2的伸缩振动峰。在CC-MMs的谱图中,-OH的吸收峰由3420 cm-1变为了3462 cm-1,-CH3吸收峰由2940 cm-1变为了2956 cm-1,-C=O的特征吸收峰由1753 cm-1变为了1702 cm-1,说明CC原料药中的-CH3、-C=O与Pluronic P123和F127中的-OH之间形成了氢键,从而增加了药物的溶解度,且载药胶束的光谱中不存在坎地沙坦酯的特征峰进一步说明CC进入胶束疏水内核。

A.原料药;B.空白胶束;C.CC-MMs。图10 不同样品的红外光谱图 A.API;B.Blank micelles;C.CC-MMs.Fig.10 Infrared spectra of different samples
2.6.5CC-MMs与P123和F127单一胶束比较 分别取P123与F127载药胶束溶液适量,分别按照“2.3”项下进行EE、DL及沉降率的测定,及按照“2.6.2”项下测定其粒径、PDI以及Zeta电位,结果见表4。表4表明,相对于单一P123胶束或F127胶束,P123和F127所形成的混合胶束体系更稳定,且具有更高的EE及DL,更小的粒径及PDI。

表4 CC-MMs与P123、F127单一胶束的比较结果 Tab.4 Comparison results of CC MMS with P123 and F127 single micelles
2.6.6饱和溶解度的测定 取过量的CC、CC-MMs冻干粉于离心管中,分别加入一定量的纯化水、pH值6.8的缓冲液,在25 ℃水浴中振荡24 h(100 r·min-1),12 000 r·min-1,离心20 min(r=4 cm),取上清液滤过,按“2.2.1”项色谱条件测定CC含量。测得在纯化水中和pH值6.8缓冲液中CC原料药的饱和溶解度分别为1.5和2.1 μg·mL-1,而载药胶束在纯化水和pH缓冲液中的饱和溶解度增至1650和1640 μg·mL-1,表明坎地沙坦酯P123/F127混合胶束可以显著提高CC的溶解度。
3 讨论
优化处方制备的CC-MMs的粒径较小,形态为分布均匀的球形,符合形成聚合物胶束的要求。且P123/F127所形成的CC-MMs相对于单一P123胶束或F127胶束,CMC值更低,更稳定,具有更高的包封率及载药量,更小的粒径及PDI。可能是由于P123具有较长的疏水PPO链段,其增溶能力较强,形成的胶束内核可以包载更多的药物,因此其所形成的胶束包封率较高,但由于P123的亲水链段较短,导致其容易团聚,所形成的胶束稳定性较差,导致其沉降率较大。而F127具有较长的亲水链,虽然能增加胶束的空间稳定性,但由于其所形成的疏水核心体积较小,因此其包封率及载药量较低。综上所述,P123/F127混合胶束可以提高CC的溶解性能。通过协同发挥泊洛沙姆P123和F127的特点和作用,实现对疏水性药物CC进行装载并对处方工艺优化。为实现纳米制剂的长期保存以及大大降低聚合物纳米胶束制剂中的水含量,提高稳定性,将采用冻干技术制备成坎地沙坦酯纳米胶束冻干粉,为进一步研究提供给药方式。
随着各种新型两亲性嵌段共聚物的发展,基于胶束的药物递送系统已成为潜在的纳米药物递送技术,并在很多领域取得了重大进展。聚合物胶束易于制备、易于载药、易于载到病灶部位,再加上智能化,相信今后会有更多的胶束制剂从理论设计应用到临床治疗中。
