Chaetomium globosum CGMCC 6882发酵所产黄酮类化合物对小鼠生长和肠道菌群的影响
2022-12-08王璐范伊琳王子朝郭佳源王琦牛梦师怡宁
王璐,范伊琳,王子朝,3,郭佳源,王琦,牛梦,师怡宁
1.河南工业大学 生物工程学院,河南 郑州 450001;2.华商国际工程有限公司,北京 100069;3.河南工业大学 国家工程实验室/省重点实验室,河南 郑州 450001;4.河南工业大学 国际教育学院,河南 郑州 450001
0 引言
肠道微生物对宿主的健康至关重要,在营养、发育、代谢、病原体抗性、免疫调节等方面发挥着重要作用[1]。黄酮是主要由2个苯环(A环和B环)与3个碳原子桥连接形成的具有C6—C3—C6结构,且广泛存在于植物根、叶、花和种子中的化合物[2-3]。作为酚类化合物,黄酮不仅具有抗氧化、抗菌和抗癌活性[4],还能够与肠道微生物相互作用[5]。已有研究[6]证实,黄酮可通过调节细胞因子改变肠道微生物区系进而调节肠道免疫功能。李明等[7]研究发现,黄酮类化合物可调节炎症性肠病患者肠道菌群,促进肠道微生态平衡。B.Chen等[8]证实,在小鼠日粮中添加天然黄酮衍生物可显著减轻右旋糖酐硫酸钠诱导小鼠结肠炎的严重程度。白利琴[9]研究发现,多糖、黄酮复配物能够抑制大鼠肠道中有害菌繁殖并促进有益菌增长。此外,近年来不断有学者发现,黄酮类化合物对体重也有一定的调控作用,如E.F.Hoek-van den Hil等[10]研究发现,所有黄酮类化合物均可显著抑制小鼠因高脂饮食诱导的体重增加;V.Panda等[11]研究也表明,富含黄酮的菠菜叶提取物能够增强大鼠饱腹感从而降低其食欲,进一步达到减轻大鼠体重的效果。
随着生活水平的提高和生活方式的改变,不合理饮食结构成为影响人们身体健康的重要因素。肠道菌群是寄居在人体肠道内的微生物群落,参与人体的营养、代谢、免疫调节等过程,与多种代谢性疾病、免疫性疾病的发生发展密切相关,在膳食与人类健康中发挥着重要的桥梁作用。因此,从人们生活中不可替代的饮食入手,通过提高饮食的功能属性,可为提升人体健康和预防疾病的发生发展做出重要贡献。课题组前期研究[12]中,通过对绞股蓝内生真菌CGMCC 6882(C.globosumCGMCC 6882)进行发酵获得了一种黄酮类化合物,但该黄酮类化合物的安全性及生物活性却并不明确。基于此,本研究拟对小鼠灌喂C.globosumCGMCC 6882发酵所产黄酮类化合物,检测小鼠体重及肝脏、蛋白代谢、肾脏等血清生化指标,并分析小鼠肠道菌群物种组成和多样性、代谢物短链脂肪酸(SCFAs)种类和含量变化,研究该黄酮类化合物对小鼠生长和肠道菌群的影响,以期为黄酮类化合物通过肠道菌群影响机体营养与健康的机理研究提供指导或参考。
1 材料与方法
1.1 主要材料与试剂
黄酮类化合物,其生产、制备、分离、纯化等均参照付乾振等[12]的方法进行。SPF级昆明小鼠60只(批准号SCXK:2017-0002,体重(20±1)g,雄性),购于郑州大学实验动物中心。H2SO4、乙醚等,均为分析纯,购于天津市科密欧化学试剂公司。
1.2 主要仪器与设备
AU5800型全自动生化分析仪,美国贝克曼库尔特有限公司产;7890A型高效气相色谱仪,美国安捷伦科技有限公司产;XFH-50CA型电热式压力蒸汽灭菌锅,上海博迅医疗生物仪器股份有限公司产;TGL-16gR型高速台式离心机,上海安亭科学仪器厂产;YP10002型电子天平,余姚市金诺天平仪器有限公司产。
1.3 实验方法
1.3.1 急性毒性动物实验将SPF级昆明小鼠在温度(24±1)℃、湿度(60±5)%条件下,正常饲养7 d(每天分别于光照和黑暗中各培养12 h)进行小鼠适应性生长;挑选42只生长活泼、无异样且体重相近的小鼠,根据实验天数,将空白对照组分成4组(CON1,CON7,CON14,CON21),将C.globosumCGMCC 6882发酵所产黄酮类化合物组(即实验组)分成3组(TES7,TES14,TES21),共7组,每组6只,实验前12 h禁食不禁水;给实验组小鼠每1 g体重灌服5 mgC.globosumCGMCC 6882发酵所产黄酮类化合物溶液,给空白对照组小鼠灌喂等量质量浓度为0.9%的生理盐水,实验组和空白对照组均隔天灌喂1次。
1.3.2 小鼠血清及肠道菌群的采集在实验的第1 d、7 d、14 d、21 d对小鼠逐只称重,而后采用摘眼球法收集血液用于小鼠血液生化指标检测。取血后,采用颈椎脱臼法杀死小鼠并进行解剖,无菌条件下取小鼠盲肠内容物于灭菌的1.5 mL EP管中并标记。同时,将装有盲肠内容物的EP管用封口膜密封并放于冰箱中,于-20 ℃冷藏,用以检测肠道菌群。
1.3.3 小鼠血清指标的检测小鼠血液样品在4 ℃、3500 r/min条件下离心10 min,收集上层血清并用全自动生化分析仪检测总蛋白、白蛋白、球蛋白、尿酸、谷丙转氨酶、谷草转氨酶等指标。
1.3.4 粪便细菌DNA提取与生物信息分析将盲肠内容物放于烧杯中,加入4 mL去离子水并搅拌,用细菌DNA试剂盒提取小鼠粪便中的细菌总DNA,并对提取的DNA样本进行质检,检验合格的样本用于后续分析。以16 S rDNA“V3+V4”高变区序列设计引物,进行肠道菌群DNA的PCR扩增,引物序列为338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)。将PCR扩增产物纯化后测序,无误则采用FLASH(v1.2.8)软件将序列拼接成高质量Tags,并将序列建库引入的Barcode和引物序列去除,然后采用Vsearch(v2.3.4)软件过滤嵌合体。将相似度大于97%的序列聚类为操作分类单元(Operational Taxonomic Unit,OTU),而后进行OTU聚类分析和物种分类学分析。
1.3.5SCFAs含量测定将0.1 g盲肠内容物悬浮于500 μL饱和NaCl溶液中,加入20 μL 体积分数为10%的H2SO4溶液进行酸化;加入1.2 mL乙醚后,将混合物在4 ℃、8000 r/min条件下离心10 min,取有机上清液,加入0.25 g Na2SO4混合5 min以除去水分;用0.22 μm有机滤膜过滤上清液并用高效气相色谱仪进行测定。
色谱条件:载气N2;分流比20∶1,流速1.5 mL/min;色谱柱HP-INNOWAX(30 m×0.25 mm×0.25 μm),温度由60 ℃提高到190 ℃,维持4 min;注射温度200 ℃,电离温度250 ℃;进样量5 μL。
1.4 数据处理
所有实验均重复3次,数据结果以(平均值±标准差)表示。采用SPSS18.0对数据进行统计学分析,*代表差异显著(P<0.05),**代表差异极显著(P<0.01)。利用Origin 2017绘图。
2 结果与分析
2.1 黄酮类化合物的生物安全性评价分析
黄酮作为一种天然活性物质,其安全性已得到学者们的普遍认可。B.Chen等[8]研究发现,柑橘黄酮衍生物对小鼠没有明显的毒性,不会造成小鼠不良反应;王伟等[13]研究发现,木犀草素黄酮类化合物对人源巨噬细胞THP-1无细胞毒性作用。本研究中,笔者对C.globosumCGMCC 6882发酵所产黄酮类化合物的安全性进行研究发现,实验组小鼠生长状态良好,无明显不良反应,无死亡情况,初步证明该黄酮类化合物对小鼠安全无毒。同时,笔者对不同生长时期各组小鼠血清的生理生化指标进行了检测,结果见表1,其中,不同小写字母代表组间差异显著(P<0.05),下同。由表1可知,灌喂C.globosumCGMCC 6882发酵所产黄酮类化合物后,小鼠肝功能(谷丙转氨酶、谷草转氨酶、谷氨酰转肽酶)、蛋白代谢(总蛋白、白蛋白、球蛋白、白球比)、肾功能(尿素、肌酐、尿酸)等生理生化指标均在正常范围内,这进一步证明C.globosumCGMCC 6882发酵所产黄酮类化合物安全无毒。
2.2 黄酮类化合物对小鼠体重的影响分析
肥胖可引起高血压、高血脂、高血糖、心脑血管等疾病,除加强运动及控制饮食之外,还可通过调整饮食结构或改善食物的健康性预防和控制肥胖[14]。黄酮类活性物质的体重调控作用已逐渐得到学者们认可,如周敬凯等[15]研究发现,地菍总黄酮能够抑制高脂饮食的转化与吸收,控制小鼠体重的增长;马欣雨等[16]研究发现,王不留行黄酮苷能够显著降低动脉粥样硬化小鼠体重。本研究各组小鼠体重变化见表1。由表1可知,空白对照组与实验组小鼠体重均随饲养时间的延长而增加,但实验组小鼠体重增加速率低于空白对照组。饲养21 d后,空白对照组小鼠净增体重为9.5 g,而实验组小鼠净增体重为7.2 g,说明C.globosumCGMCC 6882发酵所产黄酮类化合物有抑制小鼠体重增加的效果,与上述其他学者的研究结果一致。
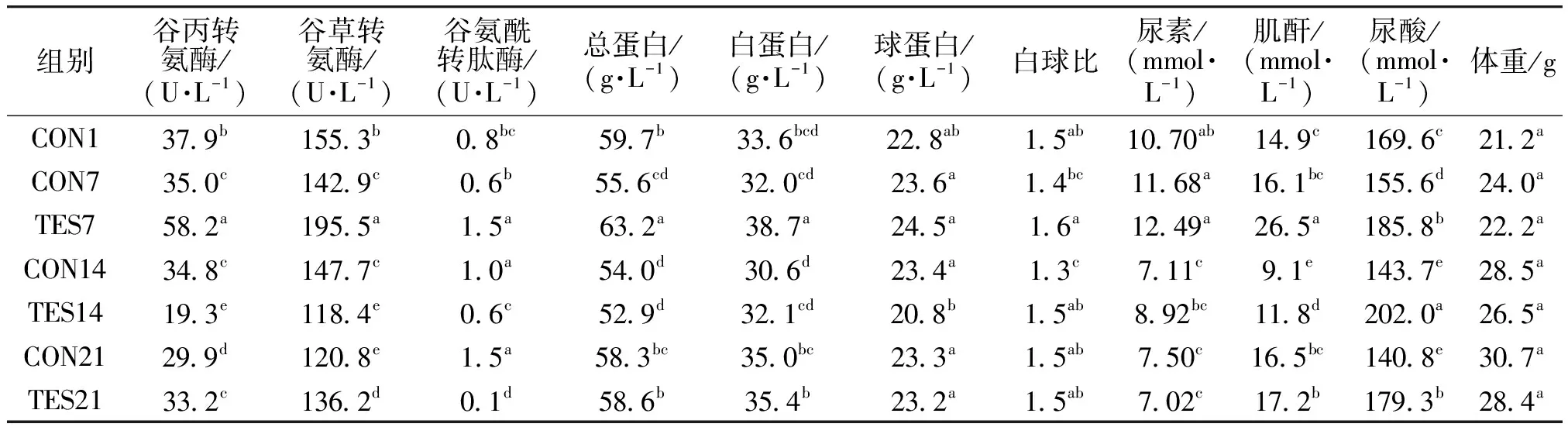
表1 各组小鼠的血清生理生化指标检测结果及体重变化Table 1 Results of serum physiological and biochemical indexes and weight changes of mice in each group
2.3 黄酮类化合物对小鼠肠道菌群Alpha多样性的影响分析
肠道菌群在肥胖发生发展中的作用已得到学者广泛认同,R.Q.Duan等[17]研究发现,全谷燕麦类黄酮能够显著降低高脂饮食小鼠的体重和脂质沉积。肠道微生物Alpha多样性指数可衡量物种的丰度和多样性。Ace指数的数值越大,表示该环境的物种越丰富,各物种分配越均匀;Chao1指数和Shannon指数的数值越高,表示生物多样性越丰富;Simpson指数的数值越高,则表示生物多样性越稀少[18]。各组小鼠肠道菌群Alpha多样性见表2,其中,*代表差异显著(P<0.05),**代表差异极显著(P<0.01),下同。由表2可知,饲养21 d后,空白对照组的Ace指数、Chao1指数和Shannon指数分别由401.419、404.967、3.844上升至416.060、426.884、4.302,实验组的Ace指数指数、Chao1和Shannon指数分别由435.613、411.362、4.103上升至489.964、437.074、4.557;空白对照组的Simpson指数由0.074降至0.043,而实验组的Simpson指数由0.048降至0.026。这表明C.globosumCGMCC 6882发酵所产黄酮类化合物可显著增加小鼠肠道菌群Alpha多样性。王方杰等[19]研究也发现,对高脂饮食诱导的肥胖小鼠灌喂胡柚黄酮8周后,与对照组相比,其Chao1指数和Shannon指数均显著上升,Simpson指数显著下降,肠道菌群多样性逐渐增加并达到最大值,该结果与本研究结果一致。
各组小鼠肠道菌群的韦恩(Venn)图如图1所示。由图1可知,空白对照组与实验组在第1 d、7 d、14 d和21 d共有的OTU数为272个;空白对照组在第7 d、14 d和21 d单独具有的OTU数分别为5个、0个和3个;实验组在第7 d、14 d和21 d单独具有的OTU数分别为0个、4个和4个。同时,空白对照组在第1 d、7 d、14 d和21 d的OUT总数分别为426个、435个、452个和468个,而实验组在第7 d、14 d和21 d的OUT总数分别为484个、499个和507个。饲养时间相同时,实验组的OUT数均高于空白对照组,表明C.globosumCGMCC 6882发酵所产黄酮类化合物可增加小鼠肠道菌群丰度。
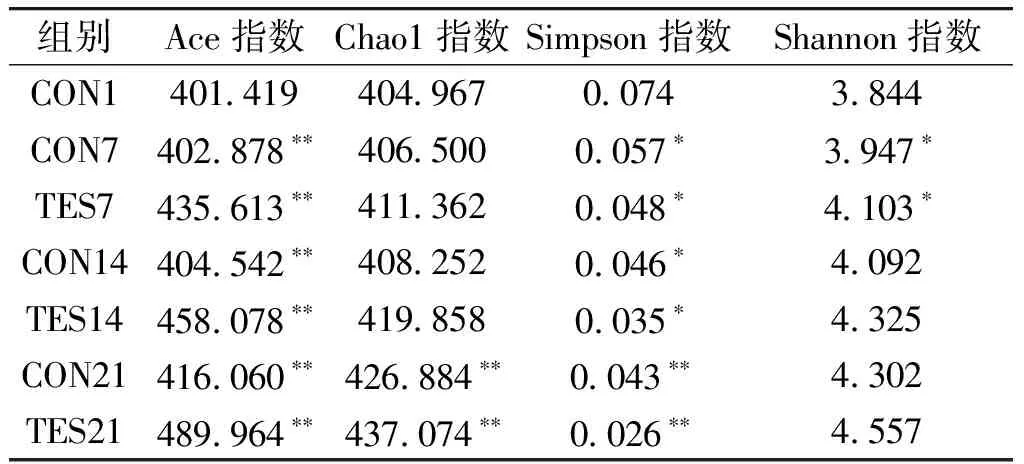
表2 各组小鼠肠道菌群Alpha多样性Table 2 Alpha diversity in gut microbiota of mouse in each group
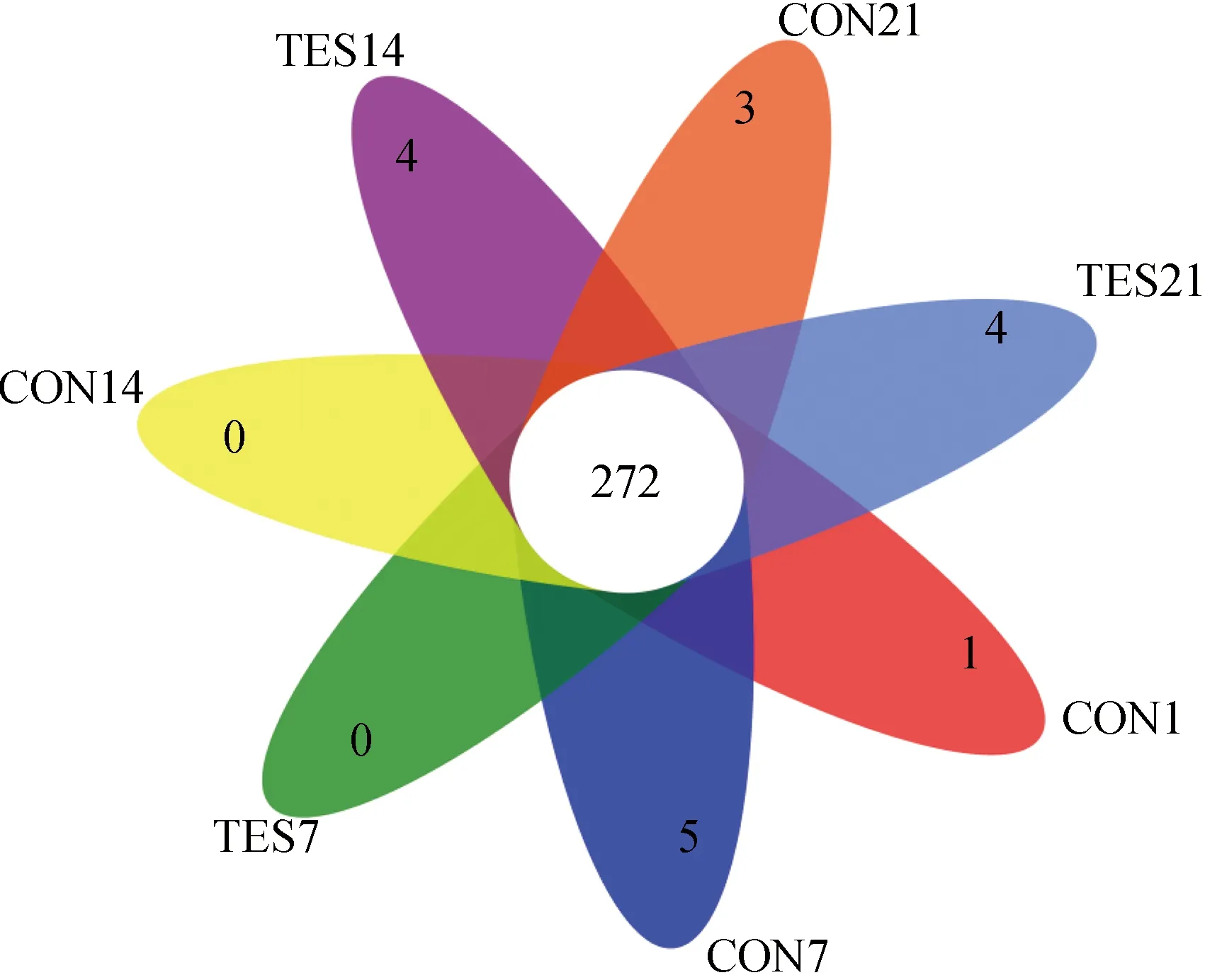
图1 各组小鼠肠道菌群的Veen图Fig.1 Veen diagram of mice gut microbiota in each group
综上所述,C.globosumCGMCC 6882发酵所产黄酮类化合物可能通过提高小鼠肠道菌群丰度和多样性以减轻小鼠体重。
2.4 黄酮类化合物对小鼠肠道菌群门水平上Firmicutes/Bacteroidetes(F/B)值的影响分析
肥胖人群和动物的肠道菌群与厚壁菌门(Firmicutes)水平升高和拟杆菌门(Bacteroidetes)水平降低有关,即这两类菌在肥胖发生发展中起着关键作用[20]。各组小鼠肠道菌群门水平上的组成如图2所示。由图2可知,空白对照组与实验组小鼠肠道中主要检测出厚壁菌门、拟杆菌门、变形菌门(Proteobacteria)、疣微菌门(Verrucomicrobia)、蓝细菌门(Cyanobacteria),其中厚壁菌门与拟杆菌门占细菌总数的95%以上。各组小鼠肠道菌群门水平上F/B值变化趋势如图3所示。由图3可知,饲养第7 d、14 d、21 d,空白对照组小鼠肠道内的F/B值分别为0.771 6、0.768 9和0.745 8,实验组小鼠肠道内的F/B值则为0.413 3、0.365 8和0.354 7,表明C.globosumCGMCC 6882发酵所产黄酮类化合物能够降低小鼠肠道中的F/B值。A.Koliada等[21]研究也发现,随着人体重指数增加,厚壁菌门总数逐渐增加,拟杆菌门总数逐渐减少,F/B值随体重增加而增加;R.E.Ley等[22]研究发现,肥胖小鼠盲肠微生物区系厚壁菌门的占比显著增加,而拟杆菌门占比相较于瘦小小鼠减少了50%。但也有研究表明,F/B值与肥胖无关,如R.Y.Gao等[23]研究发现,表皮黑棘皮症组和无表皮黑棘皮症组间的F/B值无显著差异,而表皮黑棘皮症是胰岛素抵抗肥胖者最常见的皮肤病表现。本研究中,C.globosumCGMCC 6882发酵所产黄酮类化合物组小鼠体重的降低可能与其肠道中F/B值降低相关。
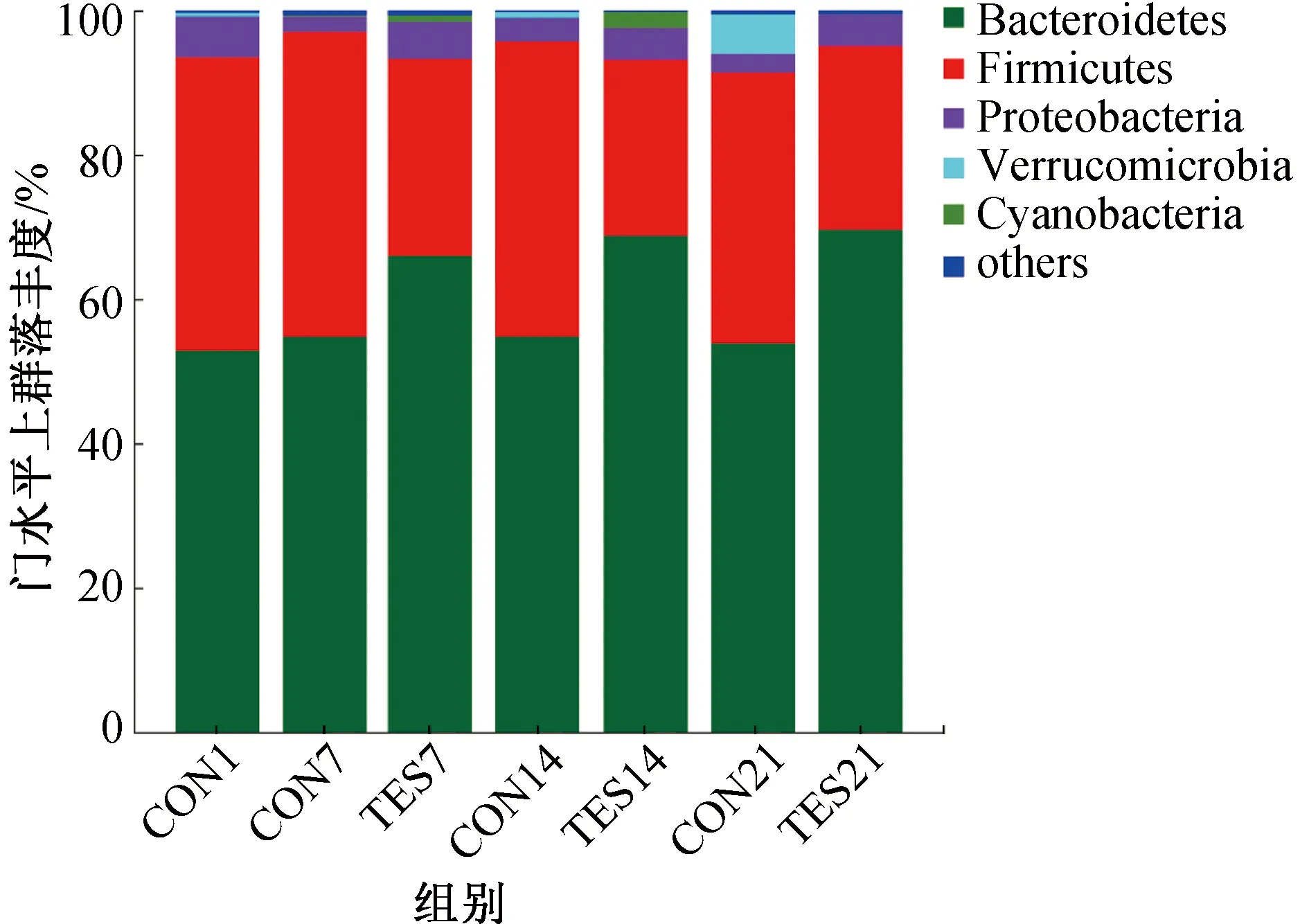
图2 各组小鼠肠道菌群门水平上的组成Fig.2 Composition of mice gut microbiota at phylum level in each group
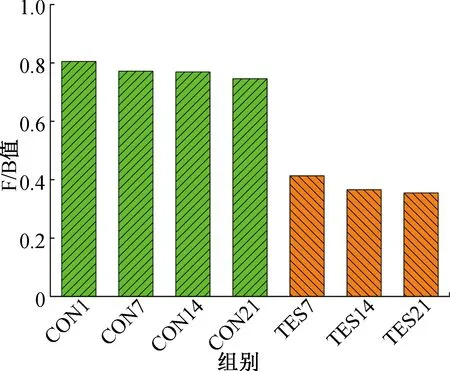
图3 各组小鼠肠道菌群门水平上F/B值变化趋势图Fig.3 Trend of F/B values at phylum level of mice gut microbiota in each group
2.5 黄酮类化合物对小鼠肠道菌群SCFAs的影响分析
SCFAs来源于肠道微生物对难消化食物的发酵,其具有重要代谢功能,对肠道健康至关重要,可作为肠道微生物与宿主间的重要分子信号,或作为调节宿主细胞代谢的新陈代谢基质[24]。各组小鼠肠道菌群的SCFAs变化如图4所示。由图4可知,空白对照组小鼠肠道内乙酸、丙酸、丁酸和总酸含量在饲养期间无显著变化,均值分别为19.0 μmol/g、8.0 μmol/g、6.9 μmol/g和33.9 μmol/g。实验组小鼠 肠道内乙酸、丙酸、丁酸和总酸含量则分别由22.1 μmol/g、9.3 μmol/g、8.1 μmol/g和39.5 μmol/g上升至29.3 μmol/g、15.2 μmol/g、9.5 μmol/g和54.0 μmol/g,表明C.globosumCGMCC 6882发酵所产黄酮类化合物可增加小鼠肠道菌群中的SCFAs含量。Y.Y.Lu等[25]研究发现,SCFAs可通过抑制米色脂肪生成及促进甘油三酯与游离脂肪酸水解而降低高脂饮食诱导的小鼠体重增加;此外,SCFAs还能通过增加饱腹感影响食物摄入量[26]。本研究中C.globosumCGMCC 6882发酵所产黄酮类化合物降低小鼠体重的原因可能与上述2个机理相关,但其具体调控机制还需要深入研究和探讨。
3 结论
本实验通过灌喂小鼠C.globosumCGMCC 6882发酵所产黄酮类化合物,检测了小鼠体重及肝脏、蛋白代谢、肾脏等血清生化指标,分析了小鼠肠道菌群物种组成和多样性、代谢物SCFAs种类和含量变化,研究了C.globosumCGMCC 6882发酵所产黄酮类化合物对小鼠生长和肠道菌群的影响。发现C.globosumCGMCC 6882发酵所产黄酮类化合物对小鼠安全无毒,可有效减轻小鼠体重,提高小鼠肠道菌群多样性和丰度,增加肠道菌群门水平上F/B值,同时,在代谢水平上可增加小鼠肠道菌群中的SCFAs含量。本研究结果对黄酮类化合物能够减轻小鼠体重具有一定的借鉴意义。
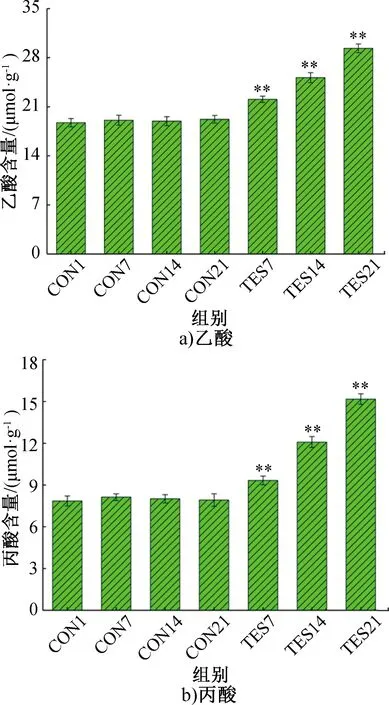

图4 各组小鼠肠道菌群的SCFAs变化
Fig.4 Changes of SCFAs of mice gut microbiota in each group
[2] GONZLEZ-PARAMS A M,AYUDA-DURN B,MARTNEZ S,et al.The mechanisms behind the biological activity of flavonoids [J].Current Medicinal Chemistry,2019,26(39):6976-6990.
[3] 肖咏梅,李明,毛璞,等.黄酮类化合物生物改性及活性的研究进展[J].河南工业大学学报(自然科学版),2019,40(2):123-131,139.
[4] BAGHERI N,AL LAWATI H A J,HASSANZADEH J.Simultaneous determination of total phenolic acids and total flavonoids in tea and honey samples using an integrated lab on a chip device [J].Food Chemistry,2021,342:128338.
[5] JENNINGS A,KOCH M,BANG C,et al.Microbial diversity and abundance of parabacteroides mediate the associations between higher intake of flavonoid-rich foods and lower blood pressure [J].Hypertension,2021,78:1016-1026.
[6] PEI R S,LIU X C,BOLLING B.Flavonoids and gut health[J].Current Opinion in Biotechnology,2020,61:153-159.
[7] 李明,卢慧,徐振江.黄酮类天然产物调控肠道微生物改善炎症性肠病的研究进展[J].河南工业大学学报(自然科学版),2020,41(3):118-129.
[8] CHEN B,LUO J K,HAN Y H,et al.Dietary tangeretin alleviated dextran sulfate sodium-induced colitis in mice via inhibiting inflammatory response,restoring intestinal barrier function,and modulating gut microbiota[J].Journal of Agricultural and Food Chemistry,2021,69:7663-7674.
[9] 白利琴.多糖黄酮对大鼠血脂代谢与肠道菌群调节作用研究[D].石家庄:河北科技大学,2020.
[10]HOEK-VAN DEN HIL E F,VAN SCHOTHORST E M,VAN DER STELT I,et al.Direct comparison of metabolic health effects of the flavonoids quercetin,hesperetin,epicatechin,apigenin and anthocyanins in high-fat-diet-fed mice [J].Genesand Nutrition,2015,10(4):23.
[11]PANDA V,SHINDE P.Appetite suppressing effect ofSpinaciaoleraceain rats:Involvement of the short term satiety signal cholecystokinin [J].Appetite,2017,113:224-230.
[12]付乾振,梁小娜,郑欣欣,等.ChaetomiumglobosumCGMCC 6882产黄酮类化合物的发酵工艺及产物抗氧化活性研究[J].河南工业大学学报(自然科学版),2022,43(1):83-90.
[13]王伟,何平,江小明.木犀草素及其黄酮苷的抗炎、抗氧化作用[J].食品科学,2020,41(17):208-215.
[14]GAO S Y,ZHAO C N,XU X Y,et al.Dietary plants,gut microbiota,and obesity:Effects and mechanisms[J].Trends in Food Science & Technology,2019,92(C):194-204.
[15]周敬凯,翁竞玉,朱盼,等.地菍总黄酮对高脂饮食大鼠减肥作用及肠道菌群的影响[J].中成药,2021,43(10):2673-2678.
[16]马欣雨,徐非,龚蕾蕾,等.王不留行黄酮苷对小鼠动脉粥样硬化的作用及机制[J].中国药理学通报,2021,37(11):1518-1523.
[17]DUAN R Q,GUAN X,HUANG K,et al.Flavonoids from whole-grain oat alleviated high-fat diet-induced hyperlipidemia via regulating bile acid metabolism and gut microbiota in mice[J].Journal of Agricultural and Food Chemistry,2021,69:7629-7640.
[18]ZHAO R Q,YANG W J,PEI F,et al.Invitrofermentation of six kinds of edible mushrooms and its effects on fecal microbiota composition[J].LWT-Food Science and Technology,2018,96:627-635.
[19]王方杰,吴祖芳,翁佩芳,等.胡柚黄酮对高脂饮食诱导的肥胖小鼠模型肠道菌群的调节作用[J].食品科学,2020,41(21):140-146.
[20]TURNBAUGH P J,HAMADY M,YATSUNENKO T,et al.A core gut microbiome in obese and lean twins[J].Nature,2009,457:480-484.
[21]KOLIADA A,SYZENKO G,MOSEIKO V,et al.Association between body mass index and Firmicutes/Bacteroidetes ratio in an adult Ukrainian population[J].BMC Microbiology,2017,17:1017-1027.
[22]LEY R E,BCKHED F,TURNBAUGH P,et al.Obesity alters gut microbial ecology[J].Proceedings of the National Academy of Sciences of the United States of America,2005,102:11070-11075.
[23]GAO R Y,ZHU C L,LI H,et al.Dysbiosis signatures of gut microbiota along the sequence from healthy,young patients to those with overweight and obesity[J].Obesity,2018,26:351-361.
[24]MORRISON D J,PRESTON T.Formation of short chain fatty acids by the gut microbiota and their impact on human metabolism[J].Gut Microbes,2016,7:189-200.
[25]LU Y Y,FAN C N,LI P,et al.Short chain fatty acids prevent high-fat-diet-induced obesity in mice by regulating G protein-coupled receptors and gut microbiota[J].Scientific Reports,2016,6:37589.
[26]CANFORA E E,JOCKEN J W,BLAAK E E.Short-chain fatty acids in control of body weight and insulin sensitivity[J].Nature Reviews Endocrinology,2015,11:577-591.
