直链淀粉-番茄红素复合物的氧稳定性及降解动力学研究
2022-12-08孙世东赵文红
孙世东,赵文红
河南工业大学 粮油食品学院,河南 郑州 450001
0 引言
番茄红素(Lycopene)是来源于植物性食物的一种类胡萝卜素,也是一种含有多不饱和键的异戊二烯类化合物,广泛存在于番茄、番石榴、西瓜等植物果实中[1]。番茄红素具有较强的抗氧化活性[2],以及高效猝灭单线态氧[3]、抗癌抑癌[4]、清除过氧自由基[5]、预防心血管疾病[6]、调节细胞间通讯[7]、增强免疫力[8]等多种生理功能。但因易受光、氧、热等因素的影响而产生降解损失[9],限制了番茄红素的工业化应用。
复合制剂是利用物理、化学、生物等方法,将两种或两种以上物质进行复合,以达到保护其中一种物质或提升整体价值的目的[10]。研究表明,通过复合制剂可以增强番茄红素的稳定性。李万茸等[11]制备的β-酸-番茄红素复合物对其中番茄红素的光、热、酸、碱稳定性有积极影响;刘会晓等[12]研发的番茄红素纳米脂质体具有良好的储藏稳定性;此外,番茄红素与多糖类、蛋白类、脂类等结合制成的复合物制剂均表现出良好的稳定性[13-15]。淀粉对人体血糖影响较大,而淀粉-配体复合物具有抗消化性[16],且直链淀粉作为一种良好的壁材在保护功能性分子方面已得到广泛应用[17-18]。本课题组前期基于直链淀粉的回生特性制备得到直链淀粉-番茄红素复合物(ALCs),并对其结构特征进行了初步表征[19]。本文拟对该ALCs进一步进行结构分析,研究 O2和 N2条件下ALCs中的番茄红素保留率和抗氧化活性,构建其降解动力学模型以评价ALCs的氧稳定性变化规律,以期为番茄红素稳定制剂的开发与应用提供理论依据与参考。
1 材料和方法
1.1 实验材料与试剂
直链淀粉(来源于土豆,标准品)、番茄红素(纯度为 90%),上海源叶生物科技有限公司产;1,1-二苯基-2-三硝基苯肼(DPPH)(纯度为 96%),上海麦克林生化科技有限公司产;二甲基亚砜、丙酮、HCl(纯度为 36.5%)、NaOH,天津科密欧化学试剂有限公司产;N2(纯度为 98%),郑州新丰化学试剂有限公司产;蒸馏水、ALCs,实验室自制。
1.2 仪器与设备
UV1800-BPC 型紫外可见分光光度计,上海美普达仪器设备有限公司产;MX-S型涡旋振动器、MS-H280-Pro型磁力搅拌器,美国SCILOGEX公司产;YM-120S型超声波仪,广东洁盟电器有限公司产;BT-9300ST型激光粒度分析仪,丹东百特仪器有限公司产;AVANCE(3)400WB型超导(固体)核磁共振仪,德国布鲁克公司产;BWS465-785S型便携式拉曼光谱仪,美国BWTEK公司产;202-00T 型鼓风干燥箱,上海力辰科技仪器有限公司产;JXDC-10 型氮气吹扫仪,上海净信科技仪器有限公司产。
1.3 实验方法
1.3.1ALCs样品的制备参照R.Lyu 等[20]的方法,并稍作修改。称取直链淀粉300 mg,均匀分散于0.4 mL无水乙醇中,加30 mL蒸馏水溶解并于95 ℃水浴5 min;取番茄红素15 mg溶于15 mL二甲基亚砜中,于50 ℃保温备用;将直链淀粉溶液降温至50 ℃后与番茄红素溶液混合,500 r/min 搅拌 2 h,程序降温后放入 4 ℃冰箱冷藏 6 h;冷藏结束后1500 r/min离心 30 min,弃上清液,真空干燥沉淀,即制得ALCs样品。所有操作均在避光、充N2环境下完成。
1.3.2 粒径测定使用激光粒度分析仪测定样品的粒径大小。具体方法为:选用超纯水为分散剂,向加样口加入样品使颗粒折射率达到1.53,随后对样品的颗粒粒径进行测定。
1.3.3 拉曼光谱测定参照刘华玲等[21]的方法,并稍作修改。将样品放入样品池中压实、铺平并密封好后,在便携式拉曼光谱仪中进行测试,测试条件为积分时间10 000 ms,激光功率100 mW,20倍长焦物镜背向散射测量模式,扫描次数20次,在 180° 范围内搜集散射辐射,波数范围为200~2000 cm-1,所得谱图即为样品的拉曼光谱图。
1.3.4 结构类型分布测定采用配置有CP/MAS探头的超导(固体)核磁共振仪测定样品的固体核磁共振谱(NMR)。取样品100 mg,用模具压实后密封置于样品管中,将样品管放置于仪器样品池中,设置参数为:接触时间13 ms,扫描速率20 Hz,扫描次数4096次,谱宽38 KHz,检测频率100 MHz。
为了探究样品中无定形态、双螺旋结构和V-型单螺旋结构的含量分布,根据A.Baran等[22]的方法对样品固体NMR谱图进行分解。采用Microsoft Excel中的Solver工具,通过无定形亚谱(由比例因子调节并单独确定)的强度确定无定形组分的贡献,使得C4位点内的特定化学位移处获得零强度;原谱图减去得到的无定形亚谱,即为有序亚谱。研究[23]表明,C4区信号同时包含无定形态和V-型单螺旋结构信息,C4区在有序亚谱中出现的信号代表V-型单螺旋结构。因此,采用Peak Fit v4.12软件对分解得到的无序亚谱、有序亚谱进行分峰拟合(拟合谱图系数R2≥0.999)并计算峰面积,即可得到3种结构的含量信息。
1.3.5ALCs中番茄红素质量浓度和保留率测定参照X.L.Yang等[24]的方法,并稍作修改。分别配制质量浓度为 0 μg/mL、2.5 μg/mL、5.0 μg/mL、7.5 μg/mL、10.0 μg/mL和15.0 μg/mL的番茄红素丙酮溶液,用紫外分光光度计测定其在447 nm处的吸光度,每个实验均重复3次,对实验结果取平均值,绘制质量浓度-吸光度图,并进行线性拟合,得到标准曲线方程y=0.156 5x-0.011 3(R2=0.999 9)。称取一定量样品于若干试管中,分别置于O2和N2条件下,每隔一定时间取样5 mg。将取出的样品置于试管中,加入10 mL 丙酮,用混匀仪处理3 min,避光、4 ℃条件下超声处理5 min,1500 r/min离心处理15 min,取上清液于比色皿中,使用紫外可见分光光度计测量其在447 nm处的吸光度。根据公式①计算其保留率。
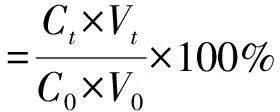
①
式中:C0是 ALCs 中番茄红素的初始质量浓度/(μg·mL-1);Ct是不同时间点ALCs中番茄红素的质量浓度/(μg·mL-1);V0是初始ALCs萃取番茄红素的丙酮体积/mL;Vt是不同时间点ALCs萃取番茄红素的丙酮体积/mL;t为不同时间点/h。
1.3.6DPPH清除率测定参考P.Pakosz[25]的方法,配置0.01 mmol/L的DPPH溶液,取1 mL浸提后的溶液(浸提番茄红素的方法同1.3.5)加入3 mL DPPH溶液中,反应30 min后在517 nm处测定吸光度。实验设置番茄红素标准品为对照。测定完成后依据公式②计算样品的DPPH清除率。
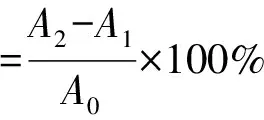
②
式中:A0为 DPPH 溶液(V(DPPH 溶液)∶V(丙酮)=3∶1)的吸光度;A1为无水乙醇与 ALCs 丙酮溶液(V(无水乙醇)∶V(ALCs 丙酮溶液)=3∶1)的吸光度;A2为DPPH 溶液与ALCs溶液(V(DPPH溶液)∶V(ALCs 丙酮溶液)=3∶1)混合反应后的吸光度。
1.3.7ALCs中番茄红素的降解动力学模型构建参考A.Aliyu等[26]的方法,依照阿伦尼乌斯方程进行降解动力学模型构建。依据 ALCs 中番茄红素的质量浓度变化分别代入零级、一级和二级降解动力学方程式进行拟合,以研究ALCs的降解动力学行为特征。各级降解动力学方程式如下。
y0=C0-Ct=kt+b
③
④
⑤
式中:k为速率常数/(μg·(mL·h)-1)。
ALCs 中的番茄红素经降解动力学拟合后,根据以上公式计算其k、半衰期(T1/2)/h、十分之一衰期(T9/10)/h等降解动力学参数。
1.4 数据处理
实验数据使用SPSS 20.0进行统计学处理,各项指标以(平均数±标准差)表示;实验组与对照组计量资料采用配对t检验,定性数据比较采用卡方检验。P<0.05时认为差异具有统计学意义。采用 Origin 8.5和Microsoft Excel 2016 作图。
2 结果与分析
2.1 ALCs的粒径分析
ALCs 和直链淀粉的粒径分布如图1所示,其中,D(10)、D(50)和D(90)表示各组样品粒径小于对应直径的颗粒量分别占颗粒总量的10%、50%和90%;D(1,0),D(2,1)、D(3,2)和D(4,3)分别表示样品的数量平均径、长度平均径、面积平均径和体积平均径;不同大写字母表示组间具有显著性差异(P<0.05),不同小写字母表示组内具有显著性差异(P<0.05),下同。由图1 可知,ALCs的D(10)、D(50)、D(90)、D(1,0)、D(2,1)、D(3,2)和D(4,3)均显著大于直链淀粉(P<0.05)。ALCs的形成改变了直链淀粉的粒径分布,且ALCs的粒径大于直链淀粉。但有研究[27]表明,进入直链淀粉空腔中的配体对直链淀粉的粒径影响不大。这表明番茄红素与直链淀粉形成复合物时,番茄红素不仅进入直链淀粉螺旋空腔中,还可能截留在直链淀粉分子间或与直链淀粉分子链缠绕形成双螺旋结构。此外,ALCs 的D(90)和D(4,3)较大,这可能是因为出现颗粒黏连现象。综上所述,ALCs具有较大的颗粒尺寸,且可能存在颗粒黏连现象。
2.2 ALCs拉曼光谱分析
ALCs 和直链淀粉的拉曼光谱图如图 2所示。由图 2 可知,ALCs与直链淀粉的拉曼光谱图较相似,因为两者都含有相同的化学键,即淀粉中特有的化学键。ALCs的拉曼峰较弱,这是因为部分直链淀粉与番茄红素形成了复合物,使得其质量浓度有所下降。与直链淀粉相比,ALCs在 1 127.04 cm-1处有1个峰,此峰为番茄红素残基的特征吸收峰[28],表明番茄红素与直链淀粉发生了复合。
2.3 ALCs结构类型分析
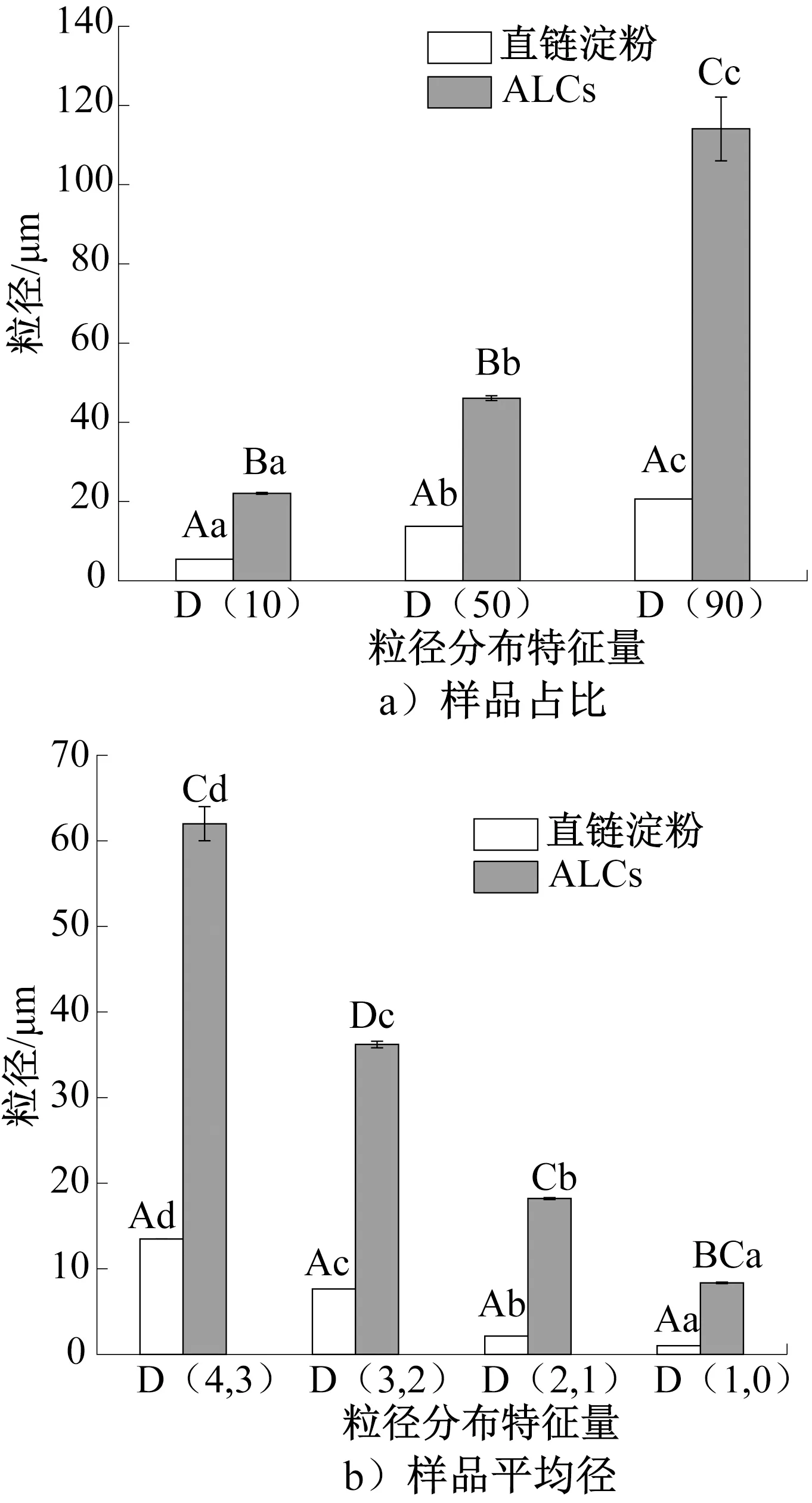
图1 ALCs 和直链淀粉的粒径分布Fig.1 Particle size distribution of ALCs and amylose
2.3.1ALCs的NMR谱图解析固体NMR谱图中峰的化学位移能够反应物质短程有序的结构信息[29]。ALCs和直链淀粉的固体NMR谱图及出峰位点如图3和表1所示。由图3可知,ALCs和直链淀粉的核磁共振谱图与经典的淀粉核磁共振谱图具有相似的出峰位点。其中,90~110 Hz为C1区,70~79 Hz 为 C2,3,5区,80~84 Hz 为C4区,58~65 Hz为C6区。核磁共振13C谱中存在关于淀粉结晶区和无定形区的信息[30]。C1区中,99~102 Hz代表淀粉双螺旋结构信息,103 Hz处的宽峰和C4区的峰代表淀粉无定形区信息。C1区的多重峰与淀粉结构类型有关。当C1区信号表现为三重峰时,表示为以麦芽三糖为最小单位的A-型淀粉颗粒折叠2次形成双螺旋结构;当C1区信号表现为双重峰时,表示为以麦芽糖为最小单位的B-型淀粉折叠3次形成双螺旋结构。当C1区信号表现为单峰时,淀粉样品内部呈无定形态[31]。但X.T.Hu等[32]研究表明,当C1区信号在100.3 Hz附近存在吸收时,样品中含有V-型结构。ALCs 中C1区信号为单峰,这表明ALCs不是 A-型和B-型。但直链淀粉的C1区信号为三重峰,这表明直链淀粉为A-型淀粉。由表 1 可知,ALCs在100.41 Hz处有吸收,即制备得到的ALCs含有V-型结构。
2.3.2ALCs双螺旋结构、V型-单螺旋结构及无定形态含量分析ALCs和直链淀粉的原NMR谱图及处理后得到的无序亚谱和有序亚谱如图4所示。采用Peak Fit软件对ALCs和直链淀粉的无序亚谱和有序亚谱进行拟合,ALCs和直链淀粉的无定形态、双螺旋结构和V-型单螺旋结构含量见表2。由表2可知,无定形态含量排序为直链淀粉(56.25%)>ALCs(26.21%);双螺旋结构含量排序为ALCs(55.95%)>直链淀粉(43.36%);V-型单螺旋结构含量排序为ALCs(17.84%)>直链淀粉(0.39%)。ALCs的3种结构含量分布为:双螺旋结构>无定形态>V-型单螺旋结构。综上所述,直链淀粉包合番茄红素形成了V-型单螺旋结构,且番茄红素与直链淀粉发生的分子链缠绕增加了ALCs的双螺旋结构含量。
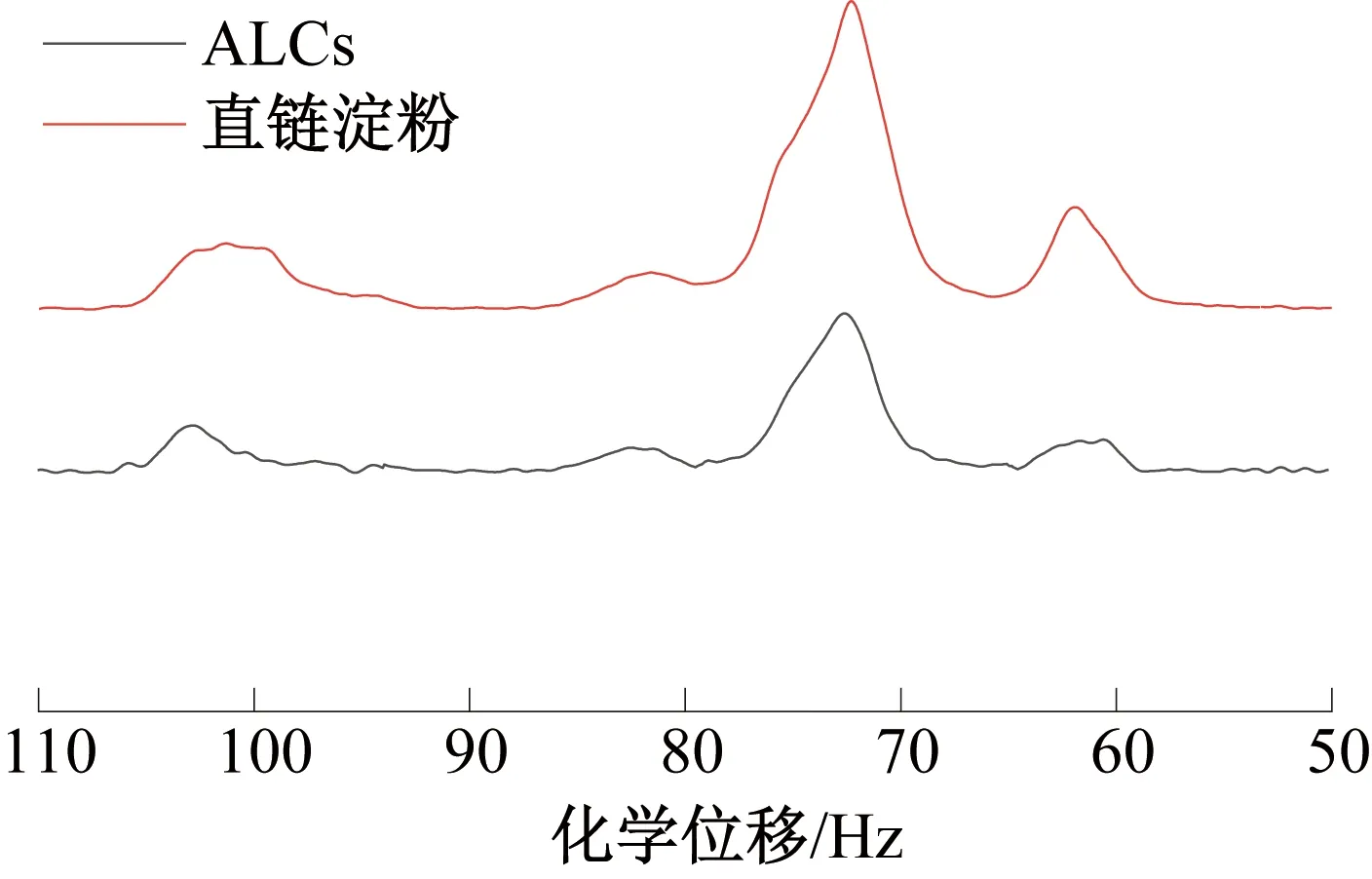
图3 ALCs和直链淀粉的固体NMR谱图Fig.3 Solid-state NMR spectra of ALCs and amylose

表1 ALCs和直链淀粉固体NMR谱图的出峰位点Table 1 Peak points of ALCs and amylose solid NMR spectra
2.4 ALCs中番茄红素保留率变化分析
不同处理条件下ALCs的番茄红素保留率变化如图5所示。由图5可知,在O2和N2处理条件下,随着处理时间的延长,ALCs的番茄红素保留率均呈降低趋势。不同条件下处理24 h后,ALCs的番茄红素保留率分别为(77.09±0.90)%(O2)、(85.19±0.42)%(N2),O2处理条件下ALCs的番茄红素保留率较低;对照组番茄红素的保留率也表现出降低趋势,不同条件下处理24 h后,番茄红素保留率分别为(50.32±0.45)%(O2)、(59.73±0.40)%(N2),O2处理条件下番茄红素的保留率较低。综上所述,两种处理条件下,随着处理时间的延长,ALCs中的番茄红素逐渐降解损失,ALCs的番茄红素氧稳定性顺序为N2>O2。由此可见,N2对ALCs中番茄红素的影响较小,因此,应尽可能将其在N2中保存。但ALCs中番茄红素保留率比对照组大,这可能与ALCs特殊的包合型结构有关。与对照组番茄红素直接暴露在环境中不同,ALCs中的番茄红素可与直链淀粉分子缠绕形成双螺旋结构,或进入直链淀粉分子螺旋空腔中[33-35],因此该制剂化产品可保护其中的番茄红素以减少其损失。以往研究也表明,制剂化产品可有效延缓其番茄红素的降解损失:连小红等[36]制备的番茄红素β-环糊精包合物在O2条件下贮藏8 d后,番茄红素的保留率为52.28%,而未经包埋的番茄红素全部损失;武花花[37]研究发现,番茄红素/羟丙基-β-环糊精包埋物在O2中24 h后,番茄红素保留率约为90%,而番茄红素晶体基本被完全氧化。
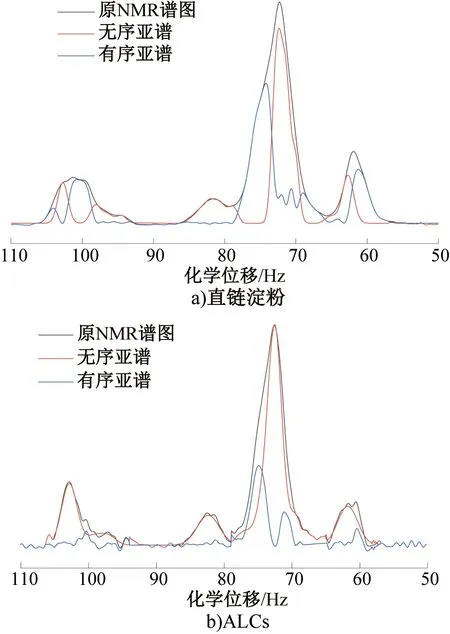
图4 ALCs和直链淀粉的原核磁共振谱图及处理后得到的有序亚谱图和无序亚谱图Fig.4 NMR spectra of ALCs and amylose and the ordered and disordered subspectra obtained after processing
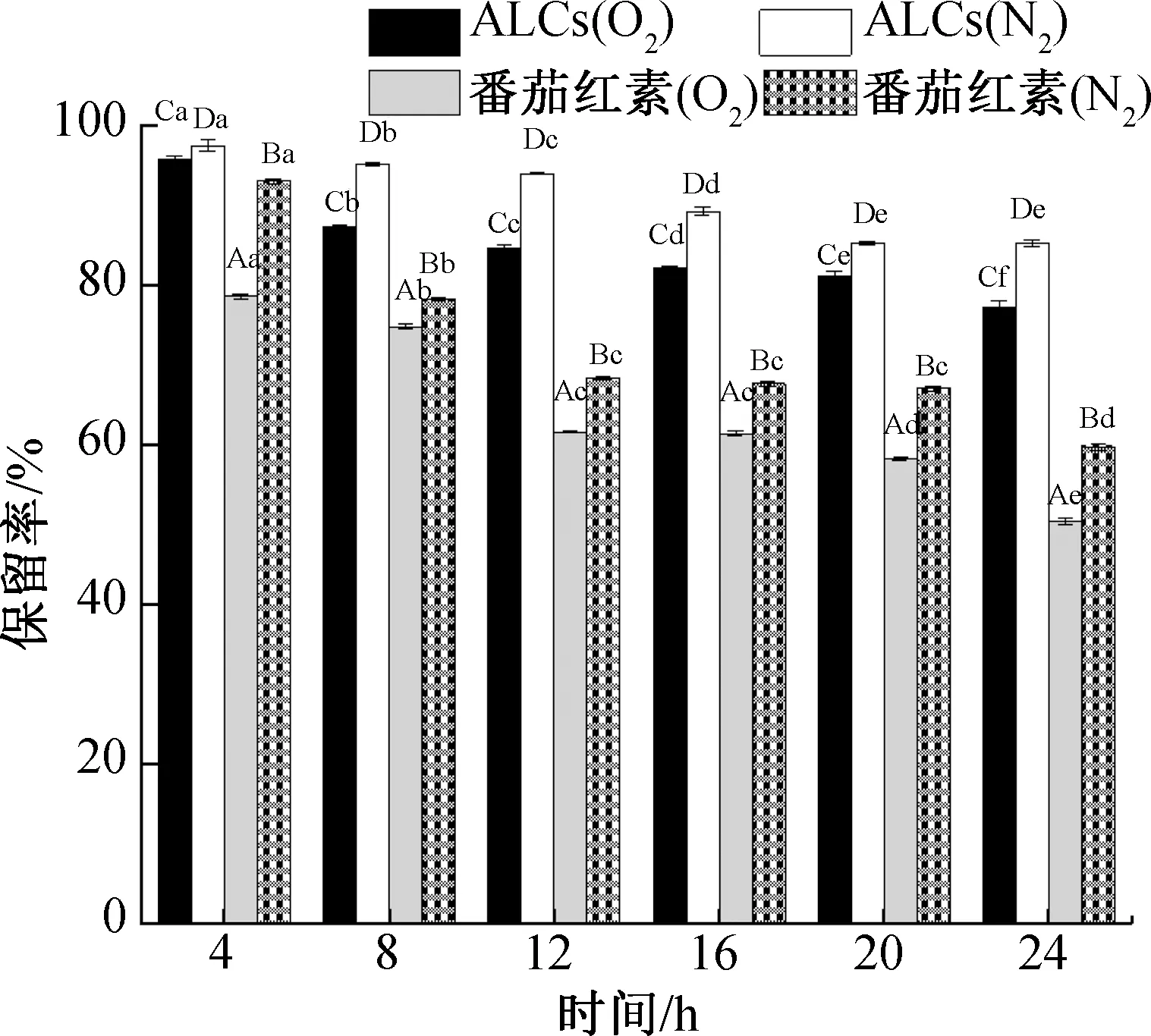
图5 不同处理条件下ALCs的番茄红素保留率变化Fig.5 Changes of lycopene retention in ALCs under different treatment conditions
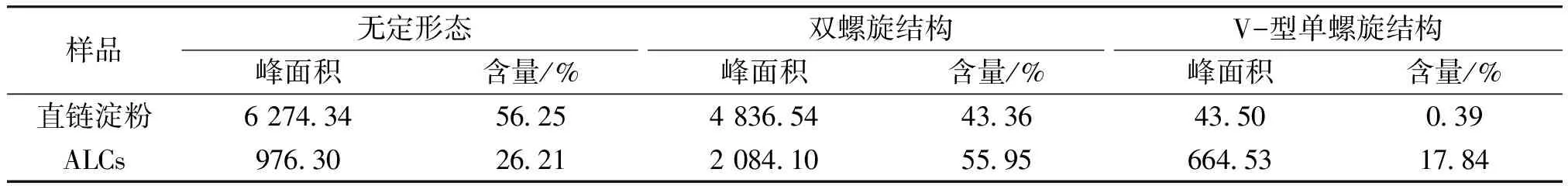
表2 ALCs和直链淀粉的无定形态、双螺旋结构和V型-单螺旋结构含量Table 2 Contents of amorphous, double helix and V-single helix structures of ALCs and amylose
2.5 ALCs的抗氧化活性变化分析
不同处理条件下ALCs的抗氧化活性如图6所示。由图6可知,在两种处理条件下,ALCs与对照组番茄红素的DPPH清除率均呈下降趋势,且ALCs表现出比对照组更强的抗氧化活性。由图6a)可知,在O2处理条件下,ALCs和对照组的DPPH清除率从最初的(49.35±0.00)%(0 h)分别显著降至(33.24±0.03)%和(16.32±0.09)%(24 h)(P<0.01),这表明ALCs在O2环境中能有效保持番茄红素的抗氧化活性。由图6b)可知,在N2处理条件下,ALCs和对照组的DPPH清除率均呈下降趋势;ALCs和对照组的DPPH清除率从最初的(49.35±0.00)%(0 h)分别显著降至(35.74±0.01)%和(17.20±0.00)%(24 h)(P<0.01),这表明ALCs在N2环境中能更好地保持番茄红素的抗氧化活性。
综上所述,随着处理时间的延长,ALCs在O2和N2环境中的抗氧化活性逐渐降低,但降低程度不同。在处理终点时,ALCs的DPPH清除率分别降低了32.64%(O2)和27.57%(N2),N2环境中的降幅相对较小。ALCs的抗氧化活性比对照组强,表明O2对ALCs的抗氧化活性影响更大;番茄红素与直链淀粉复合形成ALCs后,能更好地保持其抗氧化活性。这可能与ALCs中番茄红素的质量浓度有关。王记莲[38]研究发现,随着番茄红素质量浓度的升高,DPPH的清除率逐渐升高。而直链淀粉具有特殊的螺旋结构,在施加的外力(热处理、溶剂处理、超高压等)作用下,其分子内氢键相互作用,链状结构旋转,形成了疏水性的左手螺旋空腔结构,这时番茄红素便可借助疏水作用力进入直链淀粉的螺旋空腔与其复合[39],进而起到对番茄红素有效的保护作用。
2.6 ALCs中番茄红素的降解动力学模型分析
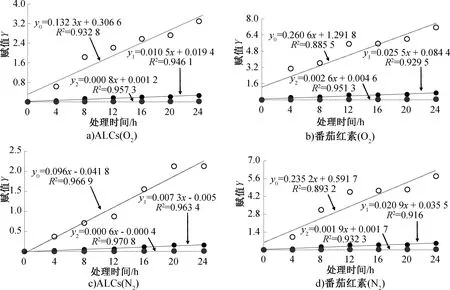
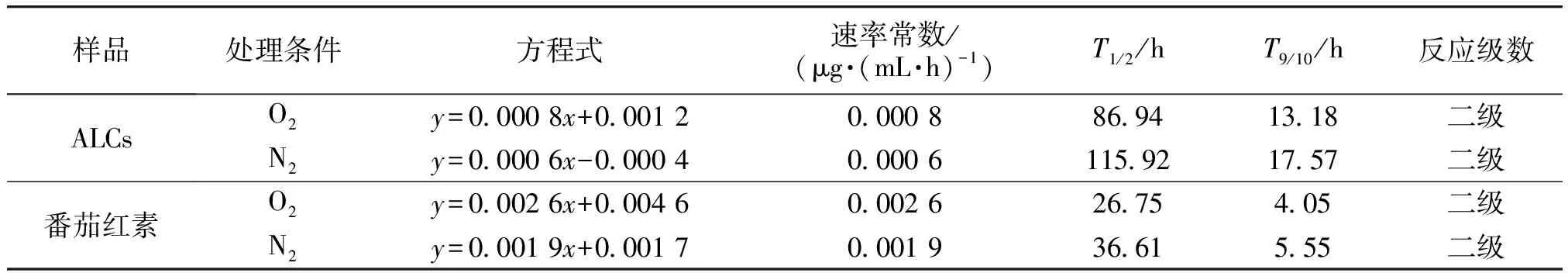
ALCs和番茄红素在不同处理条件下的番茄红素质量浓度变化见表3。不同处理条件下ALCs的降解动力学拟合图如图7所示,其中y0、y1、y2分别为零级、一级、二级降解动力学拟合方程式。由图7可知,在O2和N2处理条件下,ALCs和番茄红素的二级动力学拟合R2均最大,符合二级降解动力学模型。
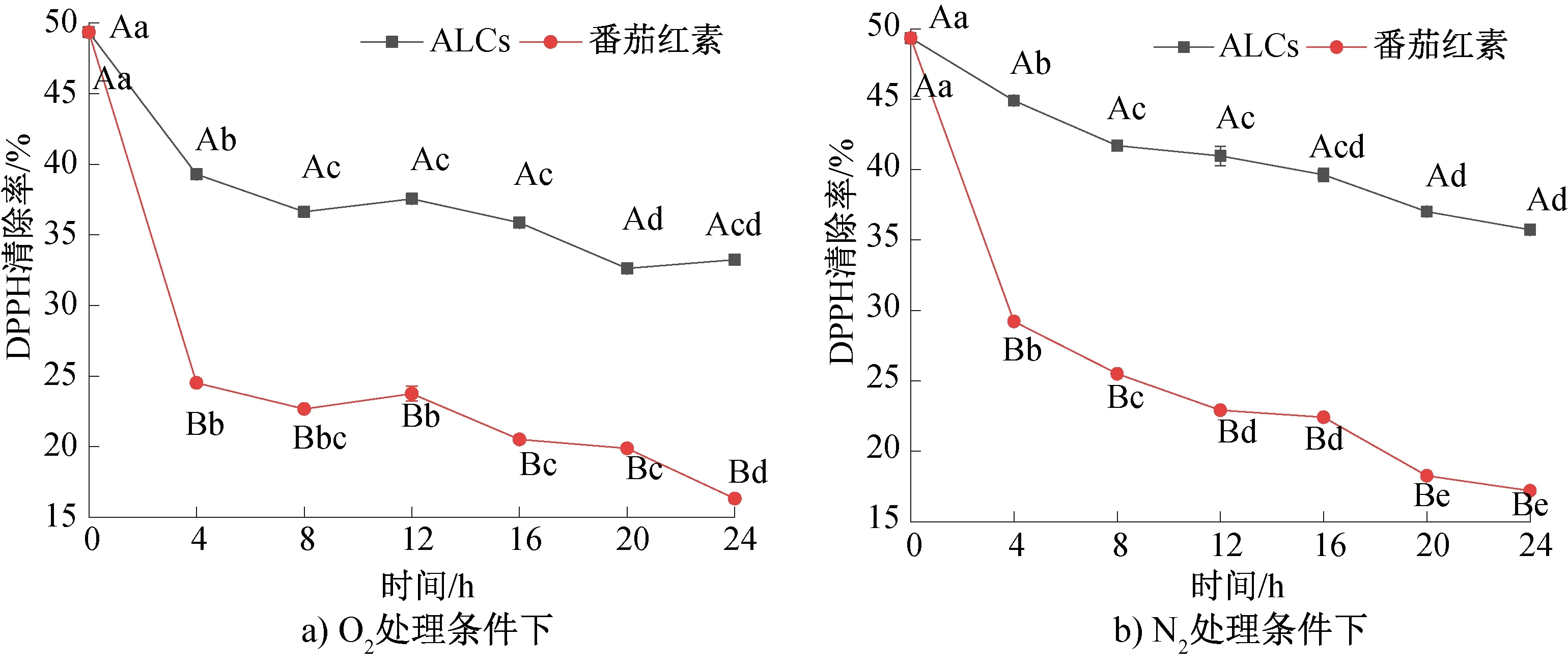
图6 不同处理条件下ALCs的抗氧化活性Fig.6 Antioxidant properties of ALCs under different treatment conditions
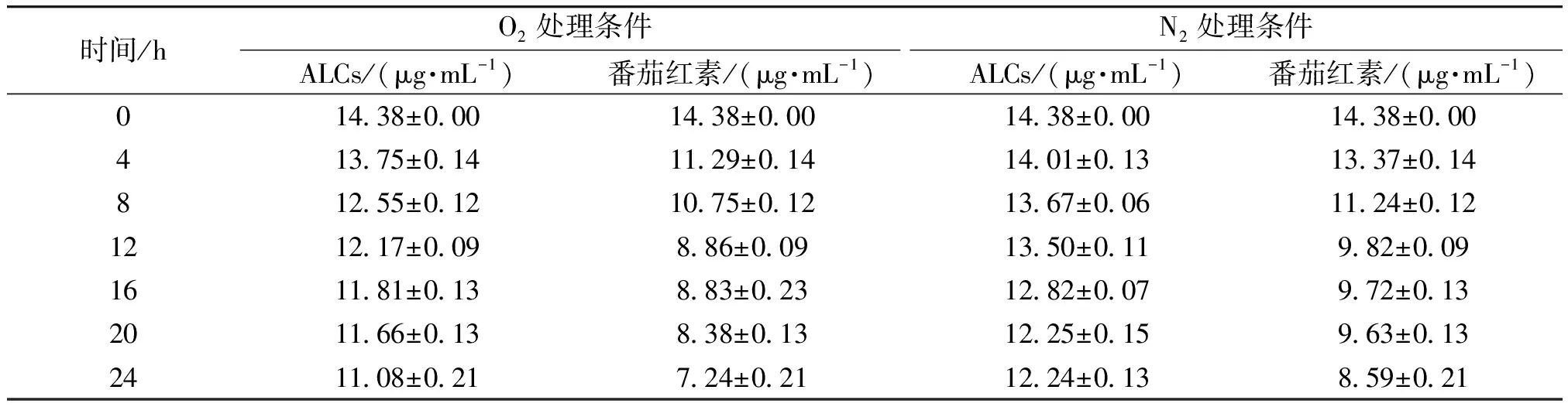
表3 ALCs 和番茄红素在不同处理条件下的番茄红素质量浓度变化Table 3 Changes of lycopene content of ALCs and lycopene under different treatment conditions
不同处理条件下ALCs的降解动力学拟合参数见表4。由表4可知,ALCs在不同处理条件下的番茄红素T1/2大小顺序为O2(86.94 h)
3 结论
本文通过激光粒度分析、拉曼光谱和NMR对ALCs的结构进行了表征,研究了ALCs 中番茄红素的保留率和抗氧化活性变化,并构建了番茄红素降解动力学模型。结果表明:直链淀粉包合番茄红素形成了V-型螺旋结构,且番茄红素与直链淀粉发生了分子链缠绕使ALCs的双螺旋含量增加。ALCs的氧稳定性顺序为O2 图7 不同处理条件下ALCs的降解动力学拟合图Fig.7 Fitting diagram of degradation kinetics of ALCs under different treatment conditions 表4 不同处理条件下ALCs的降解动力学拟合参数Table 4 Fitting parameters of degradation kinetics of ALCs under different treatment conditions