绿茶茶末多酚的提取、鉴定及其生物活性研究
2022-12-08汪雪莲冯慧祥薛世华谢譞刘鹏展
汪雪莲,冯慧祥,薛世华,谢譞,刘鹏展
华南理工大学 食品科学与工程学院,广东 广州 510641
0 引言
在茶叶生产过程中会产生约占产品总质量30%的茶末。这些茶末的化学成分组成与茶叶基本相同,富含多酚、游离氨基酸、多糖等生物活性物质,其中多酚含量甚至可达干物质的30%。此外,茶末具有的抗氧化、调节血糖、降低血脂及胆固醇含量等药用价值也已被理论和临床验证[1-2]。然而,由于形态、口感等问题,茶末只能作为加工副产物,主要用作活性成分提取、功能性食品、保健食品、吸附材料、牲畜饲料等的原料,未得到充分利用。
植物多酚是一类天然的多羟基化合物,具有良好的抗氧化作用,在植物体内普遍存在,山茶属、苹果属植物中含量极为丰富[3-4]。茶叶来源的植物多酚又称茶多酚,是以儿茶素及其衍生物为主的混合物,可占茶叶中多酚类物质总质量的50%~60%[5]。茶多酚具有较强的生理活性和多种健康益处,可用于生产抗病毒制剂、抗肿瘤、糖尿病、肥胖症药物[6]、心血管保健药物[7-8]等。此外,茶多酚作为油脂的抗氧化剂,可抑制油脂的体内、体外氧化[9]。李元慈等[10-13]研究发现,茶多酚还具有降脂护肝的功效。其原理可能是茶多酚通过清除肝脏中自由基、提高总超氧化物歧化酶(T-SOD)活性、降低丙二醛(MDA)含量和肝体比等[12],提高了肝脏的抗氧化能力,达到了护肝的作用[14]。茶末富含茶多酚等物质,对其提取物生理活性的研究多基于混合提取物,而对茶多酚等具体组分进行定性和定量分析并评价其生理活性的系统研究尚不多见。
西湖龙井是我国代表性的绿茶品种,年产量近3×104t,每年会产生大量的茶末等副产物。此外,绿茶属于不发酵茶,加工过程中多酚等抗氧化成分保留较好。基于此,本研究拟选取西湖龙井茶末为原料,利用不同极性有机溶剂萃取得到化学成分组成差异较大的萃取相,通过体外自由基清除实验评价各萃取相的抗氧化活性,依据胰脂肪酶抑制率、α-淀粉酶抑制率等筛选出具有最佳活性的萃取相,并采用液相色谱-串联质谱(LC-MS)及高效液相色谱(HPLC)对其化学成分进行定性和定量分析,以期证明茶末的潜在利用价值,为茶末的综合利用等相关产业提供科学依据和参考。
1 材料与方法
1.1 材料与试剂
西湖龙井茶末(明前春茶),浙江省绍兴市毛坪茶业有限公司产;无水乙醇,富宇精细化工有限公司产;福林酚、聚乙烯醇,国药集团化学试剂有限公司产;无水Na2CO3,上海穗试公司产;没食子酸、过硫酸钾,天津市大茂化学试剂厂产;正丁醇、正己烷、乙酸乙酯,天津福晨化学试剂有限公司产;橄榄油、2,2′-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)、1,1-二苯基-2-三硝基苯基(DPPH),上海麦克林公司产;异辛烷,广东光华科技公司产。以上试剂均为分析纯。
1.2 仪器与设备
SQP 型电子天平,赛多利斯科学仪器北京有限公司产;DK-S26 型电热恒温水浴锅,上海精宏实验设备有限公司产;5424R型台式高速离心机:德国 Eppendorf 公司产;Waters Xevo G2-S 型液相色谱-质谱(LC-MS)联用仪(配有电喷雾离子源(ESI)及Xcalibur1.2数据处理系统),美国Waters公司产;BIOTEK型多功能酶标仪,美国Bio Tek公司产;Thermo U3000型高效液相色谱(HPLC)仪,美国Thrmo Fisher Scientific 公司产。
1.3 实验方法
1.3.1 茶多酚提取参考李原等[15]的方法。称取一定量茶末,105 ℃条件下烘干24 h,粉碎后过30目筛;准确称取10.00 g粉末,经200 mL 60%(如无特指,文中百分数均指体积分数)的乙醇溶液于85 ℃条件下浸提60 min后,抽滤(浸提2次),将滤液减压蒸馏得到膏状液,用蒸馏水稀释至250 mL。分别用250 mL正己烷、乙酸乙酯、正丁醇、蒸馏水于室温下振荡萃取2 h,各萃取3次后合并萃取液,减压蒸馏并定容至250 mL,得到不同极性萃取相,即样品待测液。
1.3.2 总酚质量浓度测定分别吸取1 mL没食子酸标准液、蒸馏水(空白)及样品待测液于10 mL离心管中,添加5.0 mL 10%的福林酚试剂,8 min后,加入4.0 mL质量分数为 7.5%的Na2CO3溶液,摇匀[16];置于室温下反应60 min,于765 nm波长处测定吸光度。没食子酸质量浓度与吸光度的线性回归方程为y=5.994 3x+0.001 2,R2=0.999 3,线性关系良好。总酚质量浓度按下式计算。
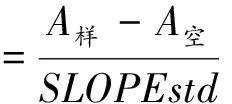
式中:A空为空白对照组的吸光度;A样为样品组的吸光度;SLOPEstd为没食子酸标准曲线斜率。
1.3.3 抗氧化活性测定参考Z.G.Zhao等[17-18]的方法测定DPPH 自由基清除率。将样品待测液稀释至0.01~0.20 mg/mL,取 1 mL VC 溶液或样品待测液,与等量 DPPH 工作液在黑暗条件下反应 30 min,于517 nm波长处测定吸光度。DPPH自由基清除率按下式计算。

参考文献[19-20]的方法测定ABTS 自由基清除率。ABTS 溶液的配制:准确称取0.384 0 g ABTS和0.066 0 g 过硫酸钾,混溶并定容至1000 mL,避光静置 16 h。使用ABTS 溶液前,用无水乙醇稀释至一定倍数,以在734 nm波长处吸光度为0.700±0.02时的ABTS溶液作为ABTS工作液。同时,使用无水乙醇将样品待测液稀释至不同质量浓度,取 20 μL 稀释后的样品溶液,加入2 mL ABTS 工作液,于714 nm波长处测定吸光度。ABTS自由基清除率按下式计算。

1.3.4 胰脂肪酶抑制率测定参考张忠[21]的方法,并稍作修改。将150 mL 2%的聚乙烯醇及50 mL橄榄油均质处理6 min,得到乳化液;取2.0 mL乳化液,加入2.5 mL PBS缓冲液(pH值为7.5),40 ℃水浴5 min;加入1.0 mL样品待测液和0.5 mL胰脂肪酶溶液,混匀,再加入6 mL无水乙醇和1 mL HCl溶液(6 mol/L)终止反应;加入3 mL异辛烷,于60 ℃条件下反应10 min后,取上层液体,加入4 mL异辛烷和1 mL新制乙酸铜显色剂,于714 nm波长处测定吸光度。胰脂肪酶抑制率按下式计算。

1.3.5α-淀粉酶抑制率测定参考王文君等[22]的方法,并稍作修改。按照表1进行α-淀粉酶抑制实验,α-淀粉酶抑制率按下式计算。
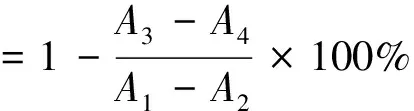
式中:A1为空白组吸光度;A2为空白对照组吸光度;A3为抑制组吸光度;A4为抑制对照组吸光度。
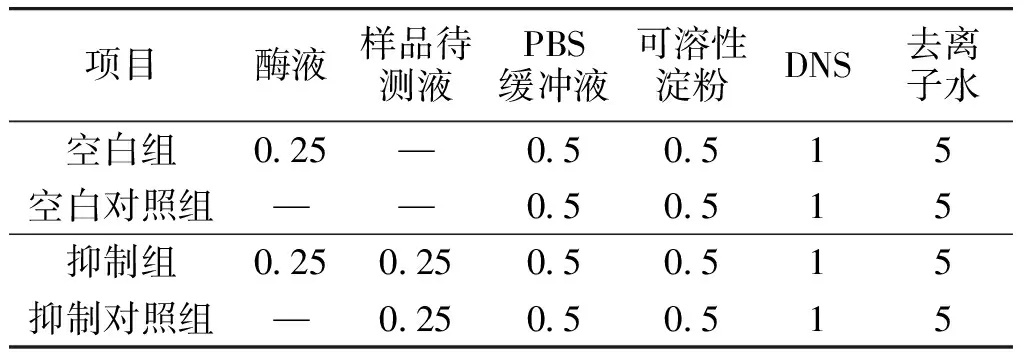
表1 各组中样品待测液与酶液的加入情况Table 1 Addition of sample and enzyme solution in each control group mL
1.3.6LC-MS成分鉴定取适量茶末乙酸乙酯萃取相,减压蒸馏,加入等体积无水乙醇溶解,过0.22 μm有机相滤膜。LC-MS联用仪配备CQUITY UPLC BEH C18色谱柱(1.7 μm×2.1 mm×100 mm),进样量为10 μL,流速为0.4 mL/min。使用流动相A(0.1%的甲酸水溶液)和流动相B(乙腈)洗脱,洗脱程序如下:0~1.5 min,5% B;1.5~11 min,5%~40% B;11~14 min,40%~95% B;14~16.5 min,95% B;16.5~16.8 min,95%~5% B;16.8~20 min,5% B。
采用ESI正离子扫描模式,扫描范围(m/z)为50~1200 amu。离子源温度为120 ℃,毛细管电压为0.5 kV,采用高纯度N2作为雾化气和干燥气,脱气气体和锥形气体流速分别为800 L/h和50 L/h。采用Xcalibur 软件分析原始数据并绘制质谱图。
1.3.7 茶末乙酸乙酯萃取相多酚含量测定取适量茶末乙酸乙酯相,减压蒸馏,加入等体积无水乙醇溶解,过0.22 μm有机相滤膜。HPLC仪配备ACQUITY UPLC BEH C18色谱柱(5 μm×2.1 mm×100 mm),进样量为10 μL,流速为0.4 mL/min。使用流动相A(乙腈)和流动相B(0.1%的甲酸水溶液)洗脱,洗脱程序如下:0~25 min,5%~20% A;25~40 min,20%~50% A;40~45 min,50%~90% B;45~50 min,90%~5% B。与标准品对比,确定出峰时间,检测波长为280 nm,采用外标法进行定量分析。
1.4 数据处理
所有实验均重复测定3次,数据结果以(平均值±标准差)表示。采用IBM spss 21.0对数据进行统计分析,使用Duncan’s检测对各变量进行ANOVA分析,P<0.05表明存在显著性差异。使用GraphPad pris m 9.2.0拟合半抑制浓度(IC50),利用Origin 2021绘图。
2 结果与分析
2.1 茶末各萃取相的总酚质量浓度分析

图1 不同萃取相中总多酚质量浓度Fig.1 Concentration of total polyphenols in different extraction phases
依次利用极性不同的溶剂对茶末的乙醇提取物进行萃取分级,不同萃取相中总酚质量浓度如图1所示,其中不同小写字母表示组间差异显著(P<0.05)。由图1可知,各萃取相总酚质量浓度大小依次为乙酸乙酯萃取相、水萃取相、正丁醇萃取相、正己烷萃取相,分别是15.66 mg/mL、2.64 mg/mL、0.80 mg/mL和0.56 mg/mL。根据相似相溶原理,茶多酚以中等极性(乙酸乙酯萃取相)和强极性(水萃取相)为主,而正丁醇萃取相和非极性(正己烷萃取相)组分较少,其中乙酸乙酯萃取相中总酚质量浓度显著高于其他3种萃取相。其原因可能是茶多酚中中等极性的类黄酮物质较多,这类物质与乙酸乙酯极性最为相近,能够在其中最大程度地溶出,而偏极性的花青素类和极性较弱的苷元类组分则较少。与之类似,李原等[15]在对凤眼果壳多酚的研究中同样发现,乙酸乙酯萃取相中多酚含量高于正己烷萃取相和正丁醇萃取相;R.Zheng 等[23]在研究甘蔗渣多酚时也发现,甘蔗渣中提取得到的乙酸乙酯萃取相中多酚含量高于石油醚萃取相、正丁醇萃取相和水萃取相。
2.2 茶末各萃取相的抗氧化活性分析
人体内过量自由基的存在会引发氧化应激,导致炎症发生,天然抗氧化剂可以通过清除多余自由基,从多个方面起到维护人体健康的作用[24]。因此,自由基清除能力是评价活性物质体内抗氧化活性的重要指标。不同萃取相的自由基清除率如图2所示。由图2可知,不同萃取相的自由基清除能力均随总酚质量浓度的增加而逐步增强;相同总酚质量浓度下,乙酸乙酯萃取相的自由基清除能力最强,其DPPH和ABTS自由基清除率的IC50分别为0.05 mg/mL和0.15 mg/mL。水萃取相对DPPH和ABTS自由基清除率的IC50分别为0.41 mg/mL和0.35 mg/mL。正丁醇萃取相对DPPH和ABTS自由基清除率的IC50为0.61 mg/mL和0.27 mg/mL。正己烷萃取相的自由基清除能力最弱,其DPPH和ABTS自由基清除率的IC50分别为9.05 mg/mL和1.03 mg/mL。如前所述,茶末乙酸乙酯萃取相中主要成分为中等极性的类黄酮物质,在相同总酚质量浓度下,其抗氧化活性强于水萃取相、正丁醇萃取相和正己烷萃取相,适用于后续相关产品的开发。
2.3 茶末各萃取相的胰脂肪酶抑制率分析

图2 不同萃取相的自由基清除率Fig.2 Free radical scavenging rates for different extraction phases
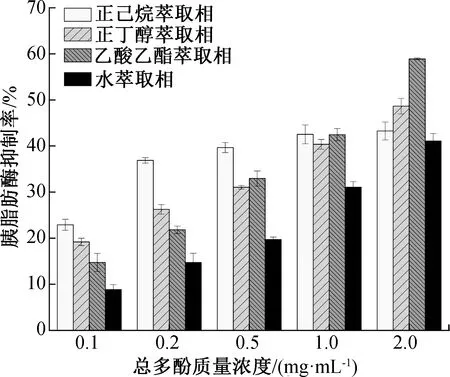
图3 不同萃取相的胰脂肪酶抑制率Fig.3 Pancreatic lipase inhibition rate of total polyphenols in different extraction phrases
胰脂肪酶是人体消化吸收膳食脂肪过程中的主要酶,抑制其活性可以减缓、减少脂肪的吸收,从而达到预防肥胖、降低血脂等功效[25]。不同萃取相的胰脂肪酶抑制率如图3所示。由图3可知,4种萃取相均表现出质量浓度依赖性的胰脂肪酶抑制率,且胰脂肪酶抑制率与总酚质量浓度存在一定的正相关性。在较低总酚质量浓度下,正己烷萃取相的胰脂肪酶抑制率显著高于其他3种萃取相,原因可能是正己烷萃取相中含有较多的低极性物质,能够与胰脂肪酶产生竞争性结合[26];正丁醇萃取相也有类似的胰脂肪酶抑制活性。随着总酚质量浓度的增加,乙酸乙酯萃取相对胰脂肪酶的抑制率快速升高,当总酚质量浓度达到2 mg/mL时,乙酸乙酯萃取相对胰脂肪酶的抑制率超过其他萃取相,且达到最高值,此时的IC50为0.89 mg/mL。刘天囡等[27]研究发现,茯砖茶多酚类物质能够抑制胰脂肪酶,抑制类型为可逆非竞争性抑制,抑制常数(Ki)为2.56 mg/mL。S.Soares等[28]通过荧光猝灭实验发现,茶多酚类物质能够改变酶蛋白所处的微环境,从而使酶活性降低。而多酚可通过“手-手套”模型与胰脂肪酶结合,改变酶分子原来的构象[21]。综上所述,茶末乙酸乙酯萃取相具有较高的胰脂肪酶抑制能力,此外,其他各萃取相同样具有一定的胰脂肪酶抑制能力,也可根据适用的环境(如极性等),选择不同萃取相用于相关产品的开发。
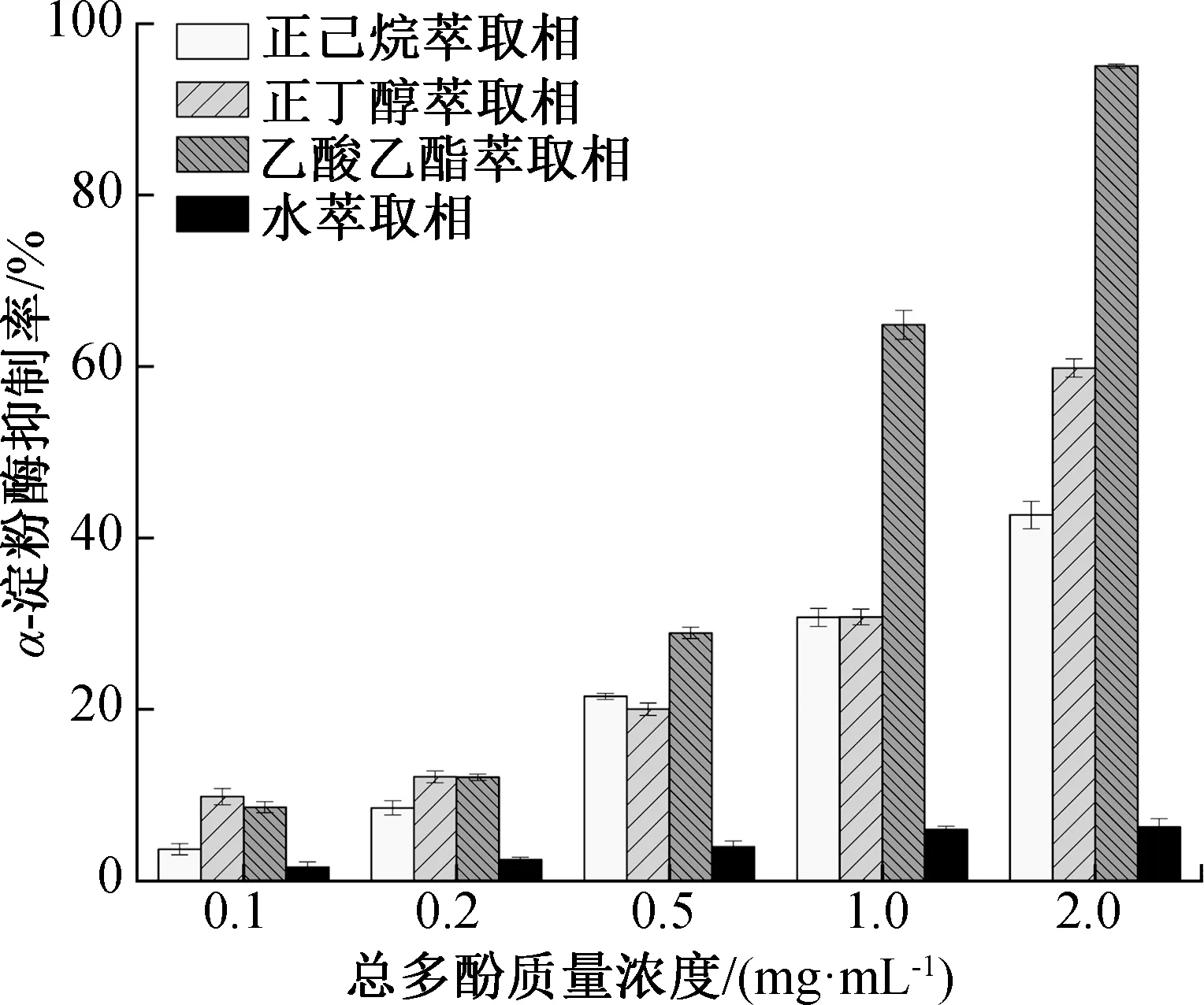
图4 不同萃取相的α-淀粉酶抑制率Fig.4 α-amylase inhibition rate of total polyphenol in different extraction phrases
2.4 茶末各萃取相的α-淀粉酶抑制率分析
α-淀粉酶可水解淀粉分子链中的α-1,4-葡萄糖苷键,生成短链糊精、寡糖、麦芽糖和葡萄糖,抑制消化道中α-淀粉酶的活性,减缓淀粉的水解速度,控制餐后血糖浓度的快速升高,降低胰岛素抵抗的风险[29]。不同萃取相的α-淀粉酶抑制率如图4所示。由图4可知,不同总酚质量浓度下,正己烷萃取相、正丁醇萃取相和水萃取相的α-淀粉酶抑制率的IC50分别为1.03 mg/mL、1.29 mg/mL和0.61 mg/mL。乙酸乙酯萃取相的α-淀粉酶抑制率显著高于其他3种萃取相,其IC50为0.39 mg/mL。这是因为乙酸乙酯萃取相中含有较多儿茶素,而X射线晶体学检测数据显示,儿茶素单体的羟基能与氨基酸活性中心的裂隙结合[30];没食子酸中的芳香环能够分别为位于(-3)/(-2)、(-1)/(+1)、(-1)/(+2)的Trp59、Tyr62、Tyr151残基提供堆积反应的条件[31];儿茶素的没食子酰基具有疏水性,能够与淀粉酶肽链上的疏水性氨基酸发生反应,使淀粉酶内部的疏水腔结构瓦解,从而降低α-淀粉酶的生物活性[32]。张丽娜[33]研究发现,多酚类物质对α-淀粉酶的抑制作用属于竞争性抑制。竞争性抑制可导致酶-底物反应的表观常数(Km)增加,但不影响酶的最大反应速率(Vmax)。茶末乙酸乙酯萃取相对α-淀粉酶的抑制作用较好,可用于开发控制血糖、降低糖尿病风险的产品。茶末的正丁醇萃取相和正己烷萃取相对α-淀粉酶的抑制率也较高,表明茶末提取物中的相对弱极性组分也有较好的α-淀粉酶抑制能力。而强极性组分(水萃取相)对α-淀粉酶活性的抑制能力较差,这可能是由于茶末中水溶性多酚不能与α-淀粉酶的活性位点结合。
综上可知,4种萃取相中,乙酸乙酯萃取相具有最高的总酚质量浓度、最强的抗氧化活性、最高的胰脂肪酶抑制率和α-淀粉酶抑制率。因此,选择乙酸乙酯萃取相作为优选组分,进一步研究其多酚类物质的组成。
2.5 茶末乙酸乙酯萃取相中多酚类物质组成分析
乙酸乙酯萃取相LC-MS总离子流图和多酚类物质鉴定结果分别如图5和表2所示。由图5和表2可知,在正离子模式下,化合物1的分子离子峰m/z为307[M+H]+,根据子离子碎片,鉴定其为表没食子儿茶素/没食子儿茶素。化合物2和4在m/z355[M+H]+处有母离子峰,且在m/z163[M+H-191]+(奎宁酸丢失)处有特征吸收峰,初步鉴定化合物2和4为绿原酸异构体。绿原酸是由咖啡酸与奎宁酸酯化形成的,参考N.B.Fang等[34]报道的绿原酸裂解形式和m/z145处的基峰离子,鉴定化合物2和4分别为绿原酸和新绿原酸。化合物3在m/z179[M+H-161]+(己糖苷丢失)处有特征吸收峰,而m/z179是6,7-二羟香豆素的特征峰,初步鉴定化合物3为6,7-二羟香豆素-3-O-己糖苷。化合物5在m/z291[M+H]+处有母离子峰,而m/z291是儿茶素的特征吸收峰,鉴定化合物5为儿茶素/表儿茶素。化合物6在m/z459[M+H]+处有母离子峰,初步鉴定其为没食子儿茶素没食子酸酯。化合物7在m/z443[M+H]+处有母离子峰,推测其为表儿茶素没食子酸酯。化合物8和9在m/z303[M+H-162]+(己糖苷丢失)处有特征吸收峰,而m/z303是槲皮素的特征吸收峰[35],表明化合物8和9是槲皮素-己糖苷衍生物。根据洗脱时间,初步鉴定化合物8为槲皮素-3-O-金丝桃苷,化合物9为槲皮素-3-O-芸香苷。化合物10在m/z611处具有分子离子峰,在m/z303处产生特殊的MS2片段,是槲皮素衍生物。该物质在m/z275[M+H-308-28]+处断裂后,在m/z183处裂解二糖基单元和CO母离子,进一步产生m/z153 碎片离子。基于类似裂解模式,初步鉴定化合物10为槲皮素-3-O-半乳糖苷[36]。化合物11和14在m/z287[M+H-162]+(己糖苷丢失)处有特征吸收峰,而m/z287是山柰酚的特征吸收峰[35],鉴定化合物11和14为山柰酚-己糖苷衍生物。根据洗脱时间,鉴定化合物11为山柰酚-3-O-半乳糖苷,化合物14为山柰酚-3-O-葡萄糖苷。化合物12和13在m/z303[M+H-132]+(戊糖苷丢失)处有特征吸收峰[35],鉴定化合物12和13是槲皮素-五碳糖苷衍生物。根据洗脱时间,鉴定化合物12为槲皮素-3-O-木糖苷,化合物14为槲皮素-3-O-阿拉伯糖苷。化合物15在m/z275[M+H-162]+处有分子离子吸收峰,而m/z275是根皮素的特征峰,初步鉴定化合物15为根皮苷。
2.6 茶末乙酸乙酯萃取相中多酚类物质的定量分析
利用HPLC对茶末乙酸乙酯萃取相中含量较高的化合物进行定量分析,结果见图6。各化合物线性方程、线性范围和相关系数见表3。由图6和表3可知,在茶末乙酸乙酯萃取相中,化合物6经标准品比对鉴定为咖啡因,它是一种黄嘌呤类生物碱化合物,是茶叶中涩味的主要来源,在茶末中的含量较高,为(23.78±3.51) mg/g;表没食子儿茶素含量最高,为(72.03±1.36) mg/g,其次是儿茶素,为(48.62±0.46) mg/g。金钰等[37]研究西湖龙井在冲调过程中茶多酚的溶出行为时发现,在100 ℃条件下冲调,表没食子儿茶素的最大溶出量为(13.48±0.13) mg/g。由此可知,乙酸乙酯萃取相可更大程度地富集茶末多酚类物质。茶末乙酸乙酯萃取相中类黄酮物质较多,并未发现花青素类、苷元类等物质,这是由于花青素在果蔬中含量较为丰富。P.Z.Liu等[38]通过紫外光谱和质谱鉴定了山楂果实中的多酚类物质,包括B型原花青素(二聚体、三聚体、四聚体)及糖基化原花青素。本研究在茶末中发现并鉴定出根皮苷,而根皮苷在蔷薇科苹果属植物中较为常见,但在茶叶中尚未见报道。
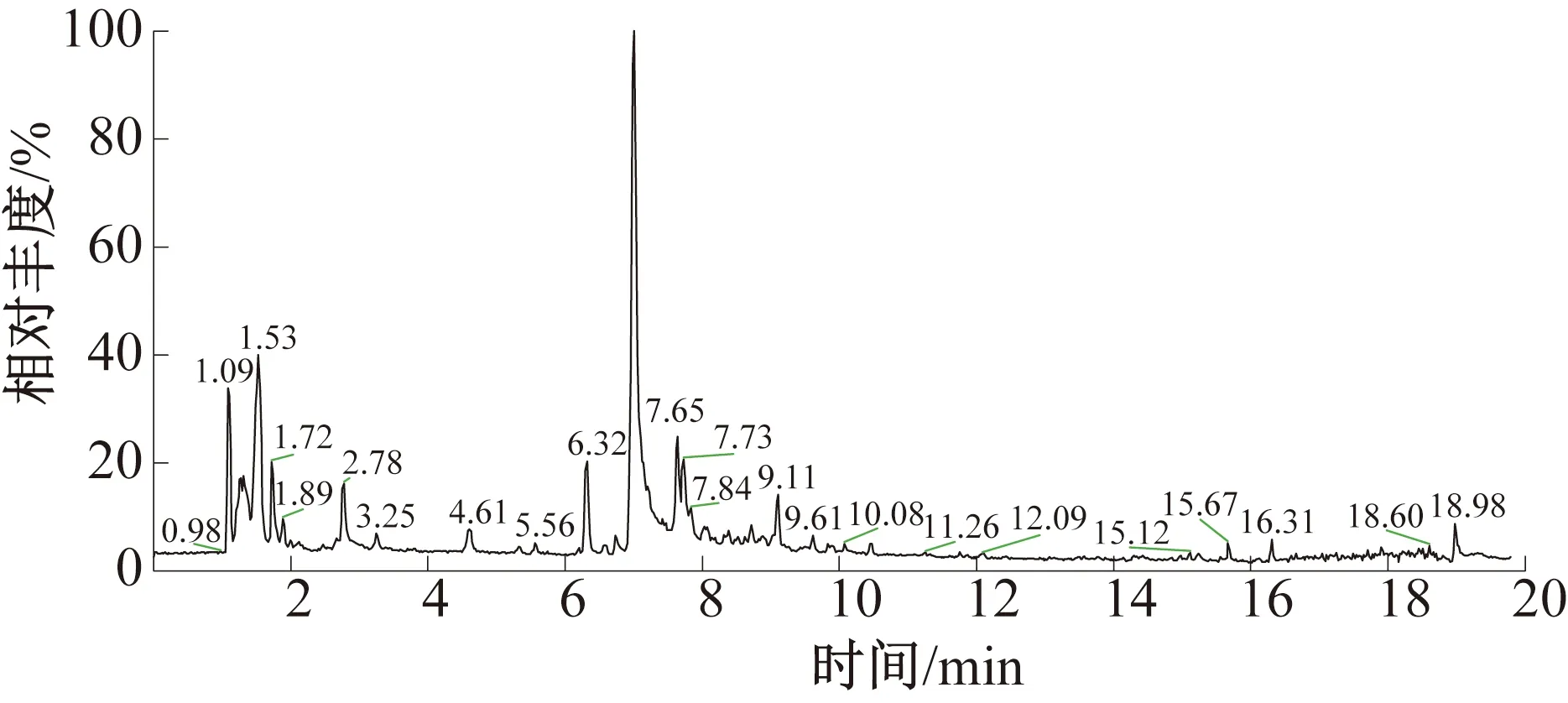
图5 乙酸乙酯萃取相的LC-MS总离子流图Fig.5 LC-MS total ion chromatogram of ethyl acetate phase extract
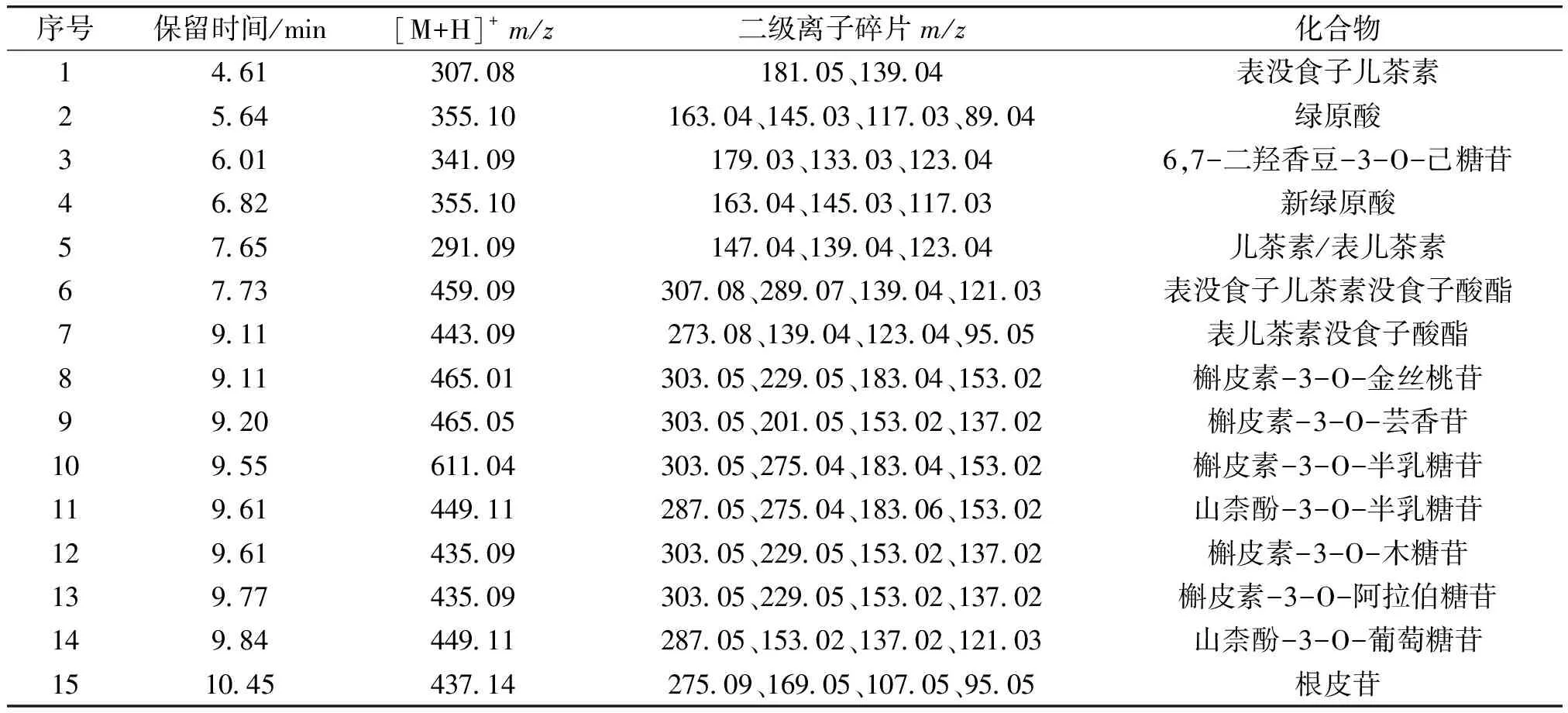
表2 乙酸乙酯萃取相的多酚类物质鉴定结果Table 2 Identification results of polyphenolic compounds in ethyl acetate phase extract
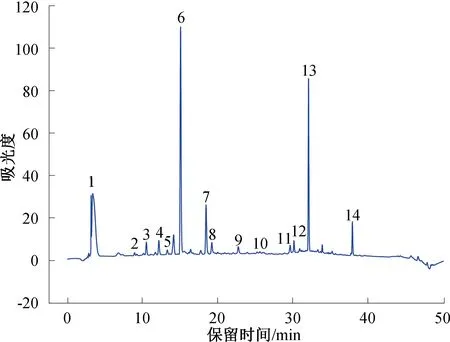
图6 乙酸乙酯萃取相HPLC图Fig.6 HPLC chart of ethyl acetate phase extract
3 结论
本文以西湖龙井茶末为原料,采用不同极性有机溶剂萃取游离多酚,发现乙酸乙酯萃取相的总多酚质量浓度最高、抗氧化活性最强、胰脂肪酶抑制率和α-淀粉酶抑制率最高,表明茶末多酚类物质具有潜在的药用价值,可进一步精制提纯后应用于预防高血糖、肥胖等疾病药品的开发。同时采用LC-MS定性分析乙酸乙酯萃取相中的多酚类化合物,利用HPLC对其中含量较高的物质进行定量分析,发现表没食子儿茶素、儿茶素、绿原酸含量较高,分别为72.03 mg/g、48.62 mg/g和41.58 mg/g。虽然多酚类物质含量丰富,但茶末乙酸乙酯萃取相仍是混合物体系,因此后期可进一步采用色谱技术对其进行分离纯化,提取出具有更高生物活性的化学组分,实现茶末的再利用进而促进茶产业资源的综合利用。
在本文研究基础上,未来仍需进一步探究茶末乙酸乙酯相中抑制胰脂肪酶和α-淀粉酶的具体活性成分、体内外作用机制及构效关系,深入研究茶末乙酸乙酯萃取相有效成分与胰脂肪酶和α-淀粉酶的作用靶点及抑制类型,并进一步通过体外模拟肠胃消化环境,研究不同萃取相在胃肠道环境中的消化耐受性,为茶末相关产品的开发提供科学的理论依据。
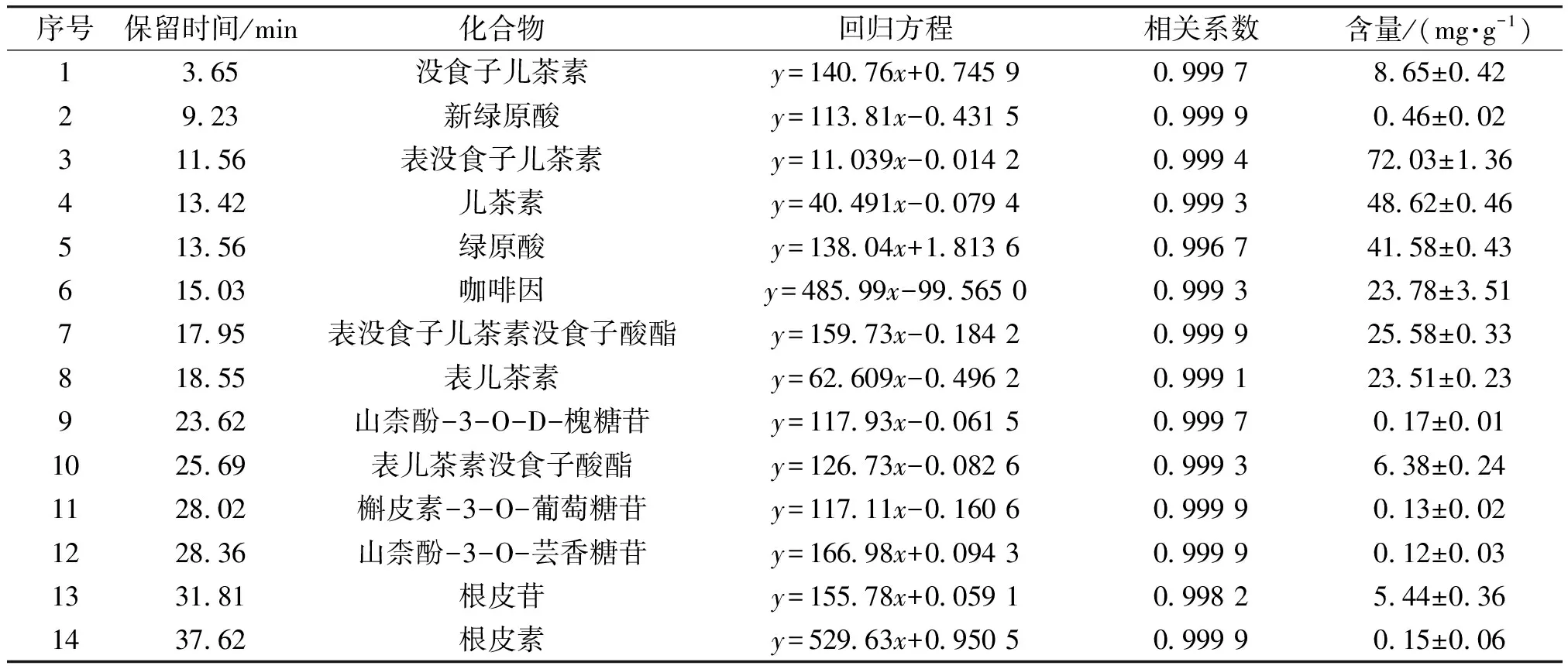
表3 各化合物线性方程、线性范围和相关系数Table 3 Linear equation, linear range and correlation coefficient of each component
