安石榴苷对UVB诱导HaCaT细胞光损伤的保护作用
2022-12-08沈芳铭尹淑涛赵冲
沈芳铭,尹淑涛,赵冲
中国农业大学 食品科学与营养工程学院, 北京 100083
0 引言
紫外线是影响皮肤健康的关键环境因素之一。长期的紫外线暴露不仅可能引起红斑、色素沉着、免疫抑制等急性损伤,还可能诱发光老化、皮肤癌等慢性损伤[1-2]。能够穿越臭氧层到达地球表面的紫外线包括320~400 nm的长波紫外线(UVA)和280~320 nm的中波紫外线(UVB)[2]。UVB是主要的生物效应诱发因子,具有比UVA更强的遗传毒性和皮肤损伤能力[3]。UVB的光子能量可被皮肤表皮角质形成细胞直接吸收,其通过诱导同一条链上相邻碱基之间生成环丁烷嘧啶二聚体(CPD)和6-4光产物(6-4PPs)而导致DNA损伤[4-5]。真核细胞可通过多种途径修复受损DNA[6],而紫外线诱导的光损伤产物主要通过核苷酸切除修复(NER)的途径去除[7]。已有研究[8-12]表明,安石榴苷、白藜芦醇、番茄红素、单宁酸、芦荟甾醇等天然活性成分能够保护UVB诱导的皮肤损伤。其中安石榴苷是石榴果皮多酚中最主要的活性成分,具有抗炎、抗氧化、抗菌、抗肿瘤等多种生理活性[12],将安石榴苷与纳米二氧化钛复配添加到化妆品基质中可发挥优良的防晒效果[13];在3D皮肤模型中,安石榴苷能降低酪氨酸酶活性、抑制黑色素生成,具有美白作用[14];安石榴苷预处理可抑制UVB照射所致的人正常皮肤永生化角质形成细胞(HaCaT细胞)凋亡[15]。目前已有研究主要集中于安石榴苷对皮肤的直接作用效果,将其作为膳食活性成分摄入、经肠道吸收后能否发挥对皮肤的保护作用尚鲜有报道。
UVB既能直接作用于DNA,也能通过产生活性氧(ROS)继发性地对细胞核及线粒体DNA造成氧化损伤[16]。M.Zahin等[17]研究发现,安石榴苷能抑制苯并[a]芘诱导的DNA加和物的形成,具有较强的抗突变活性。SIRT1蛋白作为一种广泛表达于哺乳动物体内、高度保守的去乙酰化酶,参与DNA损伤修复,有利于维护基因组的稳定性[18]。课题组前期研究[19]发现,安石榴苷能增强HaCaT细胞中SIRT1基因启动子活性,激活NER途径,去除UVB诱导产生的CPD。基于此,本文拟建立人结直肠腺癌细胞(Caco-2细胞)与HaCaT细胞肠-皮肤共培养体系,进一步研究安石榴苷经肠道吸收转运后对UVB诱导皮肤损伤的抑制效果及机制,为研发功效确切、机制明确的食品功能性成分用于防治UVB诱导的皮肤损伤提供理论依据与参考。
1 材料与方法
1.1 主要材料与试剂
安石榴苷、多聚甲醛、Triton-X100、甲醇、Tris-HCl缓冲液(pH值为6.8)、十二烷基磺酸钠(SDS)、2-巯基乙醇(2-ME),美国Sigma公司产;Caco-2细胞、HaCaT细胞、293T细胞,日本理研生物资源中心产;DMEM完全培养基,日本Nissui公司产;胎牛血清、山羊血清,美国Life Technologies公司产;带细胞培养小室的24孔Transwell培养板(3470型),美国Corning公司产;慢病毒表达质粒pSUPER.retro.puro、辅助质粒pVSV-G、pGag-pol,美国OligoEngine公司产;HilyMax试剂、Hoechst 33342溶液,日本Dojindo Molecular Technologies公司产;聚凝胺、蛋白G磁珠,美国Merck Millipore公司产;嘌呤毒素,美国Enzo Life Sciences公司产;CPD抗体(#NMDND001),日本Cosmo Bio 公司产;Alexa Fluor 555标记的山羊抗小鼠IgG抗体(A-21422),美国Life Technologies公司产;高纯度RNA分离试剂盒,日本Roche公司产;ReverTra Ace qPCR RT试剂盒,日本Toyobo公司产;KAPA SYBR Fast qPCR试剂盒,美国KAPA Biosystems公司产;Acetylated-Lysine抗体(#9441)、辣根过氧化物酶标记的马抗小鼠IgG抗体(#7076),美国Cell Signaling Technology公司产;XPA抗体(ab65963),英国Abcam公司产。
1.2 主要仪器与设备
311型细胞培养箱,美国Thermo Fisher Scientific公司产;Millicell-ERS-2型细胞电阻仪,美国Millipore公司产;CL-1000型紫外交联仪,美国UVP公司产;IN Cell Analyzer 1000活性细胞荧光显微图像获取及分析系统,英国GE Healthcare公司产;TP-800型实时荧光定量PCR仪,日本Takara公司产;LAS-1000 Lumino型图像分析仪,日本Fujifilm公司产。
1.3 实验方法
1.3.1 细胞培养Caco-2细胞及HaCaT细胞均采用含10%(如无特指,文中百分数均指体积分数)胎牛血清的DMEM完全培养基,于37 ℃、5%CO2的细胞培养箱中培养2~3 d,以适宜比例传代,选取处于对数生长期的细胞进行后续实验。
1.3.2 单层Caco-2细胞模型的构建和评价将Caco-2细胞以2×105CFU/mL、每孔250 μL接种于24孔Transwell培养板的细胞培养小室中,培养板下室加入750 μL DMEM完全培养基,根据培养液状态适时更换培养基。另设不接种Caco-2细胞的空白对照组,在Transwell 培养板的上室和下室均加入相应体积的DMEM完全培养基。
通过细胞单层跨膜电阻(TEER)判断Caco-2细胞是否形成紧密完整的肠上皮样单层。单层Caco-2细胞两侧的电阻通过细胞电阻仪测定,根据下式计算TEER。
TEER=(Rsample-Rblank)×S
式中,Rsample为样品组电阻/Ω,Rblank为空白对照组电阻/Ω,S为细胞培养小室有效膜面积(0.3 cm2)。
1.3.3shSIRT1-HaCaT细胞模型的构建参考文献[19]的方法构建shSIRT1-HaCaT细胞模型。将含有SIRT1特异性序列的短发卡(Short Hairpin,sh)RNA(序列见表1)克隆至慢病毒表达质粒pSUPER.retro.puro中。在HilyMax试剂作用下,将构建的表达载体pSUPER-puro-shSIRT1与pVSV-G、pGag-pol共同转染293 T细胞以制备病毒上清液。将293 T细胞分别经含10%和2%胎牛血清的DMEM培养基各培养24 h后,收集含有慢病毒颗粒的上清液。将HaCaT细胞用含10 μg/mL 聚凝胺的病毒上清液于37 ℃条件下感染24 h后,在HaCaT细胞中加入3 μg/mL嘌呤毒素,3 d后筛选得到稳定的shSIRT1-HaCaT细胞模型。
1.3.4UVB诱导HaCaT细胞损伤模型的构建及加药处理课题组前期研究[19]发现,10 μmol/L的安石榴苷对正常HaCaT细胞活力无显著影响,且可逆转UVB照射导致的细胞生长抑制,因此,本文选取该浓度进行实验。单层Caco-2细胞模型构建完成后,将安石榴苷母液用DMEM完全培养基稀释至10 μmol/L,替换Transwell培养板细胞培养小室中的原培养基,培养48 h后收集下室的培养液,储存于-80 ℃冰箱中,备用。
将生长状况良好、处于对数生长期的HaCaT细胞、shSIRT1-HaCaT细胞以适宜浓度接种于35 mm细胞培养皿中。培养24 h后,将各皿中的培养基吸出,添加少量PBS(1×,pH值为7.2~7.4)浸润细胞,用紫外交联仪模拟UVB照射,剂量为8 mJ/cm2,24 h后再次进行UVB照射。为保证各组实验操作的一致性,无需进行紫外线照射的实验组仍需模拟UVB照射过程,用锡箔纸覆盖避光。2次UVB照射结束6 h后,弃去旧培养基,各皿中加入回收的单层Caco-2细胞模型中下室的培养液(需提前预热),继续培养48 h后进行后续实验。
1.3.5 安石榴苷对UVB诱导HaCaT细胞产生CPD的抑制作用评价参考M.Udono等[20]的方法进行免疫荧光测试。将HaCaT细胞接种于荧光黑色平板中,培养过夜。第2 d从培养箱中取出平板,吸除原培养基。4%多聚甲醛固定15 min后,用冰冷甲醇浸没细胞,冰上孵育10 min,随后用含5%山羊血清和0.3%Triton-X100的封闭液室温封闭1 h。吸除封闭液后,加入一抗(CPD抗体)4 ℃孵育过夜,而后加入二抗(Alexa Fluor 555标记的山羊抗小鼠IgG抗体)室温孵育1 h。用Hoechst 33342溶液在室温条件下避光孵育10 min,用IN Cell Analyzer 1000获取细胞图像,用Multi-Target Analysis Tool进行成像数据分析,用Spotfire DecisionSite Client v.8.2进行可视化处理。
1.3.6HaCaT细胞内XPC基因转录水平的测定参考文献[19]的方法测定细胞着色性干皮病基因组C(XPC)的mRNA转录水平。按照高纯度RNA分离试剂盒说明书上的步骤提取细胞RNA,利用ReverTra Ace qPCR RT 试剂盒逆转录合成cDNA,参照KAPA SYBR Fast qPCR试剂盒说明书配制反应体系,随后进行聚合酶链式反应(PCR)。实验重复3次,以β-actin作为内参基因。XPC和β-actin基因的PCR碱基序列见表1。
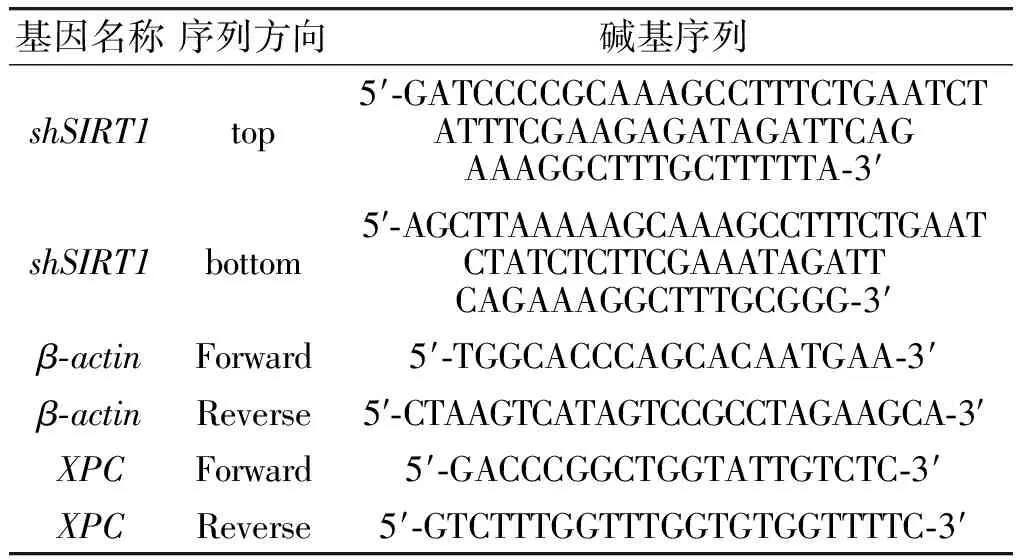
表1 引物序列Table 1 Primer sequences
1.3.7HaCaT细胞内XPA蛋白乙酰化水平的测定参照1.3.4进行实验,随后收集各组细胞,按照文献[19]的方法进行免疫沉淀实验。用预冷的NP-40裂解缓冲液进行细胞全蛋白提取,在提取的总蛋白中加入Acetylated-Lysine抗体,4 ℃孵育过夜,形成免疫复合物。加入蛋白G磁珠捕获抗体及其结合的蛋白,4 ℃孵育过夜。用样品缓冲液(1 mol/L Tris-HCl(pH值为6.8),10%SDS,10%2-ME)洗脱免疫沉淀,采用蛋白免疫印迹法分析样品。用质量分数12%的聚丙烯酰胺凝胶电泳100 min,随后将蛋白质转移到Hybond-P蛋白杂交膜上,室温条件下封闭2 h,加入XPA抗体于4 ℃条件下孵育过夜,而后加入二抗(辣根过氧化物酶标记的马抗小鼠IgG抗体)在室温条件下孵育1 h。用ImmunoStar LD化学发光法测定蛋白乙酰化水平,用图像分析仪进行可视化处理。
1.4 统计分析
采用软件SPSS 19.0处理实验数据,结果以(平均值±标准差)表示,用T检验进行显著性分析,P<0.05表示差异显著。利用软件GraphPad Prism 8作图。
2 结果与分析
2.1 单层Caco-2细胞模型的TEER分析
Caco-2细胞在体外培养的条件下可自发分化形成紧密的单细胞层组织,具有小肠微绒毛结构和各种营养物质转运载体,是理想的肠道吸收模型[21]。TEER可在一定程度上反映单层Caco-2细胞的紧密性与完整性[22]。本研究分别在Caco-2细胞接种后第3 d、第14 d进行TEER的测定。当TEER达到约 800 Ω·cm2的稳定读数时,即可认为Caco-2 细胞模型已完全分化[23]。单层Caco-2细胞的TEER测定结果如图1所示,其中***表示组间差异极显著(P<0.001),下同。由图1可知,Transwell培养板上的Caco-2细胞培养至14 d时,TEER为(2350±140) Ω·cm2,表明细胞已形成完整的致密单层,模型建立成功,可进行肠-皮肤共培养体系的构建。
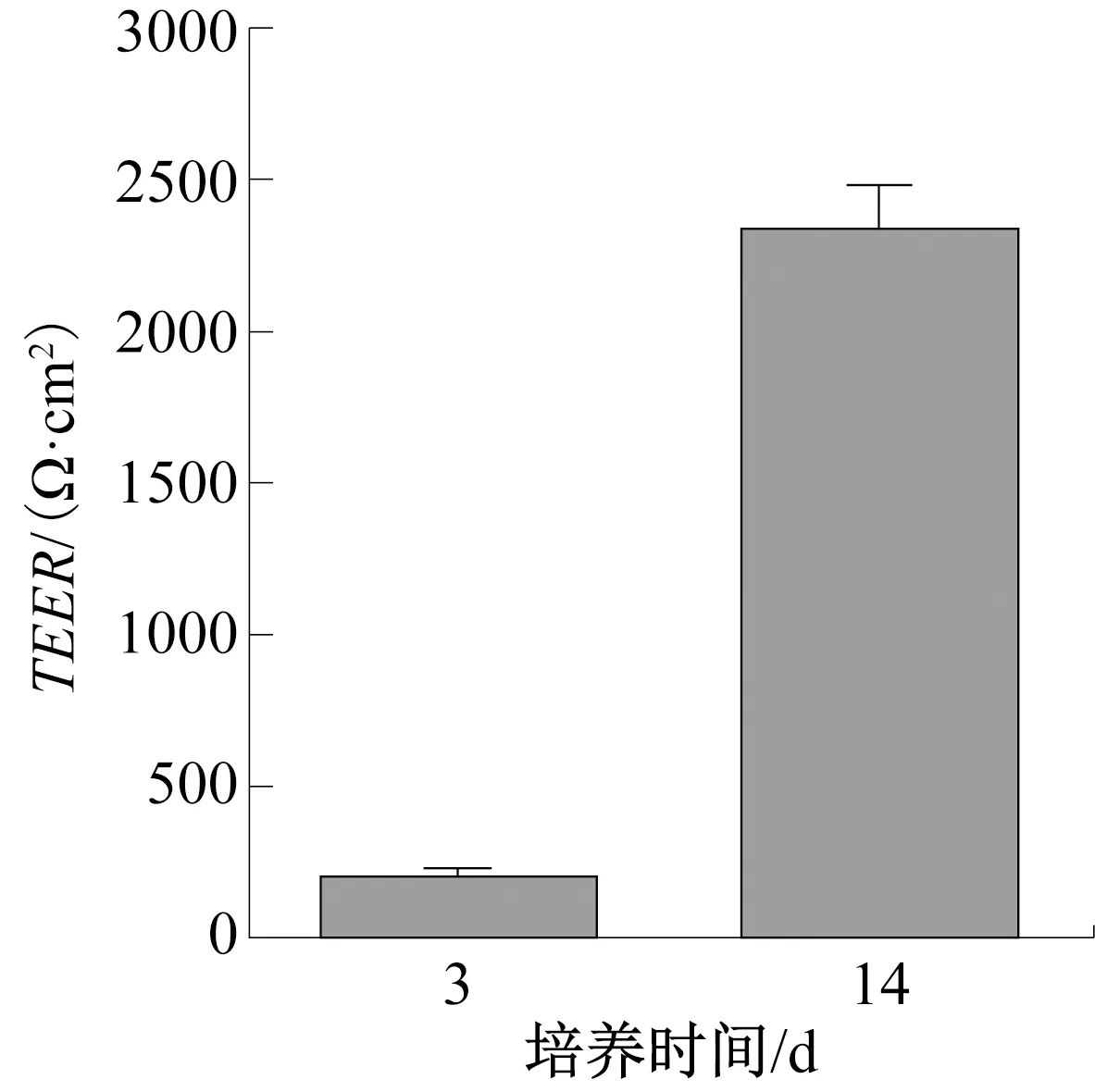
图1 单层Caco-2细胞模型的TEER测定结果Fig.1 TEER assay of monalayer Caco-2 cells
2.2 安石榴苷对UVB诱导HaCaT细胞产生CPD的抑制作用分析
CPD和6-4PPs是UVB诱导产生的主要光损伤产物,其中CPD占比约70%~80%[24-25],是哺乳动物细胞中紫外线诱导突变的主要原因[26]。F.Afaq等[27]研究发现,在UVB照射前,用石榴汁或石榴提取物(均含有包括安石榴苷在内的多酚类物质)分别在人体再造皮肤上进行预处理,均可显著减少CPD阳性细胞的数量,其作用机制与石榴衍生物的抗氧化活性和对DNA损伤修复的促进作用相关。UVB照射后,安石榴苷对HaCaT细胞内CPD水平的影响如图2所示。由图2a)可知,UVB照射使对照组的CPD阳性细胞(红色)比例从24%增加到31%,说明本研究所采取的UVB照射方式能够诱导光损伤产物的形成。安石榴苷处理后,CPD阳性细胞比例降低至22%。此外,在未经UVB照射的条件下,安石榴苷处理也能使CPD阳性细胞比例从24%降至15%。此结果与课题组前期在HaCaT细胞模型中的研究结论一致[19],表明安石榴苷在肠-皮肤共培养体系中模拟肠道吸收后仍能修复UVB诱导的光损伤,且在非紫外线照射条件下,安石榴苷对DNA也具有一定的保护作用。
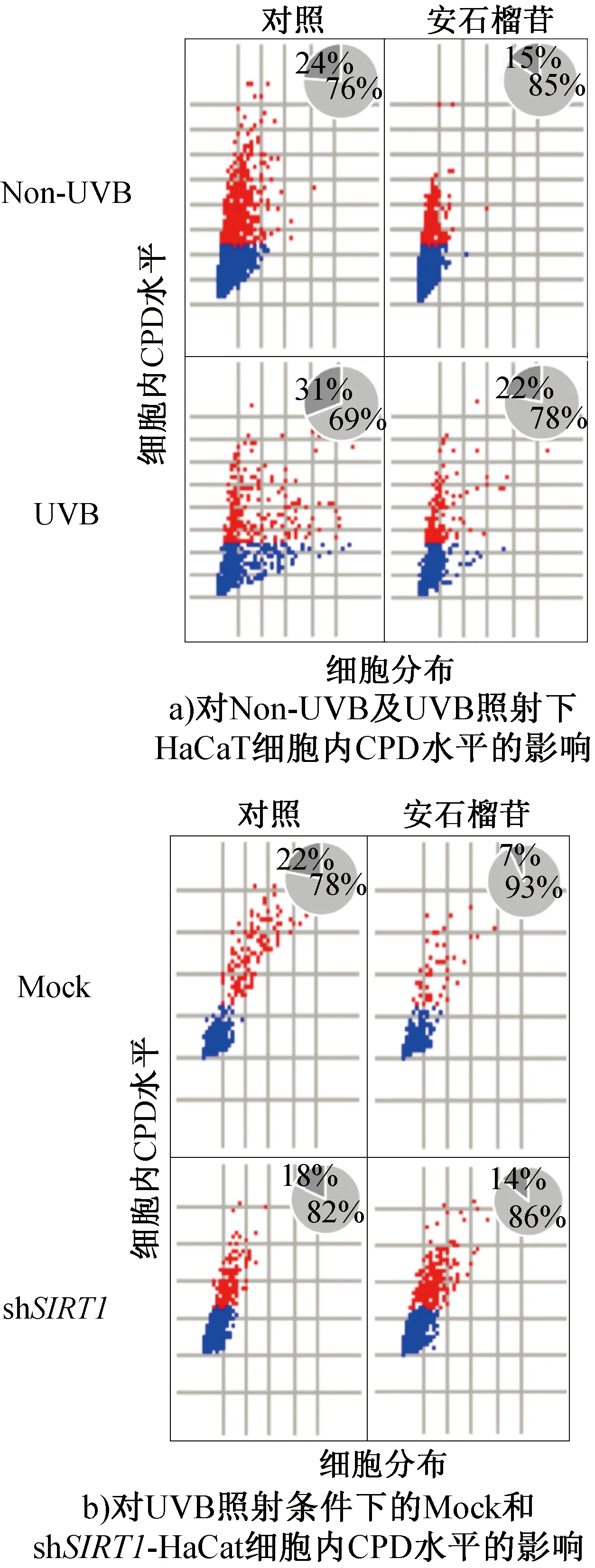
图2 安石榴苷对HaCaT细胞内CPD水平的影响Fig.2 Effects of punicalagin on CPD level in HaCaT cells
为探究安石榴苷对CPD的抑制作用是否依赖于SIRT1蛋白的调控,本实验对UVB照射条件下Mock(空白对照)和shSIRT1-HaCaT细胞中的CPD水平进行了评价,结果见图2b)。在Mock细胞中,安石榴苷使CPD阳性细胞比例从22%降至7%,慢病毒转导敲低SIRT1基因显著消除了安石榴苷对CPD的抑制效果。由此可见,安石榴苷对UVB诱导光损伤的修复依赖于SIRT1蛋白的调控。本实验在文献[19]的基础进一步证明了安石榴苷经单层Caco-2细胞模型转运后仍可发挥SIRT1蛋白的激活剂作用,促进UVB诱导的光损伤的修复。其原因可能是SIRT1蛋白可负调控p53乙酰化并抑制C-Jun氨基末端激酶的激活,从而减弱紫外线诱导的细胞凋亡[28],还可通过调控XPC基因转录在UVB诱导DNA损伤的修复中发挥作用[29]。
2.3 安石榴苷对HaCaT细胞内XPC基因转录水平的影响分析
研究[30]发现,UVB诱导产生的DNA损伤主要通过NER系统进行修复。DNA损伤识别阶段,NER系统有全基因组修复(GGR)和转录偶联修复(TCR)2条子路径[31]。在GGR中,XPC-HR23B蛋白复合物与着色性干皮病基因组E蛋白(XPE蛋白)通过识别 DNA 损伤位点启动修复反应[32]。安石榴苷对HaCaT细胞内XPC基因的mRNA转录水平影响如图3所示。由图3可知,安石榴苷显著上调了XPC基因的转录水平,这表明安石榴苷经单层Caco-2细胞模型吸收转运后可通过增强XPC基因的表达促进光损伤的修复。有研究表明,氧化应激会抑制NER途径对DNA损伤的修复[33],NER途径的激活与抗氧化活性相关[34],而安石榴苷作为SIRT1蛋白的激活剂,对光损伤修复的促进作用可能是由于其较强的抗氧化活性。
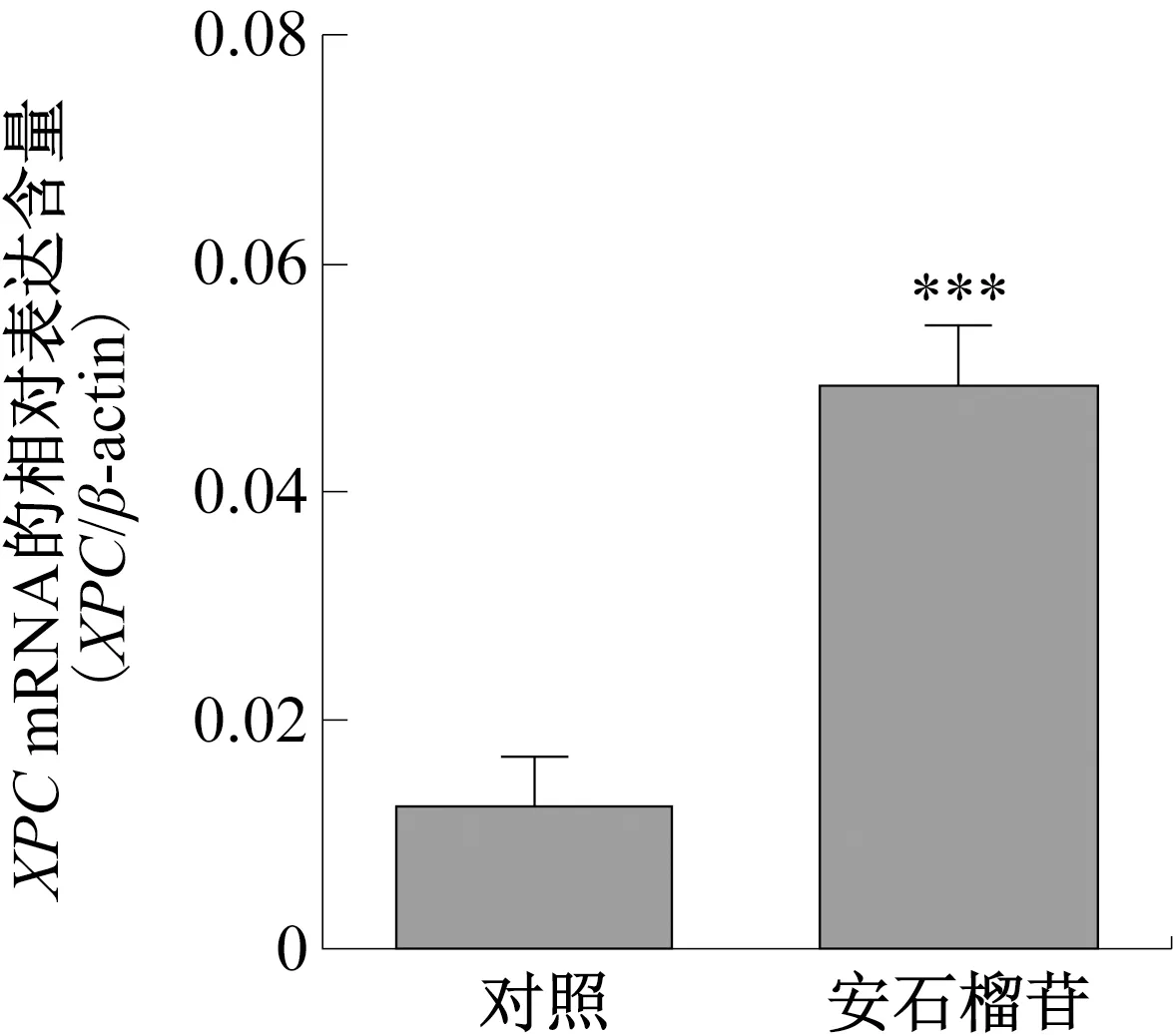
图3 安石榴苷对HaCaT细胞内XPC基因的mRNA转录水平影响Fig.3 Effects of Punicalagin on XPC mRNA transcription levels in HaCaT cells
2.4 安石榴苷对HaCaT细胞内XPA蛋白乙酰化水平的影响分析
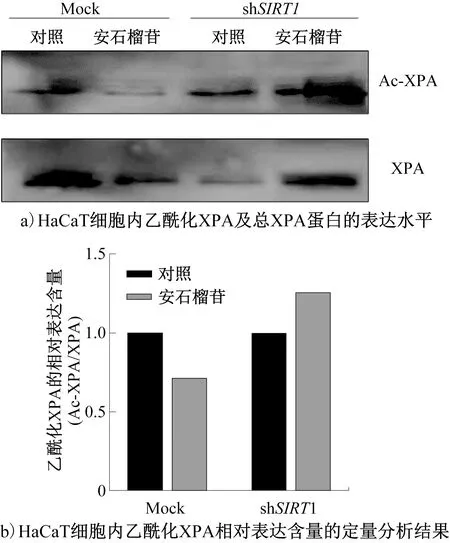
图4 安石榴苷对HaCaT细胞内XPA蛋白乙酰化水平的影响Fig.4 Effects of punicalagin on the acetylation level of XPA in HaCaT cells
XPA蛋白在DNA损伤验证环节中发挥作用,并作为分子支架通过蛋白质间的相互作用在损伤位点附近召集其他NER核心因子[35]以完成后续的损伤修复工作。UVB照射条件下,安石榴苷对HaCaT细胞内XPA蛋白乙酰化水平的影响如图4所示。由图4可知,安石榴苷显著降低了Mock细胞中XPA蛋白乙酰化水平;慢病毒转导敲低SIRT1基因表达明显抑制了安石榴苷对XPA蛋白乙酰化水平的影响。综上所述,在肠-皮肤共培养体系中,安石榴苷以SIRT1基因依赖的方式上调了NER途径相关的XPA蛋白去乙酰化水平。这可能是由于UVB照射后,SIRT1蛋白与XPA蛋白结合,使其处于低乙酰化状态,从而调节NER途径[36]。在NER途径中,DNA损伤被识别后,TFIIH复合物在损伤部位周围解开DNA链,XPA蛋白和复制蛋白A(RPA)分别与DNA的损伤部位和未受损部位结合,允许内切酶结合并切除受损DNA链[37]。而SIRT1蛋白对XPA蛋白的调控能增强XPA蛋白与RPA蛋白相互作用的能力[36],优化NER途径。尽管本文阐述了安石榴苷在肠-皮肤共培养体系中抑制UVB诱导的光损伤的可能机制,但安石榴苷在经过肠道吸收后是以何种形式作用于HaCaT细胞从而发挥保护作用仍有待深入研究。
3 结论
本文构建了Caco-2细胞与HaCaT细胞的肠-皮肤共培养体系,发现安石榴苷在经过单层Caco-2细胞模型吸收转运后仍可促进UVB诱导的光损伤的修复,其作用机制可能与激活NER途径相关的XPC基因转录水平及以SIRT1基因依赖的方式提高XPA蛋白去乙酰化水平相关。本研究为筛选能够激活SIRT1蛋白的天然活性成分提供了可行的体外模型,并提示了SIRT1蛋白的激活剂在促进修复UVB诱导的皮肤损伤中的重要性,也为安石榴苷作为膳食活性成分的开发提供了理论依据,有利于促进石榴资源的综合开发利用。后续研究工作将利用动物模型进一步阐明安石榴苷的生物活性和分子作用机制。
