抑制miR-204表达对宫内发育迟缓新生大鼠学习记忆能力的影响及相关机制
2022-12-08朱栋梁颜红霞岳健军刘剑锋李增波宋静芳
朱栋梁 颜红霞 岳健军 刘剑锋 李增波 宋静芳
(南华大学衡阳医学院附属第二医院儿科,湖南 衡阳 421001)
宫内发育迟缓(intrauterine growth restriction,IUGR)是指多数孕妇由于孕期营养不良,造成胎儿发育受损,导致新生儿出现极低出生体重,同时影响其认知和神经发育,导致学习记忆能力下降[1]。目前针对IUGR的临床治疗,多以预防为主,无法从本质上改善。海马组织作为学习和记忆的关键部位,有丰富的神经元,其中脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)及其受体酪氨酸激酶B(tyrosine kinase B,TrkB)在海马组织中含量最高,具有神经营养作用,可影响与学习和记忆能力相关的神经系统[2]。miRNA是一种非编码RNA分子,在神经疾病的发病机制中发挥重要作用,可参与神经元的增殖和凋亡[3-4]。多项研究表明,在多种因素所致学习记忆功能障碍模型动物海马组织中miR-204呈现高表达[4-5],然而下调miR-204表达可抑制神经炎症,改善学习记忆功能[6-7]。Chen等[8]通过miRNA微阵列分析正常新生大鼠和IUGR新生大鼠海马组织中差异表达的miRNA,结果显示miR-204在IUGR新生大鼠海马组织中高表达。然而miR-204高表达是否影响IUGR新生大鼠学习记忆能力目前尚不知晓。为此,本研究通过建立IUGR大鼠模型,探讨miR-204对IUGR新生大鼠远期学习记忆能力的影响,并初步阐明其作用机制,旨在为预防和治疗IUGR相关认知功能障碍提供理论基础。
1 材料与方法
1.1 实验动物
SPF级SD大鼠90只(雌性30只,雄性60只),10周龄,购自广州锐格生物科技有限公司,动物生产许可证号:SCXK(粤)2021-0059。在无特定病原体条件下饲养,温度23~25℃,相对湿度50%~57%,自由采食饮水。适应性饲养3 d。
1.2 实验试剂及仪器
标准饲料(热卡量约为1 558 kJ/100 g,蛋白质含量约为16%)和低蛋白饲料(热卡量约为1 558 kJ/100 g,蛋白质含量约为8%)购自北京华阜康生物科技股份有限公司;miR-204拮抗剂(miR-204 antagomir)及拮 抗 剂对 照(antagomir-NC)、miR-204 mimic及mimic NC均购自广州锐博生物科技有限公司;BDNF抗体、TrkB抗体、磷酸化TrkB(p-TrkB、Tyr706/707)抗体、cAMP反应元件结合蛋白(cAMP response element binding protein,CREB)抗体、磷酸化CREB(p-CREB,Ser133)抗体和GAPDH抗体购自美国CST公司;SYBR FAST qPCR Master Mix、SYBR Green PCR试剂盒购自美国KAPA Biosystems公司;PrimeScriptⅡRTase、逆转录试剂盒购自日本TAKARA公司;Luciferase荧光素酶报告检测试剂盒购自美国Biovision公司;电泳仪(型号:164-5056)美国BIO-RAD公司;PCR仪(型号:7500)购自美国ABI公司;正置显微镜(型号:CX23)购自日本Olympus公司;Morris水迷宫装置(型号:63034)购自深圳瑞沃德生命科技有限公司;全功能酶标仪(型号:Synergy H4)购自美国BioTek公司。
1.3 实验方法
1.3.1 IUGR模型构建90只SD大鼠按照雌雄比1∶2于18时进行合笼,次日9时检查雌鼠阴栓,共计受孕25只,记为妊娠第0天。25只孕鼠单只单笼饲养,采用随机数字表法分为正常饮食组(n=10)和低蛋白饮食组(n=15):正常饮食组孕鼠孕期全程给予标准饲料;低蛋白饮食组孕鼠孕期全程给予低蛋白饲料。幼鼠出生12 h后称重,低蛋白饮食组幼鼠体重低于正常饮食组幼鼠2个标准差,表示IUGR建模成功[9]。幼鼠均由母鼠母乳喂养,低蛋白饮食组母鼠继续给予低蛋白饲料,正常饮食组母鼠继续给予标准饲料。
1.3.2 动物分组及干预实验一:取25只正常幼鼠设为正常组,25只IUGR幼鼠设为IUGR组,分别于出生后第0、7、14、21、28天[9]各取5只幼鼠进行称重并颈椎脱臼法处死,取海马组织冻存,采用qRT-PCR检测各时间点幼鼠海马组织中miR-204表达水平。实验二:取10只正常幼鼠设为对照组,30只IUGR幼鼠分别设为模型组、miRNA拮抗剂对照组(antagomir-NC组)和miR-204拮抗剂组(antagomir组),每组10只。于出生后第3天,antagomir-NC组幼鼠腹腔注射antagomir-NC,antagomir组幼鼠腹腔注射miR-204 antagomir,5 nmol/次,对照组和模型组幼鼠注射0.9%氯化钠溶液,每隔3 d注射1次,共7次。
1.3.3 Morris水迷宫实验实验二各组每只大鼠于30日龄时进行Morris水迷宫实验,该实验包括定位航行实验和空间探索实验。定位航行实验:实验前,站台放置于第四象限,将大鼠置于站台上适应10 s,随后大鼠从不同象限面朝池壁入水,记录大鼠120 s内登上站台的时间(逃避潜伏期),若大鼠在120 s内未找到站台,实验者将其引上站台适应10 s,记录逃避潜伏期为120 s。按照上述进行操作,每天4次,每次间隔1 h,训练4 d。空间探索实验:定位航行实验结束24 h后,撤除站台,将大鼠面朝池壁放入第一象限相同入水点,记录120 s内跨越原站台的次数。
1.3.4 qRT-PCR实验实验二各组每只大鼠于36日龄时取右侧海马组织冻存。实验一各时间点各组取5个样本及实验二各组取10个样本,按照TRIzol试剂说明书提取总RNA,分光光度计测定总RNA浓度及纯度。将总RNA逆转录成cDNA,取1 μL cDNA进行PCR扩增。PCR反应程序:预变性95℃3 min,95℃5 s,56℃10 s,72℃25 s,共39个循环;65℃5 s;95℃50 s。miR-204以U6作为内参基因,BDNF以GAPDH作为内参基因,通过2-ΔΔCt方法计算实验一中各时间点miR-204和实验二中miR-204、BDNF mRNA的相对表达量[10]。引物序列见表1。

表1 引物设计
1.3.5 尼氏染色将实验二各组每只大鼠于36日龄时取左侧海马组织采用4%多聚甲醛固定,将固定24 h的海马组织取出常规脱蜡至水,行冠状切面,制备石蜡切片(厚度4 μm)。然后石蜡切片置于60℃温箱中使用1%甲苯胺蓝染色40 min,蒸馏水冲洗后,分别置于由低到高(70%、80%、95%和100%)的乙醇中脱水,二甲苯再次透明,最后中性树胶封片。在显微镜下观察海马CA1区病理变化,并随机选取3个视野统计尼氏小体数量,取其平均值[11]。
1.3.6 Tunel检测海马组织细胞凋亡水平将已脱蜡水化后的石蜡切片用蛋白酶K工作液于37℃中孵育15 min。然后加入50 μL Tunel反应混合液,在湿盒、暗室中加盖37℃孵育60 min。用PBS冲洗3次。加入50 μL转化POD,在湿盒中37℃孵育30 min。用PBS冲洗3次。加入100 μL DAB底物于室温孵育10 min。用PBS冲洗3次。苏木精复染,脱水,透明。封片后在显微镜下观察海马CA1区细胞凋亡水平,随机选取3个视野计数阳性细胞数(棕色),计算细胞凋亡率=凋亡细胞数/总细胞数[12]。
1.3.7 Western blot检测相关蛋白表达取30 μg蛋白与上样缓冲液混合,沸水浴10 min使蛋白变性后离心取上清上样,SDS凝胶电泳2 h分离蛋白,湿转PVDF膜,5%脱脂奶粉室温封闭2 h,依次加入BDNF(1∶1 000)、TrkB(1∶1 000)、p-TrkB(1∶1 000)、CREB(1∶1 000)、p-CREB(1∶1 000)及内参GAPDH(1∶1 000)抗体,室温孵育1 h。PBST清洗3次,加入按照1∶10 000稀释的HRP标记的二抗室温孵育1 h,PBST清洗3次,进行ECL化学发光检测。以GAPDH作为内参进行条带分析,计算目的蛋白BDNF、TrkB、p-TrkB、CREB及p-CREB相对表达量[13]。
1.3.8 双荧光素酶报告基因实验使用TargetScanHuman7.2在 线 数 据 库(http://www.targetscan.org/vert_72/)预 测miR-204和BDNF的 靶向结合位点。设计BDNF-3'-UTR野生型(BDNFWT)及BDNF-3'-UTR突变型(BDNF-MUT)片段序列,通过PCR扩增、回收、酶切和纯化后构建荧光素酶报告载体。采用Lipofectamine 3000试剂分别 将miR-204 mimic和mimic NC与BDNF-WT或BDNF-MUT共同转染至293T细胞中。转染48 h后,按照荧光素酶报告检测试剂盒说明书进行操作,并使用酶标仪进行测定萤火虫和海肾荧光素酶活性,相对荧光素酶活性=萤火虫荧光素酶活性/海肾荧光素酶活性。
1.4 统计学分析
应用SPSS 20.0软件对数据进行统计学分析,计量资料以均值±标准差(±s)表示,两组间比较采用两样本t检验,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 IUGR幼鼠体重和miR-204水平变化
与正常组比较,IUGR组出生后第0、7、14、21、28天幼鼠体重降低(表2),而海马组织中miR-204表达水平升高(表3),差异均有统计学意义(P<0.001)。体重是临床评估IUGR的诊断标准,体重结果表明本研究已成功构建IUGR大鼠模型。IUGR幼鼠海马组织中miR-204含量呈时间依赖性,即随着时间的增长miR-204含量升高(F=43.444,P<0.001),而正常幼鼠miR-204含量无变化(F=0.252,P=0.905),提示miR-204可能参与IUGR病程。
表2 两组幼鼠不同时间点体重比较(±s,g;n=25)

表2 两组幼鼠不同时间点体重比较(±s,g;n=25)
注:[IUGR]宫内发育迟缓。
组别正常组IUGR组t值P值第0天7.1±0.5 5.2±0.4 6.398<0.001第7天14.3±0.6 11.7±0.4 8.147<0.001第14天23.4±1.0 19.7±0.8 6.281<0.001第21天32.3±1.2 25.1±0.9 10.556<0.001第28天64.6±2.0 40.2±1.5 21.803<0.001
表3 两组幼鼠不同时间点海马组织中miR-204 mRNA相对表达比较(±s,n=25)
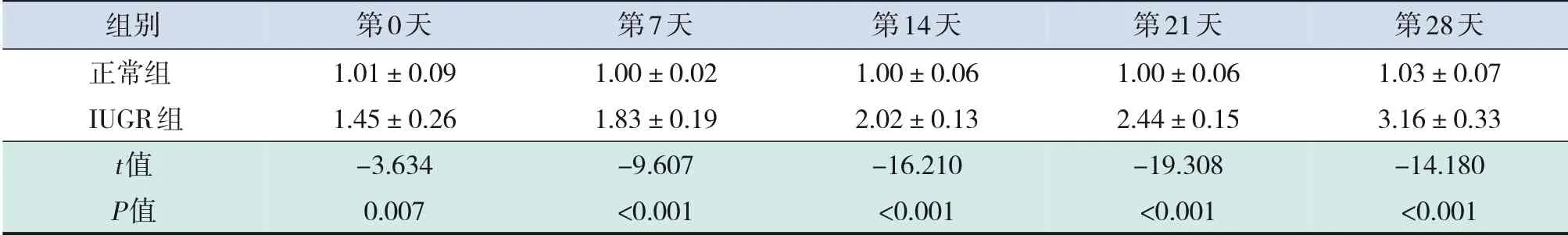
表3 两组幼鼠不同时间点海马组织中miR-204 mRNA相对表达比较(±s,n=25)
注:[IUGR]宫内发育迟缓。
组别正常组IUGR组t值P值第0天1.01±0.09 1.45±0.26-3.634 0.007第7天1.00±0.02 1.83±0.19-9.607<0.001第14天1.00±0.06 2.02±0.13-16.210<0.001第21天1.00±0.06 2.44±0.15-19.308<0.001第28天1.03±0.07 3.16±0.33-14.180<0.001
2.2 各组大鼠学习与记忆能力比较
与对照组比较,模型组大鼠逃避潜伏期增加,跨台次数减少,差异均有统计学意义(P<0.001);与模型组比较,antagomir组大鼠逃避潜伏期减少,跨台次数增加,差异均有统计学意义(P<0.001),而antagomir-NC组逃避潜伏期、跨台次数与模型组比较差异无统计学意义(P>0.05)。提示IUGR会引起学习与记忆能力障碍;抑制miR-204表达后,学习与记忆能力得到改善。见表4。
表4 各组大鼠水迷宫实验数据比较(±s,n=10)
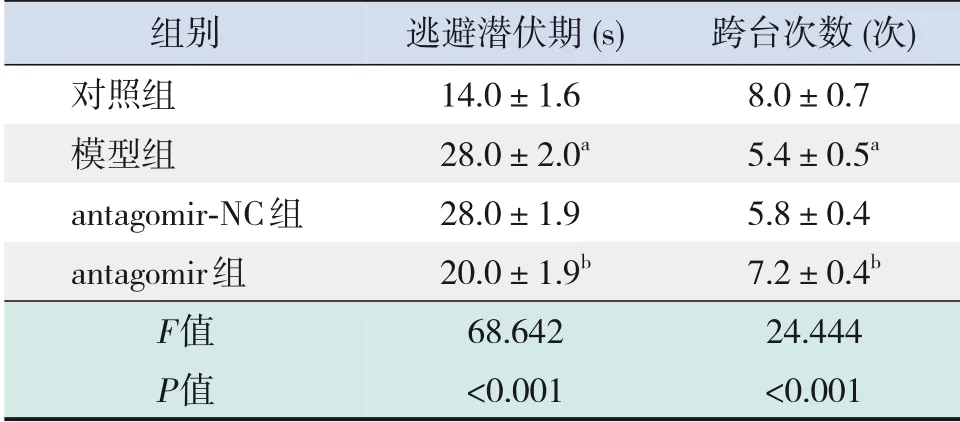
表4 各组大鼠水迷宫实验数据比较(±s,n=10)
注:a与对照组相比,P<0.001;b与模型组相比,P<0.001。
组别对照组模型组antagomir-NC组antagomir组F值P值逃避潜伏期(s)14.0±1.6 28.0±2.0a 28.0±1.9 20.0±1.9b 68.642<0.001跨台次数(次)8.0±0.7 5.4±0.5a 5.8±0.4 7.2±0.4b 24.444<0.001
2.3 各组大鼠海马组织中miR-204和BDNF mRNA表达水平比较
与对照组比较,模型组miR-204表达水平升高,BDNF mRNA表达水平降低,差异均有统计学意义(P<0.001);与模型组比较,antagomir组miR-204表达水平降低,BDNF mRNA表达水平升高,差异均有统计学意义(P<0.001),而antagomir-NC组与模型组比较差异无统计学意义(P>0.05)。提示IUGR会引起海马组织中miR-204高表达,BDNF低表达;抑制miR-204表达后,海马组织中BDNF表达升高,推测miR-204可能调控BDNF。见表5。
表5 各组大鼠海马组织中miR-204和BDNF mRNA表达水平比较(±s,n=10)

表5 各组大鼠海马组织中miR-204和BDNF mRNA表达水平比较(±s,n=10)
注:a与对照组相比,P<0.001;b与模型组相比,P<0.001。[BDNF]脑源性神经营养因子。
组别对照组模型组antagomir-NC组antagomir组F值P值miR-204 1.02±0.05 3.07±0.08a 3.01±0.07 1.92±0.13b 610.526<0.001 BDNF 1.00±0.06 0.56±0.05a 0.58±0.06 0.81±0.04b 67.065<0.001
2.4 各组大鼠海马神经元损伤情况
如图1所示,对照组大鼠海马CA1区细胞排列整齐,胞浆均匀且有大量淡蓝色尼氏小体。模型组和antagomir-NC组海马CA1区细胞排列紊乱,部分锥体细胞胞核固缩,呈三角形,胞浆染色变浅且尼氏小体大量减少。antagomir组海马CA1区细胞排列较整齐,锥体细胞胞核固缩现象明显减少,尼氏小体数量有所恢复。选取36日龄大鼠,每组10只,对照组、模型组、antagomir-NC组和antagomir组海马CA1区尼氏小体数量分别为(60.1±2.9)个、(30.3±3.6)个、(31.0±3.6)个和(49.4±3.2)个。与对照组比较,模型组海马CA1区尼氏小体数量减少,差异有统计学意义(t=13.170,P<0.001);与模型组比较,antagomir组海马CA1区尼氏小体数量增加,差异有统计学意义(t=8.434,P<0.001),而antagomir-NC组尼氏小体数量无变化,差异无统计学意义(t=1.185,P>0.05)。提示IUGR可引起海马神经元损伤;抑制miR-204表达后,海马神经元受损现象得到改善。
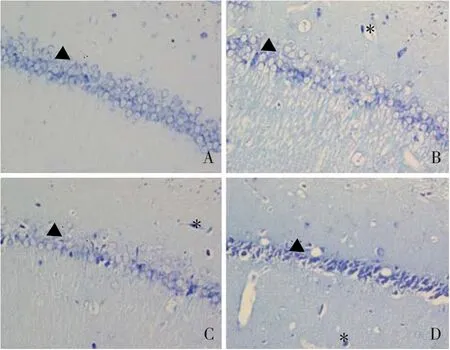
图1 海马组织CA1区病理变化(尼氏染色,×400)A:对照组;B:模型组;C:antagomir-NC组;D:antagomir组。注:▲表示尼氏小体,*表示变形锥体细胞。
2.5 各组大鼠海马组织细胞凋亡水平比较
对照组、模型组、antagomir-NC组和antagomir组海马CA1区细胞凋亡率分别为(4.7±0.9)%、(64.4±2.4)%、(62.8±2.6)%和(26.3±1.5)%。与对照组比较,模型组海马CA1区细胞凋亡率升高,差异有统计学意义(t=48.524,P<0.001);与模型组比较,antagomir组海马CA1区细胞凋亡率降低,差异有统计学意义(t=30.982,P<0.001),而antagomir-NC组细胞凋亡率无变化,差异无统计学意义(t=1.350,P>0.05)。见图2。

图2 海马组织CA1区细胞凋亡变化(Tunel染色,×400) A:对照组;B:模型组;C:antagomir-NC组;D:antagomir组。
2.6 各组大鼠海马组织BDNF/TrkB信号通路活化情况
与对照组比较,模型组大鼠海马中BDNF、p-TrkB和p-CREB蛋白水平降低,差异有统计学意义(t=9.861、3.976、9.295,P<0.001)。模 型组TrkB和CREB蛋白水平与对照组比较,差异无统计学意义(t=1.102、0.556,P>0.05)。与模型组比较,antagomir组大鼠海马中BDNF、p-TrkB和p-CREB蛋白水平升高,差异有统计学意义(t=19.152、9.286、13.553,P<0.001);而antagomir组TrkB和CREB蛋白水平与模型组比较,差异无统计学意义(t=1.837、1.892,P>0.05),而antagomir-NC组以上所有指标蛋白水平与模型组比较,差异无统 计 学 意 义(t=0.489、0.262、0.667、0.835、0.060,P>0.05)。提示IUGR可引起大鼠海马组织BDNF/TrkB信号通路的失活;抑制miR-204表达后,海马组织BDNF/TrkB信号通路被激活。见表6和图3。
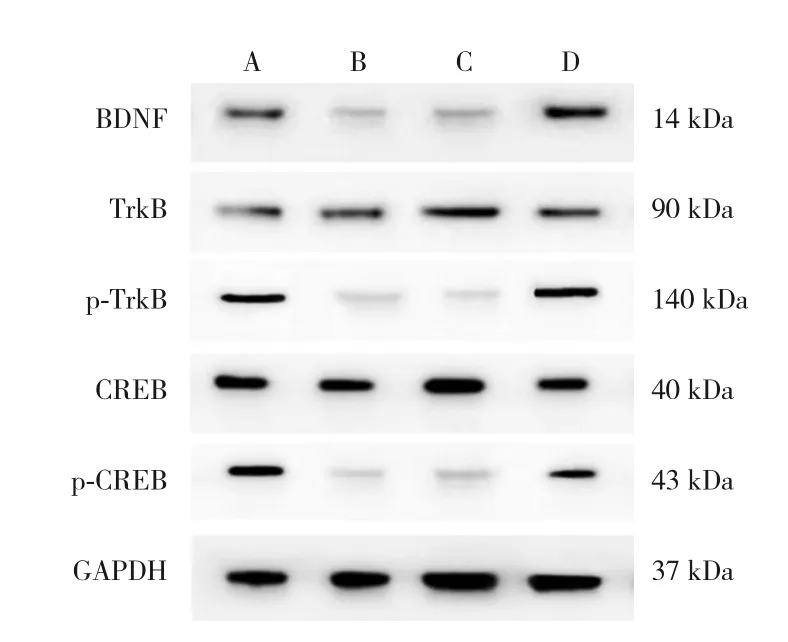
图3 各组大鼠海马组织BDNF/TrkB信号通路相关蛋白表达水平 A:对照组;B:模型组;C:antagomir-NC组;D:antagomir组。
表6 各组大鼠海马组织中BDNF/TrkB信号通路相关蛋白表达水平比较(±s,n=10)

表6 各组大鼠海马组织中BDNF/TrkB信号通路相关蛋白表达水平比较(±s,n=10)
注:a与对照组相比,P<0.001;b与模型组相比,P<0.001。[BDNF]脑源性神经营养因子;[TrkB]酪氨酸激酶B;[p-TrkB]磷酸化酪氨酸激酶B;[CREB]cAMP反应元件结合蛋白;[p-CREB]磷酸化cAMP反应元件结合蛋白。
组别对照组模型组antagomir-NC组antagomir组F值P值BDNF 0.536±0.036 0.294±0.055a 0.306±0.032 0.764±0.023b 164.523<0.001 TrkB 0.566±0.061 0.524±0.032 0.534±0.084 0.594±0.051 1.397 0.280 p-TrkB 0.480±0.030 0.304±0.082a 0.276±0.039 0.694±0.090b 42.139<0.001 CREB 0.606±0.022 0.586±0.047 0.616±0.092 0.654±0.042 1.261 0.321 p-CREB 0.554±0.031 0.244±0.070a 0.246±0.045 0.696±0.056b 92.616<0.001
2.7 miR-204与BDNF的靶向作用关系
如图4所示,通过TargetScan在线数据库显示,miR-204与BDNF-3'-UTR之间存在潜在的互补序列,miR-204基因序列中UUCCCUU碱基与BDNF基因序列中AAGGGAA碱基配对,形成沉默复合体,阻止BDNF基因转录翻译,减低BDNF蛋白表达水平。提示miR-204可靶向调控BDNF。双荧光素酶报告基因实验结果显示,在转染BDNF-WT质粒的细胞中,与共转染mimic NC比较,共转染miR-204 mimic可降低细胞荧光素酶活性,差异有统计学意义(1.00±0.05 vs 0.47±0.04,t=18.009,P<0.001);在转染BDNF-MUT质粒的细胞中,与共转染mimic NC比较,共转染miR-204 mimic不能降低细胞荧光素酶活性,差异无统计学意义(1.01±0.07 vs 0.98±0.06,t=0.343,P>0.05)。

图4 BDNF-3'-UTR预测的miR-204结合位点
3 讨论
IUGR可引起胎儿发育不匀称和神经系统发育障碍,导致学习和记忆能力下降。海马组织主要负责学习和记忆,而IUGR中缺血和营养不良等因素会引起海马组织尼氏小体锐减,尼氏小体作为神经元功能状态的标志,出现数量减少时,会引起神经元受损,损伤海马组织,导致学习和记忆能力衰退[14-15]。本研究采用低蛋白饮食法建立IUGR大鼠模型,结果显示IUGR幼鼠体重显著低于正常幼鼠,并表现出明显的学习和记忆能力障碍,与Chen等[16]研究结果一致,提示IUGR大鼠模型构建成功。本研究还发现,随着饲养时间的延长,IUGR幼鼠海马组织中miR-204含量逐渐升高,而正常组幼鼠海马组织中miR-204含量无变化,提示miR-204可能参与IUGR。
在IUGR研究中,miRNAs一直保持敏感性水平。miR-204作为miRNAs中的一员,已证实其参与神经系统的调控,但暂无与IUGR相关的研究。Hung等[17]研究发现miR-204-5p下调可导致BDNF/TrkB过表达和AKT/mTOR/Rac1信号通路激活,使海马中的激素和神经元得到调节,缓解精神压力。Zhang等[18]研 究 表 明,抑 制miR-204通过阻断BRUCE与STX17的相互作用来预防阿尔茨海默病中海马神经轴突营养不良,治疗记忆障碍。本研究结果显示,IUGR大鼠海马组织中miR-204含量升高,尼氏小体数量降低,细胞凋亡率升高,且出现明显的学习和记忆能力障碍;miR-204拮抗剂干预后,IUGR大鼠海马组织中miR-204表达被抑制,海马神经元及学习和记忆能力有所改善。提示miR-204可能改善IUGR大鼠学习和记忆能力。本研究还发现,IUGR大鼠海马组织出现BDNF表达降低,而抑制miR-204表达后,BDNF表达上升,说明miR-204可能调控BDNF。
BDNF/TrkB信号通路可增强IUGR患儿神经元突触联系和可塑性,影响学习记忆功能[19]。研究[20]显示,BDNF被激活后,在轴突末端与TrkB受体结合,促使TrkB受体内酪氨酸残基自身磷酸化,使p-TrkB水平升高,进而促使ras-MAPK通路活化,激活CREB,并使CREB磷酸化,p-CREB水平增加(图5)。甘世明等[21]研究显示,激活BDNF/TrkB信号通路可使前体细胞和树突进行分化和连接,从而保护神经。Ge等[22]研究显示,miR-204和BDNF/TrkB信号通路可能参与胚胎期及成年期氟铝暴露引起的子代大鼠空间学习记忆障碍,而抑制miR-204表达可激活BDNF/TrkB通路从而改善空间学习记忆障碍。本研究结果显示,IUGR大鼠海马组织中miR-204高表达,BDNF、p-TrkB及p-CREB水平降低,BDNF/TrkB信号通路活化被抑制,而抑制miR-204表达后,海马组织中BDNF、p-TrkB及p-CREB水平升高;p-TrkB和p-CREB都是TrkB和CREB的活化形式,各组大鼠海马组织内TrkB和CREB表达均无明显变化。为了进一步探讨miR-204与BDNF的关系,本研究进行双荧光素酶报告基因检测结果显示miR-204是BDNF负调控分子。提示抑制miR-204表达可引起BDNF的高表达,从而激活BDNF/TrkB信号通路,保护海马神经元,改善IUGR大鼠学习及记忆能力。但本研究未设置miR-204表达促进组,因此无法完全确定机制,只能提出miR-204的作用机制可能是与靶向调控靶向BDNF/TrkB信号通路有关。
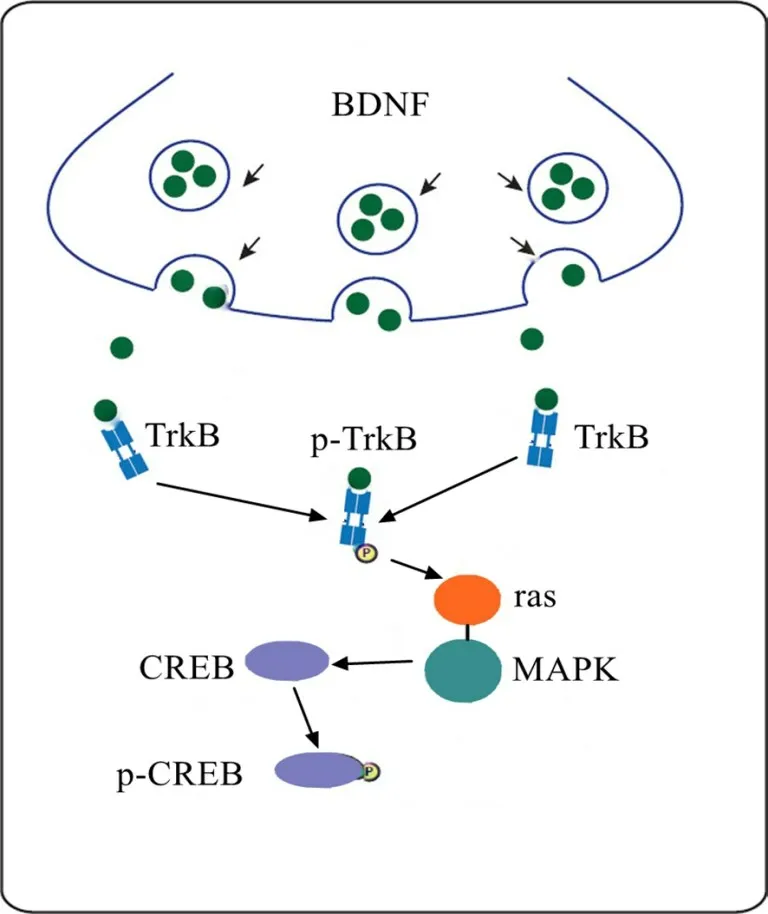
图5 BDNF/TrkB信号通路活化机制图
综上所述,抑制miR-204可改善IUGR新生大鼠学习及记忆功能,其作用机制可能与靶向激活BDNF/TrkB信号通路有关,本研究为miR-204可能作为IUGR的潜在标志物或者治疗靶点提供了一个强有力的依据。
