基于列线图的儿童脓毒症早期诊断模型的建立
2022-12-08滕沁伶鞠梅刘章英贺晓春
滕沁伶 鞠梅 刘章英 贺晓春
(1.四川省妇幼保健院,四川 成都 610000;2.西南医科大学,四川 泸州 646000)
脓毒症是因机体对病原微生物感染失调所致的器官功能障碍,严重者可致患儿死亡[1]。因脓毒症的病因各异,且临床表现也具有多样性,尚无明确的实验室检查指标作为脓毒症早期诊断的依据[2]。血培养是明确病原体的重要手段,但因培养耗时较长可能有延误治疗的风险[3]。快速序贯器官衰竭评价(quick Sequential Organ Failure Assessment,qSOFA)常用作发病时器官功能障碍程度的评估[4],该指标包括收缩压、呼吸频率及意识障碍3项内容,主要用于床旁评估,简便易行,但上述指标受多方面因素的影响,易引起误判,因此有必要联合其他指标以提高该评分对儿童脓毒症的早期诊断价值。可溶性髓样细胞触发受 体-1(soluble triggering receptor expressed on myeloid cell 1,sTREM-1)为近年新发现的细菌感染标志物,研究显示细菌或真菌感染时可上调sTREM-1在吞噬细胞上的表达而促进炎症因子的分泌,以放大宿主对微生物的反应[5],因而被认为可能与脓毒症的病情具有相关性。C反应蛋白(Creactive protein,CRP)、降钙素原(procalcitonin,PCT)等炎症指标也常用于脓毒症患者炎症程度的评估。儿童脓毒症的发生受多方面因素影响,目前的早期诊断方法均难以全面反映患儿病情,因此本研究旨在通过多因素分析探讨儿童脓毒症早期诊断的指标,并以此构建列线图模型,以期为儿童脓毒症患者的早期诊断提供参考。
1 资料与方法
1.1 研究对象
回顾性选取2018年1月—2021年6月四川省妇幼保健院收治的儿童脓毒症患者为脓毒症组,根据性别、年龄(±2岁)进行1∶1∶1配对选择同期住院的局部感染患儿为局部感染组,非感染性疾病的患儿为对照组。
纳入标准:(1)脓毒症组符合《儿童脓毒性休克(感染性休克)诊治专家共识(2015版)》中脓毒症的诊断[6]:发热(肛温>38.5℃)或低体温(肛温<35℃)、心动过速(低体温者可以无心动过速),伴以下至少一个脏器功能异常:意识改变、低氧血症、血清乳酸增高或洪脉。(2)局部感染组符合《诸福棠实用儿科学》[7]中感染的相关诊断但尚未达到脓毒症的标准。(3)对照组无明显的感染指征。(4)入院前均未接受药物治疗。(5)患儿家属知情同意。
排除标准:(1)患有先天性疾病;(2)合并免疫系统疾病。
1.2 实验室指标检测
调查对象入组后抽取治疗前空腹外周静脉血2 mL,置促凝集生化管中,以3 000 r/min转速离心15 min后取血清,采用双抗体夹心酶联免疫分析法对sTREM-1水平进行检测,试剂盒由上海瑞番生物科技生产。采用罗氏公司生产的Elecys2010型电化学免疫分析仪对CRP、PCT、白细胞介素-6(interleukin-6,IL-6)、白细胞介素-10(interleukin 10,IL-10)等指标进行检测。
1.3 qSOFA
收集患儿入院时收缩压、呼吸频率及意识改变情况,采用qSOFA对各组调查对象进行评估。标准如下:意识改变、收缩压低于100 mmHg、呼吸频率在22次/min以上,符合1项即计1分[8]。
1.4 小儿危重病例评分法
小儿危重病例评分法(Pediatric Critical Illness Score,PCIS)是目前临床常用的小儿危重病例病情评估方法。该评分系统包括呼吸、氧分压、pH等10项内容,满分100分,80分及以下者为危重病例[9]。
1.5 统计学分析
采用SPSS 22.3软件行统计学分析。计数资料以例数与百分率(%)表示,组间比较采用χ2检验;计量资料以均值±标准差(±s)表示,多组间比较行单因素方差分析,组间两两比较采用LSD-t检验。儿童脓毒症发生的多因素分析采用多因素logistic逐步回归分析。采用R 4.1.2软件的rms包构建列线图模型,以受试者工作特征(receiver operating characteristic,ROC)曲线分析评估模型的价值,并以计算机模拟充分采样(Bootstrap)法进行内部验证。P<0.05为差异有统计学意义。
2 结果
2.1 3组患儿的一般情况
2018年1月—2021年6月四川省妇幼保健院共收治儿童脓毒症病例94例,排除先天性疾病患儿7例,抽血前已接受抗菌药物治疗8例,合并免疫系统疾病3例,最终入组76例。纳入局部感染组76例,对照组76例。3组患儿性别、年龄、体重指数的比较差异均无统计学意义(P>0.05),见表1。
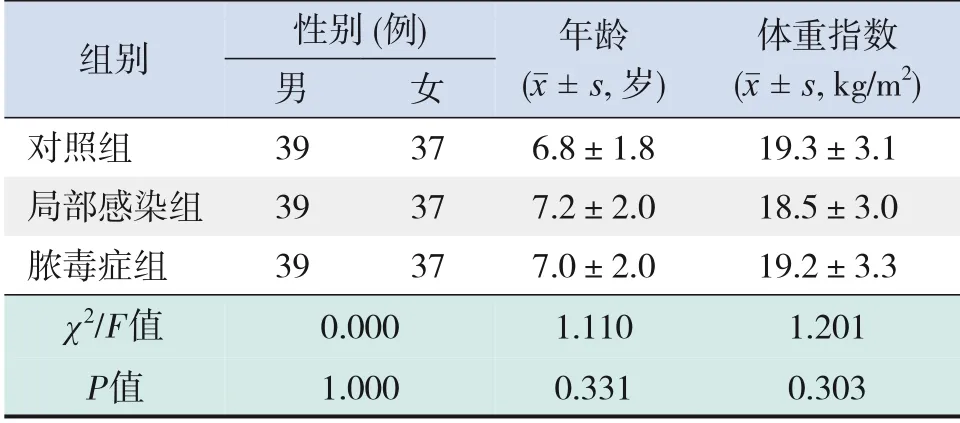
表1 3组患儿一般资料比较
2.2 3组血液学生化指标、qSOFA评分及PCIS评分的比较
脓毒症组、局部感染组、对照组sTREM-1、CRP、PCT、IL-6、IL-10、qSOFA评分及PCIS评分差异均有统计学意义(P<0.05),且血清sTREM-1、CRP、PCT、IL-6、IL-10及qSOFA评分呈脓毒症组>局部感染组>对照组的趋势(P<0.05),PCIS评分呈脓毒症组<局部感染组<对照组的趋势(P<0.05),见表2。
表2 3组sTREM-1、qSOFA评分及PCIS评分的比较(±s)

表2 3组sTREM-1、qSOFA评分及PCIS评分的比较(±s)
注:a示与对照组比较,P<0.05;b示与局部感染组比较,P<0.05。[sTREM-1]可溶性髓样细胞触发受体-1;[qSOFA]快速序贯器官衰竭评价;[PCIS]小儿危重病例评分法;[CRP]C反应蛋白;[PCT]降钙素原;[IL-6]白细胞介素-6;[IL-10]白细胞介素-10。
组别对照组局部感染组脓毒症组F值P值n 76 76 76 sTREM-1(pg/mL)128±33 174±42a 249±54a,b 147.734<0.001 qSOFA评分(分)0.92±0.23 1.47±0.35a 2.21±0.69a,b 146.646<0.001 PCIS评分(分)97±10 88±7a 64±8a,b 313.614<0.001 CRP(mg/dL)3.7±1.2 6.9±1.9a 15.0±4.2a,b 344.628<0.001 PCT(ng/mL)2.3±0.5 8.5±2.1a 10.9±3.0a,b 329.185<0.001 IL-6(ng/dL)8.0±2.0 17.4±3.9a 32.1±6.1a,b 595.868<0.001 IL-10(ng/dL)35±9 55±13a 82±24a,b 152.756<0.001
2.3 观察指标与脓毒症关系的多因素logisitc回归分析
将上述3组比较差异有统计学意义的因素作为自变量,以是否发生脓毒症为因变量行多因素logistic逐步回归分析。结果显示,sTREM-1、qSOFA评分、PCIS评分、CRP、IL-6及IL-10与儿童脓毒症独立相关(P<0.05),见表3。

表3 观察指标与脓毒症关系的多因素logisitc回归分析结果
2.4 列线图模型的建立与验证
将多因素logistic回归分析显示的与脓毒症显著关联的指标用于建立早期诊断脓毒症的列线图(图1)。根据各变量具体值进行赋分,将各变量得分相加后得到总分可得出儿童脓毒症的预测概率。如某患儿sTREM-1为140 pg/mL,得33分;qSOFA评分为1分,得21分;PCIS评分为60分,得37分;CRP为80 mg/dL,得52分;IL-6为20 ng/dL,得41分;IL-10为50 ng/dL,得29分。则该患儿总分合计213分,根据列线图(图1)总分213分对应脓毒症发生概率在0.2~0.3之间,可预测该患儿脓毒症发生概率为20%~30%之间。以ROC分析法评估列线图模型的预测价值,曲线下面积为0.837,95%CI为0.760~0.914,提示本研究建立的模型区分度较好(图2)。再以Bootstrap法对列线图进行内部验证,以原始数据重复抽样1 000次,结果显示:平均绝对误差为0.024,模型表现与理想模型基本拟合,提示模型预测准确度较高(图3)。

图1 脓毒症发生概率的列线图预测模型 通过获取患儿模型中各指标值,相应坐标轴上分别向上作垂直线,与分值线段相交点则为该指标的分数,各指标相加后获得总分,再在总分坐标轴上向下作垂直线,与脓毒症发生概率轴相交点即为脓毒症的预测概率。[sTREM-1]可溶性髓样细胞触发受体-1;[qSOFA]快速序贯器官衰竭评价;[PCIS]小儿危重病例评分法;[CRP]C反应蛋白;[IL-6]白细胞介素-6;[IL-10]白细胞介素-10。

图2 脓毒症发生概率列线图的ROC曲线

图3 脓毒症发生概率列线图的校准曲线 “理想模型”代表最优的预测效能,“模型表现”代表列线图模型拟合出的预测概率曲线,“偏差校正”为校正过度拟合后的预测概率曲线,代表列线图模型的预测效能,与“理想模型”越接近则列线图模型的预测效能越好。
3 讨论
脓毒症是因细菌、真菌等病原微生物感染所引起的疾病,脓毒症及其所引起的脓毒症休克及多器官功能不全仍是引起儿科危重症患者死亡的主要原因[10-11]。儿童脓毒症患者早期体征及临床表现多不典型,病原微生物检测则需要48~72 h才能获得结果,且具有一定的假阴性率,因此该病的早期诊断难度较大[12]。PCIS评分为目前临床常用的儿童危重症病例评估指标,目前也常用作儿童脓毒症患者的病情评估,但该评分系统不是针对儿童脓毒症患者而设计,导致其诊断效能不高,难以对患儿的病情进行快速识别,因此有必要寻找更为简单、快捷的指标以提高诊断效能[13]。
qSOFA为“Sepsis-3”新提出的用于早期识别脓毒症患者的方法[14],该方法目前在国内主要用于成人脓毒症的快速识别,在儿童脓毒症患者中应用的研究较少。本研究显示:qSOFA评分与儿童脓毒症独立相关,且qSOFA评分呈脓毒症组>局部感染组>对照组的趋势,提示qSOFA评分可作为区分脓毒症、局部感染及非感染性疾病的一个指标。qSOFA与PCIS评分系统相比,临床资料获取容易且参数较少,指标简便易用,有助于指导临床上对儿童脓毒症患者的快速识别。但儿童收缩压、呼吸频率及意识障碍受多方面因素的影响,除脓毒症外的其他多种疾病也可引起上述指标的改变而引起临床的误判,因此本研究选择血清sTREM-1、CRP等特异性较强的客观指标进行联合检测[15]。
本研究显示,血清sTREM-1、CRP、IL-6及IL-10均与儿童脓毒症独立相关,且血清sTREM-1、CRP、IL-6及IL-10均呈脓毒症组>局部感染组>对照组的趋势。sTREM-1为近年新发现的炎症相关免疫球蛋白的一种,其可选择性地在巨噬细胞、中性粒细胞及单核细胞等髓样细胞表面表达,并可通过促进肿瘤坏死因子、IL-8等炎症因子释放而触发或放大单核细胞炎症反应,在感染性疾病患者的血液、尿液、痰液中均有明显的升高[16-17]。有研究显示,细菌感染过程中中性粒细胞和单核/巨噬细胞膜结合可使sTREM-1的表达明显改变,并在6 h达到高峰,在呼吸机相关性肺炎等细菌感染性疾病中均可明显升高,且其浓度的高低可反映机体感染的严重程度,加上其具有出现时间早、半衰期短与体内感染同步等优势,对该指标进行检测可有效反映机体细菌感染严重程度[18]。CRP为肝脏合成的急性时相反应蛋白的一种,在机体出现感染、炎症、创伤等应激反应时可致其水平明显升高,一般在感染6~8 h后CRP水平即开始升高,在24~48 h即可达到高峰,因此该指标常用于多种感染性疾病的早期诊断[19]。此外,本研究显示IL-6及IL-10也与儿童脓毒症独立相关。IL-6及IL-10为白细胞介素家族中的成员,上述因子均为T淋巴细胞所释放,IL-6为促炎因子的一种,当机体出现病原体进入机体后可由吞噬细胞吞噬并将抗原信号呈递至T细胞诱发炎症反应,会出现升高;而IL-10具有抑制炎症的作用,因此,在炎症时升高,发挥抑制炎症的作用[20]。
列线图模型为临床常用的多因素logistic回归分析的可视化模型。本研究在多因素分析基础上建立的列线图模型经ROC分析及Bootstrap法进行内部验证证实具有较高的区分度与准确度,这可能与本研究建立的列线图指标既保留了qSOFA和PCIS评分快捷、方便、操作简便的特点,又有血清sTREM-1、CRP作为针对感染专属性较高的指标配合以提高儿童脓毒症患者的早期诊断准确度。列线图模型最大的优势在于其为可视化预测模型,简便、直观、使用方便。医护人员可使用该模型向患儿家属展示并告知其采取预防措施的目的,有利于患儿家属理解病情,提高患儿家属的治疗依从性。
综上所述,本研究显示sTREM-1、qSOFA评分、PCIS评分、CRP、IL-6及IL-10与儿童脓毒症独立相关,以上述指标建立的列线图模型对儿童脓毒症的诊断具有较高的区分度与准确度,临床实用价值较高。但本研究为单中心研究,样本量有限,选择的指标也较少,在后续的研究中将增加样本量、增加指标以进一步丰富列线图模型,提高模型的诊断效能。
