中药有效成分防治骨关节炎的作用机制研究进展
2022-12-08谢兴文赵永利李建国李鼎鹏韩宪富黄委委
李 辉,谢兴文,赵永利,李 宁, ,李建国,李鼎鹏,陈 欣,韩宪富,黄委委
·综 述·
中药有效成分防治骨关节炎的作用机制研究进展
李 辉1,谢兴文2*,赵永利2,李 宁1, 2,李建国3,李鼎鹏3,陈 欣2,韩宪富1,黄委委1
1. 甘肃中医药大学,甘肃 兰州 730000 2. 甘肃中医药大学附属医院,甘肃 兰州 730000 3. 西北民族大学附属医院,甘肃 兰州 730030
骨关节炎是临床上最常见的关节退行性疾病,影响整个关节组织。中药因低不良反应、低成本、多靶点起效等优势在骨关节炎的防治中占据重要位置。研究发现中药有效成分防治骨关节炎的作用机制主要包括减少炎症因子的产生、减轻氧化应激、抑制基质降解酶、调节软骨细胞代谢及调控相关信号通路等方面。主要综述了中药有效成分防治骨关节炎作用机制的研究进展,旨在为进一步研究中药有效成分在骨关节炎防治中的应用价值提供参考和依据。
中药有效成分;骨关节炎;炎症因子;氧化应激;基质降解酶;软骨细胞代谢;信号通路
骨关节炎作为当前临床上最常见的骨科疾病之一,其发病特征包括关节软骨、滑膜组织及软骨下骨的破坏性改变等[1]。骨关节炎的病因涉及炎症、氧化应激、关节损伤、年龄等多种因素。据估计目前全世界约3亿人患有骨关节炎,常导致患者关节疼痛、功能丧失和生活质量下降,是老年人残疾的主要原因,每年用于骨关节炎的医疗费用高达3030亿美元[2]。目前临床上骨关节炎的治疗目标主要是改善患者的疼痛症状,减少残疾,提高生活质量。保守治疗如口服非甾体抗炎药和镇痛药,虽能缓解骨关节炎症状,但伴随的胃肠道不良反应时有发生,且无法阻止骨关节炎的进一步发展,除手术治疗晚期骨性关节炎外,尚无有效逆转骨关节炎的治疗方法[3]。因此,寻找一种有效且简便低廉的防治方式显得尤为重要。中药因低不良反应、低成本、多靶点起效等优势在骨关节炎的治疗中占据重要位置,有效成分作为中药起效的主要物质,其防治骨关节炎的作用及机制引起科学家的广泛关注,并得到深入研究。大量研究结果表明,中药有效成分通过减少炎症因子的产生、减轻氧化应激、抑制基质降解酶表达、调节软骨细胞代谢、调控相关信号通路在骨关节炎的防治中扮演重要角色[4]。本文综述了近年来中药有效成分治疗骨关节炎的作用机制,以期为骨关节炎的药物治疗提供参考和依据。
1 减少炎症因子的产生
炎症不仅与骨关节炎的症状和体征相关,还与进行性软骨丢失密切相关,炎症因子通过影响软骨细胞的正常生理功能加速骨关节炎的进展[5]。研究发现,白细胞介素-1β(interleukin-1β,IL-1β)和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)是驱动软骨降解的2种主要分解代谢炎性细胞因子,加之炎性因子如前列腺素E2(prostaglandin E2,PGE2)和环氧合酶-2(cyclooxygenase-2,COX-2)的积聚可诱导软骨细胞产生更多的一氧化氮(nitric oxide,NO),损伤线粒体呼吸链,诱导软骨细胞凋亡及细胞外基质(extracellular matrix,ECM)降解[5]。此外,骨关节炎中涉及的促炎细胞因子可激活核因子-κB(nuclear factor-kappa B,NF-κB)信号通路,进而调控这些细胞因子的表达和诱导基质金属蛋白酶(matrix metalloproteinases,MMPs)及解聚素金属蛋白酶(a disintegrin-like and metalloprotease,ADAMTS)分解代谢活性上调,从而形成一个恶性循环,并且NF-κB信号通路可与其他途径相互作用,加重软骨退变[6]。
文印宪等[7]研究结果表明当归多糖可通过抑制软骨细胞IL-1β、IL-6等炎症因子的合成,减轻软骨局部炎症反应,促进蛋白多糖的合成,恢复软骨基质的稳态,进而起到抗骨关节炎的功效。江晨镝等[8]通过厚朴酚干预骨关节炎模型大鼠,结果发现厚朴酚可通过抑制IL-1β、TNF-α和IL-6的表达,进而发挥有效的抗炎活性来保护骨关节炎模型大鼠的软骨。常青等[9]通过研究黄芩苷对IL-1β诱导大鼠软骨细胞炎症反应的作用,发现黄芩苷组软骨细胞中NO、IL-6、PGE2和TNF-α含量均显著降低,提示其作用机制可能与抑制炎症反应相关。余素姣等[10]研究结果表明,黄芪甲苷能抑制炎症小体活化并影响软骨细胞IL-1β及TNF-α的产生,进而抑制关节软骨细胞的炎症损伤。郑洁等[11]通过对骨关节炎模型大鼠关节腔注射低、中、高剂量(5.00、8.75、12.50 mg)青藤碱干预10次,结果表明,中、高剂量组关节液中IL-6、IL-17、ADAMTS-4和ADAMTS-5的含量较模型组显著降低,表明青藤碱对骨关节炎模型病变软骨有保护作用。也有研究发现青藤碱通过降低膝关节骨性关节炎(knee osteoarthritis,KOA)患者血清及关节液中IL-1β、IL-6、TNF-α的表达,具有保护软骨细胞免受因炎症异常激活导致的降解作用[12]。陈谱等[13]以膝关节置换术废弃的软骨组织中提取的软骨细胞为研究对象,发现白芍总苷可显著降低软骨细胞中IL-1β、TNF-α的表达,且疗效呈剂量相关性,证明白芍总苷对骨关节炎软骨细胞具有明显的抗炎特性。
2 减轻氧化应激
活性氧自由基(reactive oxygen species,ROS)在骨关节炎的病理发生发展过程中起着重要作用,关节内过量的ROS能够加速氧化应激反应,导致软骨细胞和ECM严重受损,从而加速骨关节炎的进展[14]。过氧化氢(hydrogen peroxide,H2O2)被认为是ROS的一种常见形式,H2O2可产生ROS,H2O2的积累参与了骨关节炎的发展[15]。H2O2能诱导人软骨细胞产生诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS),而iNOS是NO合成的关键酶。一旦被诱导,NO可以在很长一段时间内以恒定速率合成,可抑制ECM中II型胶原的合成并促进其降解[16]。NO还会抑制软骨细胞中ECM的分泌,影响软骨内营养物质的交换,并将其留在不良的微环境中,最终导致其降解和逐渐退化[17]。此外,丙二醛和超氧化物歧化酶(superoxide dismutase,SOD)是衡量氧化应激反应的2个重要指标,可参与细胞内的信号转导机制,一旦其浓度失衡,氧化应激反应就会加剧[18]。
有研究发现,苍术内酯II可通过相关途径蛋白磷酸化抑制细胞凋亡,升高骨关节炎大鼠血清中SOD水平,降低丙二醛水平,进而降低氧化应激,缓解骨关节炎模型大鼠软骨损伤[19]。杨波等[20]运用白藜芦醇干预原代软骨细胞,结果表明白藜芦醇通过上调抗氧化酶基因的表达,能降低H2O2诱导的ROS和脂质氧化水平,从而作为一种直接的抗氧化剂,对软骨细胞起到保护作用。Pan等[21]研究发现,黄芩苷可降低丙二醛的水平,增加SOD和NO的水平。此外,黄芩苷还可显着提高终板软骨细胞中iNOS的微小核糖核酸(microRNA,miRNA)水平,进而减轻H2O2诱导的软骨细胞氧化应激和凋亡。川芎嗪作为川芎根茎中的主要活性成分,在IL-1β诱导的软骨细胞中,可增加SOD水平、降低丙二醛水平和抑制IL-1β诱导的软骨细胞中ROS的产生来减轻氧化应激反应[22]。刘文斌等[23]的研究结果表明,绞股蓝提取物通过降低丙二醛水平,提高SOD活性,能抑制IL-1β诱导的软骨细胞氧化应激,减轻软骨细胞损伤。
3 抑制基质降解酶表达
关节软骨细胞外基质在调节软骨细胞代谢和功能中起着至关重要的作用。ECM主要由II型胶原蛋白和含有糖胺聚糖、透明质酸和硫酸软骨素的大型蛋白聚糖网络构成[24]。软骨细胞代谢异常,其特征是ECM的损伤,包括ECM降解增加和生成减少、软骨细胞死亡和蛋白多糖及胶原的降解[25]。而MMPs作为软骨基质降解的关键酶,其和ADAMTS的过度表达可导致蛋白多糖和胶原的降解,加重骨关节炎的发生发展[25]。同时,金属蛋白酶组织抑制剂(tissue inhibitor of metalloproteinase,TIMP)可抑制蛋白多糖的活性,减少蛋白多糖的降解。
槲皮素广泛分布于植物界,具有抗炎、抗病毒、抗肿瘤等药理活性,可维持关节软骨ECM的完整性[26]。袁小亮等[27]研究表明槲皮素可显著降低MMP-13/TIMP-1的值,抑制ECM的降解,进而保护关节软骨。曾丽[28]研究发现淫羊藿苷能降低骨关节炎大鼠模型软骨组织中MMP-1、MMP-3、MMP-13等蛋白的表达水平。此外,淫羊藿苷比单通路抑制剂更强地抑制MMPs表达,这可能与槲皮素参与调节多个信号通路有关,通过多靶点效应抑制骨关节炎软骨中MMPs的表达。五味子中含有多种木脂素类成分,包括五味子甲素和五味子乙素。五味子乙素和五味子甲素在骨关节炎治疗中具有相似的药理作用,能抑制IL-1β诱导的软骨细胞分泌MMPs,上调II型胶原和蛋白多糖的基因表达[29]。Wang等[30]研究发现补骨脂素具有雌激素样作用,可以保护软骨细胞,降低MMPs的表达。此外,丹参酮I可以减少II型胶原和蛋白多糖的降解,上调相关的高迁移率族蛋白11基因表达,同时下调基因表达,从而减轻软骨损伤[31]。
4 调节软骨细胞代谢
软骨细胞凋亡是骨关节炎的特征之一。关节中的许多基因和信号通路可影响软骨细胞的增殖和凋亡,一旦基因和信号通路异常表达,就会抑制软骨细胞的增殖并促进其凋亡[32]。虽然自噬能帮助维持软骨细胞的正常生理状态,但其减少也会促进软骨细胞的损伤。骨髓间充质干细胞具有很强的分化能力,可以在有利于软骨重建的特定环境中被诱导分化为软骨细胞[32]。
有研究发现,骨关节炎模型大鼠关节腔注射当归多糖可改善软骨的合成,降低滑膜炎症和纤维化程度[33]。马笃军等[34]发现牛膝总皂苷能有效增强骨关节炎模型兔体外软骨细胞的细胞活力,促进软骨细胞增殖,提高II型胶原蛋白表达。汤晓晨[35]运用甲苯胺蓝染色检测退变软骨细胞中II型胶原和蛋白多糖时发现,在一定浓度、一定时间内黄芪甲苷通过提高相关细胞因子的表达,明显减缓退变软骨细胞增殖及老化的情况,进而起到延缓关节软骨退变的作用。廖州伟等[36]运用不同剂量的牛膝醇提物含药血清干预软骨细胞,研究结果表明牛膝醇提物可通过增加人骨关节炎软骨细胞的增殖活力,降低细胞生长阻滞,增加细胞脱氧核糖核酸合成及减少细胞凋亡来促进软骨细胞的生长,对人骨关节炎软骨细胞具有保护作用。廖军锋等[37]研究表明,毛蕊异黄酮可增强骨关节炎软骨细胞的增殖能力,减少软骨细胞凋亡。孙海峰等[38]发现淫羊藿苷可通过改善人软骨细胞凋亡率,进而改善骨关节炎软骨细胞病变。
5 调控相关信号通路
5.1 磷脂酰肌醇-3激酶(phosphatidylinositol-3-kinases,PI3K)/蛋白激酶B(protein kinase B,Akt)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路
研究发现,PI3K/Akt/mTOR信号通路是具有多个调节器和效应器的复杂信号通路,其在软骨内稳态过程中是所必需的[39-40]。先前的分析表明,与正常软骨相比,PI3K/Akt/mTOR信号通路在骨关节炎患者的软骨组织中下调[41]。因此,抑制PI3K/Akt/ mTOR信号通路,通过恢复软骨内环境平衡,可减轻骨关节炎所致的关节损伤。自噬是能量利用和营养代谢的重要调节因子,是一种细胞内稳态机制,可清除功能失调和受损的大分子和细胞器[42]。未能进行自噬会导致活性氧的产生增加和线粒体功能障碍,并且自噬到凋亡的转换与软骨细胞向骨关节炎的进展有关[43]。mTOR途径是自噬的关键抑制因子,受PI3K/Akt上游信号通路的集中调控。骨关节炎软骨中mTOR的上调与软骨细胞的凋亡增加和自噬相关基因的表达减少有关[44]。研究表明软骨敲除后,mTOR可上调自噬,减少细胞凋亡,改变小鼠软骨内环境平衡[45]。PI3K/Akt/mTOR信号通路调控骨关节炎发生发展的可能机制见图1。

Caspase-3/9-半胱氨酸天冬氨酸蛋白酶-3/9
青藤碱可通过下调大鼠PI3K/Akt信号通路,进而缓解踝关节炎模型大鼠的症状[46]。续断总皂苷能够通过调控自噬相关蛋白的表达,抑制PI3K/ Akt/mTOR通路过度活化的途径,发挥其促进骨关节炎模型大鼠软骨细胞发生自噬的作用[47]。谢获[48]研究发现牛膝总皂苷可降低关节液中NO含量和软骨细胞的凋亡水平,提高Akt的Thr308表位在兔膝软骨细胞中的活化程度,提示其机制可能与干预PI3K/Akt信号转导通路提高Akt的Thr308表位活化程度有关。杨阳等[49]利用动物模型证实白杨素可通过抑制PI3K/Akt信号通路,下调自噬蛋白的表达抑制自噬,进而保护软骨细胞。研究发现运用蛇床子素干预骨关节炎模型大鼠,检测软骨组织中PI3K、Akt蛋白的表达显著降低,提示蛇床子素改善膝骨关节炎模型大鼠的症状与抑制PI3K/Akt/NF-κB信号通路相关[50]。曹舒兴等[51]研究姜黄素对大鼠骨关节炎软骨细胞的保护作用,结果表明姜黄素通过Akt/mTOR信号通路诱导自噬,进而对骨关节炎大鼠发挥保护作用。姚旭等[52]研究表明芍药苷能通过抑制细胞内PI3K/Akt信号通路增加软骨细胞的自噬能力,减少炎症因子的生成来治疗骨关节软骨的炎症反应。
5.2 NF-κB信号通路
研究发现NF-κB转录因子在骨关节炎中异常激活,作为一种致病因子,参与了许多与骨关节炎相关的事件,包括软骨细胞分解代谢、软骨细胞存活和滑膜炎症[53-54]。NF-κB直接或间接诱导基质降解酶和其他骨关节炎相关因子的表达,从而协调异常的软骨分解代谢途径。NF-κB通过位于、和基因启动子中的NF-κB反应元件诱导分解代谢基因的表达[55],促进主要促炎及破坏骨关节炎介质的表达,包括IL-1β、TNF-α和IL-6、COX-2、PGE2等[56]。NF-κB信号通路调控骨关节炎发生发展的可能机制见图2。
陈谱等[57]研究结果表明,芍药苷各组与模型组比较,IL-1β、IL-6、TNF-α含量及ADAMTS-5表达水平均降低,并且芍药苷各组与模型组比较,NF-κB p65表达水平明显降低,进而表明芍药苷可以阻止NF-κB通路激活,抑制软骨细胞炎症及延缓软骨退变。谢子康等[58]研究发现蒲公英甾醇对骨关节炎模型大鼠具有保护作用,能减轻关节软骨组织的病理学改变,其作用机制可能与炎症抑制及NF-κB信号通路活化受阻有关。研究发现槲皮素可抑制胶原诱导性关节炎小鼠关节炎症反应,其机制可能与槲皮素抑制NF-κB信号通路有关[59]。蔡松涛等[60]研究表明枸杞多糖处理的骨关节炎软骨细胞上清液中IL-1β和TNF-α水平降低,细胞中iNOS蛋白表达下调,同时NF-κB p65蛋白水平降低,提示枸杞多糖能够降低骨关节炎软骨细胞炎性细胞因子水平,抑制NF-κB信号通路,从而改善骨关节炎症损伤。

TLR-Toll样受体 IκB-NF-κB抑制因子 IKK-IκB激酶
5.3 Wnt/β-连环蛋白(β-catenin)信号通路
研究发现,Wnt/β-catenin信号通路是调节骨关节炎发生发展的一条独特的信号通路,在人类遗传学中,与Wnt/β-catenin信号通路相关的基因改变被认为是骨关节炎发生的易感因素[61]。经典的Wnt信号通路通过调节细胞内β-catenin水平和β-catenin的亚细胞定位来触发其在细胞内的信号传递。在缺乏Wnt蛋白的情况下,β-catenin水平保持稳定状态。过量的β-catenin蛋白通过与轴蛋白1/2、腺瘤样息肉蛋白(adenomatous polyposis coli,APC)、蓬乱蛋白和酪蛋白激酶I(casein kinase I,CKI)以磷酸化依赖的方式在一个“破坏复合物”中降解[61]。该蛋白复合物磷酸化β-catenin蛋白羧基末端的特定氨基酸残基[62]。当Wnt配体与其受体卷曲蛋白和低密度脂蛋白受体相关蛋白(LDL-receptor-related protein,LRP)5或6结合时,卷曲蛋白、LRP5和LRP6受体的胞内部分与蓬乱蛋白、APC和轴蛋白1/2蛋白相互作用,导致β-catenin从破坏复合体释放,并允许β-catenin转位到细胞核。β-catenin与T细胞转录因子结合,激活细胞核中Wnt靶基因的表达[62]。骨硬化蛋白是Wnt的拮抗剂,它们竞争性地与Wnt的辅助受体LRP5和LRP6结合,从而抑制Wnt信号转导[63]。分泌型卷曲相关蛋白-3是Wnt/β-catenin信号通路的一种可溶抑制物,研究发现,其变异与发生髋关节骨性关节炎的风险之间存在关联,因其多态降低了抑制物结合Wnts的能力,从而增加了Wnt/β-catenin信号的激活[64]。Wnt/β-catenin信号通路调控骨关节炎发生发展的可能机制见图3。
乔磊等[65]研究结果表明,紫丁香苷可通过抑制Wnt/β-catenin信号通路的活化改善骨关节炎大鼠关节软骨组织病理损伤。吴成武等[66]研究徐长卿丹皮酚对IL-1β诱导的软骨细胞损伤的影响,发现徐长卿丹皮酚可通过降低IL-1β诱导的软骨细胞凋亡率、Wnt和β-catenin蛋白表达,进而通过调控Wnt/β-catenin信号通路起到保护软骨细胞损伤的作用。此外,川芎嗪能降低模型组大鼠软骨细胞中Wnt-3a miRNA、β-catenin miRNA、MMP-13 miRNA等蛋白的表达,从而延缓KOA软骨退变,提示其机制可能与抑制Wnt/β-catenin信号通路相关[67]。研究表明续断醇提物能下调滑膜组织中Wnt和β-catenin的蛋白表达,进而抑制滑膜组织Wnt/β-catenin信号通路活化,发挥对骨关节炎具有潜在的保护作用[68]。

GSK-3β-糖原合成酶激酶-3β
5.4 其他信号通路
骨关节炎的发病涉及多条信号通路。研究表明,Notch信号通路在软骨细胞增殖、分化及凋亡方面起着重要的调控作用[69]。史桂荣等[70]研究结果表明,黄芪多糖通过抑制Notch信号通路,对小鼠骨关节炎可起到一定的治疗作用。谢平金等[71]研究结果表明,川芎嗪可通过抑制血管内皮生长因子/Notch信号通路介导的血管新生,在一定程度上改善多方面的组织学表现,进而抑制早期膝骨关节炎的进展。骨保护素(osteoprotegerin,OPG)/NF-κB受体活化因子(receptor activator of NF-κB,RANK)/NF-κB受体活化因子配体(receptor activator of NF-κB ligand,RANKL)信号通路与骨关节炎的重要病理改变软骨下骨硬化密切相关[72]。王斌等[73]运用香豆雌酚干预骨关节炎患者的软骨细胞,发现其能增加关节软骨细胞OPG/RANKL值,减少MMP-1、MMP-3水平表达,具有一定的软骨保护作用。李亦丞[74]研究发现,青蒿琥酯通过调节OPG/RANKL/RANK信号通路抑制破骨细胞分化,降低活跃的骨吸收,减少血管内皮生长因子的释放,进而维持软骨下骨微观结构。值得注意的是,目前中药有效成分调控其余与骨关节炎相关信号通路的研究较少,还需要更多关注和更深入的研究。中药有效成分对骨关节炎的作用机制见表1。
6 结语
骨关节炎发病机制复杂,目前尚未完全阐明。ECM降解紊乱、软骨细胞凋亡、炎症反应及氧化应激等病理过程并不是孤立存在的,它们之间存在相互交织的关系。中药有效成防治骨关节炎因其不良反应小、价廉效优、作用靶点广泛,越来越受到研究人员的关注[75]。本文通过综述近10年来的相关研究成果,从炎症因子、氧化应激、基质降解酶、软骨细胞代谢及相关信号通路5个方面来探讨中药有效成分抗骨关节炎的作用机制。目前众多中药有效成分已在体内外实验中显示出巨大的骨关节炎治疗潜力。因此,中医药治疗骨关节炎是非常有益的,但中药有效成分对骨关节炎的潜在治疗作用是多通路、多靶点综合作用的结果,加之中药的药效学研究进展相对缓慢和缺乏大量的临床前和临床试验数据。未来的研究应积极利用现代药理学手段深入精准了解其作用机制及作用靶点,筛选出有效单体成分,进而为骨关节炎的治疗积累有效的候选药物。此外,将骨关节炎发病机制研究与中药有效成分的研究相结合可能是今后研究的重要方向。
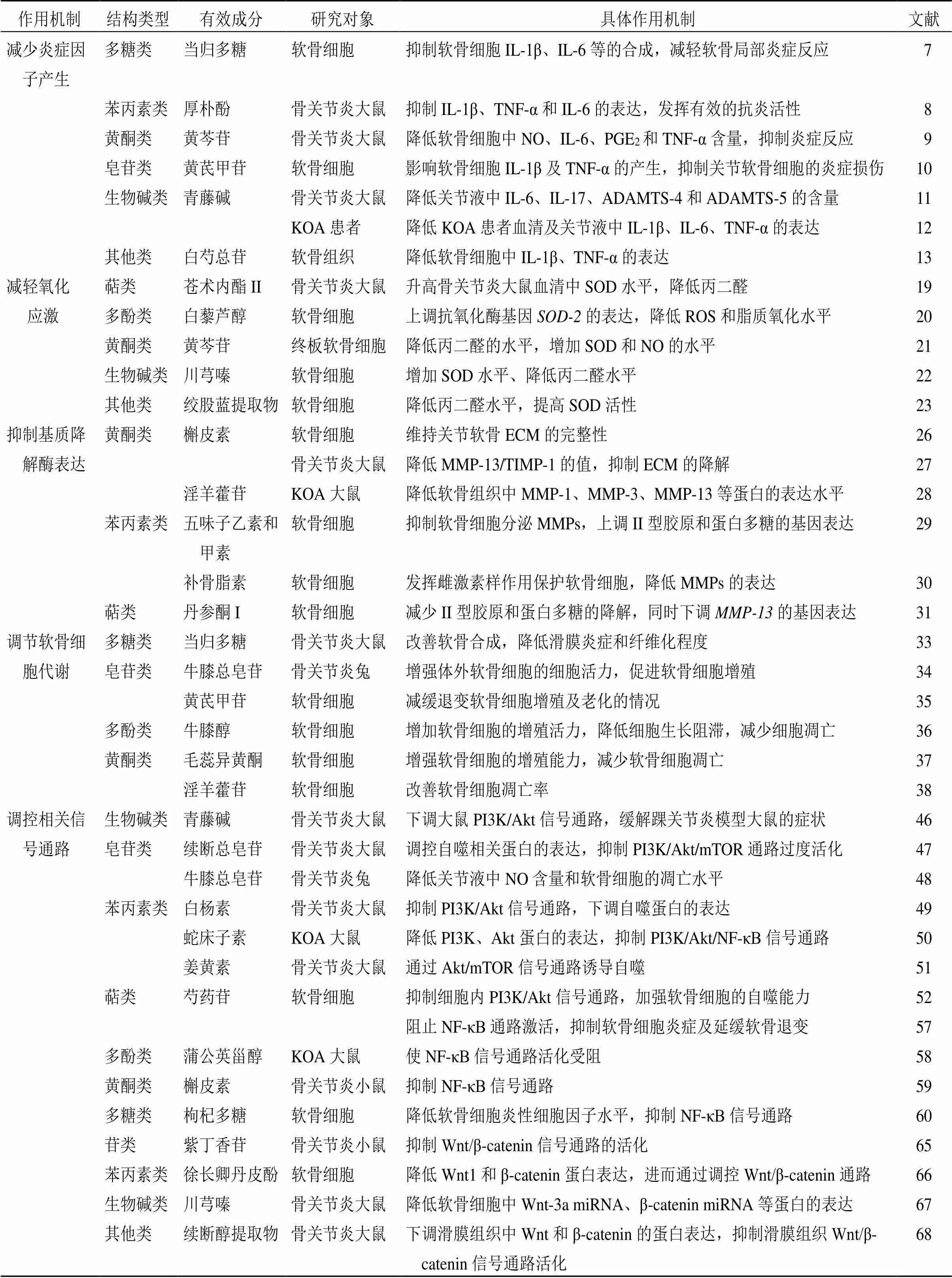
表1 中药有效成分对骨关节炎的作用机制
利益冲突 所有作者均声明不存在利益冲突
[1] Sacitharan P K. Ageing and osteoarthritis [J]., 2019, 91: 123-159.
[2] Murphy L B, Cisternas M G, Pasta D J,. Medical expenditures and earnings losses among US adults with arthritis in 2013 [J]., 2018, 70(6): 869-876.
[3] Lambova S N, Müller-Ladner U. Osteoarthritis-current insights in pathogenesis, diagnosis and treatment [J]., 2018, 14(2): 91-97.
[4] Li L F, Liu H Q, Shi W M,. Insights into the action mechanisms of traditional Chinese medicine in osteoarthritis [J]., 2017, 2017: 5190986.
[5] Shen J, Abu-Amer Y, O’Keefe R J,. Inflammation and epigenetic regulation in osteoarthritis [J]., 2017, 58(1): 49-63.
[6] 李辉, 谢兴文, 李建国, 等. NF-κB信号通路在骨关节炎中的作用 [J]. 生命的化学, 2021, 41(9): 1915-1919.
[7] 文印宪, 秦俊, 谭扬, 等. 当归多糖组分APS-3c软骨保护作用的体外研究 [J]. 武汉大学学报: 医学版, 2019, 40(1): 1-5.
[8] 江晨镝, 李世政. 厚朴酚对骨关节炎的抗炎和软骨保护作用 [J]. 免疫学杂志, 2020, 36(5): 416-421.
[9] 常青, 王伟, 杨增华, 等. 黄芩苷对IL-1β诱导大鼠软骨细胞凋亡和炎症反应的抑制作用及相关机制研究 [J]. 中国免疫学杂志, 2020, 36(21): 2603-2607.
[10] 余素姣, 谭慧. 黄芪甲苷通过炎症小体活化影响软骨细胞炎性因子的表达 [J]. 中国组织工程研究, 2019, 23(11): 1652-1656.
[11] 郑洁, 赵莉平, 胡亚莉, 等. 青藤碱对兔膝骨关节炎模型组织形态学及关节液炎性细胞和聚集蛋白聚糖酶含量的影响 [J]. 中国中医药信息杂志, 2019, 26(6): 51-54.
[12] 段力军. 基于NF-κB探讨肥胖KOA中IPFP的功能机制和青藤碱抗软骨细胞炎性损伤研究 [D]. 北京: 北京中医药大学, 2019.
[13] 陈谱, 阮安民, 周俊, 等. 白芍总苷对骨关节炎软骨细胞炎症及退变的影响 [J]. 中国组织工程研究, 2021, 25(29): 4614-4618.
[14] Ansari M Y, Ahmad N, Haqqi T M. Oxidative stress and inflammation in osteoarthritis pathogenesis: Role of polyphenols [J]., 2020, 129: 110452.
[15] Fitzpatrick C M, Athwal A. Celebrating 20 years of open access publishing at BMC musculoskeletal disorders [J]., 2020, 21(1): 771.
[16] Xia B J, Chen D, Zhang J S,. Osteoarthritis pathogenesis: A review of molecular mechanisms [J]., 2014, 95(6): 495-505.
[17] Abramoff B, Caldera F E. Osteoarthritis: Pathology, diagnosis, and treatment options [J]., 2020, 104(2): 293-311.
[18] Marchev A S, Dimitrova P A, Burns A J,. Oxidative stress and chronic inflammation in osteoarthritis: Can NRF2 counteract these partners in crime? [J]., 2017, 1401(1): 114-135.
[19] 杨光, 惠越, 陈奎, 等. 苍术内酯II对骨关节炎大鼠软骨损伤、血清炎症因子和氧化应激的调节作用及机制研究 [J]. 中医学报, 2021, 36(3): 601-607.
[20] 杨波, 龙慧, 王郑钢, 等. 白藜芦醇激活Nrf-2信号抑制H2O2诱导的骨关节炎软骨细胞凋亡、氧化损伤和炎症反应 [J]. 中国现代应用药学, 2021, 38(19): 2359-2366.
[21] Pan Y T, Chen D, Lu Q Y,. Baicalin prevents the apoptosis of endplate chondrocytes by inhibiting the oxidative stress induced by H2O2[J]., 2017, 16(3): 2985-2991.
[22] Yu T, Qu J, Wang Y,. Ligustrazine protects chondrocyte against IL-1β induced injury by regulation of SOX9/NF-κB signaling pathway [J]., 2018, 119(9): 7419-7430.
[23] 刘文斌, 李艳兵, 周焱涛. 绞股蓝提取物通过调控lncRNA PICSAR对IL-1β诱导软骨细胞损伤的保护作用及机制研究 [J]. 疑难病杂志, 2021, 20(10): 1045-1049.
[24] Gao Y, Liu S Y, Huang J X,. The ECM-cell interaction of cartilage extracellular matrix on chondrocytes [J]., 2014, 2014: 648459.
[25] 李辉, 李宁, 谢兴文, 等. 中医药干预基质金属蛋白酶表达治疗膝骨性关节炎研究进展 [J]. 中国骨质疏松杂志, 2022, 28(1): 120-123.
[26] 茅华杰. 槲皮素对骨性关节炎的作用及其机制研究 [D]. 杭州: 浙江大学, 2019.
[27] 袁小亮, 李林福, 施伟梅, 等. 槲皮素对关节软骨中MMP-13、TIMP-1表达的影响 [J]. 时珍国医国药, 2016, 27(2): 283-285.
[28] 曾丽. 淫羊藿苷抑制骨关节炎基质金属蛋白酶的机制研究 [D]. 重庆: 重庆医科大学, 2014.
[29] Tu C, Huang X J, Xiao Y F,. Schisandrin A inhibits the IL-1β-induced inflammation and cartilage degradation via suppression of MAPK and NF-κB signal pathways in rat chondrocytes [J]., 2019, 10: 41.
[30] Wang C L, Al-Ani M K, Sha Y Q,. Psoralen protects chondrocytes, exhibits anti-inflammatory effects on synoviocytes, and attenuates monosodium iodoacetate-induced osteoarthritis [J]., 2019, 15(1): 229-238.
[31] Wang X P, Fan J B, Ding X M,. Tanshinone I inhibits IL-1β-induced apoptosis, inflammation and extracellular matrix degradation in chondrocytes CHON-001 cells and attenuates murine osteoarthritis [J]., 2019, 13: 3559-3568.
[32] Li Z, Wang Y J, Xiang S,. Chondrocytes-derived exosomal miR-8485 regulated the Wnt/β-catenin pathways to promote chondrogenic differentiation of BMSCs [J]., 2020, 523(2): 506-513.
[33] 刘军, 陈廖斌, 汪晖, 等. 当归多糖对大鼠骨性关节炎形态改变的影响 [J]. 武汉大学学报: 医学版, 2010, 31(5): 608-612.
[34] 马笃军, 彭力平, 曹亚飞, 等. 牛膝总皂苷含药关节液对骨关节炎体外软骨细胞增殖及凋亡的实验研究 [J]. 中国中医骨伤科杂志, 2019, 27(3): 1-5.
[35] 汤晓晨. 黄芪甲苷干预人膝骨关节炎退变关节软骨细胞的效应及机制研究 [D]. 南京: 南京中医药大学, 2015.
[36] 廖州伟, 王立新, 胡烈奎, 等. 牛膝醇提物对人膝骨关节炎软骨细胞增殖、周期及凋亡的影响 [J]. 世界中西医结合杂志, 2019, 14(11): 1539-1542.
[37] 廖军锋, 王虹, 吕晓宇. 毛蕊异黄酮对人骨关节炎软骨细胞增殖和凋亡的影响 [J]. 广西医科大学学报, 2021, 38(11): 2133-2139.
[38] 孙海峰, 杨茂伟, 时永臣, 等. 中药淫羊藿苷对TDP-43介导的骨关节炎软骨细胞病变的作用机制 [J]. 世界中医药, 2019, 14(7): 1672-1676.
[39] Sun K, Luo J, Guo J,. The PI3K/AKT/mTOR signaling pathway in osteoarthritis: A narrative review [J]., 2020, 28(4): 400-409.
[40] Mobasheri A, Rayman M P, Gualillo O,. The role of metabolism in the pathogenesis of osteoarthritis [J]., 2017, 13(5): 302-311.
[41] Rosa S C, Rufino A T, Judas F,. Expression and function of the insulin receptor in normal and osteoarthritic human chondrocytes: Modulation of anabolic gene expression, glucose transport and GLUT-1 content by insulin [J]., 2011, 19(6): 719-727.
[42] Chen J Z, Crawford R, Xiao Y. Vertical inhibition of the PI3K/Akt/mTOR pathway for the treatment of osteoarthritis [J]., 2013, 114(2): 245-249.
[43] Duarte J H. Osteoarthritis: Autophagy prevents age-related OA [J]., 2015, 11(12): 683.
[44] Dalle Pezze P, Ruf S, Sonntag A G,. A systems study reveals concurrent activation of AMPK and mTOR by amino acids [J]., 2016, 7: 13254.
[45] Zhang Y, Vasheghani F, Li Y H,. Cartilage-specific deletion of mTOR upregulates autophagy and protects mice from osteoarthritis [J]., 2015, 74(7): 1432-1440.
[46] 何龙, 葛占洲, 伍永权, 等. 青藤碱通过PI3K/Akt信号通路改善大鼠踝关节炎的研究 [J]. 西北药学杂志, 2022, 37(3): 71-76.
[47] 商连斌. 基于PI3K/AKT/mTOR通路探讨续断总皂苷对KOA大鼠软骨细胞自噬的调控机制研究 [D]. 沈阳: 辽宁中医药大学, 2021.
[48] 谢获. 牛膝总皂甙对兔早期骨关节炎及PI3K/AKT通路的影响 [D]. 遵义: 遵义医学院, 2011.
[49] 杨阳, 何宇, 史于传, 等. 白杨素通过PI3K/AKT信号通路抑制LPS诱导的软骨细胞自噬 [J]. 中国药理学通报, 2021, 37(5): 662-668.
[50] 段志远, 于强, 周驰, 等. 蛇床子素对膝骨关节炎大鼠的作用及对PI3K/Akt/NF-κB信号通路的影响 [J]. 解剖科学进展, 2021, 27(1): 111-114.
[51] 曹舒兴, 周楠, 王进, 等. 姜黄素通过Akt-mTOR信号通路调控细胞自噬对骨关节炎大鼠的保护作用研究 [J]. 河北医药, 2021, 43(24): 3685-3689.
[52] 姚旭, 王清华, 茹艺, 等. 芍药苷抑制PI3K/AKT信号促进细胞自噬治疗骨关节炎 [J]. 吉林中医药, 2020, 40(8): 1076-1079.
[53] Lepetsos P, Papavassiliou K A, Papavassiliou A G. Redox and NF-κB signaling in osteoarthritis [J]., 2019, 132: 90-100.
[54] Choi M C, Jo J, Park J,. NF-κB signaling pathways in osteoarthritic cartilage destruction [J]., 2019, 8(7): 734.
[55] Kobayashi H, Hirata M, Saito T,. Transcriptional induction of ADAMTS5 protein by nuclear factor-κB (NF-κB) family member RelA/p65 in chondrocytes during osteoarthritis development [J]., 2013, 288(40): 28620-28629.
[56] Latourte A, Cherifi C, Maillet J,. Systemic inhibition of IL-6/Stat3 signalling protects against experimental osteoarthritis [J]., 2017, 76(4): 748-755.
[57] 陈谱, 阮安民, 周俊, 等. 基于NF-κB信号通路探讨芍药苷对LPS诱导的人软骨细胞炎症及退变的作用机制 [J]. 北京中医药大学学报, 2020, 43(11): 903-909.
[58] 谢子康, 史铭钰, 蒋阳, 等. 蒲公英甾醇治疗大鼠膝关节骨关节炎的作用机制初步探索 [J]. 实用骨科杂志, 2022, 28(5): 416-421.
[59] 谢延平, 李艳宝. 槲皮素对胶原诱导性关节炎小鼠Toll样受体4/核因子-κB信号通路的影响 [J]. 安徽医药, 2022, 26(5): 859-863.
[60] 蔡松涛, 孙京涛, 魏瑄. 枸杞多糖抑制核因子-κB (NF-κB) 通路降低骨关节炎软骨细胞炎性细胞因子水平 [J]. 细胞与分子免疫学杂志, 2018, 34(11): 989-993.
[61] Zhou Y C, Wang T Y, Hamilton J L,. Wnt/β-catenin signaling in osteoarthritis and in other forms of arthritis [J]., 2017, 19(9): 53.
[62] Wiese K E, Nusse R, van Amerongen R. Wnt signalling: Conquering complexity [J]., 2018, 145(12): dev165902.
[63] Clevers H, Nusse R. Wnt/β-catenin signaling and disease [J]., 2012, 149(6): 1192-1205.
[64] de Palma A, Nalesso G. WNT signalling in osteoarthritis and its pharmacological targeting [J]., 2021, 269: 337-356.
[65] 乔磊, 邸振宇, 乔曼, 等. 紫丁香苷对前交叉韧带横断诱导的大鼠骨关节炎的影响 [J]. 局解手术学杂志, 2022, 31(1): 10-15.
[66] 吴成武, 王伟, 汤休书, 等. 徐长卿丹皮酚通过调控Wnt/β-catenin通路保护IL-1β诱导的软骨细胞损伤 [J]. 中国老年学杂志, 2021, 41(23): 5346-5351.
[67] 肖强, 郭子龙, 杨晓宏. 基于Wnt/β-catenin信号通路探讨川芎嗪延缓膝骨关节炎软骨退变的机制 [J]. 中医药导报, 2022, 28(2): 37-42.
[68] 周煜虎, 段明明, 曹强. 续断醇提物对骨关节炎的治疗作用及相关分子机制的研究 [J]. 中国中医骨伤科杂志, 2020, 28(7): 1-5.
[69] Liu Z, Ren Y, Mirando A J,. Notch signaling in postnatal joint chondrocytes, but not subchondral osteoblasts, is required for articular cartilage and joint maintenance [J]., 2016, 24(4): 740-751.
[70] 史桂荣, 任博文, 张仲博, 等. 黄芪多糖干预对骨关节炎模型小鼠关节软骨损伤的修复 [J]. 中国组织工程研究, 2022, 26(20): 3236-3242.
[71] 谢平金, 罗臻, 卢启贵, 等. 川芎嗪和过表达miR-20b-5p干预早期膝骨关节炎模型大鼠滑膜、软骨和软骨下骨血管新生的组织学变化 [J]. 中国组织工程研究, 2023, 27(2): 237-245.
[72] 王迷娜, 刘璐, 赵洛鹏, 等. 膝骨关节炎炎性因子及信号通路的研究进展 [J]. 中国骨伤, 2020, 33(4): 388-392.
[73] 王斌, 高益, 彭立波, 等. 香豆雌酚对膝骨关节炎患者软骨细胞OPG/RANKL及MMP-1、MMP-3表达的影响 [J]. 东南大学学报: 医学版, 2015, 34(1): 47-51.
[74] 李亦丞. 基于NF-κB及OPG/RANKL/RANK信号通路探究青蒿琥酯对骨关节炎的作用及机制 [D]. 乌鲁木齐: 新疆医科大学, 2020.
[75] 柴润东, 郭虹. 药物干预类风湿性关节炎骨代谢紊乱的研究进展[J]. 药物评价研究, 2020, 43(10): 2133-2137.
Research progress on mechanism of effective components of traditional Chinese medicine in preventing and treating osteoarthritis
LI Hui1, XIE Xing-wen2, ZHAO Yong-li1, LI Ning1, 2, LI Jian-guo3, LI Ding-peng3, CHEN Xin2, HAN Xian-fu1, HUANG Wei-wei1
1. Gansu University of Chinese Medicine, Lanzhou 730000, China 2. Affiliated Hospital of Gansu University of Chinese Medicine, Lanzhou 730000, China 3. Affiliated Hospital of Northwest University for Nationalities, Lanzhou 730030, China
Osteoarthritis is the most common joint degenerative disease in clinic, which affects the whole joint tissue. Traditional Chinese medicine plays an important role in treatment of osteoarthritis because of its advantages such as low adverse reactions, low cost and multi-target effect. It has been found that the mechanisms of effective components of traditional Chinese medicine in prevention and treatment of osteoarthritis mainly include reducing the production of inflammatory factors, reducing oxidative stress, inhibiting matrix degrading enzymes, regulating chondrocyte metabolism and regulating related signaling pathways. The research progress on mechanism of effective components of traditional Chinese medicine in the prevention and treatment of osteoarthritis was reviewed in this paper, to provide reference and basis for further study of the application value of effective components of traditional Chinese medicine in the prevention and treatment of osteoarthritis.
effective components of traditional Chinese medicine; osteoarthritis; inflammatory factors; oxidative stress; matrix degrading enzyme; chondrocyte metabolism; signaling pathways
R282.710.5
A
0253 - 2670(2022)23 - 7543 - 10
10.7501/j.issn.0253-2670.2022.23.026
2022-07-27
国家自然科学基金资助项目(81860864);国家自然科学基金资助项目(83160911);国家自然科学基金资助项目(82060873);甘肃省拔尖人才(科学技术领域)培养扶持资金项目(省委人才小组函[2021]2号);甘肃省第二人民医院院内重点项目(YNZD2021-2);中央高校基本科研业务费项目(31920210041)
李 辉(1996—),男,甘肃陇西人,硕士研究生,研究方向为骨关节疾病的基础与临床。E-mail: 2214866576@qq.com
通信作者:谢兴文(1972—),男,甘肃甘谷人,博士,博士生导师,研究方向为骨关节疾病的基础与临床。E-mail: 827975272@qq.com
[责任编辑 崔艳丽]
