华南忍冬花蕾中1个新的单萜苷类化合物
2022-12-08王团委王振中王秋红耿剑亮
王团委,王振中,王秋红,耿剑亮, 4*
• 化学成分 •
华南忍冬花蕾中1个新的单萜苷类化合物
王团委1, 2, 3,王振中2, 3,王秋红1,耿剑亮1, 2, 3, 4*
1. 广东药科大学中药学院,广东 广州 510006 2. 江苏康缘药业股份有限公司,中药制药过程新技术国家重点实验室,江苏 连云港 222001 3. 江苏康缘药业股份有限公司,中药提取精制新技术重点研究室,江苏 连云港 222001 4. 南京中医药大学,江苏 南京 210023
研究华南忍冬干燥花蕾(山银花)的化学成分。综合应用HP-20、硅胶、ODS、Sephadex LH-20和半制备液相等多种色谱学方法进行分离纯化,并根据化合物的理化性质和核磁共振波谱数据进行结构鉴定。采用LPS诱导小鼠巨噬细胞RAW264.7模型,以抑制炎性细胞因子一氧化氮(NO)的分泌为评价指标对分离得到的化合物进行体外抗炎活性评价。从华南忍冬干燥花蕾70%乙醇提取物中分离鉴定了5个化合物,分别为8-[α--arabinopyranosyl- (1′′→6′)-β--glucopyranosyl]-2,6-dimethyloct-1,2′′-lactone(1)、天师酸(2)、黄麻脂肪酸F(3)、天师酸甲酯(4)和黄麻脂肪酸F甲酯(5)。化合物1为新的单萜苷类化合物,命名为忍冬单萜A,化合物2~5为首次从忍冬属植物中分离得到。化合物对LPS诱导的RAW264.7细胞中NO的分泌均无显著的抑制作用。
华南忍冬;山银花;一氧化氮;8-[α--arabinopyranosyl-(1′′→6′)-β--glucopyranosyl]-2,6-dimethyloct-1,2′′-lactone;忍冬单萜A;天师酸;黄麻脂肪酸F;天师酸甲酯
山银花又名山花、南银花、土忍冬、土银花等,为忍冬科(Caprifoliaceae)忍冬属Linn.植物灰毡毛忍冬Hand.-Mazz.、红腺忍冬Miq.、华南忍冬DC.或黄褐毛忍冬Hsu et S. C. Cheng的干燥花蕾或带初开的花,具有清热解毒、疏散风热的功效,临床上主要用于治疗用于痈肿疔疮、喉痹、丹毒、热毒血痢、风热感冒、温病发热[1]。主要分布于我国四川、广东、广西、湖南等南方各地。山银花的化学成分多样,主要含有皂苷类[2-8]、有机酸类[9-15]、黄酮类[16-17]、环烯醚萜苷[18-20]、挥发油[21-22]等,现代药理学研究表明山银花提取物及其化学成分具有抗菌抗病毒[23-26]、抗氧化[27-29]、解热抗炎[30-32]、抗肿瘤[33-34]和保肝[35-38]等多种药理活性。金银花和山银花作为我国清热解毒常用中药,《中国药典》2005年版之前均将金银花和山银花收载为金银花使用,直至《中国药典》2005年版才将二者分别收载。而山银花的产量高、花期长、价格低廉,种植规模大,资源丰富。但目前关于山银花的药理学研究主要集中于粗提物或有效部位的药效评价,缺乏对山银花中所含化学成分及药理作用的系统深入研究。为了给山银花在医药、化工、食品、饮料工业等方面的应用价值和安全性作出科学的评价和提供质控标准,合理开发和利用这一丰富的自然资源,故对山银花中的化学成分进行系统研究,为制定山银花药材及相关中成药质量标准的提升奠定物质基础。
为进一步探索山银花的有效成分,本实验综合应用HP-20、硅胶、ODS、Sephadex LH-20和半制备液相等多种色谱学方法,对华南忍冬干燥花蕾70%乙醇提取物经石油醚、醋酸乙酯和正丁醇萃取得到的醋酸乙酯部位的化学成分进行研究,从中分离得到5个化合物,分别鉴定为8-[α--arabinopyranosyl- (1′′→6′)-β--glucopyranosyl]-2,6-dimethyloct-1,2′′- lactone(1)、天师酸(tianshic acid,2)、黄麻脂肪酸F(corchorifatty acid F,3)、天师酸甲酯(tianshic acid methyl ester,4)和黄麻脂肪酸F甲酯(corchorifatty acid F methyl ester,5)。化合物1为新的单萜苷类化合物,命名为忍冬单萜A;化合物2~5均为首次从忍冬属植物中分离得到。采用脂多糖(lipopolysaccharide,LPS)诱导小鼠巨噬细胞RAW264.7模型,以抑制炎性细胞因子一氧化氮(NO)的分泌为评价指标对分离得到的化合物进行体外抗炎活性评价。
1 仪器与材料
Brucker AVANCE 600型核磁共振仪(德国Bruker公司),Finni-gan LCQ Advantage MAX质谱仪,Waters Snapt G2 mass spectrometer高分辨质谱仪,Shimadzu分析高效液相色谱(Shimadzu LC-6AD series pump equipped with a UV detector),Shimadzu制备型高效液相色谱,P2000旋光测定仪、FT/IR-480 plus红外光谱仪(KBr压片)、JASCOV-550 紫外-可见光谱仪(日本Jasco公司)。分析高效液相色谱柱为Phenomenex Gemini(C18,250 mm×4.6 mm,5 μm),制备高效液相色谱柱为C18柱(250 mm×20 mm,5 μm,Nacalai tesque Inc.,日本)。TS100型倒置显微镜(日本尼康公司);A10051560型超净工作台(AIRTECH公司);ZW-A型微量振荡器(常州国华仪器有限公司);L530型离心机(湘仪集团);S25型小舞灵旋涡混合器(德国IKA公司);EDP3-plus电动多道移液器(美国RAININ公司);1000、200、20、10 μL单道移液器(Brand公司)。
薄层硅胶GF254和柱色谱硅胶(青岛海洋化工厂),HP-20大孔树脂(Mitsubishi-Chemical,日本),反相ODS填料(Merck公司),Sephadex LH-20填料(Amersham Biosciences公司),Toyo-pearl HW-40填料(Toyo Soda MFG);95%乙醇(食用级,连云港长和酒业有限公司),水(三蒸水,自制),分析纯试剂(南京化学试剂有限公司)。DMEM高糖细胞培养基(Hyclone),胎牛血清(Lonsera),LPS(南京大治生物科技有限公司),二甲基亚砜(DMSO,阿拉丁试剂),24孔细胞培养板(JET公司),96孔细胞培养板(JET公司),0.25%胰酶细胞消化液(Gibco),NO检测试剂盒:NaNO2,Griess 试剂II+Griess试剂II(上海碧云天);亚硝酸钠(南京化学试剂股份有限公司)。单糖标准品-Glc(批号C10911131,质量分数99%,Macklin公司)、-Glc(批号E1506024,质量分数98%,Aladdin公司)、-Ara(批号C14635692;质量分数98%,Macklin公司)、-Ara(批号J24M10R89091;质量分数98%,上海源叶生物有限公司)。
山银花药材于2021年购自安徽亳州(产地湖南溆浦),药材经南京中医药大学吴启楠教授鉴定为忍冬科植物华南忍冬DC.的干燥花蕾,样品标本(20210506)现保存于江苏康缘药业股份有限公司标本室。
2 提取与分离
山银花干燥花蕾10 kg,8倍量70%乙醇加热回流提取3次,每次2 h,合并提取液,减压浓缩之后,得流浸膏7 L。总浸膏用适量水分散均匀后,1次用石油醚、醋酸乙酯和正丁醇进行萃取,分别得到石油醚部位(151 g,LC-1)、醋酸乙酯部位(283 g,LC-2)和正丁醇部位(246 g,LC-3)。取醋酸乙酯部位LC-2(240 g)进行硅胶柱色谱(φ 8.5 cm×100.0 cm)分离,二氯甲烷-甲醇(100∶0、98∶2、95∶5、90∶10、85∶15、80∶20、70∶30、60∶40、50∶50、0∶100)梯度洗脱得到共11个馏份Fr. 2A~2K。Fr. 2H(11.9 g)经ODS柱色谱(φ 80.0 cm×5.0 cm)分离,甲醇-水(2∶8、4∶6、6∶4、7∶3、10∶0)梯度洗脱得到Fr. 2H1~2H9,2H6(3.2 g)经制备液相(50%乙腈-酸水,体积流量8 mL/min,示差检测器RID)纯化得到化合物2(101.2 mg,R=21 min)、3(93.2 mg,R=14 min)、4(23.0 mg,R=23 min)和5(50.3 mg,R=17 min)。2I(12.8 g)经ODS柱色谱(φ 5.0 cm×80.0 cm)分离,甲醇-水(2∶8、4∶6、6∶4、7∶3、10∶0)梯度洗脱得到Fr. 2I1~2I11,2I8(4.2 g)经硅胶柱色谱(φ80.0 cm×5.0 cm)分离,氯仿-甲醇(100∶0、98∶2、95∶5、90∶10、85∶15、80∶20、70∶30、60∶40、50∶50、0∶100)梯度洗脱得到Fr. 2I1~2I9,2I5经半制备液相(25%乙腈-酸水,体积流量4 mL/min,208 nm)纯化得到化合物1(11.8 mg,R=15 min)。
3 糖的绝对构型的鉴定
3.1 单糖标准品的衍生化实验
参考文献的方法[39],对单糖标准品进行衍生化反应,反应过程见图1。取单糖标准品混合物(-Glc、-Glc、-Ara、-Ara,各0.5 mg),加入左旋半胱氨酸甲酯(-cysteine methyl ester,1 mg)和吡啶(1 mL),置于60 ℃下反应1 h。再加入邻甲苯异硫氰酸酯(-tolyl isothiocyanate,1 µL),继续在60℃下反应1 h。反应完成后,混合物直接作为供试品,以进行HPLC分析。
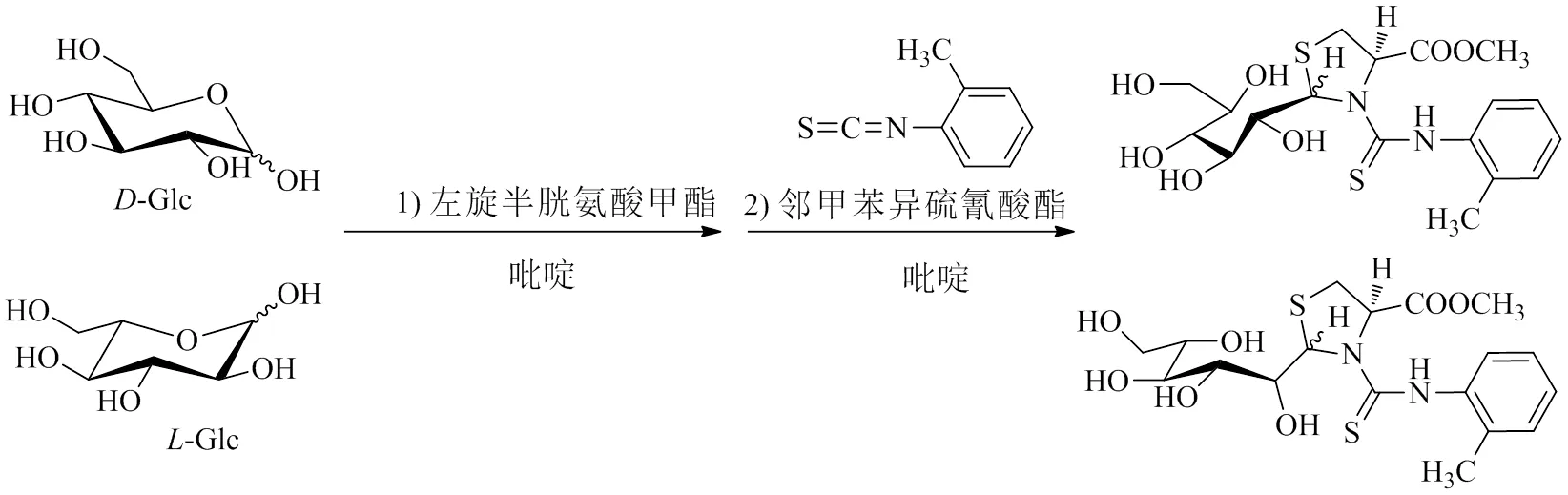
图1 醛糖与左旋半胱氨酸甲酯和邻异硫氰酸酯的反应
3.2 化合物的水解及衍生化反应
取化合物(约1 mg),加入2 mol/L HCl (2 mL),置于80~90℃水浴中反应1 h。将混合物蒸干,加入1 mL水混悬,再加入等体积的水饱和的氯仿萃取。取水层,蒸干,用与单糖对照品一样的方法进行衍生化反应,得到HPLC供试品。
HPLC分析条件:色谱柱Phenomenex Gemini(C18,250 mm×4.6 mm,5 μm);流动相为25%乙腈(0.1%甲酸);体积流量0.8 mL/min;柱温35 ℃;进样量10 µL;检测波长250 nm;检测时间40 min。
3.3 结果
通过对比化合物水解得到的糖基衍生物和单糖标准品衍生物在HPLC图谱中的保留时间确定化合物结构中所含有的糖基类型,结果见图2。化合物1所含糖基类型为-Glc和-Ara。
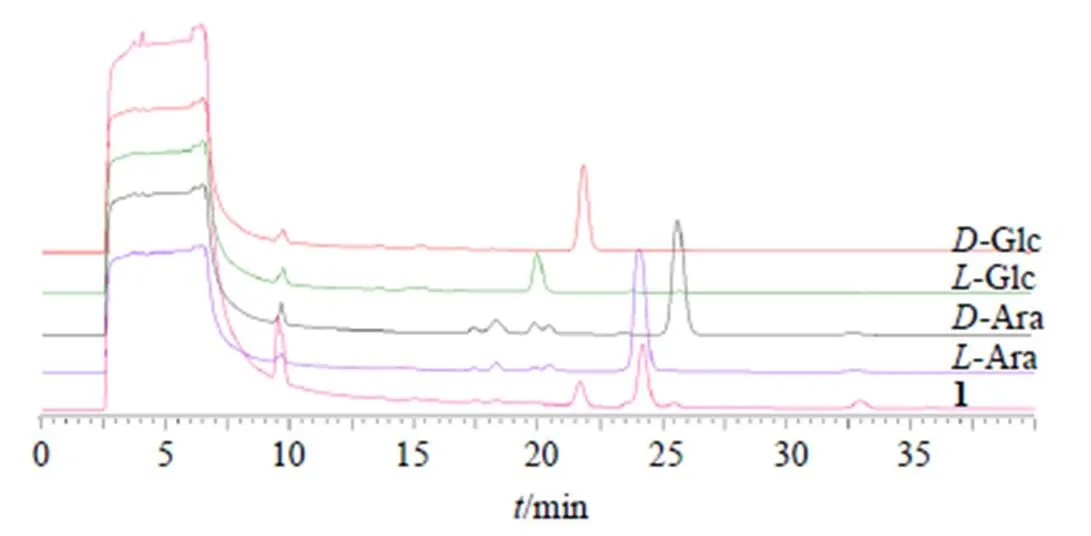
图2 化合物1的糖基衍生物与单糖标准品衍生物HPLC对比图
4 结构鉴定
化合物1:白色无定形粉末,[α]29 D−36.8(0.50,CH3OH)。HR-ESI-MS给出/465.233 9 [M+H]+(计算值为465.233 6),确定分子式为C21H36O11,计算不饱和度为4。UV(甲醇)图谱可见max(log): 204 (3.6), 230 (3.3)。IR (KBr) 光谱给出max: 3418, 2929, 2358, 1715, 1064 cm−1。
1H-NMR (600 MHz, CD3OD) 图谱,低场区显示见2个糖端基质子信号 [H4.50 (1H, d,= 6.8 Hz), 4.21 (1H, d,= 8.0 Hz)],高场区可见2个甲基氢信号[H1.15 (3H, d,= 7.0 Hz, 9-CH3), 0.91 (3H, d,= 6.6 Hz, 10-CH3)]。13C-NMR (150 MHz, CD3OD) 结合DEPT-135谱共显示21个碳信号,包括11个糖残基的碳信号、1个季碳信号 (C178.3)、2个次甲基 (C40.4, 29.7)、5个亚甲基 (C68.9, 37.4, 37.1, 35.5, 24.9)、2个甲基 (C21.5, 18.4),推测结构中可能存在单萜结构片段。由1H-1H COSY谱(图3),可观察到H-9/H-2/H-3/H-4/H-5/H-6/H-10以及H-6/H-7/H-8之间存在明显相关,结合H3-9 (H1.15)/C-1 (C178.3), C-2 (C40.4), C-3 (C35.5) 的HMBC相关,进一步确证了结构中存在单萜结构片段。
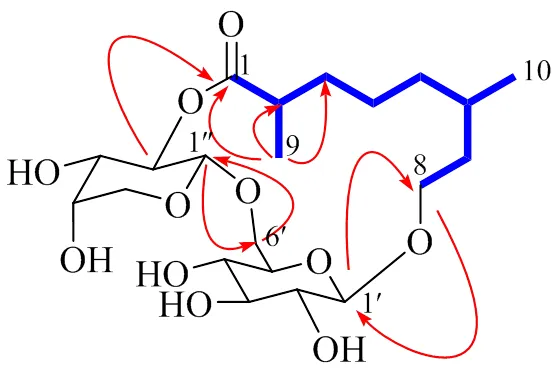
图3 化合物1的主要1H-1H COSY () 和HMBC ()相关
化合物的1D核磁图谱中显示结构中含有2分子糖残基,对其进行糖水解衍生化实验,结果表明化合物1所含2个糖基分别为-Glc和-Ara(图2),结合糖端基质子信号 [H4.50 (1H, d,= 6.8 Hz), 4.21 (1H, d,= 8.0 Hz)] 中的偶合常数提示葡萄糖端基碳构型为β构型,阿拉伯糖端基碳为α构型。在HMBC谱中,可见H-1′′ (H4.50)/C-6′ (C68.5) 和H-6′ (H4.15, 3.65)/C-1′′ (C101.5) 相关,提示阿拉伯糖基和葡萄糖基为1→6连接,此外,可见相关峰H-2′′ (H5.03)C-1 (C178.3) 和H-8 (H3.76, 3.71)/C-1′ (δ104.4) (图3),提示单萜结构片段分别连接在阿拉伯糖基的2位和葡萄糖基的1位。
综合NMR图谱信息,归属了化合物1的碳氢信号(表1)。鉴定化合物1的结构为8-[α-- arabinopyranosyl-(1′′→6′)-β--glucopyranosyl]-2,6- dimethyloct-1,2′′-lactone;经SciFinder Scholar网络检索,未发现相关报道,表明化合物1为1个新的单萜苷类化合物,命名为忍冬单萜A(图4)。化合物的绝对构型有待进一步确定。
化合物2:白色无定形粉末,HR-ESI-MS给出/331.248 3 [M+H]+(计算值为331.248 4),确定分子式为C18H34O5,计算不饱和度为2。1H-NMR (600 MHz, C5D5N): 2.46 (2H, m, H-2), 1.60 (2H, m, H-3), 1.26~1.34 (6H, m, H-4~6), 1.46 (2H, m, H-7), 4.47 (1H, m, H-8), 6.27 (1H, dd,= 15.6, 5.5 Hz, H-9), 6.32 (1H, dd,= 15.6, 5.8 Hz, H-10), 4.44 (1H, m, H-11), 3.88 (1H, m, H-12), 1.78 (2H, m, H-13), 1.53~1.76 (8H, m, H-14~17), 0.81 (3H, m, CH3-18);13C-NMR (150 MHz, C5D5N): 176.2 (C-1), 35.0 (C-2), 25.8 (C-3), 26.3 (C-4), 29.9 (C-5), 26.3 (C-6), 38.6 (C-7), 72.1 (C-8), 136.8 (C-9), 131.0 (C-10), 75.4 (C-11), 76.3 (C-12), 33.8 (C-13), 30.1 (C-14), 29.6 (C-15), 32.5 (C-16), 23.2 (C-17), 14.5 (C-18)。氢谱、碳谱数据与文献报道的数据一致[40],故鉴定化合物2为天师酸。

表1 化合物1的核磁数据(600/150 MHz, CD3OD)
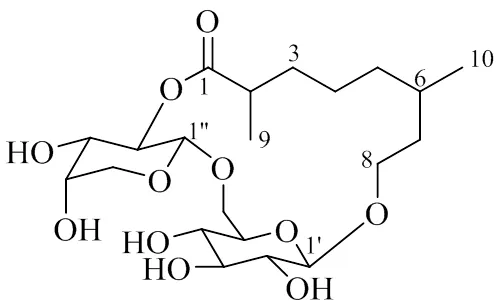
图4 化合物1的结构
化合物3:白色无定形粉末,HR-ESI-MS给出/329.232 6 [M+H]+(计算值为329.232 8),确定分子式为C18H32O5,计算不饱和度为3。1H-NMR (600 MHz, C5D5N): 2.28 (2H, t,=7.3 Hz, H-2), 1.59 (2H, m, H-3), 1.33 (8H, m, H-4~7), 1.50 (2H, m, H-8), 4.48 (1H, m, H-9), 6.31 (1H, dd,= 15.6, 5.6 Hz, H-10), 6.38 (1H, dd,= 15.5, 6.0 Hz, H-11), 4.54 (1H, t,= 5.8 Hz, H-12), 4.00 (1H, m, H-13), 2.34 (1H, m, H-14a), 2.10 (3H, overlapped, H-14b, 17), 5.85 (1H, m, H-15), 5.50 (1H, m, H-16), 0.93 (3H, t,= 7.5 Hz, CH3-18);13C-NMR (150 MHz, C5D5N): 176.3 (C-1), 35.1 (C-2), 26.0 (C-3), 26.3 (C-4), 30.0 (C-5), 29.8 (C-6), 30.2 (C-7), 38.7 (C-8), 72.1 (C-9), 136.9 (C-10), 131.1 (C-11), 75.6 (C-12), 75.7 (C-13), 31.9 (C-14), 133.2 (C-15), 127.3 (C-16), 21.3 (C-17), 14.7 (C-18)。氢谱、碳谱数据与文献报道的数据一致[41],故鉴定化合物3为黄麻脂肪酸F。
化合物4:白色无定形粉末,HR-ESI-MS给出/345.263 9 [M+H]+(计算值为345.264 1),确定分子式为C19H36O5,计算不饱和度为2。1H-NMR (600 MHz, C5D5N) 显示1组反式双键信号H6.32 (1H, d,= 15.6, 5.8 Hz), 6.27 (1H, dd,= 15.5, 5.5 Hz),1个甲氧基信号H3.62 (3H, s),1个甲基信号H0.81 (3H, m),3个羟基偕氢H4.47 (1H, m), 4.44 (1H, m), 3.88 (1H, m)。13C-NMR (150 MHz, C5D5N) 图谱共显示19个碳信号,结合DEPT 135图谱,发现共含有1个季碳信号 (C176.2)、5个次甲基碳信号 (C136.8, 131.1, 76.4, 75.4, 72.0)、11个亚甲基碳信号(C38.6, 35.0, 33.8, 32.5, 30.1, 29.9, 29.7, 26.4, 26.2, 25.8, 23.2)、1个甲氧基碳信号(C51.5)、1个甲基碳信号(C14.5)。将化合物4的核磁数据与2对比发现4仅多出1个甲氧基信号[H3.62 (3H, s);C51.5],其他数据一致[40],故鉴定化合物4为天师酸甲酯。
化合物5:白色无定形粉末,HR-ESI-MS给出/343.248 0 [M+H]+(计算值为343.248 1),确定分子式为C19H34O5,计算不饱和度为3。1H-NMR (600 MHz, C5D5N) 显示2组双键信号H6.38 (1H, dd,= 15.5, 6.0 Hz, H-11), 6.31 (1H, dd,= 15.6, 5.6 Hz, H-10), 5.85 (1H, m, H-15), 5.50 (1H, m, H-16),1个甲基信号H0.93 (3H, t,= 7.5 Hz, CH3-18),1个甲氧基信号H3.62 (3H, s, CH3),3个羟基偕氢H4.54 (1H, t,= 5.8 Hz, H-12), 4.48 (1H, m, H-9), 4.00 (1H, m, H-13)。13C-NMR (150 MHz, C5D5N)图谱共显示19根碳信号,结合DEPT-135图谱,发现共含有1个季碳信号 (C176.3),7个次甲基碳信号 (C136.9, 133.2, 131.1, 127.3, 75.7, 75.6, 72.1),9个亚甲基碳信号 (C38.7, 35.1, 31.9, 30.2, 30.0, 29.8, 26.3, 25.9, 21.3),1个甲基碳信号 (C14.7),1个甲氧基碳信号 (C51.6)。将化合物5的1H-NMR、13C-NMR数据与3对比发现5仅多出1个甲氧基信号[H3.62 (3H, s, CH3),C51.6],其他数据一致[41],故鉴定化合物5为黄麻脂肪酸F甲酯。
5 化合物体外抑制NO释放活性
5.1 细胞活力测试
RAW 264.7细胞在37 ℃的培养箱中以含有10% FBS和1% PS的DMEM培养基为基质培养至细胞密度为2×105个/mL。取对数生长期细胞均匀接种于96孔板中(每孔400 μL),样品组中加入分别加入50、20、10 μmol/L药物,对照组加入等量无血清的DMEM培养基。继续培养24 h后,于多功能酶标仪测定490 nm吸光度()值。
5.2 炎症因子NO测试
取RAW 264.7 细胞均匀接种于96 孔板中(终密度2.5×105个/mL),继续培养24 h 后吸去上清液。模型组和样品组中加入LPS(终质量浓度为1 μg/mL),对照组中加入等量无血清的DMEM 培养基,样品组中药物的终浓度为50、20、10 μmol/L。24 h 后取50 μL 上清液,加入Griess A 试剂和Griess B 试剂各50 μL。在酶标仪上540 nm 处测定最终产物的值,根据标准曲线计算亚硝酸盐浓度并按公式计算抑制率。
抑制率=(模型组NO平均含量-样品组NO平均含量)/(模型组NO平均含量-对照组NO平均含量)
5.3 实验结果
实验结果表明,各化合物在其测试浓度下对RAW 264.7 细胞均无细胞毒性。各化合物对LPS诱导的RAW264.7细胞NO的分泌均无显著抑制作用,抑制率均低于2.05%。
6 讨论
金银花和山银花作为我国清热解毒常用中药,其功能主治相同、化学成分相似,但目前的研究多集中于金银花,而山银花的药理学研究主要集中于粗提物或有效部位的药效评价,缺乏对山银花中所含化学成分及其药理作用的系统深入研究,不利于明确和区分二者的临床应用价值以及山银花自然资源的合理开发利用。另一方面山银花与金银花的主要差异性成分,是三萜及皂苷类成分,其在山银花药材中的含量也相对较大,但目前市售来自山银花的三萜皂苷类化学对照品品种单一(仅有灰毡毛忍冬皂苷甲、乙和川续断皂苷乙),因而本实验整体研究思路是对山银花中三萜及皂苷类富集部位进行系统的化学成分研究,首先进行采用溶剂萃取法进行粗分离得到水部位、醋酸乙酯部位和正丁醇部位。经过HPLC及UPLC-Q/TOF-MS分析,山银花中三萜及皂苷类成分主要富集在醋酸乙酯部位,因此本研究首先对醋酸乙酯部位进行系统的研究,为山银花质量标准的提升提供标准品。后续本课题组将继续对山银花中的主要成分(三萜及皂苷类成分)进行规模化制备,并结合山银花的功能主治建立合理的药效评价模型对分离得到的化合物进行活性评价,建立山银花与功效相关联的指纹图谱,提供山银花鉴别用指标成分标准品的制备方法,为山银花药材及相关中成药质量标准的提升奠定物质基础。
利益冲突 所有作者均声明不存在利益冲突
参考文献
[1] 中国药典 [S]. 一部. 2020: 32-33.
[2] Liu J, Zhang J, Wang F,. Isolation and characterization of new minor triterpenoid saponins from the buds of[J]., 2013, 370: 76-81.
[3] 柴兴云, 李萍, 窦静, 等. 山银花中皂苷类成分研究 [J]. 中国天然药物, 2004, 2(2): 339-340.
[4] Chen Y, Feng X, Jia X D,. Triterpene glycosides from. Isolation and structural determination of seven glycosides from flower buds of[J]., 2008, 44(1): 39-43.
[5] Chen Y, Shan Y, Zhao Y Y,. Two new triterpenoid saponins from[J]., 2012, 23(3): 325-328.
[6] Chen Y, Zhao Y Y, Wang M,. The first chlorogenic acid ester saponin from[J]., 2012, 47(6): 940-943.
不同小波基以及分解层去噪后Rs,n对比如图4所示.在db小波族中,db7去噪后的Rs,n相比其它dbN小波基高;当小波基达到最佳分解层后,若继续对信号进行分解,分解后的信噪比会下降,说明分解层不是多越好.在sym小波族中,sym9去噪后信号的Rs,n明显高于symN的其它小波基.根据表3统计db7和sym9部分分解层去噪后Rs,n指标,使用小波基db7对波峰属于高斯峰的带噪信号7层分解处理后的质量最好.
[7] Chen Y, Zhao Y Y, Wang M,. A new lupane-type triterpenoid saponin from[J]., 2014, 49(6): 1087-1090.
[8] Mei Y D, Zhang N, Zhang W Y,. Two new ursane-type nortriterpenes fromand their iNOS-inhibitory activities [J]., 2019, 17(1): 27-32.
[9] 柴兴云, 窦静, 贺清辉, 等. 山银花中酚酸类成分研究 [J]. 中国天然药物, 2004, 2(6): 339-340.
[10] 汤丹, 李会军, 钱正明, 等. 黄褐毛忍冬花蕾咖啡酰奎宁酸类成分研究 [J]. 中国药学杂志, 2007, 42(20): 1537-1539.
[11] 许小方, 李会军, 李萍, 等. 灰毡毛忍冬花蕾中的化学成分 [J]. 中国天然药物, 2006, 4(1): 45-48.
[12] Liu J, Zhang J, Wang F,. Chemical constituents from the buds ofin Sichuan, China [J]., 2014, 54: 68-70.
[13] 陈雨, 赵友谊, 吴双, 等. 灰毡毛忍冬花蕾水溶性化学成分研究 [J]. 中药材, 2012, 35(2): 231-234.
[14] 姚彩云, 宋志军, 李汉浠, 等. 红腺忍冬基源山银花的化学成分 [J]. 天水师范学院学报, 2014, 34(5): 10-12.
[16] 柴兴云, 王林, 宋越, 等. 山银花中黄酮类成分的研究 [J]. 中国药科大学学报, 2004, 35(4): 299-302.
[17] 温建辉, 倪付勇, 赵祎武, 等. 山银花化学成分研究 [J]. 中草药, 2015, 46(13): 1883-1886.
[18] Liu J, Zhang J, Wang F,. New secoiridoid glycosides from the buds of[J]., 2012, 12(7): 1561-1562.
[19] Mei Y D, Li H B, Liu L X,. A new nitrogen-containing iridoid glycoside from[J]., 2021, 35(20): 3432-3438.
[20] Mei Y D, Li H B, Pang Q Q,. Lonimacranaldes A-C, three iridoids with novel skeletons from[J]., 2019, 9(38): 22011-22016.
[21] 黄丽华, 王道平, 詹尚明, 等. 黄褐毛忍冬花蕾挥发油化学成分分析 [J]. 贵州科学, 2011, 29(2): 44-47.
[22] 唐丽君, 周日宝, 刘笑蓉, 等. 超临界CO2流体萃取法与水蒸气蒸馏法提取灰毡毛忍冬中挥发油的GC-MS比较研究 [J]. 湖南中医药大学学报, 2010, 30(9): 109-113.
[23] 陈丽娜. 山银花的抗菌作用初步研究 [J]. 临床医学工程, 2009, 16(10): 46-47.
[24] 刘岚, 李荣. 山银花药用成分的提取及抑菌活性研究 [J]. 中南医学科学杂志, 2012, 40(3): 298-300.
[25] 盛卸晃, 刘文谦, 薛霞, 等. 绿原酸体外抗单纯疱疹病毒作用 [J]. 中国天然药物, 2008, 6(3): 232-234.
[26] 华桦, 鄢良春, 吴诗惠, 等. 山银花、金银花微毒测试(Microtox)与安全性研究[J]. 世界中医药, 2020, 15(2): 219-224.
[27] 张伟敏, 魏静, 胡振, 等. 灰毡毛忍冬提取纯化物抗氧化性研究 [J]. 食品科学, 2008, 29(3): 109-112.
[28] 徐望龙, 李云贵, 孙林军, 等. 山银花黄酮粗提物抗氧化活性的体外观察 [J]. 中成药, 2014, 36(6): 1292-1294.
[29] 管福琴, 刘敏, 单宇, 等. 灰毡毛忍冬中五环三萜类化合物的抗氧化活性研究 [J]. 时珍国医国药, 2013, 24(6): 1315-1317.
[30] 胡扬帆, 李胜华. 灰毡毛忍冬花挥发性有机物的抗炎作用及机理研究 [J]. 时珍国医国药, 2012, 23(12): 3031-3035.
[31] 白仲杰, 任群利, 俸婷婷, 等. 基于炎症细胞模型的灰毡毛忍冬抗炎活性研究 [J]. 现代中药研究与实践, 2015, 29(5): 35-39.
[32] Guan F Q, Wang H T, Shan Y,. Inhibition of COX-2 and PGE2 in LPS-stimulated RAW264.7 cells by lonimacranthoide VI, a chlorogenic acid ester saponin [J]., 2014, 2(5): 760-764.
[33] Wang J, Zhao X Z, Qi Q,. Macranthoside B, a hederagenin saponin extracted fromand its anti-tumor activitiesand[J]., 2009, 47(7): 1716-1721.
[34] Shan Y, Guan F Q, Zhao X Z,. Macranthoside B induces apoptosis and autophagy via reactive oxygen species accumulation in human ovarian cancer A2780 cells [J]., 2016, 68(2): 280-289.
[35] 时京珍, 宛蕾, 陈秀芬. 黄褐毛忍冬总皂甙对几种化学毒物致小鼠肝损伤的保护作用 [J]. 中药药理与临床, 1990, 6(1): 33-34.
[36] 时京珍, 刘耕陶. 黄褐毛忍冬皂甙对对乙酰氨基酚致小鼠肝脏毒性的保护作用 [J]. 药学学报, 1995, 30(4): 311-314.
[37] 时京珍, 刘耕陶. α-常春藤皂甙和无患子皂甙B对小鼠肝微粒体细胞色素P-450的作用 [J]. 中国药理学报, 1996, 17(3): 264-266.
[38] 李熠, 匡稳定, 周容容, 等. 山银花黄酮类提取物对人肝L-02细胞甘油三酯蓄积及SREBP-1c表达的影响 [J]. 中南医学科学杂志, 2015, 43(2): 145-149.
[39] Tanaka T, Nakashima T, Ueda T,. Facile discrimination of aldose enantiomers by reversed-phase HPLC [J]., 2007, 55(6): 899-901.
[40] 陈雪松, 陈迪华, 斯建勇, 等. 天师栗化学成分的研究 [J]. 药学学报, 2000, 35(3): 198-200.
[41] 李帅, 匡海学, 冈田嘉仁, 等. 鬼针草化学成分的研究(I) [J]. 中草药, 2003, 34(9): 782-785.
A new monoterpene glycoside from
WANG Tuan-wei1,2, 3, WANG Zhen-zhong2, 3, WANG Qiu-hong1, GENG Jian-liang1, 2, 3, 4
1. School of Traditional Chinese Medicine Guangdong Pharmaceutical University, Guangzhou 510006, China 2. State Key Laboratory of New-tech for Chinese Medicine Pharmaceutical Process, Kanion Pharmaceutical Co., Ltd.,Lianyungang 222001, China 3. Key Laboratory for the New Technique Research of TCM Extraction and Purification, Kanion Pharmaceutical Co., Ltd.,Lianyungang 222001, China 4. Nanjing University of Chinese Medicine, Nanjing 210023, China
To study the constituents from the dried flower buds of.The compounds were isolated and purified by column chromatography of HP-20 macroporous resin, silica gel, ODS, Sephadex LH-20, and semi-preparative RP-HPLC. Their structures were elucidated by physicochemical properties and spectral analyses. Taking NO as the evaluating indicator, the model of LPS-induced RAW264.7 cells was used to evaluate theanti-inflammatory activity of isolates.Five compounds were isolated and identified from the 70% ethanol extract of, including 8-[--arabinopyranosyl-(1′′→6′)-β--glucopyranosyl]-2,6-dimethyloct-1,2′′-lactone (1), tianshic acid (2), corchorifatty acid F (3)、tianshic acid methyl ester (4) and corchorifatty acid F methyl ester (5), respectively.Compound 1 is a new monoterpene glycoside, named comfusanoside A. Compounds 2—5 are identified fromfor the first time. All the isolates had no significant inhibitory effect on NO secretion in RAW264.7 cells stimulated by LPS.
DC.;; NO; tianshic acid; 8-[α--arabinopyranosyl-(1′′→6′)-β--glucopyranosyl]-2,6-dimethyloct-1,2′′-lactone;comfusanoside A; tianshic acid; corchorifatty acid F; tianshic acid methyl ester
R284.1
A
0253 - 2670(2022)23 - 7317 - 07
10.7501/j.issn.0253-2670.2022.23.001
2022-07-23
国家中医药管理局中央财政转移支付地方项目:基于重点研究室研究领域的中医药多学科研究能力提升项目-中药提取精制新技术
王团委,男,本科,研究方向为中药及天然药物的活性成分研究。E-mail:wtwang007@126.com
通信作者:耿剑亮,博士,研究方向为中药及天然药物活性成分研究、代谢组学研究。E-mail: gengjianliang8521@126.com
[责任编辑 王文倩]
