基于Akt/ERK/NF-κB信号通路探究松果菊苷对缺氧性肺动脉高压新生大鼠肺血管重塑的影响
2022-12-08张艺森
胡 冰,张艺森
基于Akt/ERK/NF-κB信号通路探究松果菊苷对缺氧性肺动脉高压新生大鼠肺血管重塑的影响
胡 冰,张艺森
驻马店市中心医院儿科,河南 驻马店 463000
基于蛋白激酶B(protein kinase B,Akt)/细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)/核因子-κB(nuclear factor-κB,NF-κB)通路探究松果菊苷对缺氧性肺动脉高压(hypoxic pulmonary hypertension,HPH)新生大鼠肺血管重塑的影响。按照随机数字表法将Wistar新生大鼠分为对照组、模型组、大花红景天口服液(1.78 mL/kg)组、松果菊苷(40 mg/kg)+Akt激活剂SC79(0.04 μg/kg)组和松果菊苷低、高剂量(15、40 mg/kg)组,每组12只。除对照组外,其余组大鼠缺氧15 d制备HPH模型;对照组大鼠不进行缺氧处理。从缺氧第1天至第15天,各给药组给予相应药物,检测各组大鼠在第3、7、11、15天的肺动脉压;末次给药24 h后,检测各组大鼠右心室肥大指数;采用苏木素-伊红(HE)染色检测各组大鼠肺血管形态,并计算肺小动脉中层血管壁厚度占肺小动脉外径的百分比(MT)、肺小动脉中层横截面积占总横截面积的百分比(MA);采用Masson染色检测各组大鼠肺组织纤维化;采用Western blotting检测大鼠肺组织中Akt/ERK/NF-κB信号通路相关蛋白表达。与对照组比较,模型组大鼠肺动脉压、右心室肥大指数、MT、MA、胶原纤维面积占比均显著升高(<0.05),肺组织中p-Akt、p-ERK1、p-NF-κB p65蛋白表达水平均显著升高(<0.05);与模型组比较,松果菊苷各剂量组和大花红景天口服液组以上指标均显著降低(<0.05);Akt激活剂SC79明显减弱了高剂量的松果菊苷对HPH新生大鼠肺血管重塑的保护作用(<0.05)。松果菊苷能够通过抑制Akt/ERK/NF-κB信号通路抑制HPH新生大鼠的肺血管重塑。
松果菊苷;缺氧性肺动脉高压;新生大鼠;蛋白激酶B/细胞外调节蛋白激酶/核因子-κB通路;肺血管重塑
新生儿缺氧性肺动脉高压(hypoxic pulmonary hypertension,HPH)是新生儿重症监护室中最常见的由于缺氧性疾病诱发的严重肺血管疾病,其病理变化包括肺动脉收缩反应增加和远端肺小动脉过度重塑[1]。基于上述变化,目前对于新生儿HPH的治疗采用综合策略,包括吸入一氧化氮、机械通气以改善氧合和使用诱导肺血管扩张的药物如前列腺素、内皮素受体拮抗剂和磷酸二酯酶抑制剂等[2-3]。但该治疗方案存在一定的局限性以及不良反应[4]。因此,开发新的药物来治疗新生儿HPH具有重要意义。
松果菊苷是肉苁蓉Ma的主要活性成分,具有抗氧化、抗炎、抗细胞凋亡、抗肿瘤等多种药理作用[5]。研究报道,松果菊苷能够通过调节肺动脉功能抑制HPH进展[6]。抑制蛋白激酶B(protein kinase B,Akt)/细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)/核因子-κB(nuclear factor-κB,NF-κB)信号通路可改善肺动脉高压大鼠肺血管重塑和心肺损伤[7],但松果菊苷能否通过调控Akt/ERK/NF-κB信号通路影响HPH新生大鼠的肺血管重塑尚不明确。本研究旨在探究松果菊苷对HPH新生大鼠肺血管重塑的影响以及其作用机制。
1 材料
1.1 动物
SPF级7~10日龄新生Wistar大鼠72只,雌雄各半,体质量20~30 g,购自郑州市惠济区华兴实验动物养殖场,生产许可证号SCXK(豫)2019-0002。动物饲养于驻马店市中心医院动物实验室,12 h光/12 h暗循环、温度25~27 ℃、湿度50%~70%,自由进食饮水。动物实验经驻马店市中心医院动物伦理委员会批准(批准号20-0436)。
1.2 药品与试剂
松果菊苷(批号20211208,质量分数≥98%)购自宝鸡市国康生物公司;Akt激活剂SC79(批号20220806)购自上海碧云天生物公司;大花红景天口服液(国药准字号B20070002,批号20211105)购自西藏藏药集团股份有限公司;兔源p-Akt抗体(批号ab38449)、p-ERK1抗体(批号ab131438)、p-NF-κB p65抗体(批号ab239882)、Akt抗体(批号ab8805)、ERK1抗体(批号ab109282)、NF-κB p65抗体(批号ab32536)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(批号ab9485)、HRP标记的山羊抗兔二抗(批号ab205718)均购自英国Abcam公司。
1.3 仪器
Ei生物显微镜(日本尼康公司);DYCP-31DN型电泳仪(北京六一仪器厂);BL-420型生物信号采集系统(成都泰盟软件有限公司);FA2204C型电子分析天平(上海恒勤仪器设备有限公司)。
2 方法
2.1 分组、造模及给药
按照随机数字表法将Wistar新生大鼠随机分为对照组、模型组、大花红景天口服液(1.78 mL/kg,阳性对照药物)[8]组、松果菊苷(40 mg/kg)+SC79(0.04μg/kg)[9]组和松果菊苷低、高剂量(15、40 mg/kg)[6]组,每组12只。除对照组外,其余组大鼠参照文献方法[10]制备HPH模型:在9.5%~10.5% O2、温度22~25 ℃、湿度60%~70%、昼夜比为12∶12的条件下,将Wistar新生大鼠放入常压低氧舱,每天缺氧8 h,共缺氧15 d;对照组大鼠不进行缺氧处理。从缺氧第1~15天,松果菊苷低、高剂量组ip松果菊苷,并ig等体积的生理盐水;大花红景天口服液组ig大花红景天口服液,且ip等体积的生理盐水;松果菊苷+SC79组ip松果菊苷和SC79,且ig等体积的生理盐水;对照组和模型组ip等体积的生理盐水,且ig等体积的生理盐水,1次/d。
2.2 肺动脉压的检测
第3、7、11、15天,各组大鼠ip 2%戊巴比妥钠(40 mg/kg)麻醉后,利用生物信号采集系统检测各组大鼠肺动脉压。
2.3 右心室肥大指数的检测
末次肺动脉压检测结束后,大鼠脱颈椎处死,分离心脏,去除心房后保留心室组织,沿心室沟分离右心室、左心室和隔膜,滤纸吸水后,分别称定右心室、左心室和隔膜质量,计算右心室肥大指数。
右心室肥大指数=右心室质量/(左心室质量+隔膜质量)
2.4 苏木素-伊红(HE)染色检测各组大鼠肺血管形态
取各组大鼠肺组织,于10%中性福尔马林缓冲液中固定,用石蜡包埋制成5 μm厚的切片,进行HE染色以评估各组大鼠肺血管形态变化,根据病理图像分析软件测定肺小动脉中层血管壁厚度、肺小动脉外径、肺小动脉中层横截面积和总横截面积,计算肺小动脉中层血管壁厚度占肺小动脉外径的百分比(MT)、肺小动脉中层横截面积占总横截面积的百分比(MA)。
2.5 Masson染色检测各组大鼠肺组织纤维化
取各组大鼠肺组织石蜡切片,用Weigert铁苏木素脱蜡染色,再用丽春红酸性品红染色液染色,经磷钼酸处理后再用苯胺蓝染色。切片经1%冰醋酸处理、乙醇脱水、二甲苯冲洗后,用中性树脂密封。于光学显微镜下观察每个切片中肺组织纤维化程度,并评估胶原纤维面积占比。
2.6 Western blotting检测各组大鼠肺组织中Akt/ERK/NF-κB信号通路相关蛋白表达
取各组大鼠肺组织,加入RIPA裂解液,匀浆后提取总蛋白,蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,封闭后分别加入p-Akt(1∶2000)、p-ERK1(1∶2000)、p-NF-κB p65(1∶2000)、Akt(1∶1000)、ERK1(1∶1000)、NF-κB p65(1∶1000)、GAPDH(1∶2000)抗体,4 ℃孵育过夜;加入二抗(1∶2000),室温孵育2 h;加入ECL发光试剂显影,采用Image J软件分析条带灰度值。
2.7 统计学分析
3 结果
3.1 松果菊苷对HPH大鼠肺动脉压的影响
如表1所示,第3、7、11、15天,与对照组比较,模型组大鼠肺动脉压均显著升高(<0.05);与模型组比较,松果菊苷各剂量组和大花红景天口服液组大鼠肺动脉压均显著降低(<0.05);与松果菊苷低剂量组比较,松果菊苷高剂量组和大花红景天口服液组大鼠肺动脉压均显著降低(<0.05);与松果菊苷高剂量组比较,松果菊苷+SC79组大鼠肺动脉压显著升高(<0.05)。
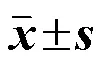
表1 松果菊苷对HPH大鼠肺动脉压的影响(, n = 12)
1 mm Hg=133 Pa 与对照组比较:*<0.05;与模型组比较:#<0.05;与松果菊苷低剂量组比较:&<0.05;与松果菊苷高剂量组比较:@<0.05,下表同
1 mm Hg = 133 Pa*< 0.05control group;#< 0.05model group;&< 0.05echinacoside low-dose group;@< 0.05echinacoside high-dose group, same as below tables
3.2 松果菊苷对HPH大鼠右心室肥大指数的影响
如表2所示,与对照组比较,模型组大鼠右心室肥大指数显著升高(<0.05);与模型组比较,松果菊苷各剂量组和大花红景天口服液组大鼠右心室肥大指数均显著降低(<0.05);松果菊苷低剂量组比较,松果菊苷高剂量组和大花红景天口服液组大鼠右心室肥大指数显著降低(<0.05);与松果菊苷高剂量组比较,松果菊苷+SC79组大鼠右心室肥大指数显著升高(<0.05)。
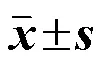
表2 松果菊苷对HPH大鼠右心室肥大指数的影响(, n = 12)
3.3 松果菊苷对HPH大鼠肺血管形态及肺血管重塑指标MT、MA的影响
如图1所示,与对照组比较,模型组大鼠肺小动脉壁明显增厚,肺小动脉管腔变窄;与模型组比较,松果菊苷各剂量组和大花红景天口服液组大鼠肺小动脉壁厚度减小,肺小动脉管腔变宽;与松果菊苷高剂量组比较,松果菊苷+SC79组大鼠肺小动脉壁增厚,肺小动脉管腔变窄。
如表3所示,与对照组比较,模型组大鼠MT、MA明显升高(<0.05);与模型组比较,松果菊苷各剂量组和大花红景天口服液组大鼠MT、MA均显著降低(<0.05);与松果菊苷低剂量组比较,松果菊苷高剂量组和大花红景天口服液组大鼠MT、MA显著降低(<0.05);与松果菊苷高剂量组比较,松果菊苷+SC79组大鼠MT、MA显著升高(<0.05)。
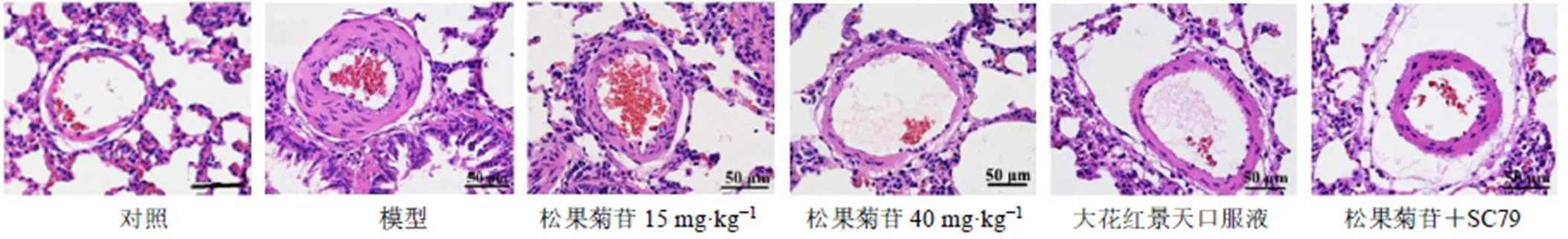
图1 松果菊苷对HPH大鼠肺血管形态的影响(HE, ×200)
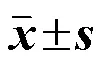
表3 松果菊苷对HPH大鼠肺血管重塑指标MT、MA的影响(, n = 6)
3.4 松果菊苷对HPH大鼠肺组织纤维化的影响
如图2和表4所示,与对照组比较,模型组大鼠肺组织中有大量胶原沉积,胶原纤维面积占比明显升高(<0.05);与模型组比较,松果菊苷各剂量组和大花红景天口服液组大鼠肺组织中胶原沉积有所改善,胶原纤维面积占比显著降低(<0.05);与松果菊苷高剂量组比较,松果菊苷+SC79组大鼠肺组织中胶原沉积增多,胶原纤维面积占比明显升高(<0.05)。

图2 松果菊苷对HPH大鼠肺组织纤维化的影响(Masson, ×400)
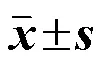
表4 松果菊苷对HPH大鼠肺组织胶原纤维面积占比的影响(, n = 6)
3.5 松果菊苷对HPH大鼠肺组织中Akt/ERK/NF-κB信号通路相关蛋白表达的影响
如图3和表5所示,与对照组比较,模型组大鼠肺组织中p-Akt/Akt、p-ERK1/ERK1和p-NF-κB p65/NF-κB p65蛋白表达水平均显著升高(<0.05);与模型组比较,松果菊苷各剂量组和大花红景天口服液组大鼠肺组织中p-Akt/Akt、p-ERK1/ERK1和p-NF-κB p65/NF-κB p65蛋白表达水平均显著降低(<0.05);与松果菊苷低剂量组比较,松果菊苷高剂量组和大花红景天口服液组大鼠肺组织中p-Akt/Akt、p-ERK1/ERK1和p-NF-κB p65/NF-κB p65蛋白表达水平显著降低(<0.05);与松果菊苷高剂量组比较,松果菊苷+SC79组大鼠肺组织中p-Akt/Akt、p-ERK1/ERK1和p-NF-κB p65/NF-κB p65蛋白表达水平显著升高(<0.05)。

图3 松果菊苷对HPH大鼠肺组织中Akt/ERK/NF-κB信号通路相关蛋白表达的影响
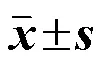
表5 松果菊苷对HPH大鼠肺组织中Akt/ERK/NF-κB信号通路相关蛋白表达的影响(, n = 6)
4 讨论
新生儿HPH是儿童的一种严重肺动脉高压类型,发病率为0.04%~0.68%[11]。在以肺血管收缩为特征的新生儿HPH的早期阶段,若对症治疗在一定程度上是有效的[12]。然而,一旦疾病进展为肺血管重塑和右心室肥大,治疗的有效性就会降低,从而导致高死亡率[13]。因此,制定有效的策略来抑制新生儿HPH肺血管重塑和右心室肥大至关重要。据报道,新生儿缺氧可导致肺血管阻力变大,最终引起肺动脉压升高[14]。本研究通过缺氧处理以诱导HPH新生大鼠模型,结果显示,与对照组比较,模型组大鼠肺动脉压升高,提示HPH大鼠模型构建成功。缺氧会升高HPH小鼠右心室肥大指数,且增加肺组织中胶原纤维的形成[15];MT、MA作为肺血管重塑的指标,在HPH新生大鼠肺组织中异常升高[16]。本研究发现,与对照组比较,模型组大鼠右心室肥大指数升高,肺组织中MT、MA及胶原纤维面积所占百分比升高,提示HPH新生大鼠肺血管重塑及肺组织纤维化严重。
研究发现,松果菊苷可抑制去甲肾上腺素诱导的大鼠肺动脉高压[17]。本研究结果与其一致,松果菊苷可降低HPH新生大鼠肺动脉压及右心室肥大指数,抑制肺血管重塑及肺组织纤维化,且呈剂量相关性,提示松果菊苷可能通过抑制肺血管重塑对HPH新生大鼠发挥保护作用。
抑制Akt通过下调依赖于ERK的NF-κB信号通路可有效改善机体的炎症反应[18]。据报道,抑制Akt/ERK/NF-κB信号通路可改善小鼠脂多糖诱导的急性肺损伤[19];抑制Akt/ERK通路可有效改善肺动脉高压大鼠的肺血管重塑[20];抑制NF-κB活化可以减轻缺氧诱导的小鼠肺动脉高压[21]。以上研究表明抑制Akt/ERK/NF-κB信号通路可发挥对肺组织的保护作用以及对肺动脉高压的抑制作用。本研究结果显示,与对照组比较,模型组大鼠肺组织中p-Akt、p-ERK1、p-NF-κB p65蛋白表达升高,表明Akt/ERK/NF-κB信号通路可能参与了HPH新生大鼠肺血管重塑过程;各剂量的松果菊苷均可降低HPH大鼠肺组织中p-Akt、p-ERK1、p-NF-κB p65蛋白表达水平,且呈剂量相关性,推测松果菊苷可能通过抑制Akt/ERK/NF-κB信号通路抑制HPH新生大鼠肺血管重塑。为了验证该推测,本研究在给予高剂量松果菊苷处理的基础上再加上Akt激活剂SC79干预HPH新生大鼠,结果显示,SC79减弱了高剂量松果菊苷对HPH新生大鼠肺血管重塑的抑制作用,证明松果菊苷通过抑制Akt/ERK/NF-κB信号通路抑制HPH新生大鼠肺血管重塑。
综上所述,松果菊苷能够通过抑制Akt/ERK/NF-κB信号通路抑制HPH新生大鼠肺血管重塑。松果菊苷可能成为临床上治疗新生儿HPH的潜在药物。
利益冲突 所有作者均声明不存在利益冲突
[1] Huang W J, Liu N, Tong X,. Sildenafil protects against pulmonary hypertension induced by hypoxia in neonatal rats via activation of PPARγ‑mediated downregulation of TRPC [J]., 2022, 49(2): 19.
[2] Lai M Y, Chu S M, Lakshminrusimha S,. Beyond the inhaled nitric oxide in persistent pulmonary hypertension of the newborn [J]., 2018, 59(1): 15-23.
[3] Wedgwood S, Steinhorn R H, Lakshminrusimha S. Optimal oxygenation and role of free radicals in PPHN [J]., 2019, 142: 97-106.
[4] Abdelkreem E, Mahmoud S M, Aboelez M O,. Nebulized magnesium sulfate for treatment of persistent pulmonary hypertension of newborn: A pilot randomized controlled trial [J]., 2021, 88(8): 771-777.
[5] Gai X Y, Wei Y H, Zhang W,. Echinacoside induces rat pulmonary artery vasorelaxation by opening the NO-cGMP-PKG-BKCa channels and reducing intracellular Ca2+levels [J]., 2015, 36(5): 587-596.
[6] Gai X Y, Lin P C, He Y F,. Echinacoside prevents hypoxic pulmonary hypertension by regulating the pulmonary artery function [J]., 2020, 144(4): 237-244.
[7] Yan G S, Wang J X, Yi T,. Erratum: “Baicalin prevents pulmonary arterial remodelingvia the AKT/ERK/NF-κB signaling pathways” [J]., 2022, 12(3): e12122.
[8] 刘洋, 罗兰, 代红燕, 等. 松果菊苷对低氧性肺动脉高压大鼠血管生长因子的影响 [J]. 中南药学, 2016, 14(3): 263-266.
[9] 李晓丹, 王强. 补肺颗粒通过调控Akt通路对慢阻肺大鼠肺组织自噬和凋亡的影响 [J]. 武汉大学学报: 医学版, 2020, 41(6): 904-910.
[10] 曹静, 罗佳媛, 吴典, 等. 血管内皮生长因子A对缺氧性肺动脉高压新生大鼠肺血管重塑的影响及其机制研究 [J]. 中国当代儿科杂志, 2021, 23(1): 103-110.
[11] Cao J, Yang L J, Wang L,. Heat shock protein 70 attenuates hypoxia‑induced apoptosis of pulmonary microvascular endothelial cells isolated from neonatal rats [J]., 2021, 24(4): 690.
[12] Distefano G, Sciacca P. Molecular physiopathogenetic mechanisms and development of new potential therapeutic strategies in persistent pulmonary hypertension of the newborn [J]., 2015, 41: 6.
[13] Hudalla H, Michael Z, Christodoulou N,. Carbonic anhydrase inhibition ameliorates inflammation and experimental pulmonary hypertension [J]., 2019, 61(4): 512-524.
[14] 吴晓宁, 许桂凤. 多巴胺联合西地那非治疗新生儿肺动脉高压的临床研究 [J]. 现代药物与临床, 2015, 30(5): 572-575.
[15] 刘坤珍, 王乐, 李明霞. 热休克蛋白70对缺氧性肺动脉高压新生大鼠肺血管重塑的作用研究 [J]. 中国当代儿科杂志, 2016, 18(2): 152-158.
[16] Ni Y J, Deng J, Liu X,. Echinacoside reverses myocardial remodeling and improves heart function via regulating SIRT1/FOXO3a/MnSOD axis in HF rats induced by isoproterenol [J]., 2021, 25(1): 203-216.
[17] Santos L A M D, Rodrigues G B, Mota F V B,. New thiazolidinedione LPSF/GQ-2 inhibits NF-κB and MAPK activation in LPS-induced acute lung inflammation [J]., 2018, 57: 91-101.
[18] Jiang K F, Guo S, Yang C,. Barbaloin protects against lipopolysaccharide (LPS)-induced acute lung injury by inhibiting the ROS-mediated PI3K/AKT/NF-κB pathway [J]., 2018, 64: 140-150.
[19] Lee H C, Liu F C, Tsai C N,. Esculetin ameliorates lipopolysaccharide-induced acute lung injury in mice via modulation of the AKT/ERK/NF-κB and RORγt/IL-17 pathways [J]., 2020, 43(3): 962-974.
[20] Cheng C C, Chi P L, Shen M C,. Caffeic acid phenethyl ester rescues pulmonary arterial hypertension through the inhibition of AKT/ERK-dependent PDGF/HIF-1αand[J]., 2019, 20(6): E1468.
[21] Chen M X, Ding Z Y, Zhang F Y,. A20 attenuates hypoxia-induced pulmonary arterial hypertension by inhibiting NF-κB activation and pulmonary artery smooth muscle cell proliferation [J]., 2020, 390(2): 111982-111991.
Effect of echinacoside on pulmonary vascular remodeling in neonatal rats with hypoxic pulmonary hypertension based on Akt/ERK/NF-κB signaling pathway
HU Bing, ZHANG Yi-sen
Department of Pediatrics, Zhumadian Central Hospital, Zhumadian 463000, China
To investigate the effect of echinacoside on pulmonary vascular remodeling of neonatal rats with hypoxic pulmonary hypertension (HPH) based on protein kinase B (Akt)/extracellular regulated protein kinase (ERK)/nuclear factor-κB (NF-κB) pathway.Wistar neonatal rats were randomly divided into control group, model group, Rhodiola Oral Liquid (大花红景天口服液, 1.78 mL/kg) group, echinacoside (40 mg/kg) + Akt activator SC79 (0.04 μg/kg) group and echinacoside low- and high-dose (15, 40 mg/kg) groups, with 12 rats in each group. Except the control group, rats in other groups were hypoxic for 15 d to prepare HPH model; Rats in control group were not treated with hypoxia. From 1st day to 15th day of hypoxia, corresponding drugs were given to each administration group, and pulmonary artery pressure of rats in each group was detected on 3rd, 7th, 11th and 15th day. 24 h after the last administration, right ventricular hypertrophy index of rats in each group was detected. Hematoxylin-eosin (HE) staining was used to detect the pulmonary vascular morphology of rats in each group, and percentage of thickness of pulmonary arterioles’ middle vascular wall to the outer diameter of pulmonary arterioles (MT) and percentage of pulmonary arterioles’ middle cross-sectional area to the total cross-sectional area (MA) were calculated. Masson staining was used to detect pulmonary fibrosis of rats in each group. The expressions of Akt/ERK/NF-κB signaling pathway related proteins in lung tissue of rats were detected by Western blotting.Compared with control group, pulmonary artery pressure, right ventricular hypertrophy index, MT, MA and percentage of collagen fiber area in model group were significantly increased (< 0.05), p-Akt, p-ERK1 and p-NF-κB p65 protein expressions in lung tissue were significantly increased (< 0.05). Compared with model group, the above indexes in each dose group of echinacoside and Rhodiola Oral Liquid group were significantly decreased (< 0.05). Akt activator SC79 obviously weakened the protective effect of high-dose echinacoside on pulmonary vascular remodeling in neonatal rats with HPH (< 0.05).Echinacoside can inhibit pulmonary vascular remodeling in neonatal rats with HPH by inhibiting Akt/ERK/NF-κB signaling pathway.
echinacoside; hypoxic pulmonary hypertension; neonatal rats; protein kinase B/extracellular regulated protein kinase/ nuclear factor-κB pathway; pulmonary vascular remodeling
R285.5
A
0253 - 2670(2022)23 - 7449 - 06
10.7501/j.issn.0253-2670.2022.23.015
2022-08-12
胡 冰(1981—),女,主治医师,主要从事儿科临床基础研究。Tel: 13839937509
[责任编辑 李亚楠]
