龙眼多糖化学结构、构效关系与药理活性研究进展
2022-12-08沈玉彬郝二伟杜正彩侯小涛梁玲玲邓家刚
沈玉彬,郝二伟,杜正彩,侯小涛, 5,梁玲玲,邓家刚*
龙眼多糖化学结构、构效关系与药理活性研究进展
沈玉彬1, 2, 3, 4,郝二伟1, 2, 3, 4,杜正彩1, 2, 3, 4,侯小涛1, 2, 3, 4, 5,梁玲玲1, 2, 3, 4,邓家刚1, 2, 3, 4*
1. 广西中医药大学,广西 南宁 530200 2. 广西中药药效研究重点实验室,广西 南宁 530200 3. 广西中医湿病方药理论与转化重点实验室,广西 南宁 530200 4. 广西农作物废弃物功能成分研究协同创新中心,广西 南宁 530200 5. 广西中医药大学药学院,广西 南宁 530200
龙眼为药食同源中药,具有补益心脾、养血安神的功效,其富含的多糖是主要活性成分之一。通过查阅国内外文献,总结龙眼多糖及其衍生物的化学结构,发现龙眼多糖具有免疫调节、抗炎、抗氧化、抗疲劳、抗肿瘤、减轻局灶性脑缺血/再灌注损伤等多种药理活性,且龙眼多糖的化学结构与药理活性关系密切,多糖相对分子质量愈大其免疫活性愈强,化学修饰乙酰化、羧甲基化、硫酸化、磷酸酯化、碱解离可增强其药理活性,而甲基化则可降低龙眼多糖药理活性。综述龙眼多糖的化学结构、构效关系与药理活性研究进展,以期为龙眼深层次开发和利用提供理论依据。
龙眼多糖;化学结构;构效关系;免疫调节;抗炎;抗氧化;抗疲劳;抗肿瘤;缺血/再灌注
无患子科植物龙眼Lour. 原产于粤,后传至闽桂,至宋时福建和两广地区都成为了龙眼的主产区,现我国的西南部至东南部种植广泛[1]。龙眼肉味甘,性温,归心、脾经,能补益心脾、养血安神[2]。《神农本草经》言其“主安志,厌食,久服强魂,聪明轻身不老,通神明”。研究表明龙眼富含多糖类成分,并且龙眼多糖具有免疫调节、抗炎、抗氧化、抗疲劳、抗肿瘤、抗脑缺血/再灌注损伤等多种药理活性。目前以龙眼为主要原料的药品、保健产品的研究开发较少,加深龙眼的化学结构、构效关系及药理活性研究有利于对龙眼进行深加工并进一步提高龙眼的价值[3-4]。本文主要对近年来龙眼多糖化学结构、构效关系及药理活性的研究进展进行综述,以期为龙眼多糖的深入研究及相关产品的开发应用提供参考依据。
1 化学结构
多糖由10个以上的单糖分子通过苷键聚合而成,相对分子质量较大,一般由几百个至几百万个单糖分子组成。龙眼多糖化学结构复杂,可参考蛋白质结构理论分为一级结构、二级结构和三级结构。一级结构包括相对分子质量、单糖组成、单糖残基、糖残基连接顺序和方式、异头物构型、糖残基绝对构型、吡喃环或呋喃环形式、支链连接形式等[5]。目前对龙眼多糖一级结构的研究较多,揭示了龙眼多糖的相对分子质量、构型、单糖组成、糖苷键类型等特征,如表1所示。
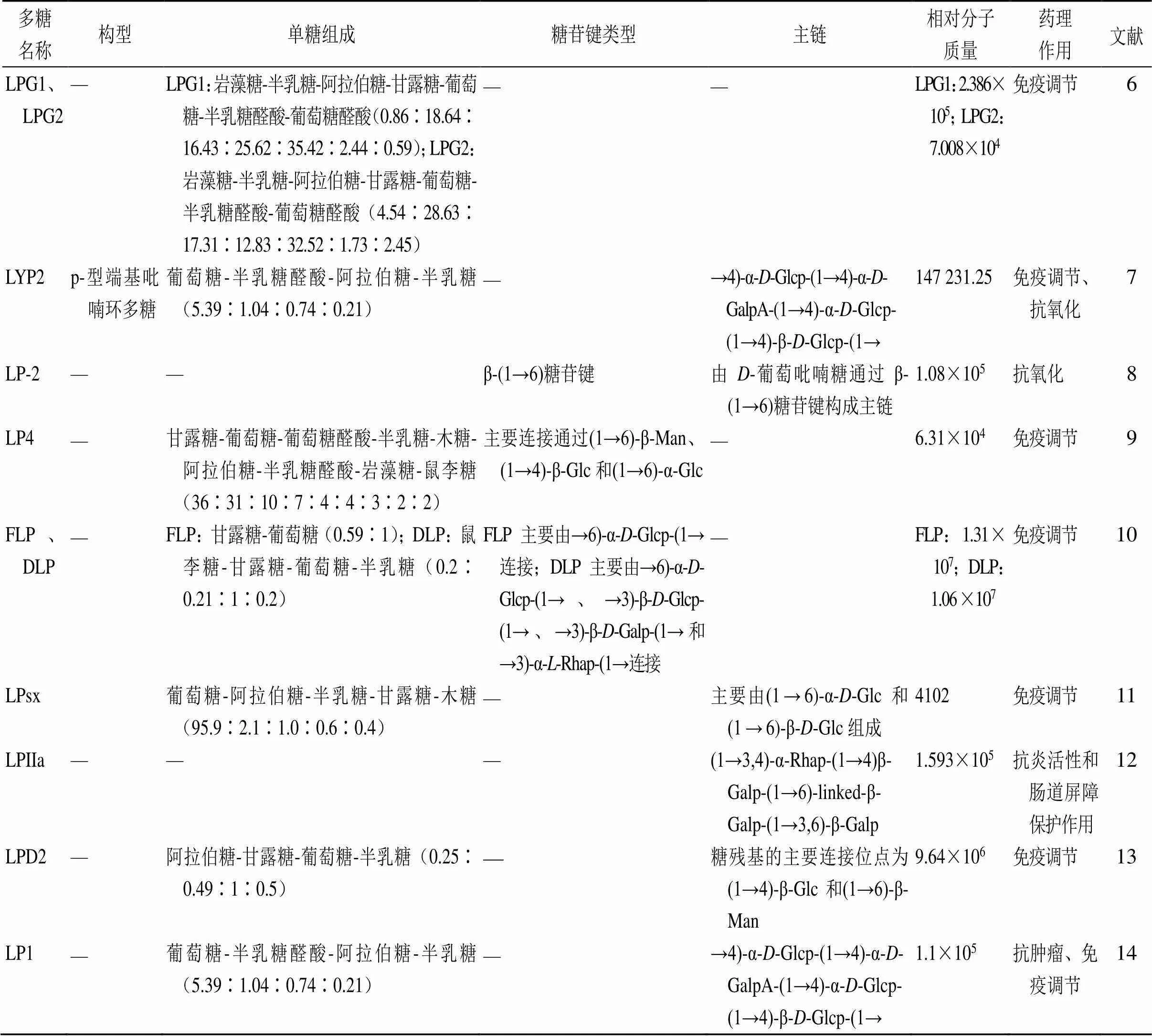
表1 龙眼多糖的结构特征

续表1
Glcp-葡萄吡喃糖 Glc-葡萄糖 Ara-阿拉伯糖 Gal-半乳糖 Xyl-木糖 GalA-半乳糖醛酸 Man-甘露糖 GalpA-半乳糖吡喃糖醛酸 Galp-半乳吡喃糖 Rhap-鼠李吡喃糖 Araf-阿拉伯呋喃糖
Glcp-glucopyranose Glc-glucose Ara-arabinose Gal-galactose Xyl-xylose GalA-galacturonic acid Man-mannose GalpA-galactopyranosyluronic acid Galp-galactopyranose Rhap-rhamnopyranose Araf-arabinofuranose
龙眼多糖根据单糖组成可分2类:一类为1种单糖组成。Zhu等[18]从龙眼肉中提取得到了一种结构为(1→6)-α--葡聚糖的水溶性纯多糖LPS1,核磁共振光谱(nuclear magnetic resonance,NMR)表明,葡萄糖残基中的异聚碳的构型为α型,相对分子质量为1.08×105,有661个葡萄糖残基。Yang等[19]从龙眼肉的水溶性粗多糖中分离出的酸性多糖LPS-A2仅含有鼠李糖。此外,龙眼壳中也可提取出1种单糖组成的多糖,秦洁华[20]采用红外光谱法(infrared spectroscopy,IR)发现所得龙眼壳多糖为α--型端基吡喃葡萄糖,完全酸水解后的龙眼壳多糖的单糖成分为葡萄糖。另一类龙眼多糖为多种单糖和糖醛酸组成的杂多糖[21-22]。
新技术的发展及广泛应用实现了多糖提取率的大幅增加,但提取技术也对多糖的一级结构产生影响。超声波用于龙眼多糖的浸提可以提高其提取率,但经超声处理后龙眼多糖高相对分子质量级分降解,相对分子质量分布发生明显变化,其逐渐减小的黏度也印证了这一点,而不同功率的影响差异不明显;此外,超声处理还能解离干制龙眼肉多糖中大部分型糖苷键以及新鲜龙眼肉多糖高相对分子质量级分中非型糖苷键结合的蛋白[23]。采用超细粉碎辅助酶处理提取的龙眼多糖(LP-SE)与热水浸提(LP-H)、超细粉碎(LP-S)提取所得的龙眼多糖相比,产率、糖含量、溶解度、阿拉伯糖和甘露糖百分比增加,而表观黏度、粒径、相对分子质量和葡萄糖百分比下降,3种龙眼多糖均含有→3)-α--Araf-(1→、→3,6)-β--Galp-(1→和α--Rhap(1→;LP-H含有→4)-β--Glcp(l→,LP-S含有→4)-β--Galp-(1→,LP-SE含有→5)-α--Araf-(1→[24]。龙眼多糖有螺旋、网状、球状、六面体等多种高级结构,不同提取方法所得龙眼多糖的高级结构存在差异。通过红外扫描、超高效聚合物色谱仪、Zeta粒径电位分析仪、电镜扫描、刚果红反应对LP-SE、LP-H、LP-S结构进行测定,发现3种龙眼多糖均为α、β-构型的酸性吡喃杂多糖,LP-SE相对分子质量与粒径较小,微观结构呈现清晰的网状结构,而LP-S与LP-SE微观形貌中,网状结构显著被破坏,3种龙眼多糖中螺旋结构的含量依次为LP>LP-S>LP-SE[25]。戎瑜[6]采用凝胶色谱激光光散射、IR、离子色谱、NMR等手段对纯化获得的2个龙眼多糖组分(LPG1、LPG2)的结构进行了表征,发现LPG1是旋转半径为47.5 nm的α构型近球状多糖,LPG2是旋转半径为6.3 nm的β构型近六面体状多糖。
王婷[26]采用傅里叶变换红外光谱、原子力显微镜和流变仪研究干制后龙眼果肉蛋白/多糖复合物LDPPC的结构表征及流变学特性,对比龙眼果肉干制前组分,LDPPC的α-螺旋、β-转角以及无规则卷曲结构发生了向β-折叠的转变,维持蛋白质二级结构构象的氢键在加热过程遭到破坏,活性位点暴露从而增强了其抗氧化活性。
2 龙眼多糖构效关系
2.1 相对分子质量与药理活性的关系
龙眼多糖的相对分子质量分布宽,而相对分子质量是影响多糖药理活性的重要因素之一[27-29]。研究发现,龙眼多糖相对分子质量愈大,抗原性愈强,激活小鼠免疫活性愈强[7]。龙眼多糖体外免疫调节活性评价发现,超声处理可降解高相对分子质量龙眼多糖,减弱龙眼多糖对脾淋巴细胞增殖、巨噬细胞吞噬和一氧化氮(nitric oxide,NO)生成的刺激活性,但对刀豆蛋白A(concanavalin A,Con A)诱导淋巴细胞增殖的刺激活性显著增强[23]。热水浸提法、超微粉碎辅助法和超微粉碎纤维素酶辅助法3种方法制得的龙眼多糖(LP、LP-S、LP-SE),LP-SE与LP和LP-S相比,具有相对分子质量小、糖醛酸含量低、鼠李糖和阿拉伯糖含量高、低黏度和高溶解性的特性,对比LP、LP-S,LP-SE对巨噬细胞分泌NO、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-6(interleukin- 6,IL-6)、白细胞介素-1β(interleukin-1β,IL-1β)的免疫刺激活性最强,且呈剂量相关性[25]。
2.2 化学修饰与药理活性的关系
2.2.1 乙酰化、羧甲基化 研究发现乙酰基和羧甲基的引入有利于提高龙眼多糖(LYP2)的抗氧化活性,乙酰化龙眼肉多糖(Ac-LYP2)和羧甲基化龙眼多糖(CM-LYP2)的抗氧化能力强于维生素C;同时LYP2、Ac-LYP2和CM-LYP2能够不同程度地增强免疫抑制小鼠的特异性免疫功能和非特异性免疫功能,调节辅助性T细胞1(T helper cell 1,Th1)/ Th2平衡紊乱,乙酰化和羧甲化提高了龙眼多糖的免疫调节活性;LYP2、Ac-LYP2和CM-LYP2在体外不仅能协同脂多糖(lipopolysaccharide,LPS)或Con A促进小鼠脾淋巴细胞增殖,而且能活化巨噬细胞,促其释放免疫活性分子NO和IL-1β、TNF-α、IL-12 p40,增强其吞噬中性红的能力[30],CM-LYP2比LYP2显示更好的免疫调节作用[31]。
2.2.2 硫酸化 Jiang等[32]制备的龙眼多糖硫酸化衍生物(LP1-S),其体外活性初步试验表明,LP1-S能刺激小鼠淋巴细胞增殖,增加小鼠巨噬细胞吞饮活性,并促使巨噬细胞产生NO、IL-6、IL-1β和TNF-α,且LP1-S对人鼻咽癌HONE1细胞的抗增殖活性高于未硫酸化龙眼多糖。
2.2.3 磷酸酯化 宁苑灵[7]研究表明,磷酸酯化龙眼多糖在环磷酰胺致免疫低下小鼠模型中显示出强于未修饰前龙眼多糖和香菇多糖的巨噬细胞吞噬能力,促进T、B淋巴细胞增殖及抗氧化能力,通过刺激Toll样受体(Toll-like receptor,TLR)-核转录因子-κB(nuclear factor kappa-B,NF-κB)的髓样分化因子88(MyD88)依赖性途径,活化NF-κB介导的体液免疫和细胞免疫,从而具有调节小鼠免疫的活性作用,但不能激活非MyD88依赖性途径中NF-κB介导的免疫作用。
2.2.4 碱解离 龙眼多糖的活性与其空间构象相关,Yi等[33]研究发现碱解离使龙眼多糖(LPI)由致密的球状构象转变为微解离的球状构象(LPI1)或单螺旋链(LPI2),与LPI相比,LPI1和LPI2可显著增强脾细胞增殖和自然杀伤细胞(natural killer cell,NK)杀伤活性(<0.05),LPI、LPI1和LPI2在100或200 μg/mL时均能显著增强巨噬细胞吞噬功能。
2.2.5 甲基化 Yang等[34]研究表明,甲基化会导致龙眼多糖(PLFP)的1,1-二苯基-2-三硝基苯肼(DPPH)清除活性降低,而PLFP的超氧阴离子自由基清除活性随着甲基化程度的增加而降低。
2.3 其他
相对分子质量较小的LP-SE对植物乳杆菌、保加利亚乳杆菌、发酵乳杆菌和肠系膜明串珠菌的增殖的刺激作用强于LP-H和LP-S[35]。研究发现,氨基酸参与美拉德反应修饰的龙眼多糖,与修饰前的龙眼多糖比较,修饰的龙眼多糖具有更强的自由基清除能力和巨噬细胞免疫刺激作用,但癌细胞生长抑制能力较弱[36]。
3 龙眼多糖的药理活性
3.1 免疫调节活性
3.1.1 提取分离纯化方法对免疫调节活性的影响 不同提取方法获得的龙眼多糖免疫调节活性存在差异,刘慧君等[37]研究热水浸提法、超微粉碎辅助法和超微粉碎纤维素酶辅助法制得的龙眼多糖(LP、LP-S、LP-SE),LP-SE与LP、LP-S比较,相对分子质量小、糖醛酸含量低、鼠李糖和阿拉伯糖含量高、黏度低和溶解性高,激活巨噬细胞分泌NO、TNF-α、IL-6、IL-1β的能力显著升高。易阳等[38]研究发现龙眼多糖LPII在木瓜蛋白酶、链酶蛋白酶和胰蛋白酶的作用下发生降解后对Con A诱导的脾淋巴细胞增殖的刺激作用显著降低,但对LPS诱导的脾淋巴细胞增殖和巨噬细胞吞噬的刺激作用却显著增强,而闵婷等[23]研究发现超声可通过降解龙眼多糖减弱其(50.4 mg/mL)对脾淋巴细胞增殖、巨噬细胞吞噬和NO生成的刺激活性。Huang等[39]研究了未发酵和发酵龙眼多糖(分别记为LP和LP-F)的免疫调节作用的差异,发现相对分子质量较低的LP-F与LP相比,对巨噬细胞分泌NO和IL-6的刺激作用更强。水提取得到的龙眼多糖通过DEAE(dicthylaminoethyl)-52纤维素色谱柱得到的4个组分(LPI~LPIV)除LPI外,其他3种组分在100~400 μg/mL显著刺激淋巴细胞增殖;此外,它们对LPS诱导的细胞增殖的刺激作用和对Con A诱导的细胞增殖的抑制作用强弱顺序为LPIII>LPIV>LPII>LPI[40]。
3.1.2 龙眼肉处理方法对免疫调节活性的影响 鲜龙眼肉和干制龙眼肉的多糖免疫调节活性存在差异。新鲜和干制龙眼肉的多糖(LPX3、LPG2)均能促进小鼠肠系膜淋巴结细胞和巨噬细胞增殖,促进巨噬细胞吞噬和NO分泌,但LPG2诱导巨噬细胞IL-6、TNF-α分泌量高于LPX3[41]。王诗琪等[42]研究发现新鲜及热风、真空、红外和冷冻干制的龙眼果肉中分别提取制备的粗多糖中,热风制龙眼果肉的粗多糖刺激巨噬细胞NO和TNF-α生成的能力更强。蓝海波[43]研究发现相对于鲜龙眼多糖,干制龙眼多糖具有较强的调节巨噬细胞和脾淋巴细胞的活性,后续研究发现干龙眼中相对分子质量较小的葡聚糖组分比相对分子质量较大的葡聚糖组分表现出更强的巨噬细胞吞噬活性[44]。Gan等[10]比较新鲜龙眼和热风干燥龙眼中性多糖(FLP、DLP)的结构和免疫调节活性,发现FLP和DLP均显著增强淋巴细胞增殖、吞噬功能以及巨噬细胞产生NO、IL-1β和IL-6的作用,但干燥过程增加了龙眼多糖的支链,显著增强DLP调节淋巴细胞增殖和巨噬细胞活化的能力。
3.1.3 龙眼多糖免疫调节机制 碱提龙眼多糖LGP50S-1能通过激活NF-κB和丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路促进小鼠脾淋巴细胞增殖、IL-2分泌和迟发型超敏反应强度而增强小鼠特异性免疫功能[45]。龙眼多糖(LPIIa)可增强巨噬细胞吞噬活性和NO生成,并增加巨噬细胞诱导型一氧化氮合酶活性及TNF-α、IL-6分泌,但TLR4或TLR2被阻断后则明显减弱;同时,p38 MAPK、蛋白激酶C、磷脂肌醇-3-激酶(phosphatidylinositol-3-kinase,PI3K)、蛋白酪氨酸激酶(protein tyrosine kinase,PTK)和NF-κB的特异性抑制剂可选择性地抑制LPIIa对巨噬细胞的免疫刺激活性,表明LPIIa通过TLR4和TLR2介导p38 MAPK和NF-κB信号通路刺激巨噬细胞活化[46]。此外,研究证明龙眼多糖还可通过TLR2和TLR4介导的PI3K/蛋白激酶B(protein kinase B,Akt)、MyD88/肿瘤坏死因子受体相关因子6(tumor necrosis factor receptor-associated factor 6,TRAF6)和MyD88/IL-1受体相关激酶-4(IL-1 receptor-associated kinase-4,IRAK-4)-TRAF6途径诱导巨噬细胞活化[9,13]。研究发现干制龙眼多糖(LPG2)和新鲜龙眼多糖(LPX3)均具有激活巨噬细胞和促进肠系膜淋巴结细胞增殖的活性,且LPG2具有更强的促进巨噬细胞增殖和TNF-α、IL-6分泌的活性,LPG2主要通TLR4和TLR2介导的MyD88-NF-κB信号通路激活巨噬细胞,但anti-TLR4抑制剂和anti-TLR2单克隆抗体联合作用不能完全抑制LPG2引起的巨噬细胞TNF-α的分泌,说明除TLR4和TLR2外,可能还存在其他的受体介导了LPG2对巨噬细胞的激活[47],后续研究发现LPG2可通过调节TLR4和核苷酸结合寡聚化结构域蛋白2(nucleotide binding oligomerization domain 2,NOD2)受体相关信号通路介导巨噬细胞的激活,且LPG2酶解多糖上调TLR4和NOD2通路中信号传导蛋白和转录激活物、NF-κB、p38 MAPK的磷酸化水平的能力较LPG2强,表现出显著的激活巨噬细胞的活性[6]。除通过TLR4、TLR2和NOD2介导外,Lan等[11]研究表明,龙眼多糖LPsx还可通过Ca2+和补体受体3(complement receptor 3,CR3)介导的MAPKs及PI3K/Akt途径诱导巨噬细胞活化,并促进NO、IL-1β、IL-6和TNF-α的产生。
龙眼多糖还可通过改变肠道菌群以及肠道代谢产物而增强宿主应激条件下的免疫功能[48]。Bai等[49]研究发现龙眼多糖可升高环磷酰胺小鼠的胸腺指数、脾脏指数,通过转化生长因子-βRII与免疫球蛋白A(immunoglobulin A,IgA)类开关重组途径增加肠道细胞因子的表达,增强黏膜寻址蛋白细胞黏附分子-1和整合素α4β7的蛋白表达以升高血清IgA水平,增加聚合物免疫球蛋白受体和分泌成分以加强分泌型免疫球蛋白A的分泌。
3.1.4 龙眼多糖蛋白复合物的免疫调节活性 研究发现去除蛋白龙眼多糖和未除蛋白龙眼多糖体内外均有一定的免疫调节作用[8]。Yi等[50]研究发现龙眼多糖蛋白复合物对免疫抑制模型小鼠具有免疫调节功能,能显著增强鸡红细胞、Con A诱导的脾细胞增殖,巨噬细胞吞噬,NK细胞对YAC-1淋巴瘤细胞的杀伤作用,以及血清中γ干扰素和IL-2的分泌。体外实验发现龙眼多糖蛋白复合物有对脾细胞、NK细胞和巨噬细胞的免疫调节活性[51],干制龙眼肉多糖-蛋白络合物在50~400 μg/mL剂量内对脾淋巴细胞增殖和巨噬细胞吞噬的增强作用明显强于新鲜龙眼肉多糖-蛋白络合物[52]。
3.2 抗炎活性
向蓉等[53]研究发现丁酸梭菌-龙眼多糖发酵液对右旋葡聚糖硫酸钠诱导的小鼠溃疡性结肠炎具有一定的防治作用,其作用机制可能与降低促炎因子IL-6和TNF-α含量、提升抗炎因子IL-10含量有关。Bai等[12]用LPS处理的Caco-2细胞和RAW264.7巨噬细胞共培养模型研究龙眼多糖LPIIa的抗炎活性和肠道屏障保护作用,LPIIa可抑制LPS诱导的RAW264.7巨噬细胞中TNF-α、IL-6、NO和前列腺素E2炎症因子的产生,并抑制诱导型一氧化氮合酶和环氧合酶-2基因的表达。此外,LPIIa减弱了Caco-2细胞中肠紧密连接通道蛋白Claudin-2的表达,增加了紧密连接蛋白-1(zonula occluden-1,ZO-1)的表达。
3.3 抗氧化活性
龙眼多糖具有清除多种自由基的能力,体外对不同自由基的作用强弱依次是2,2′-联氮-双-(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS+)>DPPH>OH[15]。龙眼多糖对DPPH和OH有较强的清除能力,而对超氧阴离子的清除效果不明显;其中,龙眼多糖质量分数越高,清除DPPH活性也越强,杂蛋白可抑制清除OH、超氧阴离子活性,而糖蛋白中的蛋白质则起到促进作用[54]。龙眼多糖(LP-2)对OH的清除效果劣于相同浓度的阳性对照硫脲[8]。
不同多糖制备方法及龙眼肉制备方法可影响龙眼多糖的抗氧化活性。酶法提取龙眼多糖(EELP)和微波前处理超声波提取龙眼多糖(MUELP)均具有良好的清除OH、DPPH和ABTS自由基活性,但对超氧阴离子自由基清除较弱,且MUELP比EELP具有更强的抗氧化活性[55]。体内实验表明,超声波提取的龙眼多糖对S180肿瘤小鼠模型的OH和DPPH表现出良好的清除活性[56]。新鲜及热风、真空、红外和冷冻干制的龙眼果肉中分别提取制备的粗多糖中,冷冻干制龙眼多糖具有较强的DPPH和OH清除能力[43]。龙眼多糖的DPPH清除能力在龙眼高温热泵干制过程中呈下降的趋势[57]。
龙眼多糖复合物也具有抗氧化活性。王婷[26]研究发现鲜龙眼蛋白/多糖粗提物(LFC)和干龙眼果肉蛋白/多糖粗提物(LDC)体外抗氧化活性均低于维生素C,但LDC具有明显的还原Fe3+能力、总还原力和ABTS+清除能力,且与其浓度呈现明显的正相关;而LFC仅存在一定的ABTS+清除能力,且低于LDC,几乎没有还原Fe3+和总还原能力。龙眼多糖(LPI)和赖氨酸的共价结合产物(LPI-Lys)体外活性评价表明LPI和LPI-Lys均能有效清除DPPH和OH自由基,但同一浓度下,LPI-Lys对DPPH和OH 2种自由基的清除率明显高于LPI[58]。龙眼多糖稳定的金纳米颗粒对宫颈癌HeLa细胞具有可忽略的细胞毒性,并显示出良好的抗氧化活性[59]。
3.4 抗疲劳作用
周嘉华等[60]研究发现龙眼多糖能显著提高雄性昆明小鼠肝组织匀浆中超氧化物歧化酶(superoxide dismutase,SOD)、一氧化氮合酶活性,降低丙二醛(malondialdehyde,MDA)含量,清除氧自由基,达到抗疲劳的作用。聂英涛等[61]研究龙眼多糖抗运动性疲劳的作用及其抗氧化活性机制,发现龙眼多糖能明显延长小鼠负重游泳时间,减少小鼠尿素氮的产生以及乳酸和MDA含量,增强乳酸脱氢酶和SOD的活性,对OH有较强的清除作用。Zheng等[62]研究龙眼多糖对小鼠的抗疲劳作用,发现50~100 mg/kg剂量的龙眼多糖可延长小鼠游泳时间,增加肝糖原,降低血尿素氮、血乳酸水平。
3.5 抗肿瘤作用
龙眼果肉干燥12~24 h后其多糖对胃癌SGC7901和肝癌HepG2细胞的生长抑制、TNF-α的生成综合能力得到明显增强,但干燥60 h后其活性呈现减弱趋势[58]。Wang等[63]研究发现相对分子质量为5.7×104的水溶性龙眼多糖(WLSP)能引起肺癌A549细胞周期G1期阻滞、半胱氨酸天冬氨酸蛋白酶(cysteine aspartic protease,Caspase)-3和9的活化以及多聚二磷酸腺苷(adenosine diphosphate,ADP)核糖聚合酶的裂解,且体内实验结果表明,WLSP能够抑制A549移植瘤的生长并诱导细胞凋亡。Meng等[14]体外实验表明水溶性龙眼多糖1(LP1)对卵巢癌SKOV3和HO8910细胞具有显著的抑制作用,抑制率分别为40%和50%。Yi等[64]从龙眼粗多糖(LP3)中分离出4个组分(LPI~IV),质量浓度50~400 μg/mL时,LP3、LPI、LPII和LPIII对A549、HeLa和HepG2细胞均表现出直接的抑制作用,且呈剂量正相关性;LPIII的活性尤其是对HepG2细胞的增殖抑制作用强于其他几种多糖。Zhu等[18]提取纯化得到的龙眼多糖对HepG2细胞的生长具有一定的抗癌活性,但对乳腺癌MCF-7细胞没有细胞毒性。
3.6 抗脑缺血/再灌注损伤
研究发现龙眼多糖能明显降低脑缺血/再灌注损伤大鼠的神经功能评分、脑含水量、脑梗死体积、髓过氧化物酶(myeloperoxidase,MPO)活性及TNF-α、IL-1β水平和Bax表达,增加SOD、谷胱甘肽(glutathione,GSH)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活性和B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)表达,表明龙眼多糖具有抗脑缺血/再灌注损伤作用,其机制可能与降低MPO、TNF-α和IL-1β介导的炎症反应和减少氧化应激有关[65-66]。
3.7 其他作用
人体内过多的自由基会干扰机体正常代谢并加速衰老,机体内的抗氧化酶过氧化氢酶(catalase,CAT)、SOD、GSH-Px可对抗活性氧[67-69]。龙眼多糖(LGP50)在剂量为100和200 mg/kg时可显著提高-Gal诱导的衰老模型小鼠血清、肝、脑组织中CAT、SOD、GSH-Px的含量,降低MDA的含量,说明LGP50具有抗衰老作用[45]。龙眼多糖还可通过增加黏液蛋白2、ZO-1、Claudin-1、Claudin-4和钙黏蛋白E-cadherin在环磷酰胺小鼠中的表达来预防肠黏膜损伤[70]。此外,龙眼多糖可有效促进软骨细胞生长,增强软骨细胞外基质的分泌和合成,效果与转化生长因子-β接近[71]。龙眼多糖在体外抗糖基化活性测定中显示出良好的抑制糖基化反应的潜力[17]。
4 结语
龙眼作为一种常见水果及药食同源中药,有着极大的开发潜力,目前研究的龙眼多糖多来源于龙眼果肉,而对龙眼皮、龙眼核等农作物废弃物的研究较少,重视对龙眼皮、龙眼核的开发研究或许会有新发现。龙眼多糖的化学结构复杂,目前龙眼多糖化学结构的研究多停留于单糖组成及相对分子质量层面,深入研究龙眼多糖的主链、空间结构的报道少,且龙眼多糖的品种来源、提取、分离纯化方法各异,不同的提取分离纯化方法都会对龙眼多糖的一级结构及高级结构造成影响,进而影响其药理活性。此外,通过化学修饰如乙酰化、羧甲基化、硫酸化、磷酸酯化等也可改变龙眼多糖的药理活性。龙眼多糖药理活性的研究报道多集中在免疫调节、抗炎、抗氧化、抗疲劳、抗肿瘤、抗脑缺血/再灌注损伤等,其中对龙眼多糖免疫调节活性的研究表明其发挥免疫调节活性的作用机制是多途径、多靶点的。《本经》言龙眼“主安志,厌食,久服强魂,聪明轻身不老,通神明”。但目前少见龙眼及龙眼多糖治疗失眠及抗疲劳的研究报道,针对当下的生活方式,可进行龙眼多糖治疗失眠及抗疲劳的研究。深入研究龙眼多糖组成、构效关系、药理活性,有利于对龙眼的深加工研究并进一步提高龙眼的价值。
利益冲突 所有作者均声明不存在利益冲突
[1] 胡家虎, 李国平, 包朗. 龙眼肉的本草考证 [J]. 中国野生植物资源, 2021, 40(6): 73-77.
[2] 陈蔚文. 中药学 [M]. 第2版. 北京: 人民卫生出版社, 2012: 398.
[3] 郝娟, 董丽红, 池建伟, 等. 龙眼的健康功效及其健康食品开发的进展 [J]. 现代食品科技, 2021, 37(8): 340-349.
[4] 张宏康, 李蔼琪, 林小可, 等. 龙眼加工研究现状及展望 [J]. 轻工科技, 2017, 33(1): 1-4.
[5] 谢明勇, 聂少平. 天然产物多糖结构和功能研究: 基于大粒车前子多糖和黑灵芝多糖的深入解析 [M]. 北京: 科学出版社, 2014: 1-34.
[6] 戎瑜. 龙眼多糖激活巨噬细胞的作用与机制研究 [D]. 海口: 海南大学, 2019.
[7] 宁苑灵. 磷酸酯化和不同分子量片断龙眼肉多糖的制备及其免疫调节作用和抗氧化作用的研究 [D]. 南宁: 广西医科大学, 2013.
[8] 阳佛送. 龙眼多糖的提取、纯化、结构和抗氧化活性研究 [D]. 南宁: 广西医科大学, 2008.
[9] Lan H B, Li W, Xu J C,. A novel polysaccharide isolated from fresh longan (Lour.) activates macrophage via TLR2/4-mediated PI3/AKT and MyD88/TRAF6 pathways [J]., 2021, 12: 786127.
[10] Gan T S, Feng C, Lan H B,. Comparison of the structure and immunomodulatory activity of polysaccharides from fresh and dried longan [J]., 2021, 76: 104323.
[11] Lan H B, Cheng Y X, Mu J J,. Glucose-rich polysaccharide from dried ‘Shixia’ longan activates macrophages through Ca2+and Cr3−mediated MAPKs and PI3K-AKT pathways [J]., 2021, 167: 845-853.
[12] Bai Y J, Jia X C, Huang F,. Structural elucidation, anti-inflammatory activity and intestinal barrier protection of longan pulp polysaccharide LPIIa [J]., 2020, 246: 116532.
[13] Rong Y, Yang R L, Yang Y Z,. Structural characterization of an active polysaccharide of longan and evaluation of immunological activity [J]., 2019, 213: 247-256.
[14] Meng F Y, Ning Y L, Qi J,. Structure and antitumor and immunomodulatory activities of a water-soluble polysaccharide frompulp [J]., 2014, 15(3): 5140-5162.
[15] 查春节. 龙眼多糖的流变性、结构鉴定及其清除自由基活性研究 [D]. 武汉: 华中农业大学, 2013.
[16] Jiang G X, Prasad K N, Jiang Y M,. Extraction and structural identification of alkali-soluble polysaccharides of longan (Lour.) fruit pericarp [J]., 2009, 10(4): 638-642.
[17] Yang B, Jiang Y M, Zhao M M,. Structural characterisation of polysaccharides purified from longan (Lour.) fruit pericarp [J]., 2009, 115(2): 609-614.
[18] Zhu Q Q, Jiang Y M, Lin S,. Structural identification of (1→6)-α--glucan, a key responsible for the health benefits of longan, and evaluation of anticancer activity [J]., 2013, 14(6): 1999-2003.
[19] Yang C X, He N, Ling X P,. The isolation and characterization of polysaccharides from longan pulp [J]., 2008, 63(1): 226-230.
[20] 秦洁华. 龙眼壳多糖的分离提取及其活性初步研究 [D]. 南宁: 广西医科大学, 2010.
[21] Bai Y J, Liu L, Zhang R F,. Ultrahigh pressure-assisted enzymatic extraction maximizes the yield of longan pulp polysaccharides and their acetylcholinesterase inhibitory activity[J]., 2017, 96: 214-222.
[22] 周文君, 池建伟, 易阳, 等. 龙眼、枸杞和红枣多糖的理化性质及其协同益生活性 [J]. 现代食品科技, 2021, 37(11): 58-67.
[23] 闵婷, 孙杰, 黄菲, 等. 超声处理对龙眼果肉多糖理化特征及免疫调节活性的影响 [J]. 现代食品科技, 2016, 32(5): 124-131.
[24] Huang F, Liu H J, Zhang R F,. Physicochemical properties and prebiotic activities of polysaccharides from longan pulp based on different extraction techniques [J]., 2019, 206: 344-351.
[25] 刘慧君. 龙眼果肉多糖超微粉碎—酶解辅助提取及其理化特性与生物活性 [D]. 广州: 华南农业大学, 2018.
[26] 王婷. 干制对龙眼果肉蛋白/多糖复合物结构及性质影响的研究 [D]. 广州: 华南农业大学, 2018.
[27] 王轶帆, 邓媛元, 张雁, 等. 龙眼多糖与燕麦多糖的结构特征及其益生活性比较 [J]. 中国食品学报, 2020, 20(12): 62-71.
[28] 李珺铭, 刘富饶, 李波, 等. 基于分子量探究人参多糖免疫活性构效关系 [J]. 中成药, 2021, 43(11): 3088-3092.
[29] 王莹, 金红宇, 李耀磊, 等. 不同分子量枸杞多糖对RAW264.7巨噬细胞的免疫调节作用 [J]. 中国新药杂志, 2021, 30(12): 1079-1086.
[30] 王警. 乙酰化和羧甲基化龙眼肉多糖的制备及其抗氧化和免疫调节活性的研究 [D]. 南宁: 广西医科大学, 2016.
[31] 韦毅铭, 何舟, 田海芬, 等. 羧甲基化龙眼肉多糖制备工艺优化及其抗氧化、免疫活性 [J]. 食品科学, 2017, 38(22): 275-283.
[32] Jiang J, Meng F Y, He Z,. Sulfated modification of longan polysaccharide and its immunomodulatory and antitumor activity[J]., 2014, 67: 323-329.
[33] Yi Y, Zhang M W, Liao S T,. Effects of alkali dissociation on the molecular conformation and immunomodulatory activity of longan pulp polysaccharide (LPI) [J]., 2012, 87(2): 1311-1317.
[34] Yang B, Zhao M M, Prasad K N,. Effect of methylation on the structure and radical scavenging activity of polysaccharides from longan (Lour.) fruit pericarp [J]., 2010, 118(2): 364-368.
[35] Huang F, Liu H J, Zhang R F,. Physicochemical properties and prebiotic activities of polysaccharides from longan pulp based on different extraction techniques [J]., 2019, 206: 344-351.
[36] Yi Y, Han M M, Huang F,. Effects of a lysine-involved Maillard reaction on the structure andactivities of polysaccharides from longan pulp [J]., 2019, 24(5): 972.
[37] 刘慧君, 黄菲, 张瑞芬, 等. 龙眼果肉多糖超微粉碎-酶解提取工艺优化及其免疫活性 [J]. 中国食品学报, 2020, 20(3): 112-120.
[38] 易阳, 张名位. 龙眼肉多糖LPII的体外免疫调节活性评价 [J]. 现代食品科技, 2014, 30(4): 63-67, 111.
[39] Huang F, Hong R Y, Zhang R F,. Physicochemical and biological properties of longan pulp polysaccharides modified byfermentation [J]., 2019, 125: 232-237.
[40] Yi Y, Zhang M W, Liao S T,. Structural features and immunomodulatory activities of polysaccharides of longan pulp [J]., 2012, 87(1): 636-643.
[41] 冯潮, 温亚州, 杨宇哲, 等. 新鲜和干制龙眼果肉多糖免疫调节活性的分析 [J]. 食品与生物技术学报, 2021, 40(6): 52-59.
[42] 王诗琪, 黄晓芸, 易阳, 等. 不同方式干制龙眼果肉的粗多糖理化及生化特性比较 [J]. 食品科学, 2020, 41(13): 69-75.
[43] 蓝海波. 龙眼多糖的结构表征及其免疫调节活性研究 [D]. 海口: 海南大学, 2016.
[44] Lan H B, Nunes C, Lopes G R,.immunomodulatory activity of water-soluble glucans from fresh and dried longan (Lour.) [J]., 2021, 266: 118106.
[45] 童辉. 龙眼肉多糖LGP50和LGP50S-1免疫调节及抗衰老作用研究 [D]. 广州: 暨南大学, 2014.
[46] Yi Y, Wang H X, Zhang R F,. Characterization of polysaccharide from longan pulp as the macrophage[J]., 2015, 5(118): 97163-97170.
[47] 温亚州. 龙眼多糖免疫调节作用的研究 [D]. 海口: 海南大学, 2017.
[48] Zhang J C, Yang G M, Wen Y Z,. Intestinal microbiota are involved in the immunomodulatory activities of longan polysaccharide [J]., 2017, 61(11): 1700466.
[49] Bai Y J, Huang F, Zhang R F,. Longan pulp polysaccharide protects against cyclophosphamide-induced immunosuppression in mice by promoting intestinal secretory IgA synthesis [J]., 2020, 11(3): 2738-2748.
[50] Yi Y, Liao S T, Zhang M W,. Immunomodulatory activity of polysaccharide-protein complex of longan (Lour.) pulp [J]., 2011, 16(12): 10324-10336.
[51] Yi Y, Liao S T, Zhang M W,. Physicochemical characteristics and immunomodulatory activities of three polysaccharide-protein complexes of longan pulp [J]., 2011, 16(7): 6148-6164.
[52] 易阳, 孙杰, 王丽梅, 等. 新鲜和干制龙眼果肉中多糖的理化特征及免疫调节活性比较 [J]. 现代食品科技, 2015, 31(10): 53-62.
[53] 向蓉, 梁伟杰, 袁明贵, 等. 丁酸梭菌-龙眼多糖发酵液对小鼠溃疡性结肠炎的防治作用 [J]. 中国畜牧兽医, 2020, 47(11): 3731-3738.
[54] 王雪艳. 龙眼多糖的提取纯化及其抗氧化活性研究 [D]. 厦门: 集美大学, 2009.
[55] 贺寅. 龙眼多糖制备工艺及其抗氧化活性研究 [D]. 北京: 中国农业科学院, 2011.
[56] Zhong K, Wang Q, He Y,. Evaluation of radicals scavenging, immunity-modulatory and antitumor activities of longan polysaccharides with ultrasonic extraction on in S180tumor mice models [J]., 2010, 47(3): 356-360.
[57] 徐玉娟, 邓彩玲, 林羡, 等. 龙眼高温热泵干制过程中主要活性成分变化研究 [J]. 热带作物学报, 2014, 35(6): 1215-1220.
[58] 韩苗苗. 不同美拉德反应体系下的龙眼果肉多糖构效变化规律研究 [D]. 武汉: 武汉轻工大学, 2018.
[59] Zhang X Y, Fan L Y, Cui Y S,. Green synthesis of gold nanoparticles using longan polysaccharide and their reduction of 4-nitrophenol and biological applications [J]., 2020, 15(1): 2050002.
[60] 周嘉华, 刘雅琦, 卢慧玲, 等. 龙眼多糖通过降低肝匀浆氧自由基水平的抗疲劳作用研究 [J]. 现代医学与健康研究电子杂志, 2018, 2(5): 155.
[61] 聂英涛, 彭峰林, 李少杰, 等. 龙眼多糖通过下调氧自由基水平的抗疲劳作用研究 [J]. 广西师范大学学报: 自然科学版, 2017, 35(3): 157-161.
[62] Zheng S Q, Jiang F, Gao H Y,. Preliminary observations on the antifatigue effects of longan (Lour.) seed polysaccharides [J]., 2010, 24(4): 622-624.
[63] Wang H M, Zhang X H, Li Y X,. Antitumor activity of a polysaccharide from longan seed on lung cancer cell line A549and[J]., 2014, 35(7): 7259-7266.
[64] Yi Y, Huang F, Zhang M W,. Solution properties andanti-tumor activities of polysaccharides from longan pulp [J]., 2013, 18(9): 11601-11613.
[65] Chen J, Sun X D, Wang Y,. Effect of polysaccharides of thelongan (Lour.) Steud on inflammatory response induced by focal cerebral ischemia/reperfusion injury in rats [J]., 2010, 21(3): 219-225.
[66] Chen J, Chen X, Qin J. Effects of polysaccharides of the(Lour.) Steud on focal cerebral ischemia/reperfusion injury and its underlying mechanism [J]., 2011, 25(3): 292-299.
[67] İnal M E, Kanbak G, Sunal E. Antioxidant enzyme activities and malondialdehyde levels related to aging [J]., 2001, 305(1/2): 75-80.
[68] Li X M, Ma Y L, Liu X J. Effect of thepolysaccharides on age-related oxidative stress in aged mice [J]., 2007, 111(3): 504-511.
[69] Ahn H S, Jeon T I, Lee J Y,. Antioxidative activity of persimmon and grape seed extract:and[J]., 2002, 22(11): 1265-1273.
[70] İnal M E, Kanbak G, Sunal E. Antioxidant enzyme activities and malondialdehyde levels related to aging [J]., 2001, 305(1/2): 75-80.
[71] Zhu Shuyu, Zhou Bo, Liu Qin,. Effect of longan polysaccharides on proliferation and phenotype maintenance in rabbit articular chondrocytes[J]., 2016, 54(4): 607-617.
Research progress on chemical structure, structure-activity relationship and pharmacological activity ofpolysaccharides
SHEN Yu-bin1, 2, 3, 4, HAO Er-wei1, 2, 3, 4, DU Zheng-cai1, 2, 3, 4, HOU Xiao-tao1, 2, 3, 4, 5, LIANG Ling-ling1, 2, 3, 4, DENG Jia-gang1, 2, 3, 4
1. Guangxi University of Chinese Medicine, Nanning 530200, China 2. Guangxi Key Laboratory of Efficacy Study on Chinese Materia Medica, Nanning 530200, China 3. Guangxi Key Laboratory of Theory and Transformation of Traditional Chinese Medicine Prescriptions for Damp Diseases, Nanning 530200, China 4. Guangxi Collaborative Innovation Center of Study on Functional Ingredients of Agricultural Residues, Nanning 530200, China 5. Guangxi Scientific Experimental Center of Traditional Chinese Medicine of Guangxi University of Chinese Medicine, Nanning 530200, China
Longyan (Lour.), a traditional Chinese medicine with the “one root of medicine and food”, has the effect of tonifying the heart and spleen, nourishing blood and tranquilizing mind. Its rich polysaccharide is one of the main active ingredients. This paper summarize the chemical structures ofpolysaccharides and their derivatives by reviewing domestic and foreign literatures. The polysaccharides fromhave various pharmacological activities such as immune regulation, anti-inflammatory, anti-oxidant, antifatigue, antitumor and alleviating focal cerebral ischemia/reperfusion injury, and the chemical structure ofpolysaccharide is closely related to pharmacological activity. For example, the larger the molecular mass of the polysaccharide is, the stronger its immune activity is. Chemical modification acetylation, carboxymethylation, sulfation, phosphoric acid esterification and alkali dissociation can enhance its pharmacological activity, while methylation could reduce it. This paper summarizes the chemical structure, structure-activity relationship and pharmacological effects ofpolysaccharides, in order to provide a theoretical basis for the in-depth development and utilization of.
polysaccharides; chemical structure; structure-activity relationship; immune regulation; anti-inflammatory; anti-oxidant; antifatigue; antitumor; ischemia/reperfusion
R284;R285
A
0253 - 2670(2022)23 - 7624 - 09
10.7501/j.issn.0253-2670.2022.23.034
2022-07-10
国家药品监督管理局中药材质量监测与评价重点实验室开放课题基金(KFKT2022-5);广西科技重大专项:五种“桂十味”药材高质量生产关键技术及系列健康产品开发研究(桂科AA22096029);广西科技重大专项:中国(广西)-东盟药物创新中心建设及新药开发(桂科AA19254033)
沈玉彬(1997—),女,硕士生,研究方向为中药基础理论与药效筛选。Tel: 13558180082 E-mail: 952796574@qq.com
通信作者:邓家刚(1953—),男,教授,博士生导师,从事中药基础理论与药效筛选研究。E-mail: dengjg53@126.com
[责任编辑 潘明佳]
