基于共生菌群调控诠释外用中药治疗慢性创面机制的认知与思考
2022-12-08王裔惟徐泽宇赵宏宇尹少平段金廒
陈 军,王裔惟,徐泽宇,赵宏宇,叶 亮,尹少平,段金廒
基于共生菌群调控诠释外用中药治疗慢性创面机制的认知与思考
陈 军1, 2*,王裔惟1, 2,徐泽宇1,赵宏宇3,叶 亮1,尹少平1,段金廒2*
1. 南京中医药大学江苏省中医外用药开发与应用工程研究中心 210023 2. 南京中医药大学江苏省中药资源产业化过程协同创新中心 210023 3. 南京中医药大学附属南京医院临床科研中心 210003
在老龄化背景下慢性创面已成为严重威胁人民生命健康的重大公共卫生问题,在中医理论的指导下,外用中药在慢性创面治疗方面形成了独特的理论和治法,并且特别重视寒热药性的影响,但其科学内涵与作用机制还有待于深入诠释以更好地服务于临床应用。最新研究表明,共生菌群能够发挥免疫调节和促愈作用,故而对于慢性创面治疗具有重要意义,绝对无菌反而不利于创面愈合。因此提出通过创面菌群调控认知探讨以马勃为代表的外用中药“煨脓长肉”治疗慢性创面作用机制的研究思路,以及基于创面菌群-肠道菌群调控的创面外用中药寒热药性作用机制的研究思路,为科学认知和充分发挥外用中药临床独特疗效和医学生物学机制提供参考和借鉴,为外用中药治疗慢性创面的现代研究提供新思路。
外用中药;慢性创面;煨脓长肉;共生菌群;寒热药性;马勃
慢性创面(chronic wounds),也称为慢性难愈性创面,是指在各种内外因素的作用下,无法通过正常有序而及时的修复过程达到解剖和功能上完整状态所进入的一种病理性炎症反应状态的创面,其病程往往超过一个月。统计表明,我国慢性创面患者占外科住院患者的1.5%~3.0%[1]。慢性创面具有发病年龄较高、发病机制复杂、治疗难度大、治愈期限长、致残率高等特点,给患者及其家庭带来极大的经济和心理负担[2]。以糖尿病足溃疡为例,在我国,糖尿病患者超过1.14亿人,50岁以上的糖尿病患者的糖尿病足发病率高达8.1%,糖尿病足溃疡患者年死亡率高达11%,而截肢患者死亡率高达22%,成为糖尿病患者致残或致死的主要原因之一[3]。在我国人口老龄化背景下,慢性创面给患者、家庭和社会带来越来越沉重的负担,已成为严重威胁人民生命健康的重大公共卫生问题。
在中医理论的指导下,外用中药治疗慢性创面具有悠久的应用历史和深厚的理论积淀。早在西周时期的《周礼·天官》就记载:“疡医掌肿疡、溃疡、折疡、金疡、折疡之祝药,劀杀之齐”,说明当时已用外敷药物来治疗创面。虽然外用中药促进慢性创面愈合具有较好的疗效[4-5],但在基于西方还原论和微观科学为基础的“成分+药效”研究思路指导下,虽然发现了越来越多的有效成分和靶点,但是作用机制还是难以得到系统阐明,并且难以体现中医理论的指导作用。采用新的研究思路开展外用中药治疗慢性创面研究,已成为当前必须要考虑的问题。
1 共生菌群对于促进慢性创面愈合具有重要意义
皮肤是人体与环境的外部接口,是防止外来病原体入侵机体的物理屏障,具有保护、分泌、感觉、调温、免疫等功能[6]。皮肤同时也是数百万细菌、真菌和病毒的家园,以细菌为主的微生物(统称为“共生菌群”)与皮肤组织、细胞、分泌物、微环境等共同构成的生态系统,在皮肤表面形成第一道屏障,发挥保护机体的重要作用,目前在健康表皮层已经鉴定出至少19个细菌门和1000多个细菌物种,最常见的细菌属包括棒状杆菌、丙酸杆菌和葡萄球菌[7-8]。皮肤菌群中含有相当多的病原菌,但由于菌群间的互相制衡,其致病作用得到有效抑制。
一般情况下,创面愈合会经过凝血、炎症反应、细胞增殖和组织重塑4个有序且相互交叉影响的连续动态过程[9],慢性创面修复通常停滞在炎症反应和/或经历受损的增殖阶段[10]。周围皮肤以及一部分环境中的菌群可以在创面定植形成共生菌群,通常认为,其中的病原菌在创面经过定植、污染,形成生物被膜,诱发过度炎症,极易发生感染化脓,导致慢性创面难以愈合[11]。
然而,最新的研究发现,共生菌群是免疫调节促进创面愈合的重要因素,创面无菌反而不利于愈合。在表皮损伤时,周围皮肤的共生菌群会定植到受伤皮肤的真皮层,然后激活中性粒细胞表达CXCL10充当趋化因子招募浆细胞样树突状细胞(plasmacytoid dendritic cells,pDC),杀灭细菌并通过和细菌DNA结合激活TLR9(Toll-like receptor 9,TLR9),活化的pDC会产生大量I型干扰素,刺激成纤维细胞和巨噬细胞产生生长因子促进创面愈合[12]。
2021年发表于的研究评估了无菌小鼠(germ-free,GF)、常规特异性无病原体小鼠和野生型小鼠的创面愈合及创面诱导毛囊新生的能力,结果显示野生型小鼠最强,GF小鼠反而最弱;并且这一现象也出现在临床试验中,当使用联合抗生素抑制创面菌群,随着共生菌的减少,患者创面愈合速率显著降低[13]。该研究证明了机体再生能力不仅是内在属性,也受创面菌群调节,突出了创面愈合和共生菌群之间的进化共生关系。共生菌促进愈合的作用机制见表1。
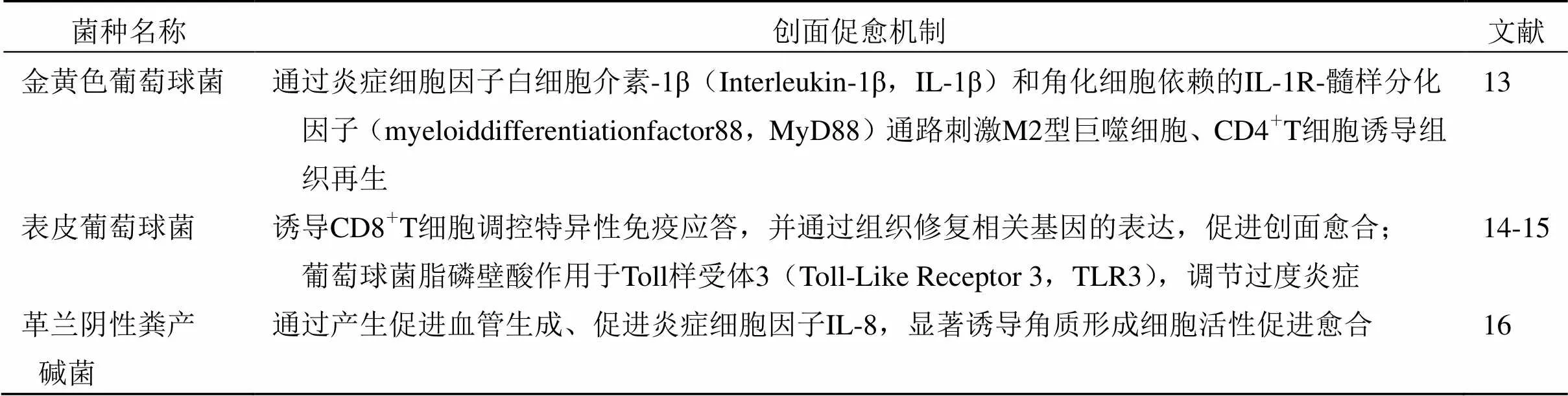
表1 共生菌促进创面愈合的机制
因此,共生菌群调控被认为是研究创面愈合机制的新途径[17],未来精确编辑微生物菌群或使用纯化的菌群和其代谢产物有望成为促进创面愈合的有效策略。
2 “煨脓长肉”是中医治疗慢性创面的重要理论
创面菌群对于慢性创面愈合的重要作用可能为中医“煨脓长肉”理论的科学性提供了有力依据。慢性创面常因菌群感染而化脓,西医认为脓是机体组织炎症过程中形成的浓稠或稀薄的混合物,为了防治化脓,基于减少细菌负荷抗感染的原则通常采用局部清创处理和抗生素治疗。而中医认为,脓因皮肉之间热胜肉腐蒸酿而成,由气血所化生[18],《黄帝内经·灵枢》认为“寒气化为热,热胜则腐肉,肉腐则为脓”,因此往往用中药“煨脓长肉”促进局部气血通畅,使创面脓液增多,载邪外出,从而促进创面愈合,中医临床甚至有“无脓不生肌”的认识[19]。
“煨脓长肉”是中医外治慢性创面的经典理论之一,最早出现于明代医家申斗垣所著的《外科启玄》:“在凡疮毒已平,脓水来少,开烂已定,或少有疼痒,肌肉未生,若不贴其膏药,赤肉无其遮护,风冷难以抵挡,故将太乙膏等贴之则煨(偎)脓长肉,风邪不能侵,内当补托里,使其气血和畅,精神复旧,至此强壮诸疮,岂能至于败坏乎?”清代《外科备要》则记载:“外用五色灵药撒之,化腐煨脓,兼琥珀膏、万应膏贴之生肌敛口”,因此也称为“煨脓生肌”。“煨脓长肉”理论认为:疮疡的出脓,是正气载毒外出的正常现象,气血充足,则脓出色黄稠厚,量多,疮口易于愈合,预后良好;反之则预后不良[20]。清代《外科全生集》更进一步指出:“毒之化必由脓,脓之来必由气血”。因此,“煨脓长肉”理论和治法被广泛应用于慢性创面的治疗[21-22],但其具体机制尚不明确,亟待用现代科学语言加以解读以促进其推广应用。
3 基于创面菌群调控的中药外用“煨脓长肉”促愈机制研究思路——以马勃Calvatia gigantea (Batsch ex Pers.) Lloyd为例
马勃是令人关注的有效促进慢性创面愈合中药。古代医家充分肯定了马勃外用敷疮的疗效和安全性。秦汉时期《名医别录》记载马勃“味辛,平,无毒,主治恶疮马疥”,南北朝时期著名中医药学家陶弘景认为马勃“敷诸疮甚良”,清代《本草从新》则充分肯定马勃安全有效,“每见用寒凉药敷疮者,虽愈而热毒内攻,变生他病,为害不小,惟马勃辛平而散,甚为稳妥”。现代研究发现马勃具有止血、抗氧化、调菌、降血糖、促进细胞增殖等药理作用,能够调控创面微生态,促进增殖期进程,恢复慢性创面愈合进程[23]。在临床应用中,马勃以粉末、液体制剂、纱布等形式被广泛外用治疗压疮[24]、臁疮[25]、冻疮[26]、糖尿病坏疽[27]等各种慢性创面,治愈率可达90%以上。
传统的马勃往往以子实体入药,能够满足止血的需要,但用于慢性创面治疗采用孢子粉可能有更好的疗效。清代《本草备要》指出:“(马勃)状如肺肝,紫色虚软,弹之粉出,取粉用”,现代临床研究发现马勃孢子粉临床外用于慢性创面通过“煨脓长肉”具有较为显著的临床治疗效果[22]。进一步的研究发现马勃孢子粉醇提物是其促进慢性创面愈合的主要活性部位,马勃孢子粉醇提物能够促进小鼠背部全层皮肤缺损性创面愈合,有效促进创面组织上皮化完整、减少炎性细胞浸润、新生胶原纤维含量更高[28],这一研究成果已经申请了发明专利[29]。
除了马勃以外,不乏其他基于“煨脓长肉”促创面愈合的中药。紫草是一味运用于创面治疗的常用中药,具有清热消肿、治疗皮肤损伤的作用,其主要活性成分紫草素,也被证明具有调控创面微生态从而促进创面愈合的作用[30]。此外,中药地榆因其含有的皂苷、多糖、黄酮类等活性成分,能够发挥止血、创面修复等作用,而同样受到广泛关注[31]。将紫草与地榆作为君药,并与其他中药(如冰片、忍冬藤、当归、白芷等)配伍制成“紫榆膏”,应用于因“毒邪入里,热毒蕴结”所致的肛周坏死性创面中,发现紫榆膏通过“煨脓长肉”促进创面修复临床疗效确切[32]。
马勃等基于“煨脓长肉”用于创面临床治疗安全有效,但其成分复杂,靶点众多,难以充分诠释其外用作用机制。由于创面的共生菌群与“煨脓长肉”密切相关且已被证明是促进慢性创面愈合的重要因素,如创面共生菌群能够通过激活M2型巨噬细胞发挥促愈作用[13],而传统外用“煨脓长肉”中药如回阳生肌膏也能通过促进慢性创面巨噬细胞的活化、表型转化发挥作用[33],如能从创面菌群调控入手阐明其作用机制,有望用现代科学语言解读“煨脓长肉”的科学原理。
4 基于创面菌群-肠道菌群调控的外用中药寒热药性机制研究思路
药性理论是中药理论的核心。“四气”是中药核心药性特征,也是阴阳的体现,寒凉属阴,温热属阳,统称为寒热药性,故用药能够使得人体恢复阴阳平衡。药性研究一直是中药研究的难点,目前有基于效应[34]、组分-机体状态-效应[35]、组分-递送-效应[36]等多种表征思路。而共生菌群调控的研究为药性研究提供了全新的视角,这一研究首先在肠道菌群调控方面取得了进展。有研究选择临床常用的、不同“四气”药性的、归脾经中药作为研究对象,以干姜、白术、茯苓、薏苡仁和黄连分别为热、温、平、凉、寒性祛湿中药,考察其提取液按2 g生药/kg ig给药于小鼠15 d后对于肠道菌群的影响,结果发现干姜、茯苓和黄连有可能从提高肠道菌群物种多样性发挥作用,而寒凉药黄连和薏苡仁对于肠道菌群相对丰度影响更为明显,表现出明显的规律性[37]。进一步的研究通过肠道菌群调控效果识别中药药性。淫羊藿古籍有温性和寒性的不同记载,采用寒证、热证模型和正常大鼠考察淫羊藿提取物ig给药15 d,通过对不同证候大鼠肠道菌群多样性的综合分析,发现生品淫羊藿药性偏寒凉[38]。
历代医家非常重视阴阳学说和寒热药性在中药外用中的应用,明代陈实功特别强调寒热药性对于创面治疗的重要意义,在《外科正宗》中提出了“诸疮原因气血凝滞而成,切不可纯用凉药,冰凝肌肉”“凡疮未破,毒攻脏腑,一毫热药断不可用;凡疮既破,脏腑已亏,一毫凉药亦不可用”等论述[39]。由于当前经常采用中药提取物、有效部位甚至单体成分外用,其是否具有寒热药性及其作用机制亟需有效手段进行研究。
慢性创面治疗中药往往能够作用于创面菌群。由于抗生素耐药的问题,寒凉中药如黄连等常用于慢性创面治疗,如有临床研究考察了甲珠黄连油膏敷贴对糖尿病足中重度感染患者创面菌群的影响,结果发现创面菌群均能被有效抑制,与对照组相比,菌群总数显著下降[40]。但由于创面菌群属于局部共生菌群,用于研究外用中药寒热药性机制存在一定的局限性,如能证明创面菌群与肠道菌群存在互作关系,基于肠道菌群表征寒热药性的研究基础,外用中药寒热药性研究的可信度有望大为提升。
清代《本草从新》指出:“每见用寒凉药敷疮者,虽愈而热毒内攻,变生他病,为害不小”。可见,不同寒热药性中药外用于创面会影响机体阴阳平衡,而寒凉中药外用于创面能够导致“热毒内攻”,从而完全有可能在肠道菌群调控上体现出来差异。《素问·生气通天论》中有“高粱之变,足生大丁”的记载,指过食高粱厚味,容易内生热毒,导致身体发生病理变化从而生出大的疮疡,而现代研究发现,内生热毒病机与肠道菌群失衡存在密切的联系:高脂、高糖饮食将诱导肠道菌群功能失调,增加大肠埃希菌属spp. 等格兰阴性菌的丰度或(和)相对比例,从而导致脂多糖等致炎因子的过度表达;也就是说,人体营养和能量过剩,脏腑气化失调致使痰瘀化生,痰瘀郁久化热生毒,从而导致机体发生一系列变化[41]。高脂饮食在诱发热毒的同时也可能同时改变皮肤菌群。动物实验发现,给小鼠食用高脂饮食6~12个月后,小鼠的真皮层变厚,高脂饮食组与正常饮食组的皮肤游离短链脂肪酸含量差异明显,并且皮肤菌群的差异明显,亲脂型牛棒状杆菌在高脂饮食组中从几乎无法检测到成为优势菌种,可能引起相应的皮肤感染[42]。
由于寒凉药外用能够有效抑制创面菌群[40]且《本草从新》认为寒凉药外用导致“热毒内攻”,而现代研究又证明热毒与肠道菌群失衡密切联系,因此,创面菌群和肠道菌群调控之间非常有可能存在互作关系。如能阐明不同药性中药作用于创面调控创面菌群和肠道菌群的机制,外用中药寒热药性作用机制尤其是寒凉药性有望通过菌群调控这一现代科学语言加以阐明。
5 共生菌群调控研究能够体现中医阴阳平衡理念
阴阳学说是中医理论的基石。成书于秦汉时期的《黄帝内经》就是根据包括阴阳学说在内的古代哲学思想构建了中医学的理论。《素问·阴阳应象大论篇》就指出:“阴阳者,天地之道也,万物之纲纪”。中医把人体内部各种相互制约、相互为用的生理结构和功能概括为阴阳2个对立面,认为阴阳在互为消长的生克运动中保持动态平衡,机体才能进行正常的生命活动。如果相互制约的功能出现紊乱,则表现出亚健康,甚至疾病,即“阴盛则阳病,阳盛则阴病。阴胜则寒,阳胜则热”。《素问·生气通天论篇》“阴平阳秘,精神乃治……阴阳离决,精气乃绝”。《素问·调经论篇》亦云:“阴阳匀平,以充其形,九候若一,命曰平人。”因此,中医治疗的最终目的就是使阴阳复归于平衡。
阴阳平衡是一种处于不断的相互消长中的动态平衡,具有多重特性。肠道菌群的平衡被认为是阴阳平衡的一种体现,阴阳消长、互根和转化都能在肠道菌群平衡中得到印证[43]。同样的,创面菌群平衡也可以看作为阴阳平衡理念的体现。体表共生菌群中存在致病菌、有益菌和其他没有直接作用的菌群,处于动态平衡中,在正常情况下,有益菌和致病菌相互制约达到平衡,体现了阴阳的对立制约。例如表皮葡萄球菌是皮肤菌群中较为丰富的物种,研究表明,皮肤角质形成细胞可以感受到表皮葡萄球菌释放的短链脂肪酸,调节自身生长速率和炎性反应,作用于伤口愈合,同时表皮葡萄球菌能够拮抗病原菌,通过分泌抗菌肽来抑制病原菌金黄色葡萄球菌的生长,但也能够与金黄色葡萄球菌一起导致合并感染甚至败血症[7]。阴阳虽然对立,但又不可分割、相互依存,阴阳对立的双方,在一定条件下,又可以向其各自相反的方向转化。同样的,体表共生菌群中有益菌和致病菌在一定条件下也可以相互转化,表皮葡萄球菌对创面愈合发挥不同作用的机制如图1所示,该机制与巨噬细胞M1/M2平衡密切相关。
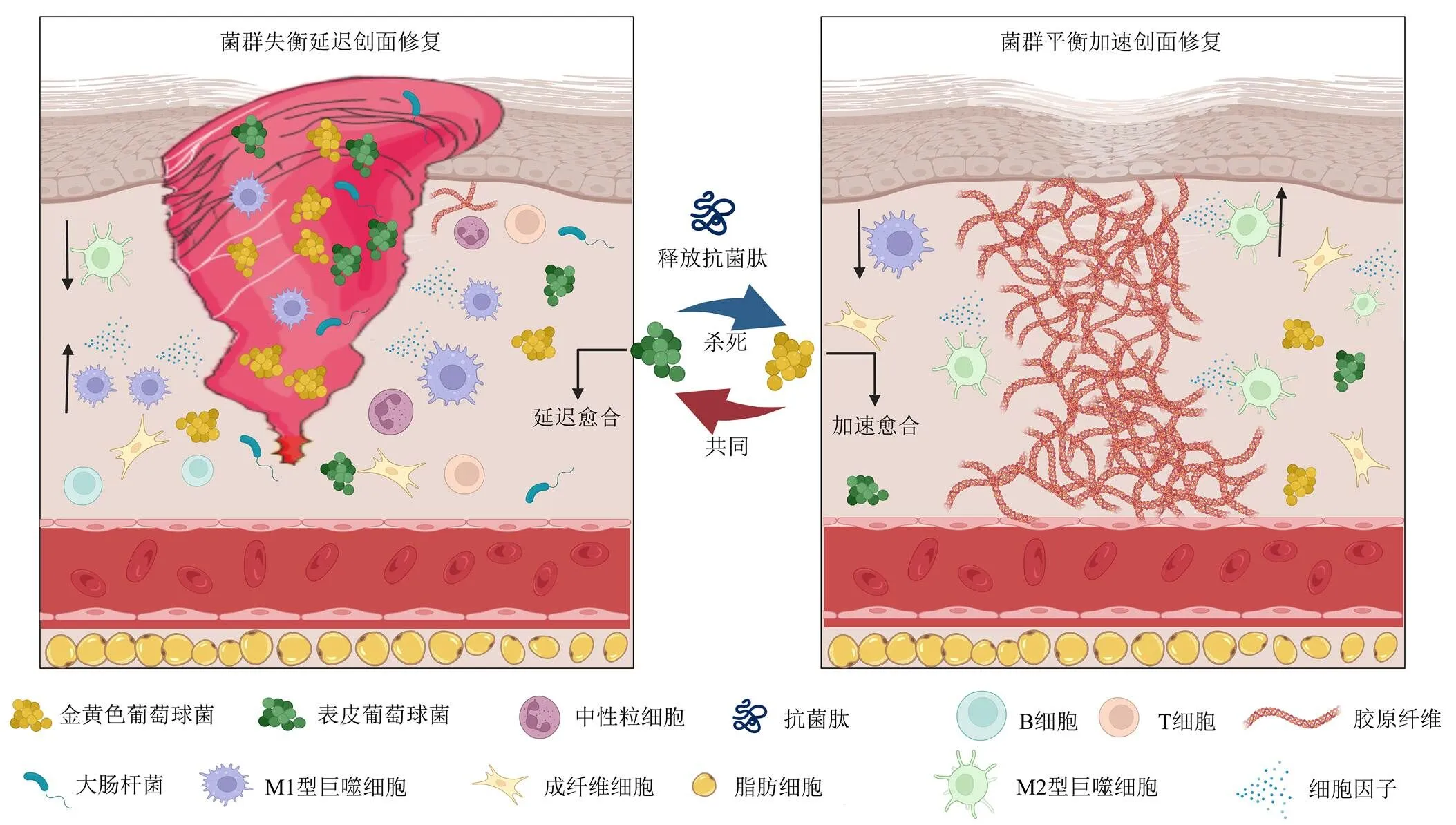
图1 表皮葡萄球菌Staphylococcus epidermidis在不同条件下抑制或促进创面愈合的机制
为了克服“成分+药效”经典的中药作用机制研究思路的不足,此前有多种力求体现中药整体性和系统论的新的研究思路和方法陆续被提出[44-45],但仍然难以满足中药作用机制诠释的需要,其原因可能是与中医基础理论的契合度不够。因此,能够体现中医阴阳平衡理念的菌群调控研究思路有望解决当前研究思路的不足,既能够通过现代科学语言诠释中药外用机制,也能够在现代研究中充分发挥中医理论的指导作用。
6 共生菌群调控研究有望揭示外用中药治疗慢性创面的关键机制
慢性创面治疗的关键机制之一在于调节巨噬细胞M1/M2平衡。创面的巨噬细胞具有吞噬和分泌的功能,在创面感染期,M1型巨噬细胞能吞噬并清除外源性异物和坏死细胞,而在创面修复期,M2型巨噬细胞能通过释放各种细胞因子调节创伤修复。外用中药被证明能够通过影响M1/M2平衡尤其是促进M2细胞极化而发挥促愈作用,例如复方五凤草液外用通过调节巨噬细胞的极化发挥“泄毒生新”促进慢性创面修复的作用,其对于创面M1型标志分子一氧化氮合成酶、肿瘤坏死因子-α、CD86重组蛋白的表达无影响,但能上调M2型标志分子精氨酸酶-1、转化生长因子-β、CD206重组蛋白的表达[46]。但是,当前的研究表明,创面菌群也是影响免疫平衡的主要因素之一,例如金黄色葡萄球菌可以通过炎症细胞因子IL-1β和角化细胞依赖的IL-1R-MyD88通路刺激M2巨噬细胞极化[12]。因此,外用中药调控共生菌群的研究不能仅仅着眼于其对于菌群的直接作用,更要关注外用中药调控菌群后对于巨噬细胞M1/M2平衡的影响。
中医在创面治疗有数千年的发展历史和理论积淀,形成了一系列的特色治疗理念和方法。当前,临床常用的抗生素在抗菌或抑菌方面的优势显著优于中药,但由于耐药问题层出不穷,治疗慢性创面往往疗效受限。在最新研究发现共生菌群对于慢性创面愈合具有重要意义的背景下,本文提出基于共生菌群调控认知的外用中药治疗慢性创面机制研究思路,一方面可以充分发挥中医在治疗慢性创面方面的理论和临床优势,另一方面也有望充分诠释中药外用的一系列关键机制如寒热药性机制。
对于慢性创面而言,外用中药治疗的关键机制可能有3点:第一在于共生菌群调控即“调菌”,而非抗菌或抑菌,有望基于创面菌群调控研究局部作用机制;第二在于整体调控,即通过创面菌群-肠道菌群调控研究全身作用机制,这也符合明代医家陈实功提出的“外之症必根于内”的观点;第三在于有效成分主要通过共生菌群调控发挥作用,因此成分即使消除,菌群的作用仍然可能存在,这一发现如能得到证实,将为中药生物药剂学提供新的研究方向。
7 结语
中药的作用特色在于多成分多靶点协同起效,故而研究往往涉及众多成分、通路和靶点以及相互之间的复杂联系,导致很难充分诠释中药的系统作用机制。与口服相比,外用中药往往组方更加复杂,成分更难追踪,涉及局部和全身两方面的作用机制,虽然其治疗慢性创面具有深厚的历史积淀和理论基础,但很难用现代科学语言阐明其作用机制。
本文系统阐述了当前发现的共生菌群促进慢性创面愈合的重要意义,回顾了“煨脓长肉”等涉及菌群调控的中医传统理论与治法,以中药马勃的研究为例讨论了基于共生菌群调控研究“煨脓长肉”机制的思路,并且进而提出基于创面菌群-肠道菌群调控的外用中药寒热药性机制研究思路,力求从共生菌群调控这一全新视角诠释外用中药作用机制,为科学认知和充分发挥外用中药临床独特疗效和医学生物学机制提供参考和借鉴。
总之,基于共生菌群调控的研究思路,能够体现中医阴阳平衡理念,能够体现中药多成分多靶点协同起效的优势和特色,有望为外用中药治疗慢性创面研究提供新的研究视角。进一步的研究将聚焦在外用中药对于共生菌群调控的具体规律与机制、菌群调控与巨噬细胞M1/M2平衡的系统联系(“煨脓”与“长肉”的关系)以及适合菌群调控的外用中药递送系统的研究等内容。此外,鉴于对于皮肤疾病已经提出“菌群移植”的设想[47],未来应用益生菌调控共生菌群治疗慢性创面也是非常有意思的研究内容之一。
利益冲突 所有作者均声明不存在利益冲突
[1] 廖新成, 郭光华. 慢性难愈性创面的分类鉴别及临床评估 [J]. 中华损伤与修复杂志: 电子版, 2017, 12(4): 303-305.
[2] Olsson M, Järbrink K, Divakar U,. The humanistic and economic burden of chronic wounds: A systematic review [J]., 2019, 27(1): 114-125.
[3] 王富军. 中国糖尿病足防治指南(2019版)解读 [J]. 河北医科大学学报, 2019, 40(11): 1241-1245.
[4] 严豪杰, 王军, 矫浩然, 等. 中药外用促进慢性难愈性创面愈合机理研究 [J]. 吉林中医药, 2012, 32(2): 156-157.
[5] 尹少平, 徐泽宇, 闵文, 等. 中药外用制剂在慢性创面治疗中的应用与思考 [J]. 南京中医药大学学报, 2020, 36(5): 690-695.
[6] Loomis K H, Wu S K, Ernlund A,. A mixed community of skin microbiome representatives influences cutaneous processes more than individual members [J]., 2021, 9(1): 22.
[7] Stacy A, Belkaid Y. Microbial guardians of skin health [J]., 2019, 363(6424): 227-228.
[8] Byrd A L, Belkaid Y, Segre J A. The human skin microbiome [J]., 2018, 16(3): 143-155.
[9] Mouritzen M V, Petkovic M, Qvist K,. Improved diabetic wound healing by LFcinB is associated with relevant changes in the skin immune response and microbiota [J]., 2021, 20: 726-739.
[10] Haalboom M. Chronic wounds: Innovations in diagnostics and therapeutics [J]., 2018, 25(41): 5772-5781.
[11] Mudrik-Zohar H, Carasso S, Gefen T,. Microbiome characterization of infected diabetic foot ulcers in association with clinical outcomes: Traditional cultures versus molecular sequencing methods [J]., 2022, 12: 836699.
[12] di Domizio J, Belkhodja C, Chenuet P,. The commensal skin microbiota triggers type I IFN-dependent innate repair responses in injured skin [J]., 2020, 21(9): 1034-1045.
[13] Wang G F, Sweren E, Liu H Y,. Bacteria induce skin regeneration via IL-1β signaling [J]., 2021, 29(5): 777-791.
[14] Linehan J L, Harrison O J, Han S J,. Non-classical immunity controls microbiota impact on skin immunity and tissue repair [J]., 2018, 172(4): 784-796.
[15] Lai Y P, di Nardo A, Nakatsuji T,. Commensal bacteria regulate Toll-like receptor 3-dependent inflammation after skin injury [J]., 2009, 15(12): 1377-1382.
[16] Kalan L R, Meisel J S, Loesche M A,. Strain- and species-level variation in the microbiome of diabetic wounds is associated with clinical outcomes and therapeutic efficacy [J]., 2019, 25(5): 641-655.e5.
[17] Johnson T R, Gómez B I, McIntyre M K,. The cutaneous microbiome and wounds: New molecular targets to promote wound healing [J]., 2018, 19(9): E2699.
[18] 陈红风. 中医外科学 [M]. 5版. 北京: 中国中医药出版社, 2021: 26.
[19] 李亚君, 周丽君, 陈明岭. “无脓不生肌”对临床的指导 [J]. 中医临床研究, 2015, 7(25): 44-45.
[20] 郭冬婕, 陈瑜, 李斌, 等. “煨脓长肉”理论的临床运用与理性思考 [J]. 中华中医药杂志, 2017, 32(11): 4812-4814.
[21] 阮晓枫, 刘敏. 论煨脓长肉与慢性难愈性创面的治疗 [J]. 湖南中医杂志, 2016, 32(5): 164-165.
[22] 孙浩. “煨脓长肉”法指导马勃孢子粉换药治疗慢性难愈性创面的临床观察 [D]. 南京: 南京中医药大学, 2021.
[23] 丁晓桐, 汤清涵, 王裔惟, 等. 马勃的化学成分研究进展及其在创面修复中的应用 [J]. 南京中医药大学学报, 2021, 37(4): 609-618.
[24] 王丽萍, 李华, 戴小青, 等. 马勃联合鱼肝油滴剂治疗压疮30例临床观察 [J]. 中国民族民间医药, 2015, 24(8): 71.
[25] 董鹏, 张丽兰. 复方马勃煎剂治疗臁疮28例 [J]. 中国社区医师, 2002, 18(15): 41.
[26] 仲济民, 陈爱东. 马勃纱布治疗冻疮 [J]. 中成药研究, 1982, 4(12): 42.
[27] 杨柳洪, 朱文俊, 诸方受. 马勃外敷治愈糖尿病引起坏疽2例 [J]. 吉林中医药, 1991, 11(5): 10-11.
[28] 丁晓桐, 王裔惟, 闵文, 等. 马勃孢子粉醇提物对小鼠全层皮肤缺损性创面的治疗作用考察[J]. 中国实验方剂学杂志, 2022, 28(8): 149-158.
[29] 陈军, 闵文, 王裔惟, 等. 一种促进创面愈合的中药和提取物及应用: CN113730447A [P]. 2021-12-03.
[30] 谢军, 毛玉洁, 王思宇, 等. 紫草素对大鼠慢性皮肤溃疡创面愈合及新生血管形成的促进作用及其机制 [J]. 解放军医学杂志, 2022, 47(1): 39-45.
[31] 郇晓宇, 孙庆. 地榆在创面修复中的作用机制研究进展 [J]. 中国中西医结合外科杂志, 2020, 26(6): 1197-1199.
[32] 许建成, 李凤盛, 宋易华, 等. 紫榆膏“煨脓长肉”换药法促进肛周坏死性筋膜炎术后愈合的临床研究 [J]. 现代医学与健康研究电子杂志, 2021, 5(10): 101-103.
[33] 孟建霞. 徐旭英辨治慢性创面经验和回阳生肌膏对慢性创面巨噬细胞的影响 [D]. 北京: 北京中医药大学, 2018.
[34] 冯静, 李玲玲, 崔瑛. 对中药药性表征的思考 [J]. 中华中医药杂志, 2020, 35(11): 5623-5625.
[35] 金锐, 张冰, 刘小青, 等. 基于药性构成“三要素”数理分析模式的中药寒热药性生物学表征差异研究 [J]. 中西医结合学报, 2011, 9(7): 715-724.
[36] 陈军, 姚俊宏, 王裔惟, 等. 基于生物药剂学思维的外用中药药性“组分-递送-效应”三要素表征思路 [J]. 南京中医药大学学报, 2021, 37(5): 654-657.
[37] 李楚洁, 黄海阳, 李晓君, 等. 干姜、白术、茯苓、薏苡仁和黄连不同药性中药对小鼠菌群多样性的影响 [J]. 辽宁中医杂志, 2018, 45(7): 1526-1529.
[38] 卢芳, 闫静思, 刘树民. 基于生理及寒热模型大鼠肠道菌群多样性变化的淫羊藿药性归属研究 [J]. 中草药, 2021, 52(13): 3954-3965.
[39] (明)陈实功著. 胡晓峰整理. 外科正宗 [M]. 北京: 人民卫生出版社, 2007: 9, 15.
[40] 于文霞, 王猛, 姚彬, 等. 中药敷贴疗法对糖尿病足创面菌群的影响 [J]. 糖尿病新世界, 2019, 22(24): 15-16.
[41] 杨化冰, 邹小娟, 高清华, 等. 代谢性炎症与动脉粥样硬化内生热毒病机探讨 [J]. 湖北中医药大学学报, 2019, 21(1): 48-51.
[42] Moestrup K S, Chen Y, Schepeler T,. Dietary control of skin lipid composition and microbiome [J]., 2018, 138(5): 1225-1228.
[43] 邵晓姣, 成泽东. 从中医阴阳五行理论谈肠道菌群 [J]. 辽宁中医药大学学报, 2013, 15(7): 136-137.
[44] 封亮, 张明华, 顾俊菲, 等. 中药物质基础“组分结构”理论的创新与实践 [J]. 中国中药杂志, 2013, 38(21): 3603-3607.
[45] 许海玉, 杨洪军. 整合药理学: 中药现代研究新模式 [J]. 中国中药杂志, 2014, 39(3): 357-362.
[46] 高璐珏, 黄子慧, 朱思洵, 等. 复方五凤草液对创面愈合和巨噬细胞极化的影响 [J]. 中成药, 2022, 44(5): 1612-1617.
[47] Paetzold B, Willis J R, Pereira de Lima J,.Skin microbiome modulation induced by probiotic solutions [J]., 2019, 7(1): 95.
Healing mechanism interpretation of chronic wounds by external traditional Chinese medicine based on regulation of commensal microbiome
CHEN Jun1, 2, WANG Yi-wei1, 2, XU Ze-yu1, ZHAO Hong-yu3, YE Liang1, YIN Shao-ping1, DUAN Jin-ao2
1. Jiangsu Provincial Engineering Research Center of Development and Application of TCM External Medication, Nanjing University of Chinese Medicine, Nanjing 210023, China 2. Collaborative Innovation Center for Industrialization Process of Traditional Chinese Medicine Resources in Jiangsu Province, Nanjing University of Chinese Medicine, Nanjing 210023, China 3. Clinical Research Center of the Affiliated Nanjing Hospital of Nanjing University of Chinese Medicine, Nanjing 210003, China
Chronic wounds have become a global public health problem under the background of aging, affecting over millions of people in China. With the guidance of traditional Chinese medicine (TCM) theory, external administration of TCM established a unique theoretical system and various therapeutic approaches in treating chronic wound, particularly on the utilization of “hot” and “cold” properties of TCM. However, its scientific implication and the underlying mechanism has yet to be understood for better use in clinical practice. Recent studies report that commensal microbiota can regulate immune responses and promote wound healing, while absolute sterility is not favourable in wound repair. These findings suggest a novel direction of TCM in the treatment of chronic wounds. In the present article, commensal microbiome and wound healing was summarized, while the representative external TCMand its roasting pus to promote regeneration role in regulating wound microbiome together with wound repair was also discussed. A research strategy based on the correlation between wound microbiome and gut microbiota was therefore raised here to further investigate hot or cold properties of TCM in the treatment of chronic wounds. This article will provide a new idea for future modern research of TCM in treating chronic wounds.
external traditional Chinese medicine; chronic wounds; roasting pus to promote regeneration; commensal microbiome; hot and cold natures;(Batsch ex Pers.) Lloyd
R28;R285
A
0253 - 2670(2022)23 - 7606 - 07
10.7501/j.issn.0253-2670.2022.23.032
2022-06-08
江苏省中药资源产业化过程协同创新中心重点项目(ZDXM-2020-25)
通信作者:陈 军(1975—),男,教授,博士生导师,主要从事中药外用制剂研究。Tel: (025)85811611 E-mail: chenjun75@163.com
段金廒(1956—),男,教授,博士生导师,主要从事中药资源研究。Tel: (025)85811291 E-mail: dja@njucm.edu.cn
[责任编辑 王文倩]
