地黄治疗2型糖尿病作用机制的研究进展
2022-12-08田文国盖晓红王春芳陈金鹏田成旺
田文国,刘 毅,盖晓红,王春芳,任 涛,陈金鹏*,田成旺*
地黄治疗2型糖尿病作用机制的研究进展
田文国1, 2,刘 毅2, 3, 4,盖晓红2, 3, 4,王春芳1, 2,任 涛2, 3, 4,陈金鹏2, 3, 4*,田成旺2, 3, 4*
1. 天津中医药大学,天津 301617 2. 天津药物研究院,天津 300462 3. 天津市中药质量标志物重点实验室,天津 300462 4. 释药技术与药代动力学国家重点实验室,天津 300462
2型糖尿病(type 2 diabetes mellitus,T2DM)是一种常见的由多因素共同导致的慢性代谢紊乱疾病。随着我国老龄化的加剧以及不健康的生活方式,T2DM发病率持续升高并趋于年轻化。地黄是传统的常用大宗药材之一,近年来发现地黄在治疗T2DM及其并发症方面疗效显著。通过查阅近年来国内外有关地黄治疗T2DM作用机制的相关文献,对地黄单味药材及其有效成分和含地黄的中药复方通过改善胰岛素抵抗、胰岛β细胞功能受损、基因、氧化应激、炎症反应以及肠道菌群失衡等方式治疗T2DM的研究进展进行综述,以期为地黄治疗T2DM的临床应用提供实验依据与理论参考。
2型糖尿病;地黄;药效成分;复方;作用机制
糖尿病是以慢性高血糖为特征,由遗传和环境因素相互作用导致的糖、蛋白和脂质代谢紊乱的慢性代谢性疾病[1]。随着人们生活水平的提高,糖尿病的患病人数呈逐年增加趋势,已经被列为继肿瘤、心血管疾病之后的第3大致死性疾病[2]。据国际糖尿病联盟(international diabetes federation,IDF)2021年统计,全球成年糖尿病患者数为5.37亿,并且预计到2045年,全球糖尿病患者人数预计将达到7.84亿[3]。根据世界卫生组织及IDF专家组建议,糖尿病可以分为1型糖尿病(type 1 diabetes mellitus,T1DM)、T2DM、妊娠糖尿病及其他特殊类型糖尿病4类,其中T2DM占糖尿病患者人数90%以上[4]。T2DM患者血糖如果控制不佳,会诱发多种并发症,如大血管病变(脑血管、外周血管)[5]、微血管病变(肾脏、视网膜)、神经病变[6]及银屑病[7]等,严重危及了患者健康和生命安全。T2DM病因复杂,其机制主要涉及胰岛素抵抗(insulin resistance,IR)、胰岛β细胞功能受损、基因、氧化应激、炎症反应以及肠道菌群失衡等。
目前治疗T2DM主要有注射胰岛素和口服降糖药物等方式,口服降糖药物包括双胍类(二甲双胍等)、磺脲类(格列吡嗪等)、α-糖苷酶抑制剂(阿卡波糖等)、格列奈类(瑞格列奈等)、噻唑烷二酮类(罗格列酮等)等。虽然化学药治疗T2DM见效快,但药物作用靶点单一,长期服用易引发酮酸中毒、出现继发性失效、肝肾慢性损伤及胃肠道消化不良等不良反应,因此迫切需要寻找更加合适的降糖药物。中医传承发展几千年,论治疾病能够从整体出发,综合调理人体气血阴阳,可有效防治疾病,在治疗糖尿病方面具有独到的见解。糖尿病在中医中属“消渴”的范畴,中医认为情志不畅、饮食不节为其主要病机,历代中医名家在“消渴症”的治疗过程中积累了大量的宝贵经验,主张以滋补肝肾、益气养阴为治疗原则。中药复杂多样的成分可发挥协同作用,代表传统的联合治疗模式[8-10]。从中药中开发T2DM治疗药物,具有疗效确切、成本低等优点。
地黄为玄参科植物地黄Libosch.的新鲜或干燥块根,地黄性寒,味甘、苦,归心、肝、肾经,具有清热凉血、养阴生津的功效,适用于舌绛烦渴等[11],其始载于《神农本草经》,被列为上品,是我国常用的大宗药材之一,因其不良反应小、能显著改善T2DM临床症状等优点而得到了广泛的应用,与人参、栝楼、葛根共称为中药治疗“消渴症”之四大圣药[12],已有上千年的用药历史。地黄根据其炮制方法的不同,可分为鲜地黄、生地黄、熟地黄和地黄炭,而地黄中含量较高的环烯醚萜单糖苷梓醇、地黄低聚糖和地黄多糖抗T2DM药理作用已成为研究热点。本文从地黄单味药材、有效成分和地黄复方等层面阐述其治疗T2DM的作用机制,以期为地黄治疗T2DM临床应用提供实验依据与理论参考。
1 单味药材
地黄为传统的大宗药材,现代研究表明,地黄对心血管疾病[13]、骨质疏松[14]和白细胞减少症[15]等疾病有显著疗效。孟祥龙等[16]建立高脂饮食并链脲佐菌素(streptozotocin,STZ)诱导T2DM小鼠模型,研究发现小鼠ig生地黄低、高(5、15 g/kg)、熟地黄低、高(5、15 g/kg)剂量4周后,Western blotting测定显示,与模型组相比,小鼠胰腺、肾脏、肝脏中核因子-κB(nuclear factor-κB,NF-κB)、Nod样受体蛋白3(Nod-like receptor protein 3,NLRP3)水平显著降低,腺苷酸活化蛋白激酶(adenosine monophosphate activated protein kinase,AMPK)、磷酸化AMPK(phosphorylation AMPK,p-AMPK)的表达水平明显升高,由此推测其改善T2DM的机制可能为生、熟地黄通过升高p-AMPK/AMPK的表达水平以减少NF-κB的活化,进而控制NLRP3炎症小体活化介导的炎症反应。核因子-E2相关因子(nuclear factor-erythroid 2-related factor 2,Nrf2)是一种重要的转录因子,参与胰岛素信号系统和炎症信号调节,当氧化应激激活时,Nrf2系统可以从细胞质转移到细胞核,并开始调控抗氧化酶的表达,与IR密切相关,是人体中一种重要的保护机制[17]。Ren等[18]研究地黄水提物对百草枯诱导的IR型糖尿病大鼠抗氧化系统Nrf2的影响,研究表明,对小鼠ig地黄水提液(1.2 g/kg)连续1周,能有效改善百草枯诱导的小鼠糖代谢紊乱,其机制可能为激活Nrf2水平,增强胰岛素信号系统传导,进而改善IR。糖尿病肾病(diabetic nephropathy,DN)是T2DM的一种常见的并发症,长期糖代谢紊乱可激活肾素-血管紧张素系统,增加肾小球滤过率和肾体积,造成肾组织微血管病变,严重影响糖尿病患者的生存质量[19]。此外,还有研究表明地黄还可通过抗氧化作用减轻DN大鼠肾组织病变[20]。
2 有效成分
迄今为止,从鲜地黄、生地黄、熟地黄、地黄叶及地黄愈伤组织中,共分离鉴定出化合物200余种,主要包括环烯醚萜类、紫罗兰酮类、苯乙醇类及糖类等[21]。现代药理学研究证明地黄中环烯醚萜苷类的代表性成分梓醇、低聚糖、多糖是地黄治疗T2DM的主要有效成分。
2.1 梓醇
梓醇是一种不稳定的环烯醚萜单糖苷,在鲜地黄中含量最多,经加工炮制后含量大幅下降。梓醇作为地黄的主要活性成分之一,体内外药理研究表明其具有抗炎[22]、抗肿瘤[23]、抗氧化[24]等多种药理作用。Bhattamisra等[25]使用PubMed和Science Direct等多种搜索引擎检索包含梓醇、T1DM、T2DM和糖尿病并发症等关键词的相关文献,检索结果表明梓醇可通过抗氧化、改善线粒体功能、抗炎、抗凋亡和抗纤维化等途径改善糖尿病及其并发症。磷脂酰肌醇-3-激酶(phosphatidylinositol-3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)通路在胰岛素信号通路中起重要作用,被认为是糖异生和糖原合成的关键调控因子[26-27],并且IR常与PI3K/Akt通路抑制有关[28]。还原型烟酰胺腺嘌呤二核苷酸磷酸氧化酶4(nicotinamide adenine dinucleotide phosphate oxidase type 4,NOX4)可介导氧化应激,AMPK可激活PI3K/Akt信号通路。Yan等[29]采用高脂饮食联合ip STZ诱导C57BL/6J小鼠建立T2DM模型,研究梓醇(0.1、0.2 g/kg)对T2DM IR的治疗作用,结果表明,与模型组相比,给药组可显著改善小鼠肝脏NOX4介导的氧化应激,激活AMPK和PI3K/Akt通路,综上表明梓醇可通过AMPK/NOX4/PI3K/Akt通路改善T2DM小鼠的IR。Zhou等[30]通过研究梓醇对高脂饮食诱导小鼠IR和脂肪组织炎症的影响,实验表明,ig梓醇(0.1 g/kg)连续4周,小鼠脂肪组织中c-Jun氨基末端激酶(c-Jun-terminal kinase,JNK)和NF-κB下降,巨噬细胞对脂肪组织的浸润显著减少,而且小鼠空腹血糖、糖耐量和胰岛素耐受性明显改善,而JNK和NF-κB信号通路是参与脂肪组织炎症和IR的关键信号通路,提示梓醇可能通过抑制JNK和NF-κB信号通路,减轻炎症反应,从而改善T2DM病症。此外,还有研究表明梓醇可通过抑制活性氧的产生和NF-κB活性来抑制晚期糖基化终末产物介导的炎症反应进而影响T2DM病情发展[31],并且还有研究报道梓醇可通过抗氧化作用改善DN病症[32]。
2.2 地黄低聚糖
低聚糖又称寡糖,一般由2~10个单糖分子以糖苷键连接而成的糖。大量实验表明,地黄低聚糖具有保护神经元[33]、改善高血脂及保护肝脏组织[34]等作用。王晓莉等[35]观察地黄低聚糖对四氧嘧啶糖尿病大鼠的降糖作用和对肠道菌群的影响,与模型组相比,给药组ig地黄低聚糖(0.2 g/kg)连续给药2周后,结果表明给药组大鼠血糖降低,肝糖原含量增加,肠道菌群中双歧杆菌类杆菌、乳杆菌等优势菌群的数量明显增多,提示地黄低聚糖可能通过调节机体整体功能,改善菌群失调状况,进而改善糖T2DM。Chiu等[36]研究发现ig熟地黄低聚糖(0.1 g/kg)可降低雄性正常ICR小鼠肠道α-葡萄糖苷酶活及db/db T2DM小鼠糖耐量,并且体外研究发现熟地黄低聚糖还可抑制大鼠肝癌H4IIE细胞磷酸烯醇式丙酮酸碳羧化酶基因表达从而抑制糖异生,提示熟地黄低聚糖可开发为α-葡萄糖苷酶抑制药物。刘景龙[37]通过实验研究地黄低聚糖(0.1、0.2 g/kg)对高脂饮食加小剂量STZ联合诱导的T2DM模型大鼠的降血糖作用,实验表明,连续给予地黄低聚糖4周后,可增加T2DM大鼠体质量、葡萄糖激酶(glucokinase,GK)活性及基因表达量,降低其空腹血糖值、葡萄糖-6-磷酸酶(glucose-6-phosphatase,G-6-pase)活性及基因表达量[37-38]。GK可介导葡萄糖诱导胰岛素释放反应的幅度,控制肝细胞对葡萄糖的摄取利用,G-6-pase是催化葡萄糖-6-磷酸水解为葡萄糖的关键酶。由此提示地黄低聚糖改善T2DM机制可能为其通过提高T2DM大鼠GK活性及基因表达,降低G-6-pase活性及基因表达,进而发挥IR。此外,还有研究表明,地黄低聚糖还可通过多靶点重建神经内分泌免疫,进而稳定T2DM患者血糖[39]。
2.3 地黄多糖
多糖一般指超过10个单糖分子以糖苷键连接而成的聚合糖高分子碳水化合物。研究表明地黄多糖具有改善骨质疏松[40]、抗焦虑[41]、增强免疫[42]等作用。蔡春沉等[43]研究表明,采用ip STZ联合高脂高糖喂养诱导肥胖型T2DM大鼠模型,连续ip地黄多糖低、中、高(10、20、30 mg/kg)剂量4周,结果表明,各给药组血清中的胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)、葡萄糖依赖性促胰岛素释放肽(glucose-dependent insulinotropic peptide,GIP)水平有所升高,GLP-1及GIP可促进胰岛β细胞分泌胰岛素,提示地黄多糖可通过改善胰岛β细胞功能,促进胰岛素分泌,进而发挥治疗T2DM的作用。赵平鸽等[44]探讨地黄多糖对四氧嘧啶诱导的导致胰岛β细胞功能障碍小鼠的降血糖作用,实验表明,ig地黄多糖(0.3 g/kg)连续4周,能够降低糖尿病小鼠血糖水平,改善血脂紊乱,提示其作用机制可能为地黄多糖对糖尿病小鼠胰岛β细胞具有一定的修复作用。Wnt信号通路是糖尿病、骨质疏松发病的共同因素,有研究表明地黄多糖可改善T2DM大鼠骨代谢,发挥抗骨质疏松作用,其机制可能与Wnt通路激活有关[45]。过氧化物酶增殖物激活受体(peroxisome proliferators-activated receptor,PPAR)是一类配体激活的核转录因子,其亚型之一PPAR-γ在降低血糖过程中发挥重要作用,研究发现地黄多糖还可通过激活PPAR-γ信号通路治疗DN病症[46]。
2.4 地黄总苷
Wnt/β-连环蛋白(β-catenin)信号通路在细胞分化、黏附、存活、凋亡等方面发挥重要作用,参与肾小球细胞增殖和肾纤维化,影响DN的发生发展,而转化生长因子-β1(transforming growth factor-β1,TGF-β1)也可调节细胞的生长和分化。Dai等[47]利用ip小剂量STZ和高脂饮食加上5%葡萄糖饮用水建立DN大鼠模型,结果表明,ig地黄总苷低、高(4.3、7.2 g/kg)剂量组可有效降低Wnt、β-catenin、TGF-β1蛋白表达,进而改善DN大鼠肾组织病变,提示地黄总苷可通过抑制TGF-β1和Wnt/β-catenin信号通路治疗DN。
综上,地黄及其有效成分治疗T2DM的作用机制见图1。

图1 地黄及其有效成分治疗T2DM的作用机制
3 含地黄的中药复方
含地黄的中药复方已在T2DM长期治疗中取得不错的临床疗效,因此从含地黄的中药复方中找寻T2DM的治疗药物,已成为T2DM药物研发的热点。
3.1 六味地黄汤/丸
六味地黄汤/丸是治疗肾阴不足消渴症的基本方,药物组成为熟地黄、山茱萸、山药、泽泻、牡丹皮、茯苓。目前对六味地黄汤/丸药理作用取得了诸多研究进展,发现其具有降血压、调血脂、降血糖等药理作用。宋志龙等[48]利用网络药理学筛选出六味地黄丸环烯醚萜类、有机酸类化合物37个与T2DM作用靶点相关,这些靶点通路包括IR、炎症、氧化应激等,提示六味地黄丸可能是通过改善IR、抗炎、抑制氧化应激通路来实现治疗T2DM作用。Dai等[49]通过高糖高脂饮食结合小剂量STZ建立T2DM大鼠模型,探讨六味地黄汤对T2DM大鼠IR PI3K/Akt信号通路的影响及IR在T2DM中作用的潜在分子机制,ig六味地黄汤(6.75 g/kg)30 d后,苏木精-伊红染色法染色显示给药组T2DM大鼠肝细胞肿胀、脂肪变性、坏死等症状减轻。Western blotting检测PI3K、Akt蛋白表达水平升高,提示六味地黄汤可通过提高胰岛素敏感性,减轻肝组织病变,起到恢复T2DM IR所致的肝损伤。有研究表明,六味地黄汤可通过促进抗氧化防御系统的功能,抑制神经元凋亡,增加神经营养因子,改善T2DM病症及其脑性病变[50]。此外,还有研究发现,六味地黄丸还可通过降低血清炎症因子白细胞介素-6(interleukin-6,IL-6)、IL-8、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α),进而调节T2DM患者血糖水平[51]。
3.2 肾气丸
肾气丸包括干地黄、山药、山茱萸、泽泻、茯苓、牡丹皮、桂枝和附子共8味中药,是中医治疗糖尿病阴阳两虚证型的首选方剂。吴治谚等[52]研究肾气丸治疗糖尿病及其并发症疗效的Meta分析发现,以肾气丸为主方治疗糖尿病及其并发症时,在一定程度上,较常规化学药更加有效。徐锋等[53]基于网络药理学研究筛选得到肾气丸中包括熊果酸、槲皮素、地黄苷A、β-谷甾醇及梓醇等100个活性成分可通过调节IR、T2DM信号通路、胰岛素信号通路等通路来发挥其抗糖尿病作用,其机制涉及到调控基因的转录、抗细胞凋亡、抑制炎症等。此外,还有研究表明,肾气丸可通过上调PI3K、Akt及p-Akt蛋白表达,进而发挥治疗T2DM作用[54]。
3.3 当归六黄汤
当归六黄汤由当归、生地黄、熟地黄、黄芩、黄连、黄柏、黄芪组成,可应用于糖尿病和一些自身免疫性疾病的治疗。彭修娟等[55]利用网络药理预测了当归六黄汤治疗糖尿病的潜在作用机制,共筛选出挥发油、黄酮类、皂苷类成分潜在活性成分70个,可作用于内分泌系统、神经系统、核苷酸代谢等与糖尿病相关的富集通路。而且有研究表明,当归六黄汤可以通过抑制PI3K/Akt通路的活化,上调过氧化物酶体增殖物激活受体-γ蛋白和基因的表达,发挥抗IR作用,从而起到治疗T2DM的效果[56]。此外,还有研究发现当归六黄汤具有保护和修复胰岛β细胞的作用[57]。
3.4 千金黄连方
千金黄连方首载于孙思邈的中医名著《备急千金要方》,由黄连和生地黄组成。该方是治疗消渴病的名方,2药合用具有滋阴清热之功效。药理实验表明,其主要成分小檗碱、梓醇及其配伍均能增加葡萄糖消耗和转运,改善IR[58]。侯衍豹等[59]采用T2DM模型动物db/db小鼠观察千金黄连方对其血糖的影响,研究结果表明千金黄连方临床等效剂量(13 g/kg)ig给药,连续给药84 d,能显著降低db/db小鼠空腹血糖,改善糖耐量异常及增强胰岛素敏感性,显著减少腹部脂肪系数,并且实验还表明千金黄连方改善IR、增加胰岛素敏感性的作用强于二甲双胍和金芪降糖片。另有研究表明,千金黄连丸能显著改善T2DM大鼠“三多一少”症状,改善IR[60],增加超氧化物歧化酶(superoxide dismutase,SOD)活力,降低丙二醛含量,提高T2DM大鼠抗氧化应激能力及减少T2DM大鼠胰岛β细胞的损伤[61]。此外,还有研究发现千金黄连丸提取物能通过促进肝糖原的合成,抑制糖尿病大鼠肠道二糖酶活性来治疗T2DM[62]。以上报道表明千金黄连方有极大的研究开发价值,对于开发治疗T2DM中药具有重大意义。
3.5 知柏地黄汤
知柏地黄汤含知母、黄柏、熟地黄、山萸肉、山药、泽泻、丹皮、茯苓8味药材,具有益气养阴等功效。临床研究表明知柏地黄汤可用于治疗阴虚火旺密切相关的T2DM,能起到缓解葡萄糖毒性,改善机体IR状态[63]。伍启华[64]探讨知柏地黄汤对T2DM大鼠糖脂代谢紊乱的调节作用及可能机制,利用高脂高糖饮食喂养联合ip STZ方法建立T2DM大鼠模型,结果表明,与模型组相比,连续ig知柏地黄汤(3.8 g/kg)8周,生化检测血清总胆固醇、三酰甘油、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)降低,高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)升高,ELISA检测表明血清TNF-α、单核细胞趋化因子-1、IL-6、丙二醛降低,谷胱甘肽过氧化物酶、SOD的水平升高,提示知柏地黄汤可改善T2DM大鼠的糖脂代谢紊乱,其机制可能与抗炎和抑制氧化应激有关。钠-葡萄糖共转运蛋白2(sodium-glucose cotransporter 2,SGLT2)主要分布在肾脏的近曲小管,抑制SGLT2可阻断重吸收葡萄糖,发挥降血糖的作用。有研究显示知柏地黄汤还可通过下调SGLT2蛋白的表达,从而改善T2DM患者糖脂代谢及肾脏功能[65]。
3.6 玉泉丸
玉泉丸是由葛根、麦冬、地黄、五味子、天花粉和甘草组成的现代制剂浓缩丸,在临床上主要用于治疗气阴两虚型T2DM,具有低不良反应、作用效果缓和持久[66]、安全性高[67]等特点。王大庆[68]利用雄性Wistar大鼠饲以高糖高脂饲料联合STZ建立T2DM模型,ig玉泉丸(4、8、12 g/kg)连续给药8周,生化指标检测显示,各给药组均能不同程度地降低T2DM大鼠血清总胆固醇、三酰甘油、LDL-C,升高血清胰岛素及HDL-C,表明其可改善T2DM血脂紊乱。此外,还有研究发现,玉泉丸还可通过降低T2DM患者TNF-α、IL-6等细胞炎症因子,进而改善T2DM患者病症[69]。
3.7 消渴丸
消渴丸是由“玉泉散”和“消渴方”化裁,含地黄、五味子、黄芪、山药、葛根、天花粉、玉米须7味中药,再加入格列本脲而制成的中西复方制剂,因其治疗效果确切、经济实惠、不良反应少,已经成为气阴两虚的T2DM患者常用的药物之一[70]。研究表明,消渴丸临床应用于T2DM患者中,有助于降低患者血糖,减低血脂及炎症因子水平及改善患者糖脂代谢水平,可获得较高的近期疗效[71]。耿春贤等[72]研究发现连续ig消渴丸(2.8 g/kg)24周,可降低Goto-Kakizaki大鼠LDL-C、升高HDL-C的含量,表明消渴丸对调节脂代谢紊乱、保护胰岛功能具有积极作用。此外,还有研究发现消渴丸中药成分对大鼠小肠黏膜α-葡萄糖苷酶具有一定抑制作用,提示其具有开发为α-葡萄糖苷酶抑制剂药物的潜力[73]。除上述复方外,近年来还有其他含地黄的中药复方对T2DM也具有较好的疗效,详见表1。
4 结语
T2DM是一种常见的由多因素共同导致的慢性代谢紊乱性疾病,其病理改变是由胰岛素分泌相对不足而导致的糖、脂肪、蛋白质、维生素、电解质等代谢紊乱引起的。随着中国老龄化的发展,以及不健康生活方式的增多,T2DM发病率持续升高并趋于年轻化。T2DM及其并发症DN、糖尿病脑病、糖尿病足等严重影响着患者的生存和生活质量,如何有效防治T2DM,延缓其发生发展,改善预后和减少致残率及病死率,提供更有效更安全的治疗方案已经成为亟待解决的难题。但由于T2DM发病机制复杂,其发病机制尚未被完全阐明,目前机制主要指向IR、胰岛β细胞功能受损、基因、氧化应激、炎症反应以及肠道菌群失衡等方面,T2DM发病机制的绝对复杂性意味着用任何统一、简洁、直接的机制来理解T2DM都可能是不全面的。磺脲类药物、双胍类药物、α-糖苷酶抑制药物等多为化学合成药,具有疗效迅速、服用方便等优势,但因其作用靶点单一,易产生耐药性,患者在使用一段时间后必须更换药物品种,才能维持疗效,最终导致患者只能依赖注射胰岛素进行治疗。中医药治疗疾病是在辨证论治的基础上利用中药通过多环节、多途径、多靶点作用于全身各个脏器系统发挥作用的,与T2DM复杂机制参与的发病病理机制相吻合,因此,中医药在T2DM的防治中具有独特的优势。T2DM在中医属“消渴”范畴,我国自古就有应用中药进行T2DM治疗的报道,我国地理位置和气候条件得天独厚,药物资源丰富,传统中药治疗T2DM具有疗效确切、不良反应小及经济实惠等优势,已成为国内外学者研究的热点。近年来从信号通路、基因、细胞、动物实验、临床试验等多维度的研究充分展示了中药防治T2DM的优势。
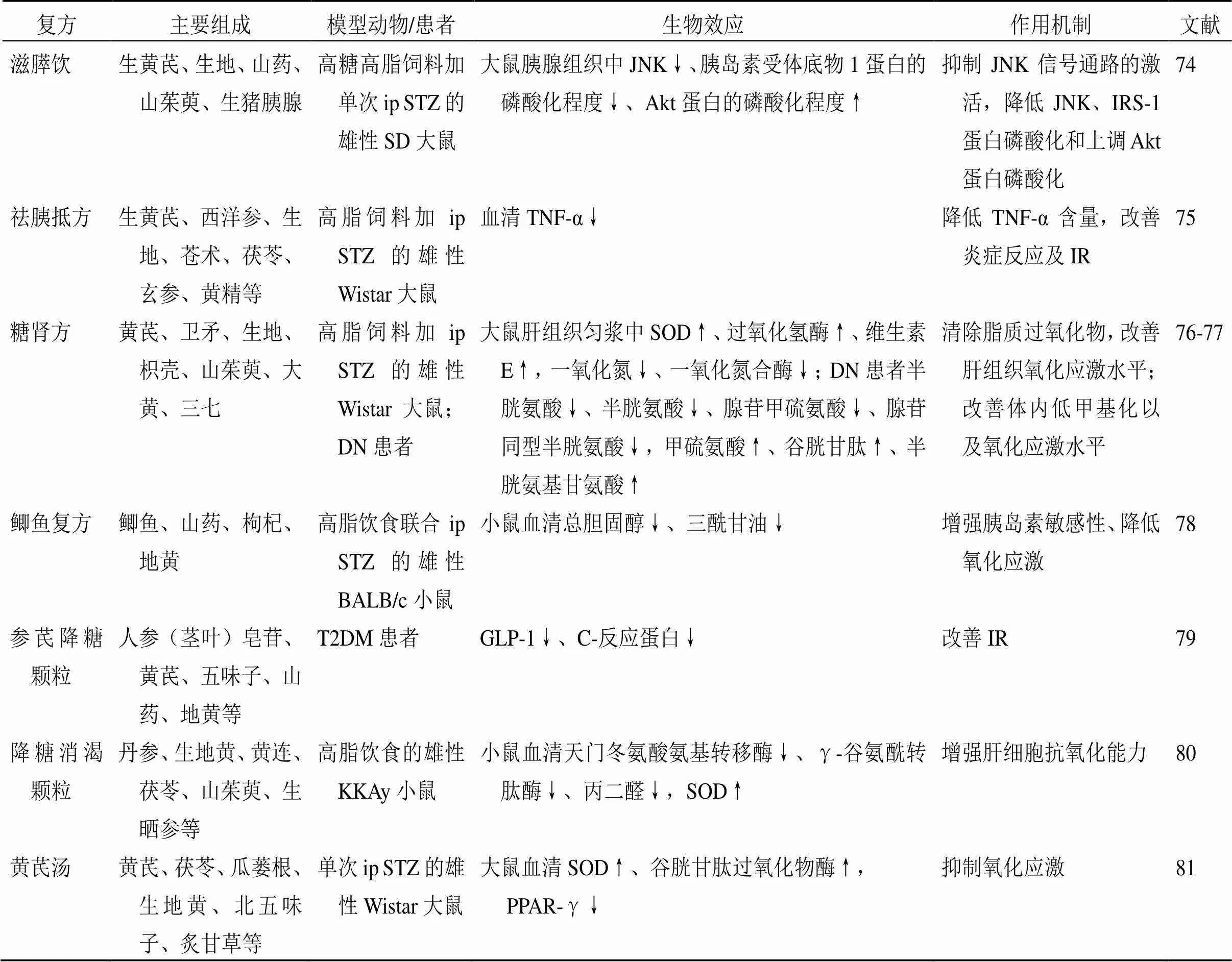
表1 含地黄的中药复方及其治疗T2DM的作用机制
“↑”表示显著升高,“↓”表示显著降低
“↑” indicates the significant increase, “↓” indicates the significant decrease
地黄从中医角度上讲具有清热凉血、养阴生津等功效,地黄及其配伍应用具有悠久的应用历史,大量的临床试验数据证明其具有优异的抗氧化、抗炎症和抗肿瘤等药理活性,其在防治T2DM及其慢性并发症中有着数千年的实践宝贵经验,随着现代医药学的发展,地黄在防治的T2DM理论和实践上都有了发展和创新。本文综述了地黄和地黄有效成分及其复方治疗T2DM的作用机制,包括地黄提取物(醇提物、水提物)、地黄环烯醚萜单糖苷梓醇、地黄低聚糖、地黄多糖以及千金黄连、六味地黄汤/丸、肾气丸等复方,数据显示其主要是通过调节多条信号通路进而发挥抗炎、抗氧化等机制发挥治疗T2DM的作用。
虽然地黄治疗T2DM的临床及实验研究取得了一定的成果,但地黄治疗T2DM的药效和机制研究还存在着一些问题。首先地黄治疗T2DM研究颇多,但重复性的研究偏多,目前临床应用地黄成型药物治疗T2DM较少,实际应用中通常其作为化学药治疗的辅助用药以加强疗效。其次,地黄成分的多样性导致了复杂的潜在作用机制,为明确其作用机制带来了困难,今后需加强对地黄单味中药、活性成分和复方的比较研究,选择好的给药方式。最后含地黄的复方发挥作用的分子机制错综复杂,其安全性评价仍有待进一步深化研究。总之,中医药以其独特的整体性和模式识别与治疗的特点,在T2DM防治过程中发挥重要作用,充分发挥中医药防治疾病的特色优势,积极开展中医药机制研究,对推动中医药现代化、国际化进程具有重要战略意义。而地黄作为传统中药,具有广阔的应用前景。随着T2DM在分子、基因等水平发病机制的研究不断深入,地黄在治疗T2DM的通路和靶点研究也在不断的深化并得到发掘。相信随着我国科学技术水平的不断进步,应用地黄等中药对T2DM及其并发症的防治率将大大提高,防治T2DM以提高全民公共健康水平也将取得重大进展。
利益冲突 所有作者均声明不存在利益冲突
[1] Xu C J, Cao Z, Yang H X,. Association between the EAT-lancet diet pattern and risk of type 2 diabetes: A prospective cohort study [J]., 2022, 8: 784018.
[2] Tai N, Wong F S, Wen L. The role of gut microbiota in the development of type 1, type 2 diabetes mellitus and obesity [J]., 2015, 16(1): 55-65.
[3] 全球5.37亿成人糖尿病中国有1.4亿 [N]. 医师报, 2021- 12-09 (B03).
[4] Lopes A, Roque F, Morgado S,. Behavioral sciences in the optimization of pharmacological and non-pharmacological therapy for type 2 diabetes [J]., 2021, 11(11): 153.
[5] Viigimaa M, Sachinidis A, Toumpourleka M,. Macrovascular complications of type 2 diabetes mellitus [J]., 2020, 18(2): 110-116.
[6] Faselis C, Katsimardou A, Imprialos K,. Microvascular complications of type 2 diabetes mellitus [J]., 2020, 18(2): 117-124.
[7] Lønnberg A S, Skov L, Skytthe A,. Association of psoriasis with the risk for type 2 diabetes mellitus and obesity [J]., 2016, 152(7): 761-767.
[8] Liu S Z, Deng Y X, Chen B,. Antihyperglycemic effect of the traditional Chinese Scutellaria-Coptis herb couple and its main components in streptozotocin-induced diabetic rats [J]., 2013, 145(2): 490-498.
[9] Bao S Y, Wang X Z, Ma Q Q,. Mongolian medicine in treating type 2 diabetes mellitus combined with nonalcoholic fatty liver disease via FXR/LXR-mediated P2X7R/NLRP3/NF-κB pathway activation [J].2022, 14(3): 367-375.
[10] Wang Z J, Bai Z, Yan J H,. Anti-diabetic effects of linarin fromvia AMPK activation [J]., 2022, 14(1): 97-103.
[11] 中国药典[S]. 一部. 2020: 129-130.
[12] 王明琴, 张雪荣, 吴宿慧, 等. 地黄用于消渴病研究进展 [J]. 新中医, 2021, 53(4): 19-24.
[13] Liu C L, Cheng L, Kwok H F,. Bioassay-guided isolation of norviburtinal from the root of, exhibited angiogenesis effect in zebrafish embryo model [J]., 2011, 137(3): 1323-1327.
[14] Gong W, Zhang N D, Cheng G,.Libosch extracts prevent bone loss and architectural deterioration and enhance osteoblastic bone formation by regulating the IGF-1/PI3K/mTOR pathway in streptozotocin-induced diabetic rats [J]., 2019, 20(16): 3964.
[15] 于震, 王军, 李更生, 等. 地黄苷A对环磷酰胺致小鼠白细胞减少症的影响[J]. 中草药, 2001(11): 45-47.
[16] 孟祥龙, 刘晓琴, 宁晨旭, 等. 生、熟地黄通过AMPK介导NF-κB/NLRP3信号通路改善高脂饲料并链脲佐菌素诱导的糖尿病小鼠的作用机制差异性研究 [J]. 中国中药杂志, 2021, 46(21): 5627-5640.
[17] Zhou Y Q, Zhang Y H, Wei J,. Cloning and analysis of expression patterns and transcriptional regulation of RghBNG in response to plant growth regulators and abiotic stresses in[J]., 2015, 4: 60.
[18] Ren L, Xu Y P, Qin G J,. Effects of water extracts ofon antioxidant system of Nrf2 in paraquat-induced insulin resistance diabetic rat model [J]., 2017, 14(6): 5847-5850.
[19] Atkins R C. The changing patterns of chronic kidney disease: The need to develop strategies for prevention relevant to different regions and countries [J]., 2005(98): S83-S85.
[20] Yokozawa T, Kim H Y, Yamabe N. Amelioration of diabetic nephropathy by dried(Di Huang) extract [J]., 2004, 32(6): 829-839.
[21] 陈金鹏, 张克霞, 刘毅, 等. 地黄化学成分和药理作用的研究进展 [J]. 中草药, 2021, 52(6): 1772-1784.
[22] Choi Y H. Catalpol attenuates lipopolysaccharide-induced inflammatory responses in BV2 microglia through inhibiting the TLR4-mediated NF-κB pathway [J]., 2019, 38(2): 111-122.
[23] Sun W X, Gao Y Y, Ding Y S,. Catalpol ameliorates advanced glycation end product-induced dysfunction of glomerular endothelial cells via regulating nitric oxide synthesis by inducible nitric oxide synthase and endothelial nitric oxide synthase [J]., 2019, 71(9): 1268-1283.
[24] Hu H M, Wang C Y, Jin Y,. Catalpol inhibits homocysteine-induced oxidation and inflammation via inhibiting Nox4/NF-κB and GRP78/PERK pathways in human aorta endothelial cells [J]., 2019, 42(1): 64-80.
[25] Bhattamisra S K, Koh H M, Lim S Y,. Molecular and biochemical pathways of catalpol in alleviating diabetes mellitus and its complications [J]., 2021, 11(2): 323.
[26] Whiteman E L, Cho H, Birnbaum M J. Role of Akt/protein kinase B in metabolism [J]., 2002, 13(10): 444-451.
[27] 万金艳, 龙宇, 张羽璐, 等. PI3K/Akt信号通路在糖尿病肾病中的作用及中药干预的研究进展 [J]. 中草药, 2021, 52(12): 3705-3716
[28] Yan F J, Dai G H, Zheng X D. Mulberry anthocyanin extract ameliorates insulin resistance by regulating PI3K/AKT pathway in HepG2 cells and db/db mice [J]., 2016, 36: 68-80.
[29] Yan J T, Wang C Y, Jin Y,. Catalpol ameliorates hepatic insulin resistance in type 2 diabetes through acting on AMPK/NOX4/PI3K/Akt pathway [J]., 2018, 130: 466-480.
[30] Zhou J, Xu G, Ma S,. Catalpol ameliorates high-fat diet-induced insulin resistance and adipose tissue inflammation by suppressing the JNK and NF-κB pathways [J]., 2015, 467(4): 853-858.
[31] Choi H J, Jang H J, Chung T W,. Catalpol suppresses advanced glycation end-products-induced inflammatory responses through inhibition of reactive oxygen species in human monocytic THP-1 cells [J]., 2013, 86: 19-28.
[32] Bao Q W, Shen X Z, Qian L,. Anti-diabetic activities of catalpol in db/db mice [J]., 2016, 20(2): 153-160.
[33] 史佳琳, 杨菁, 徐新利, 等. 地黄寡糖对谷氨酸诱导海马神经元损伤的影响 [J]. 中国药理学通报, 2009, 25(3): 357-361.
[34] Zhang R, Zhao Y, Sun Y,. Isolation, characterization, and hepatoprotective effects of the raffinose family oligosaccharides fromLibosch [J]., 2013, 61(32): 7786-7793.
[35] 王晓莉, 张汝学, 贾正平. 地黄寡糖灌胃对糖尿病大鼠的降糖作用及对肠道菌群的影响 [J]. 西北国防医学杂志, 2003, 24(2): 121-123.
[36] Chiu C Y, Hsu W H, Liu H K,. Preparedoligosaccharide regulates postprandial and diabetic blood glucose in mice [J]., 2018, 41: 210-215.
[37] 刘景龙. 地黄寡糖降血糖作用机制研究: 对肝糖代谢及相关基因表达的影响 [D]. 兰州: 兰州大学, 2009.
[38] 张汝学, 贾正平, 刘景龙, 等. 地黄寡糖对2型糖尿病大鼠肝脏糖代谢关键酶活性及基因表达的影响 [J]. 中草药, 2012, 43(2): 316-320
[39] Zhang R X, Zhou J, Li M X,. Ameliorating effect and potential mechanism ofoligosaccharides on the impaired glucose metabolism in chronic stress rats fed with high-fat diet [J]., 2014, 21(5): 607-614.
[40] Zhang Z J, Meng Y M, Guo Y X,.polysaccharide induces maturation of murine bone marrow derived Dendritic cells (BMDCs) [J]., 2013, 54: 136-143.
[41] Cui Y, Rong C L, Wang J M,. Mechanism-based anti-anxiety effects of polysaccharides extracted from Shudihuang () by two-dimensional electrophoresis analysis in rat Hippocampus proteins [J]., 2013, 33(4): 524-530.
[42] Huang Y E, Jiang C M, Hu Y L,. Immunoenhancement effect ofpolysaccharide on lymphocyte proliferation and dendritic cell [J]., 2013, 96(2): 516-521.
[43] 蔡春沉, 王洪玺, 王肃. 地黄多糖对肥胖糖尿病大鼠模型的治疗作用及对血清中GLP-1、GIP水平的影响 [J]. 中国老年学杂志, 2013, 33(18): 4506-4507.
[44] 赵平鸽, 刘晓. 地黄多糖的提取纯化及其对糖尿病小鼠血糖的影响研究 [J]. 海峡药学, 2010, 22(9): 29-32.
[45] 寇战利, 陈社论, 刘冰林. 地黄多糖通过Wnt通路对2型糖尿病大鼠骨代谢的调节作用及机制研究 [J]. 中医药导报, 2021, 27(9): 20-24.
[46] 康伟, 王肃. 地黄多糖对糖尿病肾病大鼠模型的治疗作用及对PPAR-γ信号通路的影响 [J]. 中国生化药物杂志, 2015, 35(9): 30-33.
[47] Dai X X, Su S L, Cai H D,. Protective effects of total glycoside fromleaves on diabetic nephropathy rats via regulating the metabolic profiling and modulating the TGF-β1 and Wnt/β-catenin signaling pathway [J]., 2018, 9: 1012.
[48] 宋志龙, 林奕凯. 基于网络药理学研究六味地黄丸干预二型糖尿病作用机制 [J]. 中国药师, 2020, 23(11): 2151-2155, 2183.
[49] Dai B, Wu Q X, Zeng C X,. The effect of Liuwei Dihuang Decoction on PI3K/Akt signaling pathway in liver of type 2 diabetes mellitus (T2DM) rats with insulin resistance [J]., 2016, 192: 382-389.
[50] Liu J P, Feng L, Zhang M H,. Neuroprotective effect of Liuwei Dihuang Decoction on cognition deficits of diabetic encephalopathy in streptozotocin-induced diabetic rat [J]., 2013, 150(1): 371-381.
[51] 吴涓涓. 六味地黄丸对2型糖尿病患者血糖控制及血清炎症因子表达的影响 [J]. 糖尿病新世界, 2018, 21(14): 77-78.
[52] 吴治谚, 张世鹰, 蔡虎志, 等. 肾气丸治疗糖尿病及其并发症疗效的Meta分析 [J]. 中国老年学杂志, 2016, 36(6): 1310-1312.
[53] 徐锋, 黄旭龙, 吴红梅, 等. 基于网络药理学的肾气丸治疗糖尿病作用机制研究 [J]. 中草药, 2019, 50(16): 3880-3890.
[54] 杨金伟, 喻嵘, 吴勇军, 等. 基于网络药理学探讨肾气丸干预2型糖尿病的分子机制及关键作用通路的验证 [J]. 北京中医药大学学报, 2021, 44(1): 60-68.
[55] 彭修娟, 许海燕, 陈衍斌, 等. 当归六黄汤治疗糖尿病的网络药理学作用机制分析 [J]. 中药新药与临床药理, 2019, 30(8): 952-958.
[56] Cao H, Tuo L L, Tuo Y L,. Immune and metabolic regulation mechanism of Dangguiliuhuang Decoction against insulin resistance and hepatic steatosis [J]., 2017, 8: 445.
[57] Liu T T, Cao H, Ji Y C,. Interaction of dendritic cells and T lymphocytes for the therapeutic effect of Dangguiliuhuang Decoction to autoimmune diabetes [J]., 2015, 5: 13982.
[58] 刘芳芳, 杨明炜, 王晓强, 等. 梓醇与小檗碱及其配伍对胰岛素抵抗3T3-L1脂肪细胞的影响 [J]. 中草药, 2007, 38(10): 1523-1526.
[59] 侯衍豹, 马莉, 黄妍, 等. 千金黄连方对db/db小鼠血糖的影响 [J]. 药物评价研究, 2022, 45(3): 455-463.
[60] 田爱平, 邹晨辉, 孙素娟, 等. 千金黄连丸加味方对胰岛素抵抗小鼠胰腺的影响 [J]. 中国中西医结合杂志, 2009, 29 (3): 242-245.
[61] 雷蕾. 基于传统用法的千金黄连丸治疗2型糖尿病大鼠的药效评价与机制研究 [D]. 武汉: 中南民族大学, 2019.
[62] Deng Y X, Zhang X J, Shi Q Z,. Anti-hyperglycemic effects and mechanism of traditional Chinese medicine Huanglian Wan in streptozocin-induced diabetic rats [J]., 2012, 144(2): 425-432.
[63] 曾纪斌, 蔡常娥, 陈春远, 等. 知柏地黄汤对阴虚火旺型2型糖尿病患者胰岛素抵抗指数的影响 [J]. 云南中医学院学报, 2016, 39(2): 70-72.
[64] 伍启华. 知柏地黄汤对2型糖尿病大鼠糖脂代谢紊乱的调节作用及机制 [J]. 广州中医药大学学报, 2019, 36(10): 1599-1603.
[65] 宋道飞, 万晓月, 文秀英, 等. 知柏地黄汤通过下调钠-葡萄糖共转运蛋白2保护2型糖尿病大鼠肾脏功能 [J]. 中国中西医结合杂志, 2021, 41(11): 1341-1346.
[66] 高曌, 骆天炯, 叶晨玉. 玉泉丸对气阴两虚型接受胰岛素治疗的糖尿病患者血糖波动的影响 [J]. 中草药, 2015, 46(15): 2275-2278.
[67] Peng S H, Xie Z Y, Zhang X Y,. Efficacy and safety of the Chinese patent medicine Yuquan pill on type 2 diabetes mellitus patients: A systematic review and meta-analysis [J]., 2021, 2021: 2562590.
[68] 王大庆. 玉泉丸对2型糖尿病大鼠糖脂代谢的影响 [J]. 中医药临床杂志, 2017, 29(1): 88-90.
[69] 邓银泉, 范小芬, 吴国琳, 等. 玉泉丸对2型糖尿病促炎细胞因子干预的影响 [J]. 中国中西医结合杂志, 2006, 26(8): 706-709.
[70] 刘峘, 谢雁鸣. 消渴丸上市后临床再评价文献综述 [J]. 中国中药杂志, 2011, 36(20): 2851-2854.
[71] 吕艳. 消渴丸在2型糖尿病患者中的疗效及对糖脂代谢的影响研究 [J]. 糖尿病新世界, 2021, 24(14): 69-72.
[72] 耿春贤, 刘菊妍, 邹琦, 等. 消渴丸中药组分对GK大鼠血脂、胰岛素和胰腺影响的实验研究 [J]. 世界中西医结合杂志, 2014, 9(8): 822-825.
[73] 钱瑾, 黎明, 吴嘉瑞, 等. 消渴丸中药成分对α-葡萄糖苷酶抑制作用的研究 [J]. 中国实验方剂学杂志, 2012, 18(7): 173-176.
[74] 刘欣欣, 白茹, 牛雯颖, 等. 滋膵饮对2型糖尿病模型大鼠的降糖作用及机制研究 [J]. 中国药房, 2019, 30(21): 2968-2972.
[75] 马建, 韩美子, 杜丽坤, 等. 祛胰抵方对2型糖尿病胰岛素抵抗大鼠TNF-α的影响 [J]. 中医药信息, 2013, 30(4): 51-53.
[76] 李忻, 顾立刚, 赵婷婷, 等. 糖肾方对2型糖尿病大鼠肝脏氧化应激水平及病理改变的影响 [J]. 天津医药, 2015, 43(7): 735-738.
[77] 江芝婷, 梁琼麟, 王义明, 等. 糖肾方对糖尿病肾病患者同型半胱氨酸代谢的影响 [J]. 中国中西医结合杂志, 2011, 31(8): 1057-1061.
[78] Wang Z H, Hsu C C, Lin H H,. Antidiabetic effects of Carassius auratus complex formula in high fat diet combined streptozotocin-induced diabetic mice [J]., 2014, 2014: 628473.
[79] 李晓琳, 马静, 王艳萍. 参芪降糖颗粒对2型糖尿病患者血清胰高血糖素样肽-1和C-反应蛋白的影响 [J]. 西北药学杂志, 2021, 36(1): 101-104.
[80] 张毅, 穆倩倩, 于娜, 等. 降糖消渴颗粒对自发性2型糖尿病KKAy小鼠肝脏功能和氧化应激的影响 [J]. 世界中医药, 2016, 11(9): 1849-1851.
[81] Han H Y, Cao A L, Wang L,. Huangqi decoction ameliorates streptozotocin-induced rat diabetic nephropathy through antioxidant and regulation of the TGF-β/MAPK/PPAR-γ signaling [J]., 2017, 42(5): 1934-1944.
Research progress on mechanism ofin treatment of type 2 diabetes mellitus
TIAN Wen-guo1, 2, LIU Yi2, 3, 4, GAI Xiao-hong2, 3, 4, WANG Chun-fang1, 2, REN Tao2, 3, 4, CHEN Jin-peng2, 3, 4, TIAN Cheng-wang2, 3 4
1. Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China 2. Tianjin Institute of Pharmaceutical Research, Tianjin 300462, China 3. Tianjin Key Laboratory of Quality Marker of Traditional Medicine, Tianjin 300462, China 4. State Key Laboratory of Drug Delivery and Pharmacokinetics, Tianjin 300462, China
Type 2 diabetes mellitus (T2DM) is a common chronic metabolic disorder caused by multiple factors. With the increasing aging in China and unhealthy lifestyle, the morbidity of T2DM continues to increase and tends to be younger. Dihuang () is one of the traditional bulk Chinese medicines. In recent years, it has been found thathas remarkable efficacy in the treatment of T2DM and its complications. In this paper, by reviewing the relevant literatures on the mechanism ofin treatment of T2DM at home and abroad in recent years, research progress on treatment of T2DM byand its effective ingredients and prescription containingthrough improving insulin resistance, impairing islet β cell function, genetic, oxidative stress, inflammatory response and imbalance of intestinal flora were reviewed, which can provide experimental basis and theoretical reference for the clinical application ofin the treatment of T2DM.
type 2 diabetes mellitus;; effective ingredients; compound; mechanism
R282.710.5
A
0253 - 2670(2022)23 - 7575 - 10
10.7501/j.issn.0253-2670.2022.23.029
2022-07-01
国家自然科学基金青年科学基金资助项目(82003936);中医药国际合作专项(0610-2140NF020630);释药技术与药代动力学国家重点实验室(天津药物研究院)开放课题资助项目(010161003)
田文国,硕士研究生,研究方向为药物分析与质量标志物。E-mail: tian_wen_guo@163.com
通信作者:陈金鹏,博士,助理研究员,主要从事中药新药研发及中药质量标准、药效物质基础研究。E-mail: chenjp@tjipr.com
田成旺,博士,研究员,主要从事中药新药研发及中药质量标准、药效物质基础研究。E-mail: tiancw@tjipr.com
[责任编辑 崔艳丽]
