中药多糖对非酒精性脂肪性肝病改善作用及机制研究进展
2022-12-08吴江平袁平川邵太丽柳春燕王国栋
刘 伟,吴江平, 2, 3,袁平川, 2, 3,邵太丽, 2, 3,柳春燕, 2, 3, 4,王国栋, 2, 3, 4*
中药多糖对非酒精性脂肪性肝病改善作用及机制研究进展
刘 伟1,吴江平1, 2, 3,袁平川1, 2, 3,邵太丽1, 2, 3,柳春燕1, 2, 3, 4,王国栋1, 2, 3, 4*
1. 皖南医学院药学院药物研发中心,安徽 芜湖 241002 2. 安徽省多糖药物工程技术研究中心,安徽 芜湖 241002 3. 安徽省皖南地区植物药活性物质筛选与再评价工程实验室,安徽 芜湖 241002 4. 活性生物大分子研究安徽省重点实验室,安徽 芜湖 241002
多糖是高等植物、动物细胞膜和微生物细胞壁的重要组成部分,在自然界中广泛存在,是一种重要的天然生物大分子,具有多种生物活性。非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是一种以肝细胞内脂质过载为特征的慢性肝病。近年来,研究发现中药多糖可通过调节脂质代谢紊乱、调节肠道菌群、减轻胰岛素抵抗与氧化应激、改善线粒体功能障碍等多种途径改善NAFLD。归纳总结了近年来中药多糖改善NAFLD的药理作用及相关机制,以期为多糖在NAFLD防治中的治疗应用提供一定的理论参考。
多糖;非酒精性脂肪性肝病;脂质代谢;胰岛素抵抗;氧化应激;肠道菌群
多糖是机体活动中必不可少的生物大分子,通常由10个或10个以上单糖通过不同类型的糖苷键连接构成,广泛存在于动物、植物和微生物当中[1]。多糖具有生物活性多样、空间结构复杂、自然界中广泛存在等特点[2]。随着研究的深入,研究者们发现多糖具有调节脂质代谢紊乱、调节肠道菌群、减轻胰岛素抵抗(insulin resistance,IR)与氧化应激、改善线粒体功能障碍等生物活性[3]。此外,部分多糖经结构修饰或与其他药物联用后,生物活性会大幅提升,这表明多糖类药物在疾病的防治中具有很大开发潜力[4-5]。
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是指除酒精和其他明确的损肝因素所致的,以弥漫性肝细胞大泡性脂肪变为主要特征的临床病理综合征,包括单纯性脂肪肝以及由其演变的脂肪性肝炎和肝硬化,与肥胖和2型糖尿病等疾病密切相关,同时也是导致肝病发生率不断增加的关键因素[6]。“两次打击”学说认为IR与氧化应激是NAFLD发生、发展的主要机制[7]。随着NAFLD研究的深入,“多次打击”学说认为肠道菌群结构失衡、炎症、内质网应激、线粒体损伤、肝纤维化、肝细胞凋亡等也是NAFLD重要的发生机制[8-9]。然而,健康的生活方式配合保肝类药物辅助治疗仍是目前临床防治NAFLD的主要方式[10]。
近年来,大量研究表明多糖能有效改善NAFLD脂质代谢紊乱和肝脏损伤,并对其机制进行了深入研究。本文综述了中药多糖对NAFLD改善作用及机制的研究进展,并对现有研究存在的问题和解决办法进行了讨论,旨在为中药多糖防治NAFLD提供一定的理论支持。
1 调节脂质代谢紊乱
脂肪在肝脏中过度积累是NAFLD发生的第1个关键步骤,其主要原因是脂肪合成与分解的失衡。细胞中的脂质,如三酰甘油(triglycerides,TG)、磷脂、糖脂、胆固醇酯等的代谢失衡,可能会引起脂肪合成增加与分解减慢,最终导致脂肪过度积累,诱发NAFLD等疾病[11]。
多糖可调控多种脂质代谢信号通路的表达,从而发挥脂质代谢改善作用。黄芪多糖是黄芪中一种关键活性物质。王春花等[12]研究发现对高脂高糖饮食小鼠连续ig黄芪多糖400 mg/kg 8周能有效减轻小鼠肝脂肪变性程度,降低血清TG、总胆固醇(total cholesterol,TC)、天冬氨酸氨基转移酶(aspartate aminotransferase,AST)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)、碱性磷酸酶(alkaline phosphatase,ALP)和葡萄糖水平,并使肝脏Toll样受体4(Toll-like receptor 4,TLR4)和髓样分化因子88(myeloid differentiation factor 88,MyD88)表达下降,提示黄芪多糖可能通过抑制TLR4/MyD88信号通路减轻肝脂肪变性,改善血脂紊乱。肠道通透性增加会促进NAFLD发展,荧光标记葡聚糖实验表明,小鼠ig黄芪多糖的肠道通透性显著低于ig高脂高糖的小鼠,提示黄芪多糖可改善NAFLD小鼠的肠道通透性,抑制NAFLD发展。核转录因子E2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)/血红素加氧酶-1(heme oxygenase-1,HO-1)是体内氧化应激经典信号通路,研究发现,对血脂紊乱大鼠ig黄芪多糖200 mg/kg 14 d后,血清TG、ALT、AST、ALP水平均显著降低,肝脏Nrf2、HO-1蛋白表达升高,提示黄芪多糖可能通过调控Nrf2/HO-1信号通路减轻氧化应激损伤,保护肝脏[13]。崔宁等[14]在研究黄芪各成分改善脾虚水湿不化大鼠肝功能实验中发现,黄芪多糖对肝功能提升作用最为明显,且能促进胆固醇代谢,改善血脂紊乱。枸杞多糖对NAFLD及糖脂代谢相关疾病都有良好的治疗效果。研究人员发现枸杞多糖可显著降低NAFLD大鼠TG、TC、AST、ALT水平,并增加高密度脂蛋白(high-density lipoprotein,HDL)水平,改善脂质代谢紊乱,其机制可能与调控脂质代谢通路解偶联蛋白2(uncoupling protein 2,UCP2)/沉默信息调节因子3(silent information regulator 3,SIRT3)的表达有关,且这种改善作用在联合有氧运动后显著提升[15]。此外,枸杞多糖也可显著调节NAFLD伴发糖尿病前期大鼠血浆中饱和脂肪酸和不饱和脂肪酸水平,从而调节游离脂肪酸(free fatty acids,FFAs)代谢紊乱,改善大鼠口服糖耐量,这说明枸杞多糖可缓解NAFLD大鼠脂肪酸谱的异常变化,改善NAFLD脂肪变性,从而发挥保肝作用[16]。肝脏脂肪合成与分解的失衡是引起NAFLD的关键因素,而腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)是重要的细胞能量传感器,中药多糖可通过激活AMPK信号通路,抑制肝脏脂肪生成,促进脂肪分解。一种从麦冬根茎中分离纯化且糖链结构清晰的果聚糖MDG-1具有改善NAFLD脂质代谢紊乱的功效,其机制被认为可能与其调节AMPK/固醇调节元件结合蛋白-1c(sterol regulatory element binding protein-1c,SREBP-1c)等脂代谢信号通路,抑制NAFLD肝脏脂肪合成,促进胆汁酸代谢有关[17-18]。五味子多糖可显著降低高脂饮食大鼠血清TG、TC和低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)水平,增加高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)水平,抑制脂肪合成信号通路SREBP-1c/脂肪酸合成酶(fatty acid synthase,FAS)/乙酰辅酶A羧化酶(acetyl-CoA carboxylase,ACC)表达,减少脂肪积累,提示五味子多糖可通过减少脂肪合成改善NAFLD[19-20]。红景天多糖是红景天根茎中的主要活性成分。研究发现,对高脂饮食大鼠ig红景天多糖150 mg/kg连续8周,大鼠肝脏病理损伤减轻,血清TG、TC、ALT、AST水平均显著降低,肝脏内AMPK和过氧化物酶体增殖剂激活受体α(peroxisome proliferators activated receptor α,PPARα)表达均显著升高,SREBP-1c表达显著降低,提示红景天多糖可能通过调控AMPK/PPARα/SREBP-1c信号通路,抑制脂肪合成的同时促进脂肪分解,从而改善血脂紊乱,减轻NAFLD肝脏损伤[21]。Wu等[22]发现对高脂饮食大鼠ig贻贝葡聚糖MP-A 600 mg/kg 4周后,与模型组比较,大鼠肝质量降低,脂肪变性程度减轻,血清与肝脏TG、LDL-C、HDL-C水平均降低,肝脏SREBP-1c、PPARg蛋白表达均下降,提示MP-A可通过调控SREBP-1c/PPARg信号通路抑制脂肪合成,促进脂肪分解,改善血脂水平紊乱与肝脏脂肪变性。载脂蛋白是血浆脂蛋白中的蛋白质部分,在脂质代谢平衡中发挥着重要的作用。其中,载脂蛋白A1(apolipoprotein A1,ApoA1)和载脂蛋白B(apolipoprotein B,ApoB)分别是HDL-C和LDL-C的主要结构蛋白。张赫等[23]研究发现,对高脂乳胶诱导大鼠ig黑木耳多糖50、100、200 mg/kg 6周后,大鼠血清TG、肝湿质量、肝指数均下降,HDL-C水平升高,LDL-C水平降低,且ApoA1和ApoB的表达均显著降低,提示黑木耳多糖可能通过抑制载脂蛋白活性与表达,减少胆固醇合成,改善血脂紊乱,从而减轻肝脏损伤。浒苔多糖是一种硫酸化多糖,研究发现对高脂饮食大鼠ig浒苔多糖200 mg/kg 5周后,肝脏TG、TC、胆固醇水平均显著下降,胱硫醚b-合成酶(cystathionineb-synthase,CBS)和胱硫醚γ裂解酶(cystathionine γ-lyase,CSE)表达均显著增加,血清硫化氢水平也显著升高[24]。以上数据共同提示浒苔多糖可能通过上调CBS/CSE表达升高血清硫化氢水平,从而改善脂质代谢。
具有脂质代谢改善作用是中药多糖发挥NAFLD保护作用的基础条件,安全有效、不良反应小、可用于临床防治NAFLD的多糖仍需进一步深入研究。中药多糖可多途径改善脂质代谢紊乱,减少肝脏脂肪积累,其主要机制见表1。
2 调节肠道菌群
肠道菌群在机体营养摄取和能量调节中发挥着不可替代的作用。近年来,肠道菌群与肝脏的密切联系(肠-肝轴)备受关注,为NAFLD防治提供了新思路[29-30]。研究发现,肠道菌群中主要的门,如厚壁菌门(Firmicutes)与拟杆菌门(Bacteroides)的相对丰度(F/B)值的增加和一些特定菌群的变化可以促进NAFLD的发生、发展[31]。同时,肠道菌群结构失衡也会破坏肠道屏障完整性,促内源性乙醇、脂多糖等内毒素流向肝脏,损伤肝脏的同时加重炎症反应和IR[32-34]。多糖可通过调节肠道菌群改善NAFLD血脂紊乱、炎症损伤、IR等。
灵芝水提物中分离得到的高相对分子质量(>3×105)多糖可改善高脂饮食造成的肥胖和高脂血症,降低F/B比值和变形菌门(Proteobacteria)水平[35]。此外,灵芝多糖和壳聚糖可以协同调节高脂饮食金仓鼠的血脂水平,减轻其肝脏损伤和肠道菌群结构紊乱,并增加普雷沃氏菌属和颤螺菌属等有益菌的相对丰度。研究还发现,普雷沃氏菌属、拟普雷沃氏菌属、双歧杆菌属和另枝菌属的相对丰度与高脂饮食金仓鼠的血清脂谱呈负相关,这提示一些特定细菌与脂代谢密切关联[36]。麦冬果聚糖MDG-1干预NAFLD小鼠后,a-和b-多样性分析共同表明小鼠肠道内菌群整体丰富度和多样性均得到明显提升,并且在门和属水平上,MDG-1在显著降低F/B值的同时,也增加了嗜黏蛋白阿克曼菌属的相对丰度[18]。其中,F/B值的降低被认为能减肥、调脂和降血糖;嗜黏蛋白阿克曼菌属的丰度与NAFLD发展呈负相关[17]。此外,MDG-1还促进了乙酸与戊酸等短链脂肪酸(short-chain fatty acids,SCFAs)的产生,帮助改善NAFLD[37]。针对多糖能否进入血液发挥调脂功效这一问题,菌群移植实验揭示了MDG-1可能是被肠道中细菌降解利用后引起一些菌群变化,从而间接发挥调脂、抗炎等功效,但这一假说是否成立还需进一步研究,不过这提示多糖功效的发挥可能是间接性的[38-39]。对NAFLD大鼠连续ig贻贝葡聚糖MP-A 600 mg/kg 5周后,稀疏曲线和主坐标分析表明,长期高脂饮食显著降低了大鼠肠道菌群丰富度和多样性,而MP-A显著逆转了这种降低。在门水平上,MP-A显著降低了F/B值;在属水平上,高脂饮食导致63个属相对丰度发生变化,其中13个属被MP-A显著改变,包括拟普雷沃氏菌属、拟杆菌属、嗜黏蛋白阿克曼菌属等6个属相对丰度显著升高,异杆菌属、绿脓杆菌属、氢噬胞菌属等7个属相对丰度显著降低,提示MP-A可在门和属水平上调节肠道菌群发挥NAFLD治疗作用。此外,MP-A还可显著降低NAFLD大鼠血浆中内源性乙醇和脂多糖含量,升高乙酸、丙酸、丁酸的含量,其中丁酸的高水平与肠道屏障完整性呈正相关,以上数据提示MP-A可减少内毒素产生和促进SCFAs生成,恢复肠道屏障完整性[22]。螺旋藻多糖是螺旋藻中含量最丰富的活性成分,研究证实螺旋藻多糖不仅可以改善高脂饮食大鼠血脂紊乱、高血糖和脂肪变性,还可降低大鼠盲肠内容物菌群F/B值和丙酸含量,提示螺旋藻多糖可通过调节肠道菌群改善NAFLD[40]。
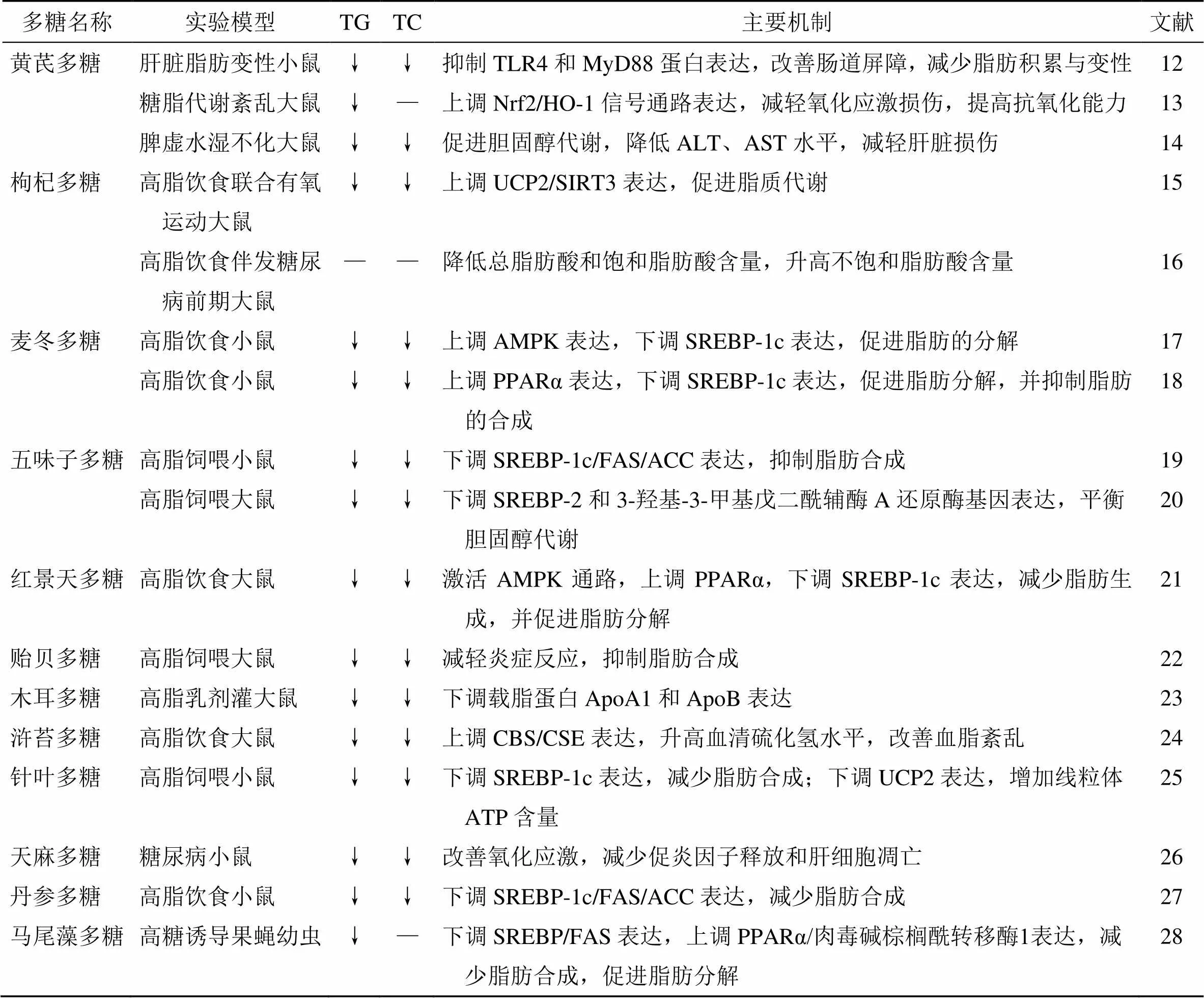
表1 中药多糖调节NAFLD脂质代谢及主要机制
“↓”表示降低;“—”表示不变
“↓” indicates decrease; “—” indicates no change
3 减轻IR
IR是引起脂肪变性的主要原因,在NAFLD患者中几乎都存在IR[41]。一些多糖能通过改善胰岛素敏感性,抑制新生脂肪合成,从而减少FFAs流向肝脏,改善NAFLD血脂水平。
红芪多糖被证实可增加IR-HepG2细胞的胰岛素敏感性,改善细胞糖代谢功能[42]。甜玉米芯多糖可增加IR-HepG2细胞的葡萄糖摄取和糖原含量,升高细胞活力和超氧化物歧化酶(superoxide dismutase,SOD)水平,降低丙二醛和活性氧水平,缓解肝细胞氧化应激损伤,改善肝细胞IR和糖代谢[43]。沙棘多糖[44]、蓝刺头多糖[45]、桦褐孔菌质多糖[46]及苦瓜碱提多糖[47-48]均能促进IR-HepG2细胞葡萄糖摄取和糖原含量的增加,降低细胞内TG和TC水平,改善IR。其中,沙棘多糖还可缓解糖尿病大鼠IR与肾损伤,减轻肝脏脂肪积累[49]。蓝刺头多糖还可促进IR骨骼肌细胞葡萄糖消耗,改善胰岛素敏感性[50]。此外,威灵仙多糖[51]、酵母多糖[52]、黄芪多糖[53]均能显著降低NAFLD大鼠或小鼠IR指数和血糖水平,改善NAFLD。
4 减轻氧化应激
由活性氧和炎症反应引起的氧化应激是导致细胞和组织损伤的重要因素。过量的活性氧还会攻击抗氧化防御系统,进一步加剧氧化应激损伤,而线粒体功能破坏、抗氧化酶活性下降、白细胞聚集以及肝炎等都是导致活性氧过量的重要因素[54-56]。
Nrf2/HO-1信号通路通过增强偶联反应和细胞抗氧化基因表达,调控解毒及消除活性氧蛋白的产生,是氧化应激经典信号通路。Deng等[57]研究发现,对蛋氨酸及胆碱缺乏饮食小鼠连续ig慈菇多糖800 mg/kg 12周后,血浆TG、TC、花生四烯酸水平均显著降低,肝脏SOD、谷胱甘肽、Nrf2和HO-1蛋白表达均显著升高,表明慈菇多糖可能通过激活Nrf2/HO-1信号通路改善脂质紊乱,促进花生四烯酸代谢,减轻肝脏氧化应激,从而发挥NAFLD保护作用。菊苣多糖被证实能显著降低NAFLD大鼠血清丙二醛水平,升高SOD水平,提高大鼠抗氧化能力,从而减轻氧化应激损伤[58]。裙带菜多糖可促进动脉粥样硬化伴发NAFLD前期小鼠的主动脉扩张,并激活Kelch样环氧氯丙烷相关蛋白1(Kelch-like ECH-associated protein 1,Keap1)/Nrf2/抗氧化反应元件(antioxidant response element,ARE)通路,减轻小鼠氧化应激损伤,发挥NAFLD保护作用[59]。石斛多糖[60]、红芪多糖[61]、玉竹多糖[62]等也可显著降低NAFLD大鼠丙二醛水平,升高SOD、谷胱甘肽过氧化物酶(glutathione peroxidases,GPXs)及过氧化氢酶(catalase,CAT)水平,提示具有抗氧化应激作用,但具体分子机制还需进一步研究。
5 改善线粒体功能障碍
作为活性氧的主要来源,线粒体功能发生障碍不仅会导致脂肪分解减慢,还会促进活性氧与促炎因子的大量释放,加重氧化应激与炎症损伤,所以有学者提出NAFLD是一种线粒体疾病的假说[63-64]。
慈菇多糖被证实不仅可以改善NAFLD小鼠脂质代谢紊乱和氧化应激,还可以抑制肝脏脂肪过氧化,减轻线粒体供能负担[57]。对高脂饮食小鼠连续ig针叶多糖800 mg/kg 9周,可显著改善小鼠氧化应激和线粒体损伤,并促进线粒体b氧化,其机制可能与针叶多糖通过激活肝脏中过氧化物酶体增殖物激活受体g共激活因子-1α(peroxisome proliferator activated receptor gamma coactivator-1α,PGC-1α)表达,从而抑制UCP2表达,增加线粒体复合物Ⅰ、Ⅳ、Ⅴ活性,恢复线粒体ATP含量有关[23]。
6 其他途径
6.1 抑制肝细胞凋亡
肝细胞凋亡可直接、间接地促进炎症与肝纤维化,是诱发NAFLD的重要因素,其过程主要受抗凋亡蛋白B细胞淋巴细胞瘤-2(B-cell lymphoma 2,Bcl-2)和促凋亡蛋白Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)的调控[65]。一些具有抑制细胞凋亡作用的多糖被证实可改善NAFLD。虫草花是单纯以人工培养基培养的蛹虫草,价格低廉,且多糖含量高。研究人员发现,对肝纤维化小鼠连续ig虫草花多糖400 mg/kg 4周后,与模型组对比,小鼠体质量升高,血清ALT、AST水平降低,肝脏病理损伤程度减轻,且肝脏肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、核因子-kB(nuclear factor-kB,NF-kB)、Bcl-2、Bax以及PPARg表达均显著升高,以上结果提示虫草花多糖不仅能抑制炎症反应,还能通过调控Bcl-2/Bax信号通路抗肝细胞凋亡,从而改善肝纤维化,缓解NAFLD进程[66]。
6.2 抑制肝纤维化
细胞外基质过度积累会造成肝纤维化的发生,多糖可通过减少基质积累,减轻肝纤维化,从而改善NAFLD。徐杰等[67]发现对肝纤维化大鼠连续ig狗肝菜多糖100、200、300 mg/kg 6周后,大鼠肝纤维化程度有所改善,且300 mg/kg剂量改善效果最为明显,胶原沉积显著减少,TNF-α、白细胞介素-6、白细胞介素-1b等促炎因子水平显著降低,肝脏丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)蛋白表达也显著下降,提示狗肝菜多糖可通过抑制MAPK信号通路抑制炎症反应,减少胶原沉积,改善肝纤维化。
7 结语与展望
多糖是自然界中广泛存在的天然物质,对动、植物和微生物加以合适的提取分离手段就可以得到不同的多糖[68]。目前部分多糖,特别是果聚糖与葡聚糖,不仅结构明确,且具有显著的调血脂、降血糖、抗氧化、增强免疫力等生物活性[69-71]。在总结近年来多糖改善NAFLD及机制研究后,发现多糖主要通过调节脂质代谢紊乱、调节肠道菌群、减轻IR与氧化应激、改善线粒体功能障碍等途径防治NAFLD。但是,现阶段也存在一些问题亟待解决:(1)作用机制研究尚不深入,有必要在现有研究的基础上深入开展多糖改善NAFLD的药理作用靶点研究,为开发疗效明确、靶点清晰的多糖类药物提供理论支撑;(2)构效关系研究还不充分,由于绝大多数多糖是混合物,目前多糖结构表征研究仍主要集中在相对分子质量、单糖组成、官能团等方面,鲜有确切的分子结构报道,这也限制了多糖在防治NAFLD中的构效关系研究;(3)临床试验还很缺乏,目前多糖防治NAFLD相关研究主要集中在细胞和动物层面,鲜有临床大规模试验,限制了多糖的继续研究与成果转化,相关研究需将基础实验与临床研究相结合,促进多糖安全有效应用于NAFLD的临床防治。
总之,具有NAFLD改善作用的中药多糖为新药的研究与开发提供了优良的天然原料,在防治NAFLD等疾病方面具有很大优势,值得继续深入研究与探索。
利益冲突 所有作者均声明不存在利益冲突
[1] Yu Y, Shen M Y, Song Q Q,. Biological activities and pharmaceutical applications of polysaccharide from natural resources: A review [J]., 2018, 183: 91-101.
[2] 刘广臣, 张红梅, 杨帆, 等. 中药多糖防治骨质疏松症作用及机制的研究进展 [J]. 中草药, 2022, 53(12): 3831-3841.
[3] Cui X W, Wang S Y, Cao H,. A review: The bioactivities and pharmacological applications ofpolysaccharides [J]., 2018, 23(5): 1170.
[4] Jiménez-Sánchez M, Pérez-Morales R, Goycoolea F M,. Self-assembled high molecular weight inulin nanoparticles: Enzymatic synthesis, physicochemical and biological properties [J]., 2019, 215: 160-169.
[5] 刘佳蕾, 王宇亮, 赵宏, 等. 百合多糖与黄芪多糖联用对慢性应激小鼠抑郁行为的影响及机制 [J]. 中国实验方剂学杂志, 2022, 28(5): 62-70.
[6] Paik J M, Golabi P, Younossi Y,. Changes in the global burden of chronic liver diseases from 2012 to 2017: The growing impact of NAFLD [J]., 2020, 72(5): 1605-1616.
[7] Friedman S L, Neuschwander-Tetri B A, Rinella M,. Mechanisms of NAFLD development and therapeutic strategies [J]., 2018, 24(7): 908-922.
[8] Pierantonelli I, Svegliati-Baroni G. Nonalcoholic fatty liver disease: Basic pathogenetic mechanisms in the progression from NAFLD to NASH [J]., 2019, 103(1): e1-e13.
[9] Manne V, Handa P, Kowdley K V. Pathophysiology of nonalcoholic fatty liver disease/nonalcoholic steatohepatitis [J]., 2018, 22(1): 23-37.
[10] 钱坤, 刘亚云, 张艳, 等. 中药抗非酒精性脂肪肝病分子机制的研究进展 [J]. 中草药, 2020, 51(19): 5083-5092.
[11] Marra F, Svegliati-Baroni G. Lipotoxicity and the gut-liver axis in NASH pathogenesis [J]., 2018, 68(2): 280-295.
[12] 王春花, 孙雪芳. 黄芪多糖在小鼠肝脏脂肪变性中的作用 [J]. 湖北农业科学, 2021, 60(8): 121-125.
[13] 颜妍肖伟利, 钟明月, 黄建, 等. 蒙古黄芪多糖通过调控Nrf-2信号通路缓解地塞米松诱导的糖脂代谢紊乱 [J]. 中国免疫学杂志, 2020, 36(3): 289-293.
[14] 崔宁, 赵文晓, 季旭明, 等. 黄芪及其拆分组分对脾虚水湿不化大鼠肝脏功能的影响 [J]. 中医药信息, 2015, 32(2): 62-65.
[15] Zhang Y P, Tang K R, Deng Y J,. Effects of shenling baizhu powder herbal formula on intestinal microbiota in high-fat diet-induced NAFLD rats [J]., 2018, 102: 1025-1036.
[16] 张梦伟, 刘双, 马佳敏, 等. 枸杞多糖联合有氧运动对非酒精性脂肪肝伴发糖尿病前期模型大鼠血浆游离脂肪酸谱的影响 [J]. 营养学报, 2022, 44(1): 64-71.
[17] Wang X, Shi L L, Wang X P,. MDG-1, anpolysaccharide, restrains process of non-alcoholic fatty liver disease via modulating the gut-liver axis [J]., 2019, 141: 1013-1021.
[18] Zhang L, Wang Y J, Wu F,. MDG, anpolysaccharide, inhibits non-alcoholic fatty liver disease by regulating the abundance of[J]., 2022, 196: 23-34.
[19] Wang C M, Yuan R S, Zhuang W Y,.polysaccharide inhibits hepatic lipid accumulation by downregulating expression of SREBPs in NAFLD mice [J]., 2016, 15(1): 195.
[20] 吴金滢, 王春梅. 五味子多糖对NAFLD大鼠肝脏SREBP2/HMGCR表达的影响 [J]. 吉林医药学院学报, 2020, 41(6): 401-404.
[21] Sun W M, Wang Y P, Duan Y Q,.polysaccharide suppresses lipid metabolism dysfunction in a rat model of non-alcoholic fatty liver disease via adenosine monophosphate-activated protein kinase pathway activation [J]., 2014, 10(3): 1237-1244.
[22] Wu J X, Shao H R, Zhang J H,. Mussel polysaccharide α--glucan (MP-A) protects against non-alcoholic fatty liver disease via maintaining the homeostasis of gut microbiota and regulating related gut-liver axis signaling pathways [J]., 2019, 130: 68-78.
[23] 张赫, 杨柠, 李家富, 等. 黑木耳多糖对非酒精性脂肪肝大鼠脂代谢的影响 [J]. 吉林医药学院学报, 2020, 41(4): 259-262.
[24] Ren R D, Yang Z, Zhao A L,. Sulfated polysaccharide fromincreases hydrogen sulfide production and attenuates non-alcoholic fatty liver disease in high-fat diet rats [J]., 2018, 9(8): 4376-4383.
[25] Hu Y Y, Yin F W, Liu Z Y,. Acerola polysaccharides ameliorate high-fat diet-induced non-alcoholic fatty liver disease through reduction of lipogenesis and improvement of mitochondrial functions in mice [J]., 2020, 11(1): 1037-1048.
[26] 樊荣, 马国华, 于珊珊. 天麻多糖对高脂饮食诱导的非酒精性脂肪肝的保护作用 [J]. 食品工业科技, 2022, 43(1): 381-391.
[27] Wang W, Xu A L, Li Z C,. Combination of probiotics andpolysaccharide alleviates hepatic steatosis via gut microbiota modulation and insulin resistance improvement in high fat-induced NAFLD mice [J]., 2020, 44(2): 336-348.
[28] He D, Yan L P, Zhang J Q,.polysaccharide attenuates high-sugar-induced lipid accumulation in HepG2 cells andlarvae [J]., 2021, 9(10): 5590-5599.
[29] Quesada-Vázquez S, Aragonès G, del Bas J M,. Diet, gut microbiota and non-alcoholic fatty liver disease: Three parts of the same axis [J]., 2020, 9(1): 176.
[30] 刘荣瑜, 王昊, 张子依, 等. 多糖与肠道菌群相互作用的研究进展 [J]. 食品科学, 2022, 43(5): 363-373.
[31] Huang X Q, Chen W F, Yan C S,. Gypenosides improve the intestinal microbiota of non-alcoholic fatty liver in mice and alleviate its progression [J]., 2019, 118: 109258.
[32] Jennison E, Byrne C D. The role of the gut microbiome and diet in the pathogenesis of non-alcoholic fatty liver disease [J]., 2021, 27(1): 22-43.
[33] Panasevich M R, Peppler W T, Oerther D B,. Microbiome and NAFLD: Potential influence of aerobic fitness and lifestyle modification [J]., 2017, 49(8): 385-399.
[34] Zhou D, Fan J G. Microbial metabolites in non-alcoholic fatty liver disease [J]., 2019, 25(17): 2019-2028.
[35] Chang C J, Lin C S, Lu C C,.reduces obesity in mice by modulating the composition of the gut microbiota [J]., 2015, 6: 7489.
[36] Tong A J, Hu R K, Wu L X,.polysaccharide and chitosan synergistically ameliorate lipid metabolic disorders and modulate gut microbiota composition in high fat diet-fed golden hamsters [J]., 2020, 44(1): e13109.
[37] Shi L L, Li Y, Wang Y,. MDG-1, anpolysaccharide, regulate gut microbiota in high-fat diet-induced obese C57BL/6 mice [J]., 2015, 81: 576-583.
[38] Safari Z, Gérard P. The links between the gut microbiome and non-alcoholic fatty liver disease (NAFLD) [J]., 2019, 76(8): 1541-1558.
[39] DeFilipp Z, Bloom P P, Torres Soto M,. Drug-resistant.bacteremia transmitted by fecal microbiota transplant [J]., 2019, 381(21): 2043-2050.
[40] Li T T, Huang Z R, Jia R B,.polysaccharides attenuate lipid and carbohydrate metabolism disorder in high-sucrose and high-fat diet-fed rats in association with intestinal microbiota [J]., 2021, 147: 110530.
[41] Machado M V, Diehl A M. Pathogenesis of nonalcoholic steatohepatitis [J]., 2016, 150(8): 1769-1777.
[42] 贺映侠, 严凤琴, 明小燕, 等. 红芪多糖对HepG2细胞胰岛素抵抗模型糖代谢及胰岛素敏感性的影响和机制研究 [J]. 中国免疫学杂志, 2021, 37(7): 870-874.
[43] 马永强, 韩烨, 张凯, 等. 甜玉米芯多糖对胰岛素抵抗HepG2细胞糖代谢功能的影响 [J]. 食品科学, 2021, 42(17): 170-176.
[44] 王秋丹, 赵凯迪, 林长青. 沙棘多糖对胰岛素抵抗HepG2细胞氧化应激的保护作用与机制 [J]. 食品与机械, 2022, 38(3): 167-172.
[45] 李冉, 夏雅娟, 高珍珍, 等. 蓝刺头多糖B通过miR-494-3p/FOXO1/PGC1α信号通路改善胰岛素抵抗HepG2细胞糖脂代谢紊乱 [J]. 中药药理与临床, 2022, 38(2): 99-104.
[46] 龙凯, 李东文, 苏明声, 等. 桦褐孔菌菌质多糖改善HepG2细胞胰岛素抵抗作用的研究[J]. 食用菌学报, 2017, 24(4): 39-43.
[47] 祝莹, 江泓霄, 贾董浩, 等. 苦瓜水提多糖和碱提多糖对HepG2细胞和线虫脂质沉积的调节作用[A] // 中国食品科学技术学会第十七届年会摘要集 [C]. 北京: 中国食品科学技术学会, 2020: 219-220.
[48] 张易, 董英, 祝莹, 等. 苦瓜碱提多糖调节HepG2细胞胰岛素抵抗的途径 [J]. 中国食品学报, 2016, 16(12): 10-16.
[49] 姚兰, 蒋成霞, 郭艳艳, 等. 沙棘多糖抑制PERK/ATF4/CHOP通路缓解糖尿病大鼠胰岛素抵抗和肝肾功能损伤 [J]. 中国临床解剖学杂志, 2021, 39(2): 187-191.
[50] 李旭东, 任书男, 青格尔, 等. 蓝刺头多糖B对胰岛素抵抗L6骨骼肌细胞耗糖量及AMPK表达的影响 [J]. 畜牧与兽医, 2020, 52(2): 67-72.
[51] 胡敏敏, 王伟, 毕洪钟, 等. 威灵仙多糖对实验性非酒精性脂肪性肝炎大鼠血清RBP4水平和胰岛素抵抗指数的干预作用 [J]. 胃肠病学和肝病学杂志, 2016, 25(4): 386-390.
[52] 余雪, 叶碧娴, 荣向路, 等. 酵母多糖对高脂诱导的胰岛素抵抗小鼠糖脂代谢的影响 [J]. 中华中医药学刊, 2017, 35(3): 713-716.
[53] 禹博威, 潘晓琼, 陈君第霞, 等. 黄芪多糖对糖尿病动脉粥样硬化大鼠糖脂代谢的影响及血管内皮保护机制 [J]. 浙江中医药大学学报, 2021, 45(5): 447-453.
[54] 汪佳佳, 毕会民, 刘敏, 等. 黄芪多糖对KKAy小鼠血糖和肝脏抗氧化能力的影响 [J]. 湖北中医药大学学报, 2015, 17(5): 5-7.
[55] 王晓琳, 翁孝刚, 王宪华, 等. 黄芪多糖预防2型糖尿病大鼠肝损伤的实验研究 [J]. 现代生物医学进展, 2016, 16(10): 1846-1849.
[56] Mota M, Banini B A, Cazanave S C,. Molecular mechanisms of lipotoxicity and glucotoxicity in nonalcoholic fatty liver disease [J]., 2016, 65(8): 1049-1061.
[57] Deng X Q, Ke X H, Tang Y B,.polysaccharide interferes with arachidonic acid metabolism in non-alcoholic fatty liver disease mice via Nrf2/HO-1 signaling pathway [J]., 2020, 132: 110806.
[58] Zhu H, Wang Z J, Wu Y L,. Untargeted metabonomics reveals intervention effects of chicory polysaccharide in a rat model of non-alcoholic fatty liver disease [J]., 2019, 128: 363-375.
[59] 叶贤英, 朱丽军, 陈瑶, 等. 裙带菜多糖对动脉粥样硬化并发非酒精性脂肪肝小鼠的保护作用 [J]. 中药新药与临床药理, 2021, 32(8): 1065-1072.
[60] 喻涓, 范艳, 杨榆青, 等. 金钗石斛多糖对非酒精性脂肪肝病大鼠TLR4和HO-1表达的影响 [J]. 西部中医药, 2021, 34(10): 25-29.
[61] 张磊, 金智生, 金彩云, 等. 红芪多糖对ob/ob小鼠肝脂质氧化的影响 [J]. 中国临床药理学杂志, 2021, 37(9): 1078-1082.
[62] 朱琪, 李庚喜, 曾立, 等. 玉竹多糖对高脂饮食诱导的大鼠肥胖和非酒精性脂肪肝的作用 [J]. 中成药, 2021, 43(6): 1612-1617.
[63] Zou X, Yan C H, Shi Y J,. Mitochondrial dysfunction in obesity-associated nonalcoholic fatty liver disease: The protective effects of pomegranate with its active component punicalagin [J]., 2014, 21(11): 1557-1570.
[64] Shen B Y, Zhao C X, Wang Y,. Aucubin inhibited lipid accumulation and oxidative stress via Nrf2/HO-1 and AMPK signalling pathways [J]., 2019, 23(6): 4063-4075.
[65] Chipuk J E, Moldoveanu T, Llambi F,. The BCL-2 family reunion [J]., 2010, 37(3): 299-310.
[66] 刘广庆, 王丹丹, 余茂耘, 等. 虫草花多糖抑制CCl4诱导的小鼠肝纤维化的作用与机制 [J]. 合肥工业大学学报: 自然科学版, 2022, 45(3): 411-416.
[67] 徐杰, 钟明利, 王跃峰, 等. 狗肝菜多糖干预MAPK信号通路抑制炎症反应缓解大鼠肝纤维化进程 [J]. 中国药理学通报, 2022, 38(4): 531-537.
[68] Xiong Q P, Song Z Y, Hu W H,. Methods of extraction, separation, purification, structural characterization for polysaccharides from aquatic animals and their major pharmacological activities [J]., 2020, 60(1): 48-63.
[69] Liu W, Wang J J, Zhang Z Z,.andantioxidant activity of a fructan from the roots ofL. [J]., 2014, 65: 446-453.
[70] Shi X D, Li O Y, Yin J Y,. Structure identification of α-glucans fromby methylation and 1D/2D NMR spectroscopy [J]., 2019, 271: 338-344.
[71] Wang Y, Liu N, Xue X,. Purification, structural characterization andimmunoregulatory activity of a novel polysaccharide from[J]., 2020, 160: 688-694.
Research progress on improving effect and mechanism of traditional Chinese medicine polysaccharides on non-alcoholic fatty liver disease
LIU Wei1, WU Jiang-ping1, 2, 3, YUAN Ping-chuan1, 2, 3, SHAO Tai-li1, 2, 3, LIU Chun-yan1, 2, 3, 4, WANG Guo-dong1, 2, 3, 4
1. Drug Research & Development Center, School of Pharmacy, Wannan Medical College, Wuhu 241002, China 2. Anhui Provincial Engineering Research Center for Polysaccharide Drugs, Wuhu 241002, China 3. Anhui Provincial Engineering Laboratory for Screening and Re-evaluation of Active Compounds of Herbal Medicine in Southern, Wuhu 241002, China 4. Anhui Province Key Laboratory of Active Biological Macromolecules, Wuhu 241002, China
Traditional Chinese medicine polysaccharides are important components of cell membranes of higher plants, animal and cell walls of microorganisms, and are widely found in nature as an important natural biomolecule with a variety of biological activities. Non-alcoholic fatty liver disease (NAFLD) is a chronic liver disease characterized by lipid overload in hepatocytes. In recent years, traditional Chinese medicine polysaccharides have been found to improve NAFLD by regulating lipid metabolism disorders, regulating intestinal flora, reducing insulin resistance and oxidative stress, and improving mitochondrial dysfunction. In this paper, related research on role and mechanism of traditional Chinese medicine polysaccharides in improving NAFLD in recent years was reviewed, in order to provide a theoretical basis for the therapeutic application of polysaccharides in prevention and treatment of NAFLD.
polysaccharides; non-alcoholic fatty liver disease; lipid metabolism; insulin resistance; oxidative stress; intestinal bacteria
R282.710.5
A
0253 - 2670(2022)23 - 7566 - 09
10.7501/j.issn.0253-2670.2022.23.028
2022-08-29
安徽省自然科学基金资助项目(1908085MH248);安徽省高校自然科学研究重大项目(KJ2021ZD0101);皖南医学院科学研究“揭榜挂帅”专项项目(WK2022J02);芜湖市科技项目(2022cg20)
刘 伟,男,硕士研究生,研究方向为多糖结构解析与活性筛选。E-mail: 13023031591@163.com
通信作者:王国栋,男,教授,博士,研究方向为活性多糖筛选与应用。E-mail: wangguodong@wnmc.edu.cn
[责任编辑 崔艳丽]
