基于质量源于设计(QbD)理念的葛根总黄酮-甘草酸纳米粉体的制备与质量评价
2022-12-08陈海溶刘贞贞刘佳佳王雨宵沈爱宗桂双英
陈海溶,丁 杨,刘贞贞,刘佳佳,王雨宵,沈爱宗,郭 健, 2, 3, 4,桂双英, 2, 3, 4
基于质量源于设计(QbD)理念的葛根总黄酮-甘草酸纳米粉体的制备与质量评价
陈海溶1,丁 杨1,刘贞贞1,刘佳佳1,王雨宵1,沈爱宗5,郭 健1, 2, 3, 4*,桂双英1, 2, 3, 4*
1. 安徽中医药大学药学院,安徽 合肥 230012 2. 药物制剂技术与应用安徽省重点实验室,安徽 合肥 230012 3. 安徽省中医药科学院药物制剂研究所,安徽 合肥 230012 4. 现代药物制剂安徽省工程技术研究中心,安徽 合肥 230012 5. 中国科学技术大学附属第一医院/安徽省立医院药剂科,安徽 合肥 230001
基于质量源于设计(quality by design,QbD)理念优化制备葛根总黄酮-甘草酸纳米粉体(total flavonoids-glycyrrhizic acid nanopowder,PG-NP),并对其进行质量评价。采用超声破碎-高压均质法制备PG-NP混悬液。以PG-NP混悬液的粒径、多分散指数(polydispersity index,PDI)和ζ电位作为关键质量属性,应用鱼骨图筛选风险因素。采用Plackett-Burman设计试验筛选关键工艺参数(critical process parameters,CCPs),在此基础上结合Box-Behnken设计优化PG-NP混悬液的处方配比,应用单因素试验确定PG-NP中冻干保护剂含量。对优化后的PG-NP进行扫描电子显微镜(scanning electron microscope,SEM)、X射线衍射仪(X ray diffraction,XRD)、差示量热扫描仪(differential scanning calorimetry,DSC)表征,并考察PG-NP中葛根素体外溶出性能。PG-NP的最优制备工艺和处方配比:药辅比为 17.5∶1、甘草酸用量为0.13%、搅拌转速为470 r/min、均质压力为128.3 MPa、甘露醇用量为5%。优化后PG-NP粒径为(228.00±7.80)nm,PDI为0.29±0.05,ζ电位为(−23.10±0.93)mV。PG-NP为具有针棒状晶型的淡黄色粉末,且其体外溶出性能较原料药有明显提高。采用QbD理念优化的PG-NP制备工艺简单易行,处方设计合理,质量可控,可有效改善难溶性成分的溶出。
质量源于设计;葛根总黄酮;甘草酸;纳米粉体;溶出度;质量评价;超声破碎-高压均质法;鱼骨图;Plackett-Burman设计;关键工艺参数;Box-Behnken设计
葛根总黄酮(total flavonoids,PF)是来源于葛根中的一类活性成分,具抗血栓[1]、抗动脉硬化[2]、抗氧化应激[3]等多种药理活性。PF中成分包括葛根素、大豆苷、3′-羟基葛根素、3′-甲氧基葛根素以及葛根素芹菜糖苷等[4],其黄酮成分上的C-4和C-7位羟基常被葡萄糖、磷脂糖或木糖等糖残基取代,形成7--或4--糖苷化合物。由于以上PF的结构特性,导致PF的水溶性和脂溶性均不佳。此外,PF的主要活性成分葛根素属于BCS分类系统IV类化合物[5],溶解度仅为0.86%,口服吸收差,生物利用度较低[6]。目前,PF的市售制剂主要为葛酮通络胶囊[7]和愈风宁心片[8]。然而PF生物利用度低导致患者顺应性差,使其临床应用受到了极大的限制[6]。为了解决难溶性药物口服吸收生物利用度低的问题,近年来相继开发了固体分散体[9]、固体脂质纳米粒[10]、微乳[11]、生物黏附制剂[12]及药物纳米粉体等新型制剂。
其中纳米粉体(nanopowder,NP)具有载药量大、溶解度高、易于加工成其他剂型、给药途径灵活的优点。NP可通过增加介质与药物晶体接触的曲率和降低粒径改善药物的生物利用度和组织分布[13]。选择NP作为PF载体,有助于提升PF的溶解度和溶出效率,为更好的发挥PF的药理作用奠定了制剂学基础。甘草酸是一种含有2种葡萄糖醛酸的三萜皂苷[14]。甘草酸的疏水性基团三萜部分残基可吸附于难溶性药物表面,亲水基团葡萄糖醛酸残基则分散在水中形成球网状结构[15],通过降低NP的自由流动性提高难溶性药物的溶解度[16]。甘草酸的表面活性特性表明其可作为NP天然稳定剂[17]。此外,有研究发现甘草酸还可通过影响肠上皮细胞膜内脂质位置和排列顺序增加药物在小肠部位的渗透,促进药物口服吸收[18]。因此,本实验选择甘草酸作为葛根总黄酮-甘草酸纳米粉体(PF-glycyrrhizic acid nanopowder,PG-NP)的稳定剂,有望进一步提高PF的溶解度和生物利用度,并为后续口服剂型开发提供依据。
由于采用传统经验筛选法对制剂处方工艺进行优化存在耗时,且无法体现各因素结合后集体效应与相互作用的缺点。采用质量源于设计(quality by design,QbD)理念对制剂处方工艺进行优化是通过实验设计建立起因变量和自变量之间的联系,管理最终产品质量的风险,具有降低产品变动性、提高生产效率以及节约生产成本的优势[19-20]。本实验以PF为原料药物,应用QbD理念优化PG-NP混悬液的制备工艺与处方。以目标产品质量特性描述(quality target product profile,QTPP)为起点,对药物质量特性、有效性深入研究分析[13]。采用鱼骨图分析法对影响PG-NP生产工艺的关键质量属性(critical quality attribute,CQA)的各类因素进行分析,运用Plackett-Burman(PB)设计试验筛选关键工艺参数(critical process parameters,CPPs),结合Box-Behnken设计(BBD)建立CPPs与CQA联系的设计空间,优选出PG-NP混悬液最优处方与制备工艺。选择单因素试验优化冻干保护剂甘露醇的含量,并采用扫描电子显微镜(scanning electron microscope,SEM)观察、X射线衍射(X ray diffraction,XRD)分析、差示量热扫描(differential scanning calorimetry,DSC)分析等方法表征PG-NP的形貌和结构,考察了PG-NP的体外溶出度。本实验通过借助QbD设计管控PG-NP全部制备过程的质量,以期得到工艺简单易行,处方设计合理,质量稳定的PG-NP。
1 仪器与材料
1.1 仪器
U3000型高效液相色谱仪,赛默飞世尔科技公司;01B203超声破碎仪;APV2000型高压均质机,德国SPX;AE240型十万分之一电子天平,美国Mettler-Toledo公司;KQ200型数控超声波清洗器,昆山市超声仪器有限公司;3000HS型粒径分析仪,美国Malvern Instrument公司;S-4800型扫描电子显微镜,株式会社日立制作所;Dmax2500 X型射线衍射仪,日本理学株式会社;RTC-2型磁力搅拌器,巩义市予华仪器有限责任公司;ZRS-8L型智能溶出试验仪,天大天发科技有限公司;Alpha 1-4 LSCplus型冷冻干燥机,德国Christ公司。
1.2 试剂
葛根素对照品,上海源叶科技有限公司,批号B20446,质量分数>98%;PF(葛根素质量分数≥31%),安徽九方制药有限公司馈赠,批号210916;甘草酸,批号NO9GS166788,质量分数≥95%,上海源叶科技有限公司;甘露醇,批号1906012,质量分数≥95%,西陇科学股份有限公司;超纯水,由Millipose公司Milli-Q超纯水系统制备;甲醇、乙腈均为色谱纯;其他试剂均为分析纯。
2 方法与结果
2.1 PG-NP混悬液的制备
精密称取PF 60.00 mg,加入1 mg/mL甘草酸的水溶液中,加热搅拌,超声15 min(20~25 kHz,390 W),得到PG-NP粗混悬液,转入高压均质机,在一定压力下均质循环15次,即得PG-NP混悬液。
2.2 平均粒径、多分散指数(polydispersity index,PDI)、再分散指数(redispersibility index,RDI)的测定
取“2.1”项中PG-NP混悬液适量,采用马尔文粒度仪平行测定粒径及PDI 3次,取均值。以RDI为纳米粉体冻干后再分散性的评价指标,计算公式为RDI=冻干再分散后测得的粒径/初始粒径。RDI数值越接近1,表明冻干后“固化损伤”越小。
2.3 QTPP分析
以QbD理念中的产品研发思路为指导,根据已经上市的PF制剂要求以及临床口服制剂要求制定了QTPP,结果见表1。
2.4 CQA分析
通过分析QTPP表格,深入探讨评估在后续处方开发、工艺筛选以及药品安全性的实验中满足规定质量属性,确定一些影响力较大的质量属性为CQA,结果如表2所示。
2.5 PG-NP混悬液的风险评估(鱼骨图法)
鱼骨图法探究可能影响PG-NP混悬液CQA的风险因素,主要包括设备、环境和人员等不可控风险因素以及物料、处方配比和制备工艺等可控因素,初步对各因素潜在风险因素进行定性评估和标记,结果见图1。
2.6 实验设计优化PG-NP混悬液处方及工艺
2.6.1 PB设计试验筛选关键影响因素 通过对PG-NP混悬液处方及制备工艺的分析,以药辅比(1)、甘草酸用量(2)、搅拌转速(3)、搅拌温度(4)、超声频率(5),超声时间(6)、高压均质循环次数(7)、高压均质压力(8)为考察对象,以粒径(1)、PDI(2)和ζ电位(3)为评价指标,利用PB设计试验筛选出对PG-NP性质影响较显著的因素。因素水平、筛选试验安排及结果见表3。

表1 PG-NP的QTPP

表2 CQA分析

图1 PG-NP混悬液鱼骨图
通过Mintab软件分析PB设计试验,其回归模型为1=−279.03+18.681+29.682+2.753+9.634+0.485-13.876-7.537-27.688,1=0.961 7,1adj=0.859 5;2=0.37-0.030 581+0.082 72+0.011 433+0.018 484+0.011 425+0.010 776-0.015 487-0.009 18,2=0.952 4,2adj=0.825 5;3=-33.175+3.2871+2.0922-1.5033+0.8804+0.3755-0.4486+0.1087+0.0638,3=0.985 7,3adj=0.947 5。说明以上模型与数据拟合度较高,模型的预测结果符合混悬液制备过程实际操作情况。通过12次运行评估8个因素,以粒径、PDI以及ζ电位为指标,确定显著影响因素CPPs。通过ANOVA和多元线性回归分析评估显著性水平和因素系数,结果见表4。结果发现主要的显著因素为处方因素药辅比和甘草酸用量(<0.05),高压均质压力对粒径的影响有显著影响(<0.05),且搅拌转速对电位也有显著影响(<0.05)。因此在接下来的BBD设计中进一步考察药辅比、甘草酸用量、搅拌转速以及高压均质压力4个变量。

表3 PG-NP关键影响因素的PB设计试验的因素水平、试验安排及结果(n = 3)
2.6.2 BBD优化 通过PB设计试验,筛选出对PG-NP混悬液性质影响较显著的4个因素:1、2、3、8。因素水平、处方优化试验结果见表5。将上述4个因素作为考察对象,以1、2和3为评价指标,采用Design Expert 12.0软件进行数据分析,对综合评分与各考察因素之间的关系进行2项式方程拟合和方差分析,结果所得方程如下:1=255.47-30.531+5.072+0.210 83-24.668+41.3912+14.2782,12=0.922 5,adj12=0.901 4;2=0.303 0-0.039 11-0.010 12-0.017 63-0.046 08+0.041 312+0.047 112+0.020 832+0.042 782,22=0.892 0,adj22=0.848 8;3=−35.29-8.371-0.014 172-0.445 03-0.504 28+12.2512,32=0.917 0,adj32=0.899 0。由此可证明模型拟合良好。各方差分析显示药辅比对粒径、PDI和ζ电位影响最大,根据拟合方程绘制各因素与粒径、PDI和ζ电位的3D曲面图2~4。

表4 Y1、Y2和Y3的统计分析
根据Design Expert 12.0实验设计软件综合评价后给出的最佳制备条件:PF与甘草酸的比例为17.5∶1、甘草酸用量为0.13%、搅拌转速为470 r/min、高压均质压力为128.3 MPa。3批验证试验与模型优选的最佳处方条件,测得PG-NP混悬液的粒径、PDI和ζ电位。

表5 BBD试验设计及结果(n = 3)
2.6.3 优化处方验证 根据Design Expert 12.0实验设计软件综合评价后给出的PG-NP混悬液的最佳制备工艺和处方:药辅比为17.5∶1,甘草酸用量为0.13%,搅拌转速为470 r/min,高压均质压力为128.3 MPa。按照“2.1”项下方法制备最优处方PG-NP 3批,按照“2.2”项方法测定PG-NP平均粒径、PDI和ζ电位,实测值与模型预测值结果见表6,可知实测值和模型预测值比较接近,说明模型预测性良好。
2.7 固化工艺考察
以PG-NP的外观和RDI为指标,考察冻干保护剂甘露醇的用量(1%、3%、5%、7%),结果见表7。随着甘露醇冻干保护剂用量增加,冻干粉表面逐渐平整,RDI呈先降低后增大的趋势。当甘露醇用量为5%时,PG-NP为色泽均匀的淡黄色粉末,质地疏松均一,无塌陷现象,且复溶后平均粒径最小,平均粒径为(228.00±7.80)nm,重分散性最佳,RDI为0.970。因此,选择5%的甘露醇用量作为PG-NP混悬液的冻干保护剂。

图2 自变量X1、X2、X3和X4与因变量Y1的3D效应面图

图3 自变量X1、X2、X3和X4与因变量Y2的3D效应面图

图4 自变量X1、X2、X3和X4与因变量Y3的3D效应面图

表6 各指标预测值和实测值
偏差=(实测值-预测值)/预测值
deviation = (observed value-predicted value)/predicted value
2.8 PG-NP质量评价
2.8.1 SEM观察形态 取适量PF原料药和PG-NP,黏附于样品池上,表层减压喷金处理以增加其电导率。在SEM下观察两者表面形态和晶体结构。由图5可见PF原料药大小不均匀,呈较大的块状。而PG-NP在高倍数电镜镜下以不规整的细小片状存在,粒径大部分分布在200 nm左右,与粒度仪测定结果相吻合。
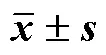
表7 冻干保护剂含量的筛选结果(, n = 3)
2.8.2 XRD分析 采用XRD分析测试样品(甘草酸、PF原料药、PG-NP冻干粉)。测试条件为CuKα作为辐射源衍射(=0.154 nm),40 kV,154 mA,连续扫描,扫描速度5°/min,间隔0.1°。通过不同晶面发生的衍射现象的强度来绘制衍射图,以得到样品晶体结构和粒度方面的信息。分析结果见图6,PG-NP相对于甘草酸的衍射峰和峰强度明显减少,结晶度降低,表明在工艺条件下PF状态发生明显改变。
2.8.3 DSC分析 将甘草酸、PF原料药、PF和甘草酸混合物及PG-NP冻干粉进行DSC分析。以氧化铝为参比物,在氮气流中,从30~300 ℃,以10 ℃/min的速率升温扫描,结果见图7,结果显示PG-NP冻干粉在163.09、167.61 ℃出现明显熔融峰,而PF和甘草酸物理混合物未出现熔融峰。据研究表明161 ℃为甘露醇的熔点峰[21],PG-NP的熔点峰相对发生了偏移,可能是制剂冻干后甘露醇结晶状态发生改变。表明PG-NP冻干粉中PF可能仍以无定形态存在。

图5 PF原料药(50 μm, a)和PG-NP (50 μm, b; 5 μm, c) 的SEM图
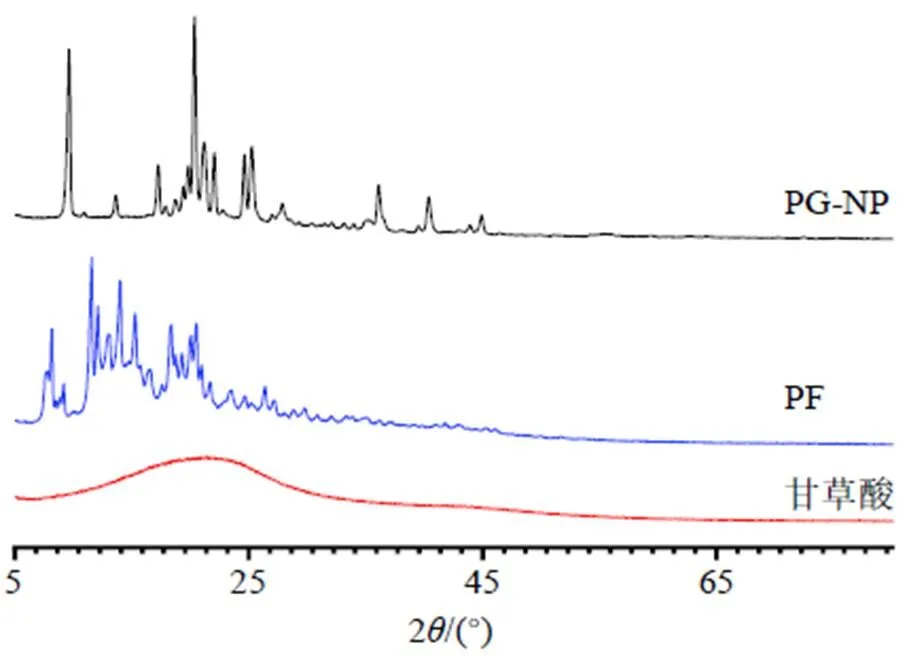
图6 PG-NP和PF的XRD图
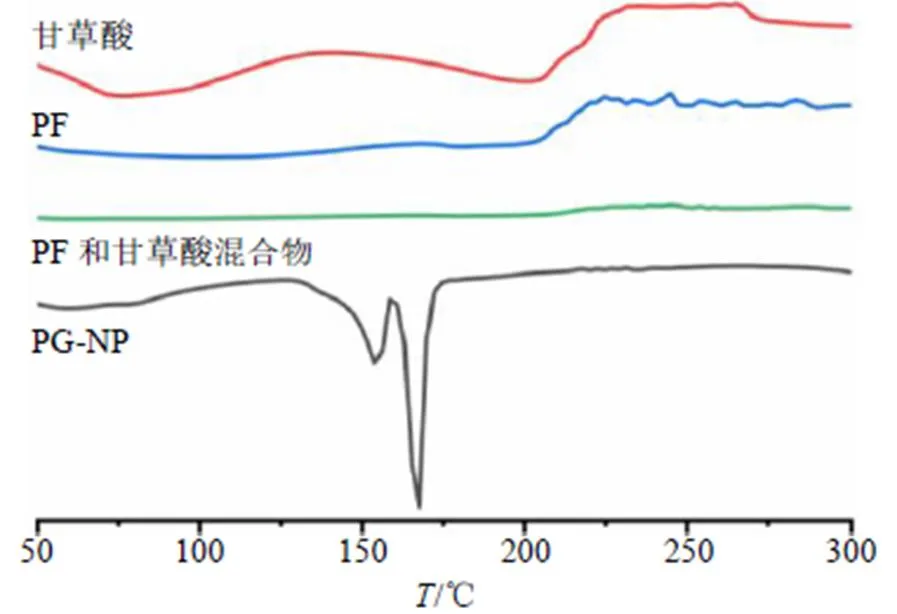
图7 PG-NP冻干粉DSC分析图谱
2.9 PG-NP体外溶出度测定
2.9.1 色谱条件 色谱柱为Kromasil柱(250 mm×4.6 mm,5 μm);流动相为乙腈-0.05%醋酸水溶液(10∶90),洗脱程序:0~20 min,10%乙腈;21~30 min,10%~20%乙腈;31~40 min,20%~10%乙腈;检测波长为254 nm;柱温40 ℃;体积流量1 mL/min;进样量10 μL。
2.9.2 对照品溶液的制备 精密称取葛根素对照品2.02 mg,用30%乙醇超声溶解置于10 mL量瓶,即得质量浓度为20.2 μg/mL的对照品储备液。
2.9.3 供试品溶液的制备 精密称取PG-NP冻干粉3.39 g,置50 mL量瓶中,加入30%乙醇溶液稀释至刻度,摇匀,即得67.80 μg/mL的对照品溶液
2.9.4 线性关系考察 精密吸取的对照品溶液适量,用30%乙醇稀释得质量浓度分别为4.04、8.08、12.12、20.20、24.24、28.28 μg/mL的葛根素对照品溶液,在“2.9.1”项色谱条件下进样分析,以质量浓度为横坐标(),色谱峰面积为纵坐标(),绘制标准曲线,得到回归方程=0.083 44+0.208 4,2=0.999 8>0.999,结果表明葛根素在4.04~28.28 μg/mL与峰面积呈良好的线性关系。
2.9.5 精密度试验 精密吸取葛根素对照品溶液6份,按“2.9.1”项下的色谱条件进样,计算葛根素峰面积的RSD为1.28%,表明仪器精密度良好。
2.9.6 重复性试验 精密称取PG-NP冻干粉0.1 g,6份,按“2.9.3”项下方法制备供试品溶液。在“2.9.1”项下的色谱条件进样,测得对应峰面积,得到葛根素质量分数的RSD为0.12%,表明本法重复性良好。
2.9.7 稳定性试验 取适当质量浓度的供试品溶液,于制备后0、1、2、4、8、12 h分别精密吸取供试品溶液,注入液相色谱仪分析,记录葛根素峰面积,测得其RSD为0.80%,表明供试品溶液在12 h内稳定。
2.9.8 加样回收率试验 精密量取已测定葛根素质量分数的PG-NP冻干粉0.05 g,6份,分别精密加入相当量的对照品溶液,挥干溶剂,同“2.9.3”项下方法处理,测定,计算加样回收率。测得葛根素的平均加样回收率为100.28%,RSD为0.68%。
2.9.9 溶出度测定 取PG-NP及PF原料药和甘草酸的物理混合物各500 mg,各12份,采用《中国药典》2020年版一部附录XC规定的溶出度测定项下第一法桨法,以300 mL水为溶出介质,温度为(37.0±0.5)℃,转速100 r/min。分别于5、10、15、20、30、40、50、60、120 min取样1 mL,同时补充同温度超纯水1 mL,0.45 μm微孔滤膜滤过,计算葛根素的累积溶出率,以时间对累积溶出率作图得溶出曲线如图8所示,PG-NP冻干粉的溶出速率较原料药得到明显提高。
PG-NP冻干粉在60 min内药物溶出度达到90.73%,60 min以后PF完全释放,达到平衡状态。图8中发现PG-NP在前20 min的溶出速率已经达到87.10%,而原料药的溶出率仅为74.15%,由此可见PG-NP冻干粉的溶出速度和程度优于原料药和甘草酸的物理混合物(<0.05)。

图8 PF和PG-NP中葛根素体外溶出度曲线(, n = 3)
3 讨论
传统的纳米制备技术如高压均质法、反溶剂沉淀法可能会造成药物混悬液不稳定或者有机物污染。本研究采用的超声破碎法的空化作用使液体产生更多的空化泡[15],降低了粒径。但是其制备得到的纳米粒径均匀性较低,所以组合高压均质机,基于其射流均匀原理所得的混悬液通过活塞间隙均质器进行均匀化制备,在剪切力和空化力作用下促进药物颗粒破碎[22],使PG-NP混悬液中的粒子更加均匀化且粒径进一步减小。体外溶出试验结果表明,小粒径的PG-NP在20 min内的体外溶出率是原料药的1.16倍。这主要归功于高压均质-超声破碎过程导致的介质与药物晶体接触的曲率增加[23]。根据Noyes-Whitney方程,粒径的减小会增加药物粉末相互作用的表面积,进一步会增加该部分在生物流体中的溶解速率。
甘草酸为天然皂苷类成分,与传统表面活性剂结构一样具有两亲性,可与药物作用形成网状结构,阻止粒子的团聚[24],较少量就使PF在水溶液中达到稳定的效果。研究表明静电斥力和空间稳定作用参与了甘草酸稳定机制[25]。同时有研究表明甘草酸进入小肠上皮细胞膜后,可以通过影响脂质的位置和排列顺序,增加细胞膜的通透性,使细胞膜弹性增加和弹性模量分布变窄,促进药物的细胞内化,提高药物的口服吸收效率[26-27]。因此,甘草酸在纳米粉体中既发挥药物辅料作用,又具有一定的药理作用潜力,体现了中药制剂的“药辅合一”理念。通过SEM、XRD、DSC的综合分析,结果表明PG-NP外观呈现不规则大小的匀称细小片状,且PF可能以无定形晶体状态存在PG-NP中。无定形晶体有利于药物成分的快速溶出,该结果通过体外溶出实验也得到了证实。
以QbD理念指导优化PG-NP混悬液的制备模型,有效提高了PG-NP的稳定性及制备工艺工业化生产的可行性,为后续的制剂工业扩大化开发提供了参考依据,也为后续的PG-NP药物生物利用度与协同增效药理作用研究奠定了基础。
利益冲突 所有作者均声明不存在利益冲突
[1] Zhou Y X, Zhang H, Peng C. Puerarin: A review of pharmacological effects [J]., 2014, 28(7): 961-975.
[2] Zhang Y, Yang X, Ge X H,. Puerarin attenuates neurological deficits via Bcl-2/Bax/cleaved caspase-3 and Sirt3/SOD2 apoptotic pathways in subarachnoid hemorrhage mice [J]., 2019, 109: 726-733.
[3] Kulczyński B, Gramza-Michałowska A, Suliburska J,. Puerarin-an isoflavone with beneficial effects on bone health [J]., 2021, 26(12): 1653-1667.
[4] 李昕, 潘俊娴, 陈士国, 等. 葛根化学成分及药理作用研究进展 [J]. 中国食品学报, 2017, 17(9): 189-195.
[5] Li H W, Dong L, Liu Y,. Biopharmaceutics classification of puerarin and comparison of perfusion approaches in rats [J]., 2014, 466(1/2): 133-138.
[6] 黎迎, 宋轶群, 何亚丽, 等. 葛根总黄酮生物黏附漂浮微丸体外Caco-2细胞转运和体内生物利用度评价 [J]. 药学学报, 2016, 51(7): 1144-1149.
[7] 李鹏跃. 基于MD-MS技术研究葛根总黄酮及葛根素静脉和鼻腔给药的药动学差异 [D]. 北京: 北京中医药大学, 2014.
[8] 张嘉家, 易荆丽, 周毅生,等. 葛根总黄酮分散片的药动学研究及其与愈风宁心片的比较 [J]. 中国实验方剂学杂志, 2014, 20(1): 107-110.
[9] 张嘉家. 葛根总黄酮分散片的制备工艺、质量标准及药动学研究 [D]. 广州: 广东药学院, 2013.
[10] 朱昆. 葛根总黄酮固体脂质纳米粒的研制 [D]. 长春: 吉林大学, 2009.
[11] 孙士淋. 葛根总黄酮自微乳制剂吸收机制的研究 [D].长春: 吉林大学, 2017.
[12] 林文慧. 葛根总黄酮胃肠道生物粘附制剂的研究 [D].北京: 中国协和医科大学, 2008.
[13] Taghipour Y D, Hajialyani M, Naseri R,. Nanoformulations of natural products for management of metabolic syndrome [J]., 2019, 14: 5303-5321.
[14] Coon J T, Ernst E.in the treatment of upper respiratory tract infections: A systematic review of safety and efficacy [J]., 2004, 70(4): 293-298.
[15] He W, Lu Y, Qi J P,. Food proteins as novel nanosuspension stabilizers for poorly water-soluble drugs [J]., 2013, 441(1/2): 269-278.
[16] Kong R P, Zhu X Y, Meteleva E S,. Enhanced solubility and bioavailability of simvastatin by mechanochemically obtained complexes [J]., 2017, 534(1/2): 108-118.
[17] 刘罗娜, 李小芳, 仲粒, 等. 以甘草酸为稳定剂制备黄芩苷固体纳米晶体 [J]. 中草药, 2019, 50(9): 2057-2064.
[18] Selyutina O Y, Polyakov N E, Korneev D V,. Influence of glycyrrhizin on permeability and elasticity of cell membrane: Perspectives for drugs delivery [J]., 2016, 23(3): 858-865.
[19] Cunha S, Costa C P, Moreira J N,. Using the quality by design (QbD) approach to optimize formulations of lipid nanoparticles and nanoemulsions: A review [J]., 2020, 28: 102206.
[20] Peterson J J, Lief K. The ICH Q8 definition of design space: A comparison of the overlapping means and the Bayesian predictive approaches [J]., 2010, 2(2): 249-259.
[21] 王莉芳, 陈孝男, 李军, 等. 龙血竭酚类提取物纳米混悬剂的制备及体外溶出研究 [J]. 中国中药杂志, 2019, 44(11): 2236-2243.
[22] Guo Z, Zhang M, Li H,. Effect of ultrasound on anti-solvent crystallization process [J]., 2005, 273(3/4): 555-563.
[23] Gujar K, Wairkar S. Nanocrystal technology for improving therapeutic efficacy of flavonoids [J]., 2020, 71: 153240.
[24] Al-Kassas R, Bansal M, Shaw J. Nanosizing techniques for improving bioavailability of drugs [J]., 2017, 260: 202-212.
[25] Chen Y C, Liu Y, Xu J N,. A natural triterpenoid saponin as multifunctional stabilizer for drug nanosuspension powder [J]., 2017, 18(7): 2744-2753.
[26] 杨富恒, 李国锋, 李振东, 等. 基于甘草酸为载体的紫杉醇-甘草酸纳米胶束的构建和口服生物利用度的评价 [J]. 中国医院药学杂志, 2018, 38(10): 1040-1044.
[27] Selyutina O Y, Polyakov N E. Glycyrrhizic acid as a multifunctional drug carrier-From physicochemical properties to biomedical applications: A modern insight on the ancient drug [J]., 2019, 559: 271-279.
Preparation and evaluation oftotal flavonoids-glycyrrhizic acid nanopowders based on concept of quality by design (QbD)
CHEN Hai-rong1, DING Yang1, LIU Zhen-zhen1, LIU Jia-jia1, WANG Yu-xiao1, SHEN Ai-zong5, GUO Jian1, 2, 3, 4, GUI Shuang-ying1, 2, 3, 4
1. School of Pharmacy, Anhui University of Chinese Medicine, Hefei 230012, China 2. Anhui Province Key Laboratory of Pharmaceutical Preparation Technology and Application, Hefei 230012, China 3. Institute of Pharmaceutics, Anhui Academy of Chinese Medicine, Hefei 230012, China 4. Anhui Province Engineering Technology Research Center of Modernized Pharmaceutics, Hefei 230012, China 5. The First Affiliated Hospital of University of Science and Technology of China/Department of Pharmacy, Anhui Provincial Hospital, Hefei 230001, China
To optimizetotal flavonoids nanopowder-glycyrrhizic acid nanopowder (PG-NP) based on concept of quality by design (QbD) and evaluate their quality.PG-NP suspension was prepared by ultrasonic crushing and high pressure homogenization method. A fishbone diagram was used to evaluate risk factors that could affect the particle size, polydispersity index (PDI) and ζ potential of PG-NP suspensions as critical quality attributes. A Plackett-Burman experimental design was used to screen the key process parameters, based on which the prescription ratio of the PG-NP suspension was optimized in conjunction with the Box-Behnken Design, then a single factor test was used to determine the content of lyoprotectant in PG-NP. The scanning electron microscope (SEM), X ray diffraction (XRD) and differential scanning calorimetry (DSC) were used to characterize the optimized PG-NP, and thedissolution properties of puerarin in PG-NP were investigated.The optimum preparation process and formulation ratio of PG-NP were as follows: the adjuvant ratio was 17.5:1; the content of glycyrrhizin acid was 0.13%; the stirring speed was 470 r/min; the homogenizing pressure was 1 283 MPa, and the content of mannitol was 5 %. The particle size of the optimized PG-NP was (228.00 ± 7.80) nm, the PDI was 0.29 ± 0.05, and the ζ potential was (−23.10 ± 0.93) mV. PG-NP was light yellow powder with needle-rod crystal form, anddissolution performance was significantly improved compared with the PDI.In this study, the preparation process of PG-NP optimized by the QbD concept was simple and feasible, the formula design was reasonable, and the quality was controllable, which can effectively improve the dissolution of poorly soluble components.
quality by design;total flavonoids; glycyrrhizic acid; nanopowder; dissolution; quality evaluation; ultrasonication and high pressure homogenization method; fishbone diagram; Plackett-Burman design; critical process parameters; Box-Behnken design
R283.6
A
0253 - 2670(2022)23 - 7384 - 09
10.7501/j.issn.0253-2670.2022.23.008
2022-06-27
安徽省高校自然科学研究重点项目(KJ2021A0538);安徽省高校自然科学研究重点项目(KJ2021A0541);安徽中医药大学药学院研究生培养基金(21pyjj05);安徽中医药大学高层次人才支持计划基金(2022rczd003)
陈海溶(1997—),女,硕士研究生,研究方向为新剂型与中药新制剂研究。Tel: 17730019304 E-mail: Chenhairong0122@126.com
通信作者:桂双英,教 授,研究方向中药新制剂与新技术研究、药物新剂型与新制剂研究。Tel: (0551)68129121 E-mail: guishy0520@126.com
郭 健,副教授,研究方向制剂新技术与新辅料研究。Tel: 19810963774 E-mail: guoj0719@126.com
[责任编辑 郑礼胜]
