白芍多糖对化学性肝损伤肝阴虚证病证结合模型的影响和作用机制
2022-12-08孟智睿魏益谦邵紫萱高学敏王景霞
贾 岚 高 晶 孟智睿 魏益谦 李 丽 邵紫萱 高学敏 王景霞
(北京中医药大学,北京,100029)
白芍为毛茛科植物芍药RadixPaeoniaeAlba的根,在中国历代医家运用的处方中具有“养血敛阴,柔肝止痛,平抑肝阳”的功效,用于头痛、眩晕、肋痛腹痛、四肢挛痛、血虚萎黄、月经不调、自汗盗汗等症[1-2]。白芍的化学成分主要有苷类化合物、鞣质、多糖、淀粉、蛋白质等[3-4],目前研究表明苷类化合物为芍药的主要有效成分,在心血管、神经等系统中起作用[5-7],然而关于占有白芍干燥根茎20%以上的白芍总多糖的药理作用研究文献较少[8]。
课题组前期对白芍总苷对化学性肝损伤肝阴虚证大鼠模型的影响和作用机制进行研究,发现其可改善肝阴虚证的证候表征,通过抑制磷脂酰肌醇-3-激酶/蛋白激酶B(Phosphatidylinositol-3-kinase-protein Kinase B,PI3K/AKT)通路,平衡抗炎与促炎机制,从而发挥保护化学性肝损伤肝阴虚证的作用,同时还可改善微循环障碍,对肝阴虚证存在的瘀血证候也有一定的影响[9]。那么白芍多糖作为白芍的另一类主要化学成分,可能是白芍治疗肝阴虚证的物质基础之一。本研究以白芍多糖为研究对象,探讨其对化学性肝损伤肝阴虚证大鼠模型的影响及作用机制,为进一步阐明和揭示白芍治疗肝阴虚证的物质基础和作用机制奠定基础。
1 材料与方法
1.1 材料
1.1.1 动物 选取无特定病原体(Specific Pathogen Free,SPF)级雄性SD大鼠40只,体质量(200±20)g,由北京斯贝福有限公司提供,动物许可证号SCXK(京)2018-0006,动物伦理审批号BUCM-4-2018080103-3009,饲养于北京中医药大学屏障系统中,室温(23±2)℃,湿度40%~60%,正常饮水,自由饮食。
1.1.2 药物 附子、干姜、肉桂配方颗粒,批号20180623,购于北京康仁堂药业有限公司;白芍饮片,批号20180801,购于北京本草方源药业集团有限公司;北沙参9 g、麦冬9 g、当归9 g、生地黄20 g、枸杞子12 g、川楝子4.5 g(一贯煎原方药物剂量和比例),批号20180715,购于北京中医药大学国医堂。药材均经北京中医药大学临床中药学教研室李伟实验师鉴定为正品。
1.1.3 试剂与仪器 CCl4(北京百诺威生物科技有限公司,批号:20170710);橄榄油(北京百诺威生物科技有限公司,批号:20180508);谷丙转氨酶(Glutamic-pyruvic Transaminase,GPT)试剂盒(长春汇力,批号:20180925);谷草转氨酶(Glutamic-oxaloacetic Transaminase,GOT)试剂盒(长春汇力,批号:20180925);苏木精-伊红(Hematoxylin and Eosin,HE)染液(谷歌生物,批号:G1005);Ⅲ型前胶原(ProcollagenⅢ,PCⅢ)ELISA试剂盒(优尔生生物,批号:L190327228);层粘连蛋白(Laminin,LN)ELISA试剂盒(优尔生生物,批号:L190307441);Ⅳ型胶原(CollagenⅣ,CⅣ)ELISA试剂盒(优尔生生物,批号:L190327207);透明质酸酶(Hyaluronidase,HA)ELISA试剂盒(华美生物,批号:G25012101);丙二醛测试盒(南京建成,批号:20181030);过氧化氢酶测试盒(南京建成,批号:20181030);谷胱甘肽过氧化物酶测试盒(南京建成,批号:20181029);总超氧化物歧化酶测试盒(南京建成,批号:20181107);Rat TNF-α Uncoated ELISA试剂盒(赛默飞生物,批号:191593002);Rat IL-6 ELISA试剂盒(联科生物,批号:A30681042);Rat IL-10 ELISA试剂盒(联科生物,批号:231070812);RNA提取液(Servicebio G3013,批号:20180609);三氯甲烷(国药集团化学试剂有限公司,批号:10006818)。
全自动生化分析仪(深圳雷杜生命科技,型号:Chemray 240);酶标检测仪(BioTeK,美国,型号:Epoch);水浴锅(姜堰市天力医疗器械厂有限公司,型号:TL-420D);电子天平[梅特勒-托利多仪器(上海)有限公司,型号:PL-203];台式高速冷冻离心机(Heal Force,型号:Neofuge 15R);纯水仪(青岛富勒姆科技,型号:FBZ2001-UP-P);全自动研磨仪(武汉赛维尔生物,型号:KH-Ⅲ);全自动生化分析仪(深圳雷杜生命科技,型号:KH-Ⅲ);台式高速冷冻型微量离心机(DragonLab,型号:D3024R);荧光定量PCR仪(ABI,美国,型号:Stepone plus);超净工作台(苏净安泰,型号:SW-CJ-1FD);超微量分光光度计(Thermo,德国,型号:NanoDrop2000);标准试剂型纯水仪(青岛富勒姆科技有限公司,型号:FBZ2001-up-p)。
1.2 方法
1.2.1 分组与模型制备
1.2.1.1 动物分组 将上述雄性SD大鼠适应性喂养后,体质量随机区组法分为空白组、模型组、阳性药组、白芍多糖组共4组,每组10只。
1.2.1.2 模型制备 1)白芍多糖制备:白芍饮片加水浸泡1 h,煎煮提取2次,每次1.5 h,加水量12、10倍,合并水煎液,通过D-101型大孔吸附树脂柱(饮片∶大孔树脂=1∶1),70%乙醇洗脱,收集洗脱液,减压浓缩至相对密度1.08~1.10(60 ℃),加乙醇至乙醇水平为80%,冷藏24 h,取沉淀,减压干燥,得白芍多糖提取物(出膏率3.82%)。2)一贯煎制备:将一贯煎原方饮片按比例置于煎煮容器内,加相当于药材量6倍的冷水浸泡2 h,煮沸30 min,滤过。药渣加3倍量水继续煎煮,煮沸20 min,滤过,合并2次滤液(生药质量浓度0.635 g/mL)。冷却后置4 ℃冰箱保存备用。3)附子、干姜、肉桂温热中药复方制备:取附子、干姜、肉桂配方颗粒,用前以蒸馏水配制成1∶1∶1的温热中药复方溶液(1.2 g/mL)。4)动物模型制备:除对照组外,其余各组大鼠均腹腔注射20% CCl4橄榄油溶液,剂量为1.5 mL/kg,2次/周(周一、周四),连续6周,第5、6周开始同时灌胃给予附子、干姜、肉桂温热中药复方制备化学性肝损伤肝阴虚证模型,1次/d,剂量18 g/kg,对照组大鼠灌胃等剂量的橄榄油溶液[10]。
1.2.2 给药方法 造模期间,对照组、模型组大鼠灌胃生理盐水,阳性药组大鼠灌胃一贯煎水提液6.35 g/kg,白芍多糖组大鼠灌胃白芍多糖提取物3 g/kg(临床一贯煎成人用量63.5 g/d[11],白芍多糖成人用量30 g/d[12],动物系数按照7倍计算,成人体质量按照70 kg计算),1次/d,连续6周。
1.2.3 检测指标与方法 1)样本采集:6周后,大鼠禁食12 h,正常饮水,采用水合氯醛麻醉,剂量为3 mL/kg,大鼠麻醉腹主动脉取血后处死,取肝脏组织冻存、固定,检测相关指标。2)一般观察:实验6周后,大鼠禁食12 h,测量体质量、肛温,观察其易激惹程度、毛发光泽度、小便颜色、大便颜色质地。具体评分标准参考文献[10-11,13]的方法,要求至少有2人观察,1人记录,对于评分标准,如果出现意见不统一,则由第3人确定,并记录。实验大鼠体征评分标准见表1。毛发评分标准见图1。3)血清血脂水平和酶活性:严格按照试剂盒说明书,应用全自动生化分析仪检测血清GPT、GOT水平,应用酶标仪采用酶联免疫吸附试验法检测血清环磷酸腺苷(cAMP)、环磷酸鸟苷(cGMP)水平。4)肝脏脂质水平和酶活性:严格按照试剂盒说明书,应用全自动生化分析仪检测肝组织匀浆丙二醛、谷胱甘肽过氧化物酶(Glutathione Peroxidase,GPX-Px)、过氧化氢酶(Catalase,CAT)、超氧化物歧化酶(Superoxide Dismutase,SOD)水平。应用酶标仪采用酶联免疫吸附试验法检测肝组织匀浆PCⅢ、CⅣ、LN、HA、白细胞介素-6(Interleukin-6,IL-6)、白细胞介素-10(Interleukin-10,IL-10)、肿瘤坏死因子-α(TNF-α)活性。5)肝脏病理切片的观察:用苏木精-伊红(Hematoxylin Eosin,HE)法染色肝脏组织,切片,观察肝脏的病理切片。6)qRT-PCR检测肝脏PI3K、AKT mRNA表达:大鼠剖腹腹主动脉取血后,将肝左叶迅速放入冻存管,在液氮中保存后转移至-70 ℃冰箱备用。

表1 实验大鼠体征评分

图1 毛发评分标准
剪取100 mg肝脏组织,先Trizol法提取总RNA。通过研磨、抽提出总RNA,再加入15 μL无RNA酶的水溶解RNA,55 ℃孵育5 min,再检测RNA浓度及纯度。接着反转录为cDNA。qRT-PCR体系为2×qRT-PCR Mix 12.5 μL,7.5 μmol/L基因引物2.0 mL、反转录产物2.5 μL、dd H2O 8.0 μL。引物序列见表2。反应程序为预变性95 ℃、10 min;95 ℃、15 s→60 ℃、60 s,循环(40次);熔解曲线60 ℃→95 ℃,每15秒升温0.3 ℃。以2-△△Ct法计算目的基因相对表达量。
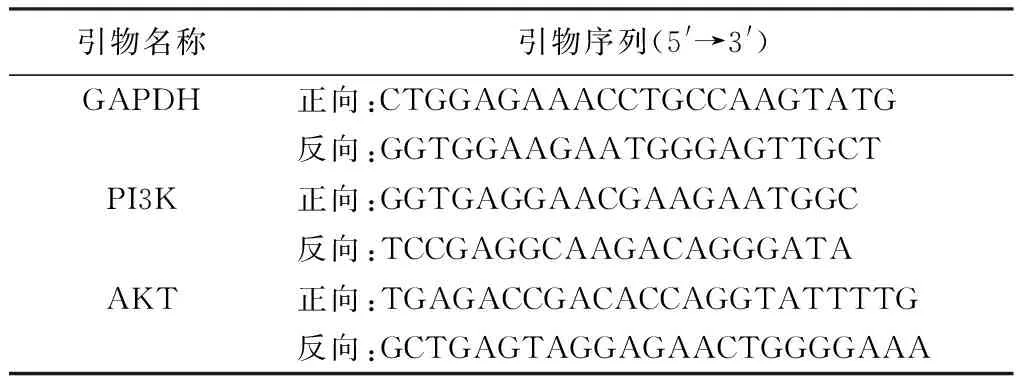
表2 引物序列
2 结果
2.1 白芍多糖对化学性肝损伤肝阴虚证大鼠证候评分和肛温的影响 经过评分可见,与空白组比较,模型组实验大鼠精神状态、毛发、小便评分显著升高,大便评分显著降低,可见模型组大鼠符合其一般情况中的描述:狂躁易激惹,活动多,抓时叫声,灌胃时反抗剧烈,毛发干枯无光泽,大便干,质地硬,小便色深黄。与模型组比较,一贯煎组、白芍多糖组改善明显(P<0.05,P<0.01)。与空白组比较,模型组大鼠肛温显著升高(P<0.001),与模型组比较,一贯煎组可显著降低模型大鼠肛温(P<0.001)。见表3。
表3 白芍多糖对肝阴虚证实验大鼠证候评分和肛温的影响
2.2 白芍多糖对化学性肝损伤肝阴虚证大鼠体质量的影响 与空白组比较,模型大鼠体质量明显下降(P<0.05)。与模型组比较,一贯煎组与白芍多糖组体质量升高,但差异无统计学意义(P>0.05)。见表4。
表4 白芍多糖对化学性肝损伤肝阴虚证大鼠体质量的影响
2.3 白芍多糖对肝阴虚证实验大鼠GPT、GOT水平的影响 与空白组比较,模型组大鼠血清GPT、GOT水平显著升高(P<0.01,P<0.001)。与模型组比较,一贯煎组、白芍多糖组血清GPT、GOT水平显著降低(P<0.01,P<0.001)。见图2。
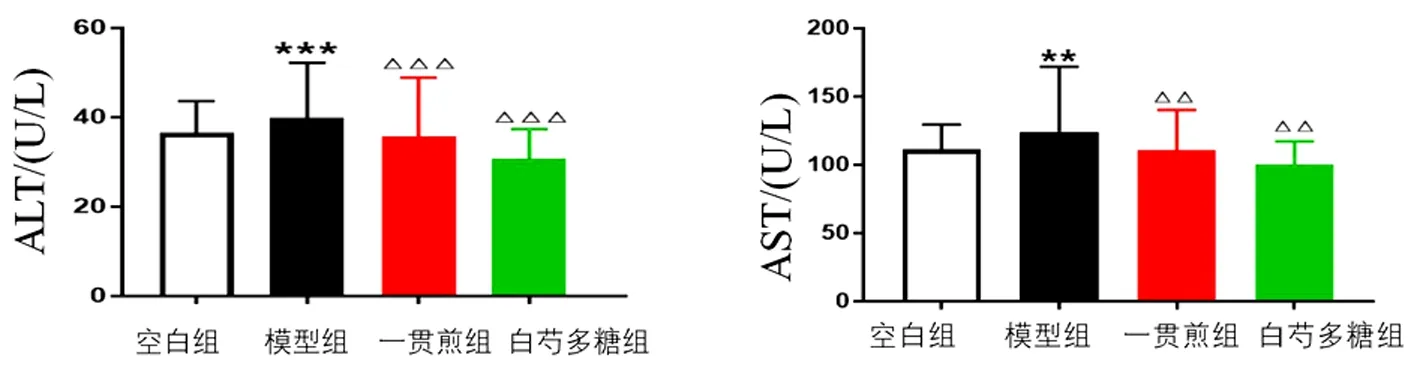
图2 白芍多糖对化学性肝损伤肝阴虚证大鼠血清GPT、GOT水平的影响
2.4 白芍多糖对化学性肝损伤肝阴虚证大鼠血清cAMP、cGMP水平的影响 与空白组比较,模型组大鼠cAMP/cGMP比值显著升高(P<0.05)。与模型组比较,一贯煎组cAMP水平及cAMP/cGMP比值显著降低(P<0.05)。见表5。
表5 白芍多糖对化学性肝损伤肝阴虚证大鼠血清cAMP、cGMP水平的影响
2.5 白芍多糖对肝阴虚证实验大鼠肝纤维化因子水平的影响 与空白组比较,模型组LN、HA、PCⅢ水平显著升高(P<0.05,P<0.01,P<0.001),与模型组比较,一贯煎组HA、PCⅢ、CⅣ、LN显著下降(P<0.05,P<0.01,P<0.001),白芍多糖组CⅣ、LN显著下降(P<0.01,P<0.001)。见图3。

图3 白芍多糖对化学性肝损伤肝阴虚证大鼠肝组织HA、PCⅢ、CⅣ、LN水平的影响
2.6 白芍多糖对肝阴虚证实验大鼠肝脏病理学的影响 空白组实验大鼠肝脏病理学切片肝组织结构正常,肝细胞无变性坏死。模型组实验大鼠的肝脏病理学切片显示较多肝细胞出现脂肪变性,胞质内可见微小的圆形脂肪空泡(黑色箭头);局部可见肝细胞灶性坏死,胞核碎裂溶解,胞质分界不清,嗜酸性增强,呈均质状(红色箭头),并伴有少量粒细胞等炎症细胞浸润(黄色箭头)。与模型组比较,一贯煎组、白芍多糖组病理改变均有所改善。见图4。
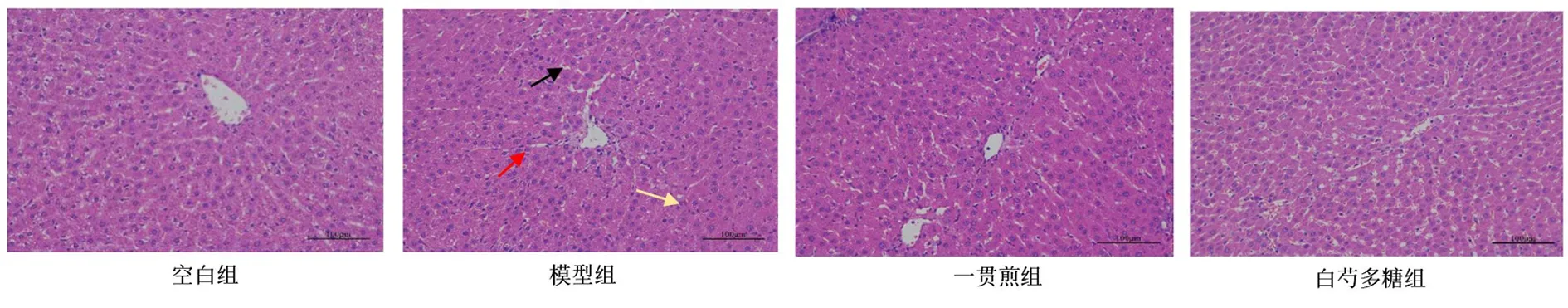
图4 大鼠肝脏病理学切片(HE染色,×200)
2.7 白芍多糖对化学性肝损伤肝阴虚证大鼠肝组织丙二醛、SOD、CAT、GSH-Px水平的影响 与空白组比较,模型组大鼠肝脏中丙二醛水平显著升高(P<0.01),GSH-Px活力显著下降(P<0.01),SOD水平显著下降(P<0.05)。与模型组比较,一贯煎组、白芍多糖组肝脏中丙二醛水平显著下降(P<0.05),GSH-Px活力显著升高(P<0.01,P<0.001)。见表6。
表6 白芍多糖对化学性肝损伤肝阴虚证大鼠肝组织丙二醛、SOD、CAT、GSH-Px水平的影响
2.8 白芍多糖对肝阴虚证实验大鼠细胞因子水平的影响 与空白组比较,模型组肝脏中TNF-α、IL-6水平显著升高(P<0.001),IL-10水平显著降低(P<0.05)。与模型组比较,一贯煎组与白芍多糖组大鼠肝脏中TNF-α、IL-6水平显著降低(P<0.001)。见图5。
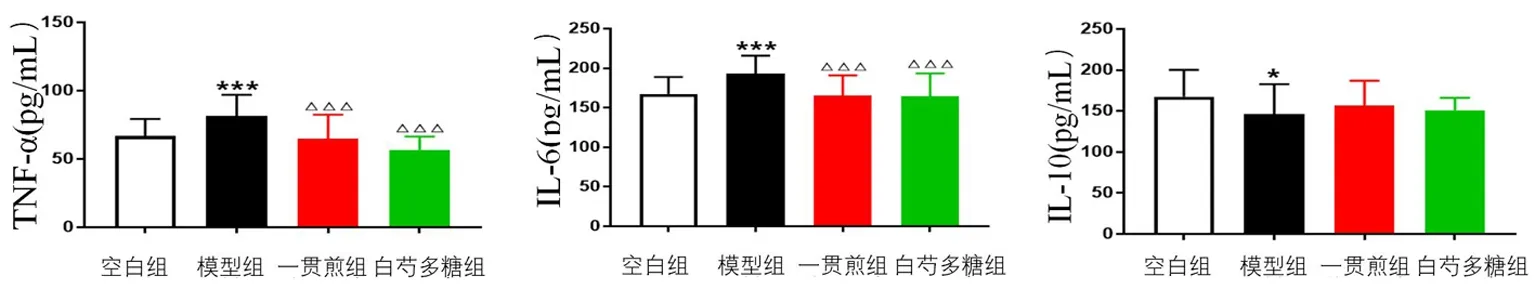
图5 白芍多糖对化学性肝损伤肝阴虚证大鼠肝组织TNF-α、IL-6、IL-10水平的影响
2.9 白芍多糖对肝阴虚证实验大鼠PI3K-AKT通路mRNA的影响 与空白组比较,模型组肝组织中PI3K、AKT mRNA表达量显著升高(P<0.01,P<0.001)。与模型组比较,一贯煎组肝组织中AKT mRNA表达量显著降低(P<0.001),白芍多糖组肝组织中PI3K、AKT mRNA表达量显著降低(P<0.01,P<0.001)。见表7。
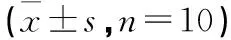
表7 白芍多糖对化学性肝损伤肝阴虚证大鼠PI3K-AKT通路mRNA的影响
3 讨论
实验结果显示,模型组大鼠体质量显著减轻、大便干硬程度评分高、小便颜色深黄、毛发无光泽评分高、肛温明显升高,并且cAMP/cGMP比值升高,TNF-α和IL-6水平升高,IL-10水平降低,血清GOT、GPT显著升高,肝脏病理切片显示轻度肝损伤、轻度肝纤维化,表明此模型符合化学性肝损伤肝阴虚证大鼠模型评价标准,可认为成功建立实验性肝阴虚证候大鼠模型[9]。同时研究表明,一贯煎为治疗肝阴虚证的代表方,能调节肝阴虚证的细胞因子紊乱,使机体细胞代谢恢复平衡,“以方测证”佐证了该化学性肝损伤肝阴虚证病证结合动物模型的合理性[14]。
中医理论指出肝阴虚证主要病机为阴阳失衡,阴虚阳亢、虚热内扰,出现消瘦、体温升高、易烦躁等的临床表现。在本实验动物模型中,白芍多糖可明显改善肝阴虚证大鼠的大便干燥状况,说明白芍多糖可缓解化学性肝损伤肝阴虚证模型阴虚表征。
cAMP、cGMP是细胞功能的重要调节物质,血中cAMP和cGMP的水平与机体神经内分泌系统的功能有关[15],对细胞功能处于稳定状态具有双向控制调节作用,与中医学的阴阳学说有相似之处,临床上阴虚证的患者cAMP/cGMP比值多数升高,因此研究结论认为cAMP/cGMP升高说明机体处于一种阴虚状态[16-17]。TNF-α和IL-6具有广泛的生物学活性,被认为是反映炎症反应严重程度的重要指标,在肝损伤的发生和发展中起着至关重要的作用[18]。PI3K-AKT信号通路可以通过调节关键的炎症介质调控炎症反应的程度,是调控2类细胞因子炎症介质-抗炎细胞因子)平衡的主要信号通路。刘晓燕等[19]用现代医学理论阐明了细胞因子紊乱所引起的阴虚证相关症状,认为细胞因子紊乱是阴虚证的病因。由此可见,环核苷酸cAMP和cGMP、细胞因子网络等均与中医的阴阳属性相似,因此环核苷酸-细胞因子网络失衡可能就是肝阴虚证机体阴阳失衡的具体体现。实验中模型组大鼠血清cAMP/cGMP比值升高,TNF-α、IL-6水平显著升高,IL-10水平显著降低,证明其环核苷酸-细胞因子网络失衡,存在阴虚证候。而白芍多糖对cAMP、cGMP及其比值水平均无明显效果,说明白芍多糖对调节cAMP、cGMP平衡无明显作用,但其可抑制PI3K-AKT通路mRNA水平,从而减少化学性肝损伤肝阴虚证炎症介质TNF-α、IL-6的释放,调节细胞因子网络平衡。
实验性肝阴虚证的定位症状中肝损伤的相关指标为GPT和GOT水平、肝脏的病理变化及肝纤维化程度。当肝脏被损伤,GPT、GOT由于细胞膜的破坏而漏出,其水平的高低反映了肝损伤程度的高低[20]。肝纤维化是慢性肝损伤主要的病理基础,PCⅢ、CⅣ、LN、HA是反映肝纤维化程度的重要指标[21]。模型组大鼠GPT、GOT、PCⅢ、LN、HA水平显著升高,表明模型构建成功,白芍多糖可显著减轻GPT、GOT、CⅣ、LN水平,发挥保护化学性肝损伤肝阴虚证的作用。同时,通过对病理切片的分析可知,白芍多糖可改善化学性肝损伤肝阴虚证大鼠肝脏的病理损伤情况。
氧化应激是慢性肝损伤的主要机制之一[22],当机体内发生氧化应激时,机体产生抗氧化剂,主要包括SOD、CAT、GPX-Px[23]。丙二醛是细胞脂质过氧化的终产物之一,其水平可反映氧化应激水平[24]。研究证明肝阴虚证候与氧化应激水平密切相关[25-26]。实验结果显示模型组存在氧化应激状态,白芍多糖可通过降低丙二醛水平,升高GSH-Px水平减轻氧化应激水平。
本研究显示,白芍多糖可缓解化学性肝损伤肝阴虚证动物模型部分阴虚证表征,在抗肝损伤方面,白芍多糖可抑制PI3K-AKT通路,通过抗肝纤维化、抗氧化应激、抗炎机制改善肝损伤。课题组前期研究显示,白芍总苷可缓解化学性肝损伤肝阴虚证大鼠阴虚表征,并且调节cAMP、cGMP平衡,在抗肝损伤方面可通过改善微循环障碍、抗炎机制发挥保护化学性肝损伤作用,并且可抑制PI3K-AKT通路[9]。
综上所述,白芍总苷与白芍多糖均可能为白芍养肝阴功效特点的物质基础,但二者养肝阴影响和作用机制不同,白芍总苷能改善阴虚证表征,调节cAMP、cGMP平衡并通过抑制PI3K-AKT通路来发挥抗炎作用,白芍多糖则主要通过改善阴虚证表征、抗肝纤维化、抗氧化应激、抑制PI3K-AKT通路mRNA水平来发挥抗炎作用,其具体机制还需要进一步探究。
