“心脑同调”法电针对焦虑模型大鼠行为学及相关信号通路的影响
2022-12-08许璐凡李诗梦惠志远曹子敏
许璐凡 王 军 李诗梦 惠志远 曹子敏 杨 磊
(1 北京中医药大学东直门医院针灸科,北京,100700; 2 北京中医药大学东方医院眼科,北京,100078)
焦虑障碍是一种以焦虑情绪为主要表现的神经症,常表现为持续的紧张不安、无明显原因和固定内容的担心,往往伴有自主神经功能障碍[1-2]。流行病学调查显示,我国焦虑障碍的发病率高达4.98%,已成为患病率最高的精神障碍疾病[3]。目前临床治疗中,抗焦虑药物可有效缓解焦虑症状,但也带来一系列不良反应,使其临床应用受到限制。鉴于西药治疗的局限性,针刺治疗具有整体调节的优势,疗效确切且不良反应少[4]。本课题组前期研究发现,基于“心脑同调”理论针刺治疗焦虑障碍疗效显著,但针刺治疗焦虑障碍的作用机制目前尚未阐明[5-7]。近年来研究发现脑源性神经营养因子(Brain Derived Neurotrophic Factor,BDNF)-酪氨酸激酶受体B(Tyrosine Receptor Kinase B,TrkB)信号通路在神经结构与功能的可塑性调节中起重要作用,该信号通路的异常表达与焦虑障碍的发病密切相关[8-9]。本研究从“心脑同调”角度取穴,观察电针对焦虑模型大鼠行为学及BDNF-TrkB信号通路的影响,探讨针刺治疗焦虑障碍的疗效及可能作用机制,为临床研究提供新的思路与实验依据。
1 材料与方法
1.1 材料
1.1.1 动物 选用32只8周龄雄性SD大鼠,体质量(200±20)g,购自斯贝福(北京)生物技术有限公司[动物许可证编号:SCXK(京)2019-0010]。饲养于北京中医药大学动物房,室温(23±2)℃,湿度(50±1)%,12 h明暗交替环境。实验程序遵循《关于善待实验动物的指导性意见》的相关规定,且经北京中医药大学动物使用和管理委员会批准(伦理审批号:BUCM-4-2019110601-4088)。
1.1.2 试剂与仪器 华佗牌电子针疗仪(苏州医疗用品厂有限公司,型号:SDZ-IIB型);毫针(北京中研太和医疗器械有限公司,规格:0.25 mm×13 mm);高架十字迷宫(上海欣软信息科技有限公司,型号:XR-XG201);旷场实验箱(上海欣软信息科技有限公司,型号:XR-XZ301);酶标仪(无锡华卫朗德仪器有限公司,型号:DR-200BS);光学显微镜(重庆奥特光学仪器有限公司,型号:BK-FL4);BDNF酶联免疫吸附试验(Enzyme Linked Immunosorbent Assay,ELISA)试剂盒(北京华英生物技术研究所,批号:20191112);BDNF抗体(北京博奥森生物技术有限公司,批号:20191104);TrkB抗体(北京博奥森生物技术有限公司,批号:20191108);水合氯醛(上海源叶生物科技有限公司,货号:Z25A10Y86923)。
1.2 方法
1.2.1 分组与模型制备 将32只SD大鼠按随机数字表法分为正常组、模型组、电针组、假针组,每组8只。各组大鼠在实验前适应性饲养7 d,在此期间实验者每日抚摸大鼠2 min。参照文献[10],采用国际通用的慢性不可预见性应激刺激法制备焦虑大鼠模型。应激刺激法包括6种:24 h禁食禁水、24 h高密度居住、30 min束缚、10 min夹尾、暖泳(31 ℃,15 min)和冷泳(18 ℃,10 min),足底电击15 min。每日随机给予1种刺激,相同刺激不连续出现,持续15 d。正常组每日抓取,不予以造模,其余各组大鼠均接受应激刺激。
1.2.2 干预方法 电针组于应激刺激前1 h进行电针干预。根据《实验针灸学》大鼠标准穴位图谱[11],将大鼠用鼠套固定后,选取“百会”“风府”“神门”“内关”进行针刺。“百会”向后平刺2 mm,“风府”向后下方斜刺1 mm,“神门”“内关”直刺1 mm。“百会”“风府”为一组,“神门”“内关”为一组,分别连接电针治疗仪。电针参数:疏密波,强度为0.15 mA,频率为20 Hz,留针20 min。于造模当天开始治疗,隔日1次,“神门”“内关”每次取单侧穴,左右交替,持续15 d。假针组参照电针组选穴,于相应穴位旁1 mm非经非穴处浅刺,不连接电针治疗仪,治疗时间与留针时间同电针组。模型组大鼠于相同时间以鼠套固定20 min,此外不作任何治疗。正常组不做任何治疗。
1.2.3 检测指标与方法
1.2.3.1 高架十字迷宫实验 于实验第15天,采用高架十字迷宫实验检测各组大鼠的焦虑水平。将大鼠置于高架十字迷宫中央区且面向开放臂,采用supermaze软件记录5 min内大鼠的活动情况,包括进入开臂次数(OE)、开臂停留时间(OT)、进入闭臂次数(CE)及闭臂停留时间(CT),根据上述指标计算进入开臂次数百分比(OE%):OE%=OE/(OE+CE)×100%,开臂停留时间百分比(OT%):OT%=OT/(OT+CT)×100%。每只大鼠测试前均用20%乙醇清除高架十字迷宫的残留气味。
1.2.3.2 旷场实验 各组大鼠于实验第15天进行旷场实验。旷场实验箱为立方形敞箱,80 cm×80 cm×40 cm,将旷场箱底部划分为面积相等的25个方格。将大鼠放置于箱底部中央方格内,运用supermaze软件记录5 min内大鼠的探究行为与运动情况。以大鼠穿越旷场箱底面的格数(四爪均进入的方格数)记录为水平运动次数,以大鼠双前肢离开旷场箱底的直立次数记录为垂直运动次数。每只大鼠测试前均用20%乙醇清除旷场实验箱的残留气味。
1.2.3.3 ELISA检测血清BDNF水平 实验第15天造模与治疗结束后,以10%水合氯醛按350 mL/kg剂量腹腔注射麻醉各组大鼠,经腹主动脉采血,血液静置后离心(4 ℃,3 000 r/min,15 min,离心半径10 cm),取上清置于-80 ℃保存。采用ELISA技术检测各组大鼠血清BDNF水平,严格按照试剂盒说明书进行检测分析。
1.2.3.4 免疫组织化学法检测前额叶皮质BDNF、TrkB蛋白表达量 取血后,快速断头剥离脑组织,分离前额叶皮质,以4%多聚甲醛溶液固定。常规脱水、包埋、切片,并严格按照免疫组织化学试剂盒说明书进行制片。免疫组织化学染色阳性表达为棕黄色颗粒。在400倍显微镜下进行图像采集,采用Image J图像分析软件对BDNF、TrkB蛋白表达量进行分析,以平均光密度值表示。
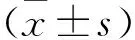
2 结果
2.1 宏观表征 正常组大鼠精神良好,皮毛润泽,反应敏捷,饮食正常,多洗脸、梳头等修饰行为;模型组大鼠毛色欠光泽,饮水迫切,大便色黑干燥,排便粒数减少,有攻击行为;电针组大鼠精神渐佳,毛色较为光泽,饮食渐增,行动较灵敏,修饰行为增多;假针组大鼠饮水增加、摄食下降、大便干燥。
2.2 大鼠高架十字迷宫实验 与正常组比较,模型组大鼠OE%、OT%值明显降低,差异有统计学意义(P<0.01,P<0.05);与模型组比较,电针组OE%、OT%值明显升高,差异有统计学意义(P<0.01,P<0.01),假针组OE%、OT%值有升高趋势,但无统计学意义(P>0.05,P>0.05);与电针组比较,假针组OT%值明显降低,差异有统计学意义(P<0.05),OE%值有降低趋势,但差异无统计学意义(P>0.05)。见表1。各组大鼠的高架十字迷宫运动轨迹显示,与正常组比较,模型组大鼠在开臂区的运动轨迹明显减少;与模型组比较,电针组大鼠在开臂区的运动轨迹明显增加;与电针组比较,假针组大鼠在开臂区的运动轨迹明显减少。见图1。

表1 各组大鼠进入开臂次数百分比、开臂停留时间百分比结果比较

图1 各组大鼠高架十字迷宫实验轨迹
2.3 大鼠旷场实验 与正常组比较,模型组水平得分、垂直得分明显下降,差异有统计学意义(P<0.05,P<0.01);与模型组比较,电针组水平得分、垂直得分明显升高,差异有统计学意义(P<0.01,P<0.01),假针组水平得分、垂直得分差异无统计学意义(P>0.05,P>0.05);与电针组比较,假针组水平得分、垂直得分显著降低,差异有统计学意义(P<0.05,P<0.05)。见表2。各组大鼠旷场实验轨迹显示,与正常组比较,模型组大鼠的活动轨迹明显减少;与模型组比较,电针组大鼠的活动轨迹明显增加;与电针组比较,假针组大鼠的活动轨迹明显减少。见图2。

表2 各组大鼠旷场实验结果比较分,n=8)

图2 各组大鼠旷场实验轨迹
2.4 各组大鼠血清BDNF水平 模型组大鼠血清BDNF水平较正常组明显降低,差异有统计学意义(P<0.01);电针组大鼠血清BDNF水平较模型组明显升高,差异有统计学意义(P<0.05);假针组大鼠血清BDNF水平较模型组差异无统计学意义(P>0.05);假针组血清BDNF水平较电针组明显降低,差异有统计学意义(P<0.05)。见表3。

表3 各组大鼠血清BDNF水平比较
2.5 各组大鼠前额叶皮质BDNF、TrkB蛋白表达 BDNF、TrkB阳性反应物呈棕黄色,主要位于细胞膜表面和细胞质。见图3~4。与正常组比较,模型组大鼠前额叶皮质BDNF、TrkB平均光密度明显降低,差异有统计学意义(P<0.01,P<0.01);与模型组比较,电针组大鼠前额叶皮质BDNF、TrkB平均光密度明显升高,差异有统计学意义(P<0.01,P<0.05),假针组大鼠前额叶皮质BDNF、TrkB平均光密度差异无统计学意义(P>0.05,P>0.05);与电针组比较,假针组大鼠前额叶皮质BDNF、TrkB平均光密度明显降低,差异有统计学意义(P<0.05,P<0.05)。见表4。

图3 各组大鼠前额叶皮质BDNF表达(免疫组织化学染色,×400,箭头示BDNF阳性细胞)

图4 各组大鼠前额叶皮质TrkB表达(免疫组织化学染色,×400,箭头示TrkB阳性细胞)
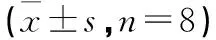
表4 各组大鼠额叶BDNF、TrkB平均光密度比较
3 讨论
中医学认为“焦虑障碍”属于“郁症”“不寐”“虚烦”等疾病范畴,多由于素体虚弱,七情内伤,或肝失疏泄,气机郁滞,或思虑过度,耗伤心神[12]。该病病机为神机被扰,病位多涉及心、脑、肝、脾,其中又与心、脑关系尤为密切。心藏神,脑为元神之府,人的精神、情志活动由心神与脑神共同支配,若心神被扰、元神失用则会出现精神、情志方面的异常。焦虑障碍存在心脑共患的特点,“心脑同调”为本病治疗的关键[13]。本实验基于前期临床研究[5-7],选取百会、风府治“脑”,神门、内关调“心”。《灵枢·卫气》曰:“头气有街……气在头者,止之于脑。”《灵枢·海论》曰:“脑为髓之海,其输上在于其盖(百会穴),下在风府。”故治“脑”取百会、风府符合气街、四海理论。根据经络理论,风府为督脉“入脑”之穴,百会为督脉“出脑”之穴,二穴共同调节脑髓,奉养脑神。神门为手少阴心经的原穴,是心原气经过和留止之处,《灵枢·九针十二原》云:“五脏有疾也,当取之十二原。”内关为手厥阴心包经络穴,《百证赋》中提及内关有“扫尽胸中之苦闷”之效,提示内关有治疗神志疾病的功效。二穴与心关系密切,具有宁心安神、宽胸解郁之效。
合适的动物模型是研究焦虑障碍发病及治疗机制的基础,慢性不可预见性应激模型是目前国际通用的焦虑障碍的造模方法之一。高架十字迷宫实验和旷场实验是动物焦虑行为学研究中较为经典的测试。高架十字迷宫实验利用大鼠对新异环境的探究特性、对高悬开放环境的恐惧及其趋暗性,形成探究与规避的行为冲突,从而评估大鼠的焦虑程度[14]。大鼠穿梭开放臂的频次及时间的所占百分比表达了大鼠的焦虑状态存在与否及其水平高低。实验结果表明,模型组大鼠OE%和OT%值显著降低,表现出明显的焦虑行为,而“心脑同调”法电针显著提高焦虑大鼠的OE%和OT%值,明显改善大鼠的焦虑行为,且优于假针组。旷场实验用于评估啮齿类动物的自发活动与探究行为,结果表明,焦虑模型大鼠水平得分与垂直得分显著降低,自发活动与探究行为明显受到抑制。“心脑同调”法电针显著增加大鼠的自发活动与探究行为,且效果明显优于假针组。通过以上行为学评价结果证实本实验造模成功,“心脑同调”法电针对焦虑大鼠行为学有较好的干预调节效应。
焦虑障碍的发病机制目前尚未阐明,其中神经营养学说获得较广泛接受。该学说认为神经网络对外界环境变化的适应性降低是导致情绪异常的主要原因,而神经营养因子可增强神经可塑性,维持中枢神经系统的内稳态,从而适应外界环境变化[15]。BDNF是一种广泛分布于中枢神经系统的神经营养因子,以前额叶皮质和海马内水平最高,在神经元的分化、增殖、营养及再生修复中起重要的作用,并且与情感调节关系密切[16-17]。BDNF通过与其特异性受体TrkB结合,引起TrkB同源二聚体化,诱导结合部位自磷酸化,按次序激活特定的蛋白质和酶,启动下游信号转导通路,从而发挥神经保护和神经营养等生物学效应,增强神经可塑性[18]。目前越来越多的证据表明BDNF-TrkB信号通路的异常表达与焦虑障碍的发生关系密切。动物实验表明,慢性束缚应激下,大鼠出现明显焦虑抑郁样行为,海马内BDNF、TrkB阳性细胞数及蛋白表达明显下降[19]。有研究证实,大脑中的BDNF可透过血脑屏障进入循环系统,且脑内BDNF水平与血清BDNF水平变化具有一致性[20]。临床研究表明,与健康者比较,广泛性焦虑障碍患者血清BDNF水平明显降低,经抗焦虑治疗后患者焦虑情绪逐渐缓解,血清BDNF水平较前明显升高[21]。由此可见,BDNF-TrkB信号通路与焦虑障碍的病理生理过程密切相关。前额叶皮质是脑内参与情绪调节的关键脑区,BDNF及其受体TrkB在前额叶皮质中有较高的表达。本实验研究结果提示,焦虑模型大鼠血清BDNF水平、前额叶皮质BDNF、TrkB表达量明显降低,而“心脑同调”法电针可纠正这一异常变化,且电针组调节效果明显优于假针组。
综上所述,本研究发现焦虑模型大鼠前额叶皮质BDNF-TrkB信号通路异常表达,可能与焦虑障碍的发生发展密切相关。“心脑同调”法电针可能通过调控该信号通路,调节神经结构与功能的可塑性,缓解大鼠的焦虑行为,从而达到对焦虑障碍的治疗作用。本研究为基于“心脑同调”理论针刺治疗焦虑障碍的机制研究提供了实验依据,后续我们将进一步探究焦虑障碍的发病机制及针刺抗焦虑的作用机制,为临床治疗焦虑障碍提供新的靶点与思路。
