新疆芜菁中均一多糖的分离纯化及结构分析
2022-12-07米合热尼沙阿木热江卡地尔亚库尔班古娜娜对山别克海力茜陶尔大洪
米合热尼沙·阿木热江,卡地尔亚·库尔班,古娜娜·对山别克,海力茜·陶尔大洪
(1新疆医科大学药学院,乌鲁木齐 830017,2新疆医科大学附属肿瘤医院医学药学部,乌鲁木齐 830011)
芜菁(BrassicarapaL.)为十字花科芸苔属亚种二年生草本植物,地下块根作为蔬菜在我国已有长时间的种植历史,主要分布在新疆和西藏,具有滋阴润肺、健胃消食、增强体质等功效[1-3]。有研究表明芜菁水提物(BAE)中含有糖、黄酮、生育酚、皂苷、挥发油、酚类、鞣质、氨基酸和蛋白质等多种化学物质[4-5],具有抗氧化、免疫调节等一系列潜在的生物学活性[6]。近年来对植物活性多糖的研究越来越多,多糖对慢性疾病的预防和治疗等生理功能引起了学者关注[7-8]。本课题组前期研究发现芜菁酸性均一多糖BRAP-2对小鼠Lewis肺癌细胞具有抑制作用,可增强巨噬细胞介导的细胞先天免疫反应[9-10]。本研究提取分离纯化芜菁多糖,采用紫外-可见分光光谱法(Ultraviolet-visible spectrophotometry,UV)、比旋光度法、气相色谱法(Gas chromatography, GC)、傅里叶红外光谱法(Infrared spectroscopy, IR)、核磁共振法(Nuclear magnetic resonance ,NMR)分别测定芜菁多糖均一组分1(BP1)和组分2(BP2)的分子质量、单糖组成、化学键组成、糖链结构,现报道如下。
1 仪器与试药
1.1 仪器UV-2700紫外分光光度计(北京普析通用仪器有限责任公司);WZZ-1型自动旋光仪(上海精密科学仪器有限公司);AVATER-360 型IR光谱仪(美国尼高力仪器股份有限公司);核磁共振光谱仪(Bruker scendTM 600)。
1.2 试剂葡聚糖标准(品天津市天新精细化工开发中心, 批号:50-99-7);阿拉伯糖(Ara)、甘露糖(Man)、葡萄糖(Glc)和半乳糖(Gal)(天津市天新精细化工开发中心, 批号:50-99-7);DEAE-纤维素52填料(上海化学试剂站分装厂);葡聚糖凝胶 Sephadex-G150 填料(上海化学试剂场,Pharmacia 进口分装)。
1.3 药材芜菁药材2021年12月采摘与柯坪县阿恰乡,经新疆医科大学药学院丛媛媛教授鉴定为十字花科芸苔属,芸苔种植物芜菁(BrassicarapaL.)的地下块根。
2 方法与结果
2.1 芜菁多糖的制备将1 kg芜菁干燥粉碎,用95%乙醇浸泡脱脂,挥干药渣后在70℃的水浴锅中用水(H2O)回流提取2次(2 h/次)。浓缩滤液,醇沉(80%乙醇)12 h。溶解已挥干的沉淀并透析48 h。冷冻干燥后得到了芜菁粗多糖BRP。采用Savag法[11]除去蛋白质,配制成100 mg/mL的多糖溶液,4 000 r/min离心15 min,再用DEAD-纤维素52柱层析(3.5×69 cm),分别用H2O和0.1~1.0 mg/mL NaCl溶液梯度洗脱。采用蒽酮-硫酸法[12]制作n-A(n为管数,A为吸光度)洗脱曲线,浓缩,透析(截留相对分子质量Mw=3 500 Da),冷冻干燥备用。将含量较高的成分取适量溶解在2 mL H2O中,4 000 r/min离心15 min,上清液上样到用3~5倍H2O固定好的sephadex-G150凝胶柱层析(2.0×60 cm),用H2O洗脱并用10 mL的离心管收集洗脱液,同上述方法测定A,浓缩,冷冻干燥后备用。制备1 mg/mL(10 mg溶解在10 mL H2O中)均一多糖溶液,以H2O为空白在UV分光光度计200~400 nm处进行扫谱。采用DEAE-纤维素52柱层析分离得到了7个组分,命名为BP1、BP2、BP3、BP4、BP5、BP6、BP7,其中BP1和BP2的含量较高。经Sephadex-G150洗脱的BP1,BP2洗脱曲线显示为单一峰,可判断为均一组分。因在260、280 nm处未出现明显的吸收峰,可认为不含蛋白质和核酸,见图1~3。
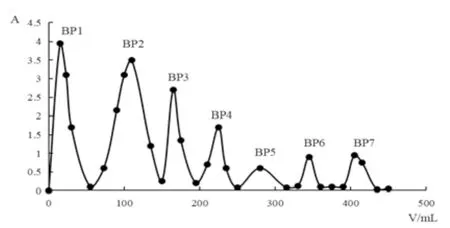
图1 DEAE-纤维素52芜菁多糖洗脱曲线

图2 BP1 UV扫描图谱

图3 BP2 UV扫描图谱
2.2 芜菁多糖相对分子质量的测定称取BP1和BP2组分各5 mg加1 mL H2O溶解,3 500 r/min离心10 min后取上清液上sephadexG-150 凝胶层析柱,每管收集2 mL。用Glu测总体积Vt制作Ve/V0-lgMw[其中Ve为各Dextran洗脱体积,V0为蓝色葡聚糖(相对分子质量200万)测定凝胶柱的空体积]标准曲线。称取BP1和BP2组分各5 mg,用两种组分样品的洗脱体积,有效分配系数Kav和已绘制的相对分子质量标准曲线计算出多糖样品的相对分子质量[13]。分别将均一组分洗脱体积代入方程:gMw=-2.5Ve/V0+8.588(r=0.999 5)计算相对分子质量,见表1。

表1 不同分子量的标准Glu 及多糖的洗脱体积及相对分子质量
2.3 芜菁均一多糖的旋光度测定各称取BP1、BP2 10 mg置10 mL容量瓶中,加H2O定容,以钠(Na)灯为光源,测定比旋光度[α]。比旋光度[α]=αL-1C,式中α为旋光度(°), L为试管的长度(dm),C为溶液的浓度(g/mL)[14]。测定结果显示,组分BP1和BP2旋光度分别为+0.19、+0.13,比旋光度分别为+18.83、+12.00,均右旋。
2.4 芜菁多糖均一组分部分酸水解分析各称取BP1、BP2 10 mg置具塞试管中,加0.05 mol/L 的三氟醋酸(CF3COOH)2 mL,90 ℃水浴中加热2 h,过量的CF3COOH反复用乙醇减压蒸干法除去,倒入透析袋(截留相对分子质量M=500)透析24 h,分别收集袋内,外部分并浓缩,冷冻干燥后进行GC分析。GC-14C条件:毛细管管柱(OV-1701,30×0.32 mm,0.25 μm),柱温度从160 ℃升至200 ℃(8 ℃/min),维持10 min,再升至230 ℃(5℃/min),维持5 min;进样口温度250℃,火焰离子化检测器温度270℃;载气(H2)线速50 mL/min,O2气流速500 mL/min,进样量1 μL,分流比3∶1。均一组分BP1和BP2袋内、外部分酸水解结果表明,组分BP1袋内、外部分水解产物说明的主链单糖残基为Man、Glc、Gal和Ara,其中Glc比较多;末端、分支单糖残基为Man和Glc。组分BP2的袋内,外部分酸水解结果可知主链单糖残基为Ara、Man、Glc和Gal,其中Glc比较多,同为末端、分支单糖残基。
2.5 芜菁多糖均一组分高碘酸氧化分析精密称取的8.100 mg 高碘酸钠(NaIO4)置100 mL容量瓶溶解定容,从中分别取1.0、2.0、4.0、6.0、8.0、10.0 mL置于50 mL容量瓶,定容摇匀,测吸光度A,绘制c-A标准曲线及线性方程。称取两份20 mg置25 mL的棕色容量瓶,避光条件下再加0.015 mol/L 的 NaIO4溶解并定容。每6 h取0.1 mL置25 mL容量瓶加 H2O定容,在最大波长222 nm处测定A。A稳定时加入2 mL乙二醇(CH2OH)2,进行所消耗的NaIO4的计算。吸取5 mL反应后的芜菁多糖组分溶液,用NaOH溶液进行滴定。取25 mL浓度为0.001 5 mol/L NaIO4溶液,并加入2 mL(CH2OH)2摇匀,吸取5 mL作为空白对照进行NaOH溶液滴定。H5IO6标准曲线所得回归方程为Y=46.418X-0.009 3,r=0.999 5(1.62~16.20 μg/mL)。HCOOH(甲酸)的生成量以NaOH的消耗量来计算。结果表明,根据多糖组分均生成HCOOH,可判断多糖结构中都含有1→6或者1→糖苷键。因NaIO4与HCOOH的摩尔质量(M)之比大于2,所以这两种糖中大量存在的糖苷键可能是1→2或者1→2,6和1→4或者1→4,6。
2.6 芜菁多糖样品的IR分析各取BP1和BP22 mg,采用压片法与200 mg溴化钾(KBr)在玛瑙研钵中研磨混匀后压片,在4 000~400 cm-1区域内进行IR扫描来确定糖苷键的构型及观察其他官能团[15]。在3 381 cm-1和3 361 cm-1处分别出现的宽强峰是糖类分子内氧氢键的伸缩振动吸收峰,说明两种多糖组分分子之间或者分子内可能存在H键;2 930 cm-1和2 933 cm-1处出现的较弱峰是糖苷键中-CH2的C-H振动吸收峰;1 600±3 cm-1吸收峰是表明含有糖醛酸的游离的R-COOH或R-COOH盐C=H不对称伸缩振动;图4中的1 408 cm-1和图5中的1 398 cm-1, 1 381 cm-1左右的峰分别是-COOH的C-O伸缩振动峰和C-H变角振动峰。BP1在1 078 cm-1,1 047 cm-1处出现强吸收峰是碳氧键伸缩振动峰,为吡喃环特征峰;因BP2糖环上C-O-C的不对称伸缩振动,所以在1 066±10 cm-1处的峰是典型的吡喃糖环内酯和-OH的吸收峰;图4中1 050±50 cm-1处较大的吸收峰是糖环C-O-C和C-O-H的碳氧伸缩振动峰;924±1 cm-1处为α-吡喃环的对称伸缩振动峰;864 cm-1,868 cm-1处的吸收峰是吡喃环上-CH的横向振动,817 cm-1处的吸收峰是α-吡喃环的碳氢键的变角振动。检测结果表明吡喃糖是组成BP1、BP2的单糖。
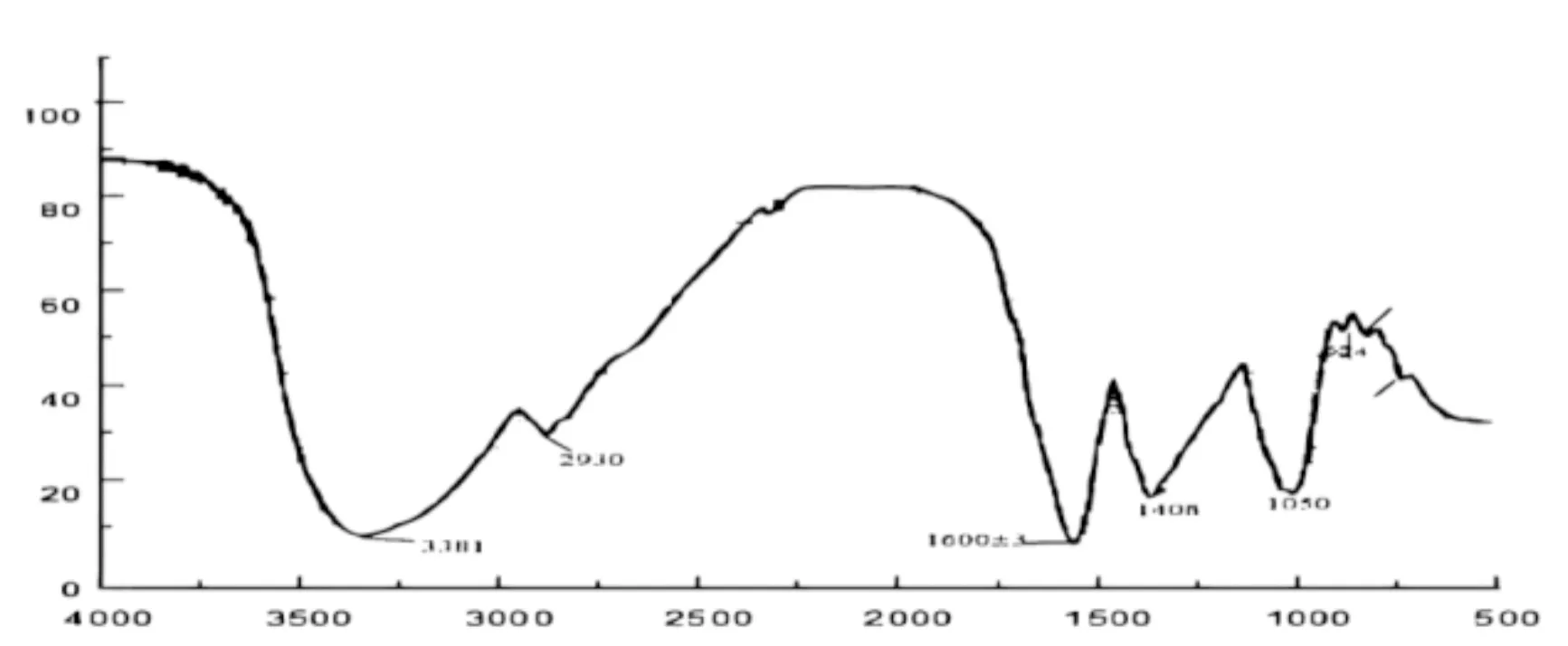
图 4 多糖 BP1 的红外光谱图

图 5 多糖 BP2的红外光谱图
2.7 芜菁多糖样品的NMR分析在NMR管中装入各40 mg的BP1、BP2,适量的H2O中充分溶解,核磁共振仪上进行1H-NMR,13C-NMR光谱分析。组分BP1和BP2的核磁共振氢谱、碳谱图显示,在δ3.0~4.5 ppm区域的大部分质子信号和δ22.92~106.47 ppm区域的异头碳信号为典型的多糖信号。如组分BP1在δ4.5~5.5 ppm的异头氢质子信号区出现了能证明含有4种单糖残基的δ5.42、5.25、5.19、4.60 ppm等4个质子信号,且异头氢化学位移值δ5.42、5.25、5.19 ppm均大于δ4.95 ppm,推断为α构型糖残基。因δ4.60 ppm小于δ4.95 ppm,可认为存在β构型糖残基。碳谱显示BP1在δ90~110 ppm异头碳信号区出现了δ104.3、100.88、94.98、91.65 ppm等4个信号峰,说明含有4种单糖残基。其中δ100.88、94.98、91.65 ppm异头碳化学位移值均小于δ103,可推断为α构型糖残基,δ104.3 ppm大于δ103 ppm,推断是β构型糖残基。组分BP2在δ4.5~5.5 ppm的异头氢质子信号区同样出现了能说明可能含有单糖残基的质子信号,分别为δ5.24、5.23、5.18、4.64 ppm,其中异头氢化学位移为δ4.64 ppm小于δ4.95 ppm,是β构型糖残基。δ5.24、5.23、5.18 ppm异头氢化学位移大于δ4.95 ppm,存在α构型糖残基。碳谱结果显示BP2在δ90~110 ppm异头碳信号区出现了δ104.37、100.95、98.79、96.92 ppm等4个信号峰,说明含有4种单糖残基。其中δ100.95、98.79、96.92 ppm异头碳化学位移值均小于δ103 ppm,可认为是α构型糖残基。大于δ103 ppm的δ104.3 ppm可证明是β构型糖残基,见表2、3。

表2 多糖BP1的1H-NMR和13C-NMR 化学位移/ppm
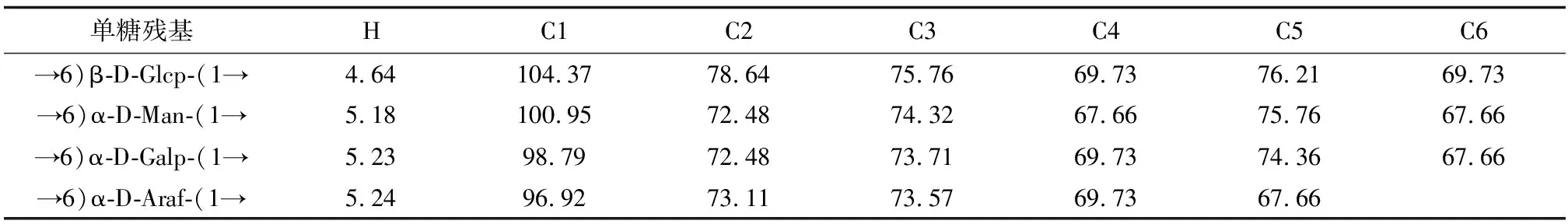
表3 多糖BP2的1H-NMR和13C-NMR 化学位移/ppm
3 讨论
高分子化合物多糖结构复杂,化学成分多样[16]。多糖之所以具有不同的生物学活性是与 其结构、单糖组成和相对分子质量等有关[17]。
本研究通过水提醇沉的方法得到芜菁粗多糖,进一步分离纯化后选择含量较高的芜菁均一多糖组分BP1、BP2,分析其相关结构鉴定。结果显示BP1和BP2相对分子质量分别为 110 662,37 844,[a]为+18.83,+12.00;BP1,BP2均由Ara、Man、Glc、Gal组成,其摩尔比分别为1∶2.90∶16.48∶1.52,1.24∶2.03∶15.24∶1。IR分析结果可知组分BP1、BP2的单糖均为吡喃糖。α-D-Man-(1→,→6)α-D-Glc-(1→和→2,6和1→连接的β-D-Gal组成BP1主链,α-D-Man-(1→,→6)α-D-Glc-(1→组成支链。组分BP2主链由→6)α-D-Ara-(1→, →6)α-D-Man-(1→和→6,1→)连接的 β-D-Glc组成,→6和1→)连接的β-D-Glc组成支链。
以上研究分析只能推测多糖的一级结构,为芜菁多糖今后进一步研究以及多糖的开发利用提供了理论依据。
