槟榔多糖对Caco-2细胞氧化损伤的保护作用
2022-12-07冀晓龙王治雯潘飞兵匡凤姣吴长浩闫溢哲
冀晓龙,王治雯,潘飞兵,匡凤姣,吴长浩,闫溢哲
1.郑州轻工业大学 食品与生物工程学院,河南 郑州 450001;2.海南华创槟榔研究院,海南 海口 571600;3.海南口味王科技发展有限公司,海南 万宁 571542
0 引言
槟榔(ArecacatechuL.)又称橄榄子、大腹子、榔玉等,属于棕榈科槟榔属常绿乔木植物,广泛种植于我国南部海南、广东、云南等省份[1]。槟榔被称为“四大南药”之首,作为中医药在我国已使用数千年;现代植化成分分析发现,槟榔中含有丰富的多糖、单宁、甾体、生物碱、黄酮等多种活性成分,具有抗抑郁、促消化、降血糖、抗氧化、抗炎、抑菌、调节肠道菌群等作用[2-3]。多糖是槟榔中主要的功能营养活性成分[4],现有研究仅报道槟榔多糖(ArecacatechuL.polysaccharide)具有显著的1,1-二苯基-2-三硝基苯肼(DPPH)自由基清除能力、Fe2+螯合能力、Fe3+还原能力[5],以及缓解H2O2和短波紫外线处理对人皮肤成纤维细胞(HSF)造成氧化损伤的作用[6]。槟榔多糖还具有一定的缓解炎症发生的作用,可抑制脂多糖(LPS)诱导巨噬细胞生成NO[7]。
氧化损伤是各种退行性疾病发生的主要原因之一。活性氧(ROS)在机体内的过量产生和累积会破坏细胞内的生物分子,造成脂质过氧化、蛋白质氧化、DNA损伤等[8]。肠道上皮细胞中具有发达的内质网系统,多种应激因素可导致内质网内未折叠或错误折叠蛋白的数量增加并发生蓄积,引发内质网应激反应,进而引发炎症、结肠炎、结肠癌等[9]。有研究者[10]提出,通过抗氧化剂、自由基清除靶向治疗、维持肠道屏障完整性、调节肠道菌群等途径可以预防或减轻溃疡性结肠炎的发生发展。因此,筛选能够有效调控氧化应激引起结肠细胞损伤的天然抗氧化剂,是预防和辅助治疗结肠炎的有效策略。
目前,基于槟榔多糖的人肠道上皮细胞氧化损伤后保护调控作用方面的研究鲜见报道。人结直肠腺癌细胞(Caco-2细胞)是常用于研究肠道屏障损伤发生和恢复机理的经典细胞系,在特定培养环境下,它能在体外分化出类似人小肠上皮细胞的结构,产生与人小肠上皮细胞相似的代谢酶系并具有分泌功能[11-12]。基于此,本研究拟采用DMNQ(内源性氧化应激诱导剂,2,3-二甲氧基-1,4-萘醌)处理Caco-2细胞诱导细胞氧化损伤模型,研究槟榔多糖对Caco-2细胞氧化损伤的保护作用,以期为槟榔多糖改善肠道损伤提供理论依据。
1 材料与方法
1.1 材料与试剂
槟榔,购于湖南口味王集团有限责任公司;Caco-2细胞,购于中国科学院上海细胞库;DMNQ,美国Sigma公司产;DMEM高糖培养基,美国Hyclone公司产;胎牛血清,美国Gibco公司产;胰蛋白酶、PBS缓冲液、一抗、二抗、双抗和显影液,武汉塞维尔公司产;CCK-8试剂盒、Annexin V-FITC/PI细胞凋亡检测试剂盒,上海碧云天生物技术有限公司产;Triton X-100、二甲基亚砜(DMSO)、低熔点琼脂糖、高熔点琼脂糖,北京索莱宝生物科技有限公司产。
1.2 主要仪器与设备
Thermo 3110型二氧化碳细胞培养箱,美国Thermo公司产;Biotek Elx808型酶标仪,美国伯腾仪器有限公司产;TS100型倒置生物显微镜、50i型荧光显微镜,日本尼康公司产;BD FACSAriaTMⅢ型高速分选流式细胞仪,美国BD公司产;垂直电泳系统、水平电泳系统、GE1DOC XR型凝胶成像系统,美国Bio-Rad公司产;磨砂载玻片、盖玻片,中国SAIL BARADN公司产;细胞培养皿和孔板,中国NEST公司产。
1.3 实验方法
1.3.1 槟榔多糖的提取和纯化槟榔多糖(本研究简称AP)的提取参考文献[5]并稍作修改。采用Sevag法脱除粗AP中的蛋白质,H2O2脱色后,利用DEAE Sepharose Fast Flow离子层析柱(2.6 cm×100 cm)和S-100 HR丙烯葡聚糖凝胶层析柱(2.6 cm×100 cm)进行分离纯化[12],采用蒸馏水进行洗脱;采用苯酚-硫酸法在490 nm波长处测定AP溶液吸光度并收集AP溶液;经3500 Da透析膜透析后,冷冻干燥获得AP。AP的平均分子质量为3.73×104Da,由甘露糖(Man)、半乳糖(Gal)、木糖(Xyl)和阿拉伯糖(Ara)组成,其物质的量比为4.1∶3.3∶0.9∶1.7;主链结构由→4)-α-Galp-(1→和→3,6)-β-Manp-(1→组成[13]。
1.3.2AP干预Caco-2细胞活力的测定采用CCK-8法测定AP干预后的Caco-2细胞活力[14]。复苏Caco-2细胞后,用DMEM高糖培养基(含10%(如无特指,文中百分数均指体积分数)的胎牛血清,1%的青链霉素(100 μg/mL)混合液,1%的非必需氨基酸和GlutaMAX)培养,培养条件为CO25%、培养温度37 ℃。传代培养后,用3~15代Caco-2细胞进行后续实验,过程中选取状态良好的Caco-2细胞进行冻存。接种适量Caco-2细胞至96孔细胞培养板中,待细胞生长至80%左右,换1%的血清培养基,分别加入终质量浓度为50 mg/mL、100 mg/mL、200 mg/mL、400 mg/mL、800 mg/mL、1000 mg/mL的AP溶液,培养24 h,利用CCK-8试剂盒检测细胞存活率。
1.3.3AP干预DMNQ诱导氧化损伤Caco-2细胞活力的测定接种适量Caco-2细胞至96孔细胞培养板中,待细胞生长至80%左右,换1%的血清培养基,饥饿培养3 h;分别加入终质量浓度为50 mg/mL和100 mg/mL的AP溶液,预保护3 h;加入DMNQ(终浓度为20 μmol/L)处理2 h,用含或不含50 mg/mL、100 mg/mL AP溶液的培养基培养24 h后,利用CCK-8试剂盒检测细胞存活率[15]。
1.3.4AnnexinV-FITC/PI细胞凋亡检测接种适量Caco-2细胞至6孔细胞培养板中,经DMNQ和AP处理后,分别收集各孔细胞上清液;将贴壁细胞消化下来后,与对应细胞上清液合并,于4 ℃、1000 r/min条件下离心5 min,PBS缓冲液(0.01 mol/L,pH值为7.4,下同)洗涤2遍,按照Annexin V-FITC/PI细胞凋亡检测试剂盒说明书进行染色处理,并使用高速分选流式细胞仪进行检测[16]。
1.3.5 单细胞电泳检测取89 mL裂解液(pH值为10.0, 2.5 mol/L NaCl,100 mmol/L EDTA,10 mmol/L Tris),加入1 mL Triton X-100和10 mL DMSO,即为裂解工作液。电泳液(300 mmol/L NaOH, 1 mmol/L EDTA, pH值为10.0)和中和液(0.4 mol/L Tris-HCl,pH值为7.5)于室温储存。用PBS缓冲液将Caco-2细胞制成悬浮液,加入适量37 ℃、质量分数为0.7%的低熔点琼脂糖,混匀后滴加到预热的磨砂载玻片(用质量分数为0.6%的正常熔点琼脂糖溶液浸泡)上,盖上盖玻片,于4 ℃条件下固化10 min;取下盖玻片,在裂解工作液中裂解40 min;PBS缓冲液洗涤3遍后,置于水平电泳槽上,加入新鲜配制的碱性电泳液避光解旋25 min,设定电压25 V,电流300 mA,电泳20 min;中和液浸泡10 min,DAPI染色液染色,盖上盖玻片,在荧光显微镜下进行观察[17]。
1.3.6 蛋白提取和蛋白质免疫印迹检测无菌巴氏吸管吸取多余培养基,PBS缓冲液洗涤3遍,随后加入1 mL RIPA裂解液(含蛋白酶抑制剂),冰上裂解15 min,刮下细胞收集于离心管中;于4 ℃、13 000 r/min离心20 min后,转移上清液至新的离心管中,-80 ℃保存,备用。调整蛋白浓度一致,按比例加入5 ×蛋白上样缓冲液后混匀,沸水浴5 min,冷却,-20 ℃保存。根据蛋白质免疫印迹步骤进行目的蛋白表达分析[18]。
1.4 数据统计与分析
为保证实验结论的可信度,进行3组独立实验,每组实验循环3次,实验结果用(平均值±标准差)表示。利用SPSS 17.0软件对单因素方差中的Ducan检验结果进行显著性分析,P<0.05、P<0.01分别表示差异显著、差异极显著[19]。
2 结果与分析
2.1 AP质量浓度对Caco-2细胞活力的影响分析
AP质量浓度对Caco-2细胞活力的影响如图1所示,其中*表示与对照组相比差异显著(P<0.05),** 表示与对照组相比差异极显著(P<0.01),下同。由图1可知,AP干预Caco-2细胞24 h后,当AP质量浓度为0~400 μg/mL时,Caco-2细胞活力均大于90%,且与对照组(CK)相比差异不显著(P>0.05);当AP质量浓度为800 μg/mL和1000 μg/mL时,均能显著抑制Caco-2细胞活力(P<0.05)。上述研究结果表明,在测试质量浓度范围(0~400 μg/mL)内,AP对Caco-2细胞没有产生显著毒性作用,故在此次研究中选取50 μg/mL、100 μg/mL作为AP对DMNQ诱导Caco-2细胞氧化损伤的干预剂量开展后续研究。
2.2 AP对DMNQ诱导Caco-2细胞氧化损伤的保护作用分析
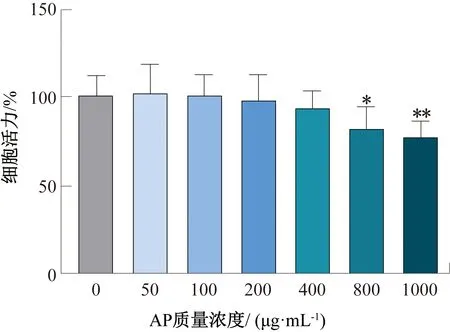
图1 AP质量浓度对Caco-2细胞活力的影响Fig.1 Effects of AP mass concentration on the viability of Caco-2 cells
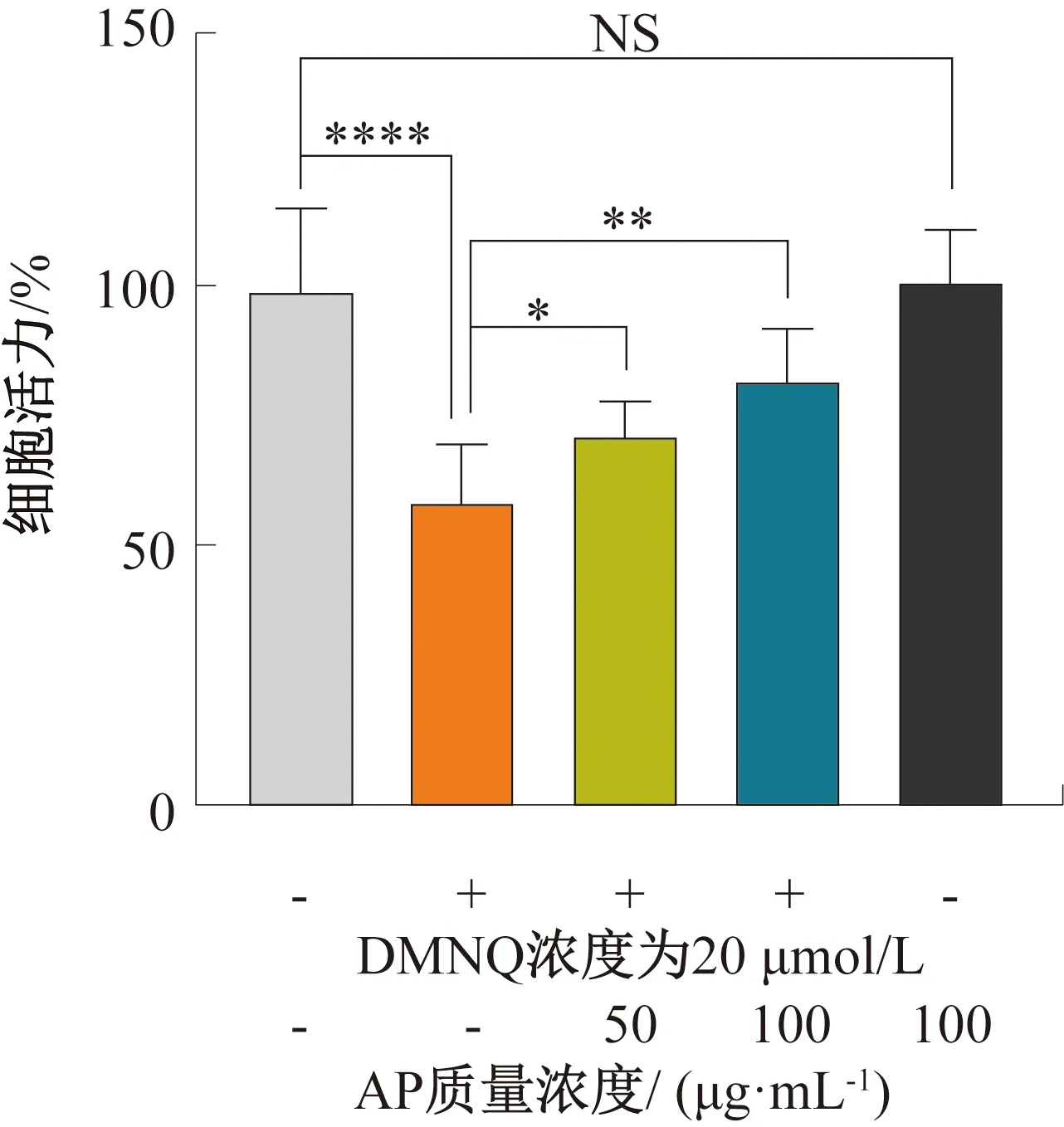
图2 AP对DMNQ诱导Caco-2细胞氧化损伤的保护作用Fig.2 Protective effect of AP on DMNQ-induced oxidative damage of Caco-2 cells
AP对DMNQ诱导Caco-2细胞氧化损伤的保护作用如图2所示,其中-表示不添加,+表示添加,**** 表示与对照组相比差异极显著(P<0.000 1), 下同。由图2可知,与对照组相比,DMNQ诱导氧化损伤组内Caco-2细胞活力显著下降,仅为57%;而经不同质量浓度AP(50 μg/mL和100 μg/mL)处理的干预保护组内,由于多糖质量浓度的提高,Caco-2细胞活力明显增加,分别达到72%和83%,与DMNQ诱导氧化损伤组相比,分别提高了26.32%和45.61%。上述研究结果表明,AP预处理可减少DMEM诱导的Caco-2细胞氧化损伤,即AP对DMEM诱导Caco-2细胞凋亡具有一定的保护作用;这与何萍萍等[19]研究红毛藻多糖对H2O2诱导Caco-2细胞氧化损伤的保护作用结果一致。
2.3 AP抑制DMNQ诱导Caco-2细胞凋亡分析
AP对DMNQ诱导Caco-2细胞凋亡及相关蛋白表达的影响如图3所示,其中*** 表示与对照组差异极显著(P<0.001),下同。由图3a)可知,经DMNQ诱导后,晚期凋亡细胞(Annexin V-FITC/PI双阳性细胞)率显著增加至10.20%,早期凋亡细胞(仅Annexin V-FITC阳性细胞)率增加至6.96%,坏死细胞(仅PI阳性细胞)率可忽略不计。经质量浓度为50 μg/mL和100 μg/mL的AP分别干预后,DMNQ引起的晚期凋亡细胞率的增加分别被抑制到5.18%和2.91%,早期凋亡细胞率的增加分别被抑制到3.62%和3.92%。对照组和质量浓度为100 μg/mL的AP干预组的凋亡细胞率无显著差异(P>0.05%)。上述研究结果表明,DMNQ诱导Caco-2细胞出现凋亡和坏死,且以晚期凋亡为主,即AP干预可以有效抑制DMNQ引起的Caco-2细胞凋亡和坏死。这与易鹏吉等[20]研究槲皮素对H2O2损伤的大鼠嗜铬细胞瘤(PC12)细胞保护作用的结果一致,其原因为槲皮素可显著改善细胞形态,有完整结构的细胞增多且重新长出突触。
单细胞电泳结果(图3b))同样验证了Annexin V-FITC/PI染色结果。对照组和质量浓度为100 μg/mL的AP干预组,其核基因组DNA完整、边界明显、无弥散拖尾现象;DMNQ诱导Caco-2细胞后,其核基因组DNA部分断裂、碎片化,经解旋、电泳后,可见明显长而宽的“彗星状”拖尾。AP干预可抑制DMNQ引起的核基因组DNA碎片化和拖尾现象,即AP抑制了DMNA诱导的Caco-2细胞氧化损伤和凋亡后产生的DNA断裂。
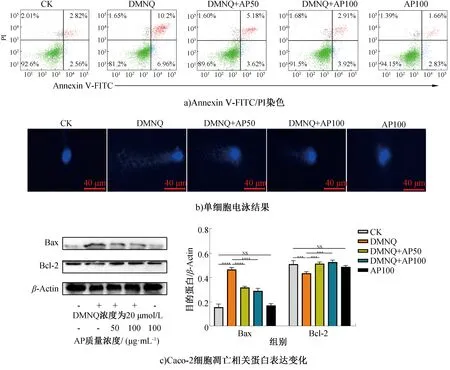
图3 AP对DMNQ诱导Caco-2细胞凋亡及相关蛋白表达的影响Fig.3 Effect of AP on DMNQ-induced apoptosis of Caco-2 cells and expression of related proteins
内源性途径(也称线粒体途径)是细胞凋亡的经典途径之一,主要由B细胞淋巴瘤2家族蛋白(抗凋亡蛋白Bcl-2 、促凋亡蛋白Bax等)引发和调节[21]。Caco-2细胞凋亡相关蛋白表达变化如图3c)所示。由图3c)可知,DMNQ能显著上调促凋亡蛋白Bax的表达,且抑制抗凋亡蛋白Bcl-2的表达;AP干预恢复了DMNQ诱导所致的促凋亡蛋白Bax表达上调及抗凋亡蛋白Bcl-2表达下降。上述研究结果表明,AP可抑制Caco-2细胞中促凋亡蛋白的表达并上调抗凋亡蛋白的表达,抑制DMNQ诱导的细胞凋亡。这与张晓霞等[22]的研究结果一致,壳寡糖可提高人神经母细胞瘤(SK-N-SH)细胞内ATP 水平,促进Bcl-2、Nrf2 和HO-1的表达,抑制Bax的表达。
2.4 AP对DMNQ诱导Caco-2细胞内质网应激的影响分析
转录激活因子6(ATF6)重组蛋白是内质网Ⅱ型跨膜蛋白,可感受内质网应激并活化转录因子C/EBP家族CHOP蛋白,诱导细胞凋亡[23]。AP对DMNQ诱导Caco-2细胞内质网应激的影响如图4所示。由图4可知,DMNQ诱导Caco-2细胞24 h后,显著促进了ATF6重组蛋白、CHOP蛋白的表达,而AP能够降低DMNQ诱导的内质网应激蛋白的高表达。上述研究结果表明,AP干预可有效改善DMNQ诱导的Caco-2细胞内质网应激反应。这与张岩岩等[24]的研究结果一致,白花蛇舌草多糖提取物(HDPE)可通过抑制喉癌Hep-2细胞内质网自噬,促进细胞内质网应激凋亡,进而抑制Hep-2细胞的增殖能力。
2.5 AP对DMNQ诱导Caco-2细胞紧密连接蛋白表达的影响分析
细胞紧密连接蛋白主要由连接黏附因子、Occludin、Claudins、闭合小环蛋白(ZO-1、ZO-2、ZO-3)等组成[25]。AP对DMNQ诱导Caco-2细胞紧密连接蛋白表达的影响如图5所示。由图5可知,DMNQ诱导Caco-2细胞24 h后,显著降低了紧密连接蛋白ZO-1、Occludin和Claudin 1的表达量(P<0.05);AP干预后,紧密连接蛋白Occludin和Claudin 1的表达量均显著上调,且高质量浓度AP (100 μg/mL)可恢复紧密连接蛋白Claudin 1的表达量至正常水平。质量浓度为50 μg/mL的 AP对紧密连接蛋白ZO-1的表达量无显著影响(P>0.05),仅在高质量浓度(100 μg/mL)AP作用下,紧密连接蛋白ZO-1的表达量才恢复至正常水平甚至高于对照组。上述研究结果表明,AP干预可修复DMNQ诱导的Caco-2细胞间紧密连接组织的损坏。这与王园等[26]的研究结果一致,发酵麸皮多糖可改善断奶大鼠空肠组织的抗氧化能力和形态结构,促进紧密连接蛋白的表达,因而具有维持肠道健康的功能。
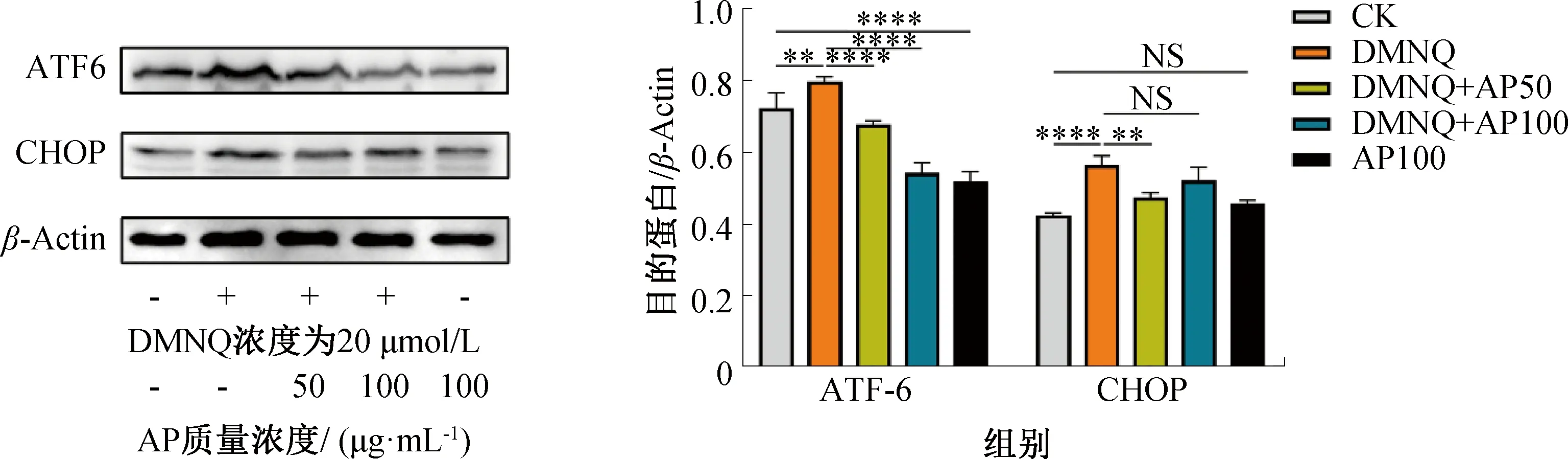
图4 AP对DMNQ诱导细胞内质网应激反应的影响Fig.4 Effect of AP on DMNQ-induced endoplasmic reticulum stress response
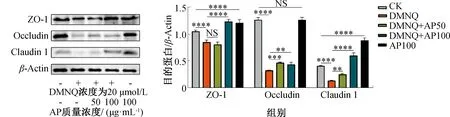
图5 AP对DMNQ诱导Caco-2细胞紧密连接蛋白表达的影响Fig.5 Effect of AP on DMNQ-induced tight junction protein expression in Caco-2 cells
3 结论
本文以DMNQ诱发人结直肠腺癌细胞(Caco-2细胞)氧化损伤为模型,研究槟榔多糖对Caco-2细胞氧化损伤的保护作用。研究结果证实了槟榔多糖对Caco-2细胞氧化损伤具有保护作用,该作用与抑制促凋亡蛋白Bax的表达及上调抗凋亡蛋白Bcl-2的表达有关;槟榔多糖可有效改善内质网应激反应并抑制细胞凋亡。研究结果还表明,槟榔多糖可以增加紧密连接蛋白ZO-1、Occludin 和Claudin 1的表达量,具有维持肠道屏障完整性的功能,但其作用及潜在机制还需在动物体上进行深入研究。本研究结果可为研究槟榔多糖对肠道健康的有益作用提供数据支持,为开发预防肠道损伤和维持肠道屏障完整性的功能性食品提供科学依据。
