食源性活性肽调控巨噬细胞极化的研究进展
2022-12-07杨文建许征莉姚丽张传伟刘春利谢旻皓马宁苏安祥
杨文建,许征莉,姚丽,张传伟,刘春利,谢旻皓,马宁,苏安祥
1.南京财经大学 食品科学与工程学院/江苏省现代粮食流通与安全协同创新中心/江苏高校粮油质量安全控制及深加工重点实验室,江苏 南京 210023;2.江苏卫生健康职业学院,江苏 南京 211800;3.安丘农业技术推广中心,山东 安丘 262100
0 引言
食源性活性肽通常被定义为对机体功能有益或具有特定生理调节作用的蛋白片段。每分子食源性活性肽的相对分子质量小于6000 Da,一般包含2~20个氨基酸残基,特殊情况下可包含20个以上氨基酸残基[1-2]。食源性活性肽具有低相对分子质量、低毒、易吸收、活性高、靶向性强等特点[3],也具有抗炎、抑菌、抗氧化、抗抑郁、抗肿瘤、免疫调节等生物活性[4-5]。目前,食源性活性肽免疫调节方面的研究受到业界广泛关注,研究者们试图从多个角度出发,探索、解析食源性活性肽的免疫调节作用机制[6]。
巨噬细胞作为先天性免疫细胞,在机体内发挥着吞噬病原体、修复损伤组织、抗肿瘤等多种免疫调节作用[7-8]。巨噬细胞具有高度可塑性,易受微环境中炎症因子、代谢物等介质诱导而发生表型和功能分化,即出现极化现象[9-10]。目前,关于食源性活性肽调控巨噬细胞极化进而发挥免疫调节作用的研究已成为热点。已有研究发现,乌鸡肽[11]、金枪鱼活性肽[12]和猴头菇活性肽[13]能显著促进巨噬细胞极化,并促进细胞因子白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)等的分泌,从而发挥免疫调节作用。因此,研究食源性活性肽对巨噬细胞极化的调控作用,对系统解析食源性活性肽的免疫调节作用机理具有重要意义。
本文拟针对食源性活性肽的来源、制备及其通过调控巨噬细胞极化发挥免疫调节作用的机制进行综述,并对其免疫调节作用的研究趋势进行展望,以期为食源性活性肽在免疫调节功能性食品中的应用提供理论依据和参考。
1 食源性活性肽来源与制备
1.1 食源性活性肽的来源
食源性活性肽来源广泛,主要包括动物源、植物源、微生物源等[14-15]。动物源活性肽可细分为乳蛋白肽、鱼类肽、胶原肽、畜产肽、蛋清肽、丝蛋白肽等[16],其中乳蛋白肽降解产生的多肽具有抗过敏、抗菌、抗氧化、抑制肿瘤生长等生物活性[17-18]。海洋动物源活性肽因具有肽链短、等电点低、疏水性强等特点,具有良好的免疫调节活性[19]。研究[20-23]表明,黄姑鱼肉活性肽、虾蛄多肽、青蛤酶解多肽和鲍鱼水解肽能显著提高巨噬细胞的增殖能力、吞噬功能、NO及IL-6、IL-1β和TNF-α的分泌水平,均表现出良好的免疫调节活性。
植物源活性肽种类丰富且来源广泛。水果果肉及种子中含有大量具有抗氧化、抗菌、免疫调节等功能的活性肽[24]。大豆中富含具有免疫调节、减少心脑血管及神经系统疾病等功能的活性肽[25]。此外,榛仁活性肽、小米醇溶蛋白肽(MPP)和核桃肽也具有良好的免疫调节活性[26-28]。
微生物源活性肽主要来源于食用藻类和食用菌类,具有抗菌、抗氧化、抗抑郁、抗疲劳、免疫调节等生物活性[29-30]。据报道[31-32],金针菇肽和杏鲍菇肽均能通过调控巨噬细胞极化,促进NO、IL-6和TNF-α分泌,发挥免疫调节活性。另外,研究[33]发现,从食用海藻中提取的活性肽具有肽链短、易吸收等特点,能够有效调节血压、血脂,改善机体免疫力。
除上述活性肽来源之外,近年来,随着工业化的不断发展,在食品生产加工过程中产生了大量副产物,部分副产物含有丰富的蛋白质,是制备活性肽的良好原料[34]。目前,已有研究从鲢鱼鱼鳞、白酒酒糟和麦麸中提取活性肽,这些活性肽能够有效清除自由基,具有良好的抗氧化活性[35-37]。利用副产物提取活性肽,可为促进生物资源的再利用和可持续发展做出贡献,具有巨大的发展潜力。
1.2 食源性活性肽的制备
目前,食源性活性肽常用的制备方法包括酶解法、物理辅助酶解法、微生物发酵法、微生物-酶协同法等。酶解法是指在特定温度和pH值条件下,利用蛋白酶特异性水解蛋白质产生活性肽的方法[38]。酶解法具有操作方便、安全性高、特异性强等优点,可制备高品质的食源性活性肽[39]。但酶解法存在商业酶价格高、产率较低、肽的溶解性较差等缺点,因此一般采用物理辅助酶解法制备食源性活性肽。李素云等[40]研究发现,与普通酶解法相比,超声波辅助酶解法能显著提高大米多肽产率,使大米多肽产率达到70.57%。另外,球磨[41]、汽爆[42]、高压均质[43]、微波[44]等辅助酶解法也已成功应用于南瓜籽肽、鱼皮肽、大豆肽和菜籽肽的制备,与普通酶解法相比,辅助酶解法可提高蛋白质的水解度和转化率。然而,也有研究[45]表明,利用超声波、高压均质等物理辅助法预处理蛋白质,可能会破坏氨基酸结构,产生苦味氨基酸,影响食源性活性肽的品质。
微生物发酵法是指利用微生物发酵产生的高活性蛋白酶将蛋白质分解成活性肽的方法[46]。该方法在发酵过程中产生的酶不仅可以去除酶解液中的苦腥味,改善食源性活性肽的风味,而且能充分释放蛋白质中的活性肽并提高其生物活性[47-48]。另外,微生物来源广泛、蛋白酶产量高,利用微生物发酵法制备活性肽可有效降低生产成本、提高生产效率[49]。王銮[50]研究发现,采用固态发酵法制备毛榛仁肽的水解率和转化率均较高,且该肽具有良好的抗氧化和降血压活性。邵家威[51]研究发现,采用发酵法从芝麻中提取的活性肽具有良好的自由基清除能力。但由于微生物发酵及代谢过程较复杂,产生的蛋白酶性质不稳定,导致活性肽的重现性较差[52],而且微生物发酵产物复杂,不利于后期活性肽的分离、纯化[53],阻碍了微生物发酵法在食源性活性肽工业生产中的应用。
采用酶解法与微生物发酵法协同作用制备多肽是提高蛋白质水解度、转化率和品质的可能途径。该方法可先利用酶水解蛋白质,再利用微生物发酵产生的蛋白酶将水解产物进一步分解成短肽或氨基酸,或先利用微生物发酵法分解蛋白质,再利用酶解法将其进一步水解为短肽或氨基酸[54]。王雪琦[55]首先采用胃蛋白酶和木瓜蛋白酶进行顺序酶解,再利用乳酸菌发酵所得酶解液进行水解,获得了具有较好抗氧化活性的羊骨胶原肽。H.Yang等[56]先用干酪乳杆菌、米曲霉等发酵豆粕24 h,再用碱性蛋白酶水解豆粕15 min,可有效提高豆粕中肽的提取率并增加总氨基酸含量。目前,虽然食源性活性肽的制备技术较完善,多种制备方法联用可提高食源性活性肽的产率和品质,但仍存在产率较低、产品品质不稳定等问题,难以实现工业化生产。
2 巨噬细胞极化现象分析
巨噬细胞是机体重要的免疫细胞,存在于多种组织和器官中,具有强大的识别、吞噬、清除病原体的作用,并在维持稳态、修复组织、吞噬病原体等免疫防御方面发挥着重要作用[57]。巨噬细胞根据其表型可分为经典巨噬细胞激活(M1型巨噬细胞)和替代巨噬细胞激活(M2型巨噬细胞)[58]。
巨噬细胞表面受体可识别脂多糖(LPS)、干扰素γ(IFN-γ)、TNF-α、集落刺激因子等诱导信号,触发一系列信号反应,从而促进巨噬细胞向M1型极化[59]。M1型巨噬细胞可分泌具有促炎活性的IL-6、TNF-α、一氧化氮合成酶(iNOS)等促炎因子,这些促炎因子可促进巨噬细胞有效抵御入侵的病原体、参与多种感染性疾病及其他慢性疾病的早期免疫防御[60-62]。
巨噬细胞受白细胞介素-4(IL-4)、白细胞介素-13(IL-13)、糖皮质激素、免疫球蛋白复合物等因子刺激后,可极化为M2型巨噬细胞[63]。M2型巨噬细胞根据其形态和功能又可分为4种亚型:M2a型由IL-4、IL-13等因子诱导极化,可分泌白细胞介素-10(IL-10)和转化生长因子-β(TGF-β),具有促进细胞生长和组织修复的功能[64];M2b型由LPS、IL-1β及免疫复合物诱导极化,可分泌细胞因子(TNF-α、IL-10和IL-6)和趋化因子(CCL20和CXCL1),促进Th1与Th3细胞分化[65];M2c型由糖皮质激素、TGF-β或IL-10诱导极化,可释放大量TGF-β、IL-10、趋化因子(CCL16和CCL18),参与修复损伤组织及吞噬凋亡细胞[66];M2d型由免疫复合物诱导极化,可促进趋化因子CCL5和CXCL10分泌,诱导IL-10产生,并减少白细胞介素-12(IL-12)和TNF-α分泌[67]。此外,M2d型巨噬细胞还能分泌血管内皮生长因子,参与血管生成和肿瘤转移[68]。总之,不同M2型巨噬细胞能通过分泌抗炎细胞因子,参与血管生成、组织再生和修复、抑制炎症发展等机体免疫调节过程[69]。因此,研究食源性活性肽对巨噬细胞的调控作用可能是阐明食源性活性肽免疫调节机理的突破口。
3 食源性活性肽调控巨噬细胞极化的机制
巨噬细胞大量聚集于多种病变组织中,与疾病的发生、发展和并发症的产生息息相关[70]。巨噬细胞的极化过程极其复杂,受细胞内多种信号分子及通路的调控,研究巨噬细胞极化的信号通路对食源性活性肽调控其极化具有重要意义。
3.1 核转录因子-κB(NF-κB)信号通路
NF-κB信号通路是调控巨噬细胞极化的经典通路,当巨噬细胞处于静息状态时,细胞质中的NF-κB与核因子κB抑制蛋白(IκB)结合为未活化的复合体。当巨噬细胞受到刺激被诱导激活后,可促进胞内抑制因子激酶(IKK)磷酸化,并作用于NF-κB-IκB复合体,进而促进IκB磷酸化,同时释放NF-κB;而游离的NF-κB恢复生理活性,转位入核,可促进巨噬细胞极化,参与一系列的免疫调节及炎症反应过程[71-72]。图1为食源性活性肽通过NF-κB信号通路调控巨噬细胞极化的过程,其中实线表示促进,虚线表示抑制,下同。
Z.W.Ji等[73]评估了MPP的免疫调节活性,发现其能通过抑制NF-κB向细胞核内转移,降低p-IκB和p65磷酸化水平,抑制巨噬细胞向M1型极化,减少促炎因子IL-1β、IL-6和TNF-α分泌,从而减轻炎症。曹靖文[74]研究发现,纳豆菌糖肽(BNGP)能够抑制LPS引起的IκB-α蛋白磷酸化,并抑制M1型巨噬细胞极化,进而抑制促炎性细胞因子(IL-1β、TNF-α)和细胞生长调节因子分泌,从而发挥免疫调节活性。研究还发现,酪蛋白糖肽(GMP)[75]、文蛤寡肽(MMO)[76]、绿豆肽(MBPH)[77]能抑制IKKα、NF-κB和p65蛋白磷酸化,缓解NF-κB通路的过度活化,抑制M1型巨噬细胞极化,降低炎症因子分泌,减缓炎症反应,发挥免疫调节活性。
3.2 丝氨酸-苏氨酸蛋白激酶(MAPK)信号通路
除了NF-κB信号通路外,MAPK信号通路也是调控巨噬细胞极化的重要通路。生长因子和炎性细胞因子与巨噬细胞表面特定受体结合后能激活MAPK,引起MAPK亚基JNK、p38和ErK磷酸化,从而介导巨噬细胞增殖、凋亡、免疫防御等生理功能[78-79]。K.He等[80]研究发现,贻贝低分子量肽(MCP)通过膜辅蛋白促进MAPK亚基JNK、ErK和p38激酶磷酸化,调节炎症介质分泌,调控巨噬细胞极化,发挥免疫调节活性。R.C.Gao等[81]研究发现,鲟鱼提取肽能够通过抑制MAPK磷酸化,减少炎症介质和细胞因子(NO、IL-6和IL-1β)释放,发挥免疫调节活性。除此之外,食用绿藻尺蠖肽[82]、大豆提取肽(SBP)[83]、海参肽(SCP)[84]均能通过阻断MAPK信号通路抑制M1型巨噬细胞极化,减少炎症因子TNF-α、IL-6和IL-1β分泌,发挥免疫调节活性。图2为食源性活性肽通过MAPK信号通路调控巨噬细胞极化的过程。
3.3 Toll样受体4/髓样分化因子88(TLR4/MyD88)信号通路
TLR4/MyD88信号通路参与血管生成、癌症及肠道炎症的免疫调节过程,在巨噬细胞的极化中也发挥着重要作用[85]。活化的TLR4激活MyD88,诱导干扰素-β(IFN-β)分泌,进而激活信号转导与转录激活因子1(STAT1)和干扰素调节因子5(IRF5),诱导NF-κB磷酸化,促进M1型巨噬细胞极化[86-88]。研究[89]表明,酪蛋白糖巨肽(GMP)能够阻断LPS诱导的TLR4/MyD88信号通路活化,抑制M1型巨噬细胞极化,降低炎症因子TNF-α、IL-13及IL-6的mRNA表达及分泌水平,发挥免疫调节作用,抑制炎症发展。图3为食源性活性肽通过TLR4/MyD88信号通路调控巨噬细胞极化的过程。
研究[90-92]表明,当机体处于稳态情况时,M1型巨噬细胞与M2型巨噬细胞的比值维持平衡状态;当机体遭遇病原体入侵或感染时,M1型巨噬细胞可率先对炎症部位作出反应,吞噬病原体并分泌促炎因子,引起机体适应性免疫。若巨噬细胞持续向M1型极化,则会导致细胞因子过度分泌,引起“细胞因子风暴”,诱发败血症、类风湿性关节炎、过敏等疾病[93]。随着炎症的发展,M2型巨噬细胞占据炎症部位主导地位,大量分泌抗炎因子IL-10、TGF-β和生长因子,抑制炎症反应并修复受损组织[94-95]。因此,研究食源性活性肽调控巨噬细胞极化的信号通路及其调控机制对维持M1型巨噬细胞与M2型巨噬细胞的比值平衡至关重要,对各类疾病的预防和治疗具有重要意义。但由于巨噬细胞功能多样,信号通路之间相互联系、协同作用,调控过程较复杂,因此,需要对食源性活性肽调控巨噬细胞极化的信号通路和调控机制进行深入研究。
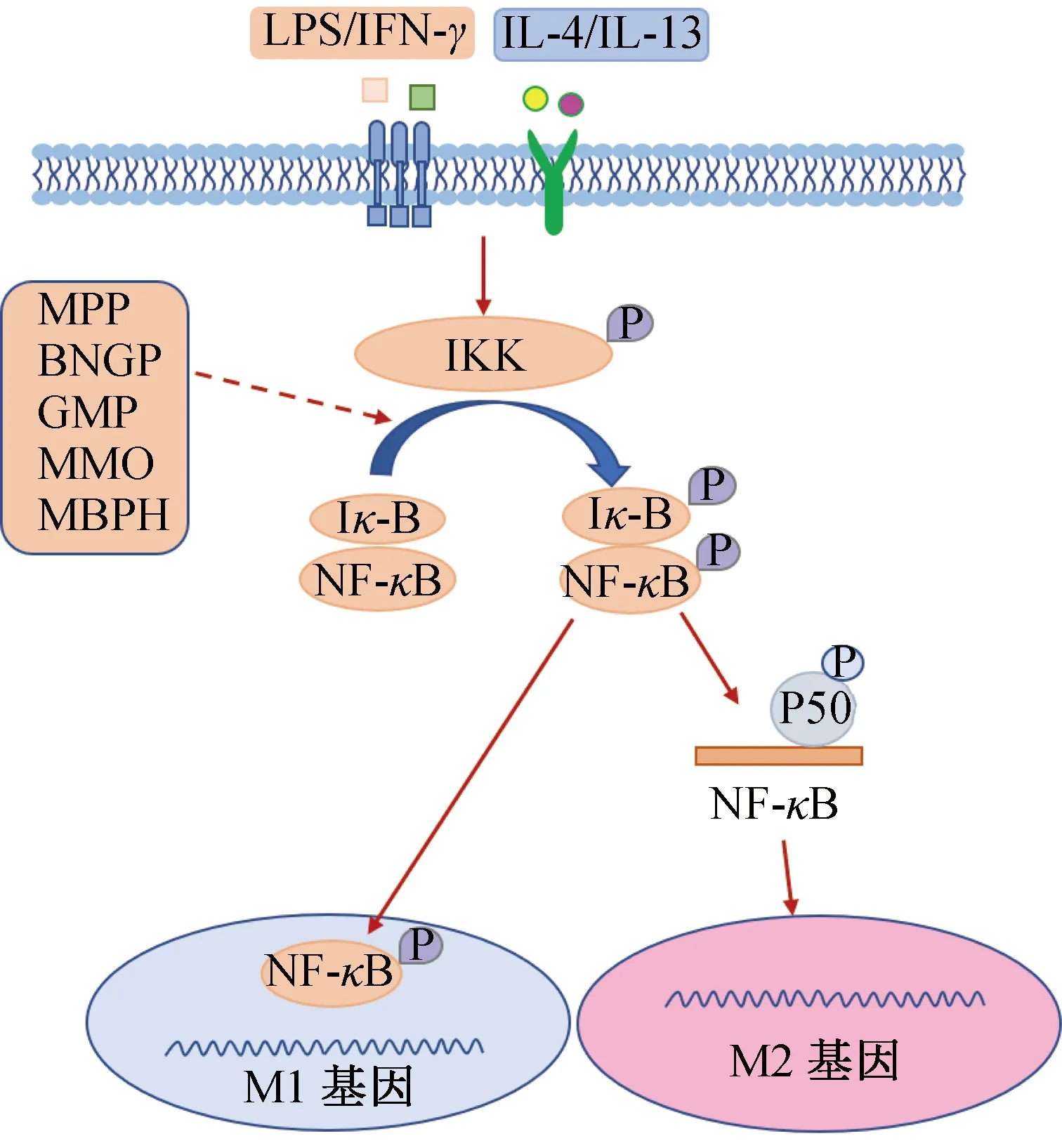
图1 食源性活性肽通过NF-κB信号通路调控巨噬细胞极化的过程Fig.1 Food-derived active peptides regulate macrophage polarization through the NF-κB signaling pathway
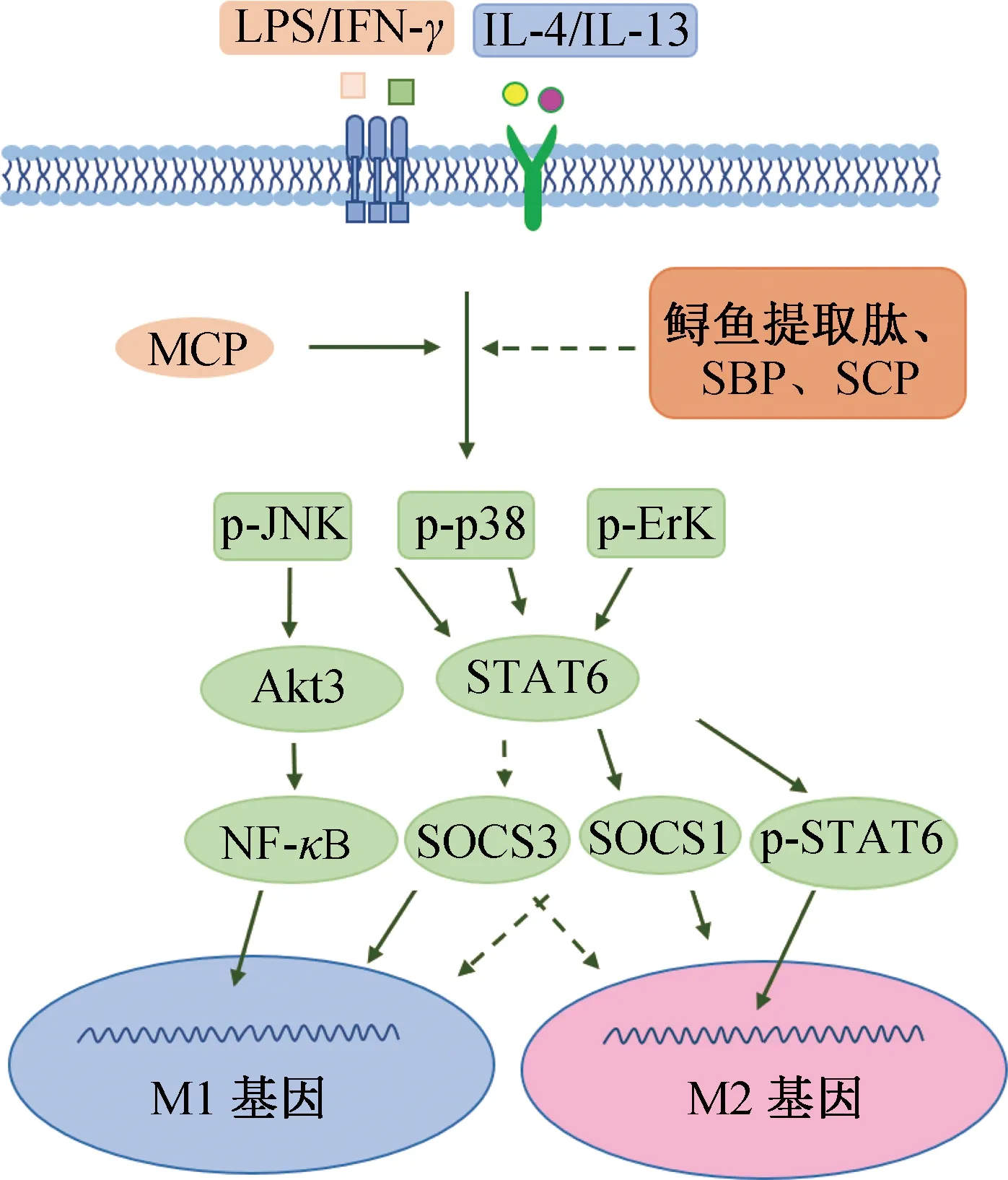
图2 食源性活性肽通过MAPK信号通路调控巨噬细胞极化的过程Fig.2 Food-derived active peptides regulate macrophage polarization through the MAPK signaling pathway
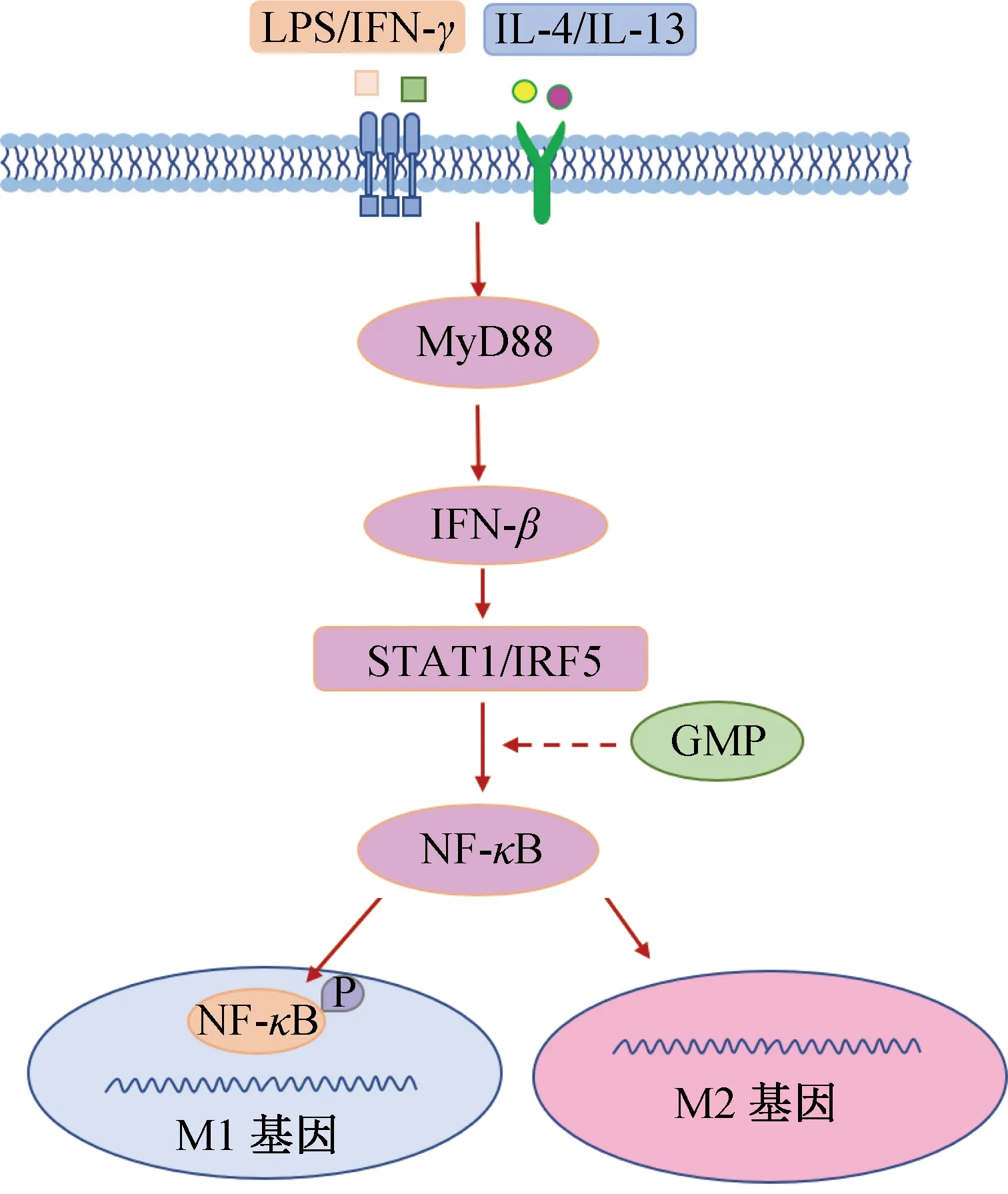
图3 食源性活性肽通过TLR4/MyD88信号通路调控巨噬细胞极化的过程Fig.3 Food-derived active peptides regulate macrophage polarization through the TLR4/MyD88 signaling pathway
4 总结与展望
本文综述了食源性活性肽的优化、巨噬细胞极化现象及食源性活性肽调控巨噬细胞极化发挥免疫调节作用机制的研究现状。食源性活性肽来源广泛,主要分为动物源、植物源和微生物源;食源性活性肽主要采用酶解法、物理辅助酶解法、微生物发酵法、微生物-酶协同法等制备,其中微生物-酶协同法有助于提高生产效率、蛋白质水解度和转化率及提取肽的品质;食源性活性肽可通过NF-κB、MAPK和TLR4/MyD88信号通路调控巨噬细胞极化以发挥免疫调节作用。目前,食源性活性肽已被证明具有良好的免疫调节活性,但多数研究基于细胞实验仅对食源性活性肽免疫调节活性的有无和大小进行分析比较,较少采用体内实验探究其调控巨噬细胞极化并影响机体免疫的机制。因此,未来相关研究可围绕巨噬细胞极化与机体健康之间的关系,采用代谢组学、基因敲除等技术从巨噬细胞功能多样性、信号通路的协同作用等方面更深入、更系统地探究食源性活性肽调控巨噬细胞极化的信号通路及调控机制,以全面解析食源性活性肽免疫调节活性机理。
