七氟烷预处理介导miR-148b-3p对大鼠脑缺血再灌注损伤的影响
2022-12-06李前辉谢小娟郭浩翔张宜林
李前辉 谢小娟 郭浩翔 张宜林
(河南科技大学第一附属医院麻醉科,河南 洛阳 471023)
脑缺血再灌注(I/R) 损伤是最具破坏性的神经系统疾病之一,它是由流向脑组织的血流减少和随后的再灌注引起的〔1〕。低血压、心搏骤停、冠状动脉搭桥或缺血性脑卒中等多种危险因素均可导致I/R的发生〔2〕。目前,I/R的发生率呈上升趋势,仍然是世界范围内致残和死亡的主要原因之一,并造成沉重的社会和经济负担〔3〕,然而,这种疾病仍然缺乏有效的治疗方法。I/R可引起神经元凋亡和氧化应激等多种有害的病理变化,导致神经功能障碍的发生〔4〕。因此,需要确定缺血引起的脑损伤的分子机制,并开发出有效的疗法以应对缺血性引起的相关疾病。七氟烷(Sevo)是一种具有最小刺激性的新型挥发性麻醉剂。研究发现,在体外和体内,七氟烷诱导预处理对脑缺血神经元损伤均具有保护作用〔5〕。虽然Sevo在大脑中的神经保护作用已被阐明,但I/R中Sevo预处理的确切分子机制仍然未知。MicroRNAs (miRNAs)是一种内源性编码的非编码小RNA,越来越多的证据表明,各种miRNA在I/R中失调,可以作为潜在的诊断或治疗靶点〔6,7〕。各种研究表明,在IR损伤的体内外实验模型中,靶向特异性miRNA可以减轻神经元损伤,恢复神经功能〔8~10〕。研究表明,miR-148b-3p在调节细胞存活率方面起着重要的作用〔11,12〕。据报道,Sevo参与大脑和周围组织中多种miRNA的调节〔13〕。但是,关于I/R进行Sevo预处理的miR-148b-3p调控机制尚不清楚。本研究探讨Sevo预处理介导miR-148b-3p在体内对I/R的影响。
1 材料与方法
1.1材料
1.1.1实验动物 选用45只SPF级健康成年雄性SD大鼠,鼠龄为7~9个月,体重250~300 g,恒定室温(23±1)℃,12 h光照/12 h黑暗,自由进食和饮水。
1.1.2主要药物和试剂 Sevo购自美国Sigma-Aldrich公司,二喹啉甲酸(BCA)蛋白浓度测定试剂盒和辣根过氧化物酶(HRP)标记山羊抗兔IgG购自上海碧云天生物技术研究所;二甲基亚砜(DMSO)购自美国Selleck Chemicals公司;苏木素-伊红(HE)染液购自南京建成生物工程研究所;荧光素酶检测试剂盒购自Solarbio公司;Lipofectamine 3000试剂、TRIzol试剂和Super RT cDNA试剂盒购自美国Invitrogen公司;兔抗大鼠双特异性磷酸酶(DUSP)1单克隆抗体、兔抗大鼠(cleaved caspase)-3单克隆抗体、兔抗大鼠cleaved caspase-9单克隆抗体和兔抗大鼠GAPDH单克隆抗体购自英国Abcam公司。
1.2方法
1.2.1动物分组与模型制备 SD大鼠随机分为5组,分别为假手术(Sham)组、大脑中动脉闭塞(MCAO)组、MCAO+miR-148b-3p antagomir组、Sevo组和antagomir+Sevo组,每组9只。MCAO+miR-148b-3p antagomir组在MCAO之前,将7 μl(20 nmol/L)的miR-148b-3p拮抗剂注入右脑室10 min;Sevo组:在MCAO之前,将大鼠用2.5%的Sevo连续预处理4 d,30 min/d;antagomir+Sevo组。通过腹膜内注射2%戊巴比妥钠45 mg/kg麻醉大鼠,将尼龙丝(直径约为0.24 mm)插入右颈总动脉中,并穿过颈总内动脉,直到阻塞大脑中动脉。闭塞2 h后,将尼龙细丝抽出以重新供应血流,以实现24 h的再灌注。用电子加热垫将直肠温度保持在正常温度范围内(37±0.2)℃。假手术组大鼠进行相同的手术程序,不阻塞大脑中动脉。在MCAO 形成2 h和再灌注24 h后,通过脱颈处死大鼠取脑,切除嗅球、小脑和低位脑干部分,将脑组织冷冻在液氮中。
1.2.2RT-PCR MCAO组分别用miR-148b-3p antagomir或Sevo单独或联合处理后,所有大鼠处死并取左侧海马组织,使用TRIzol试剂提取总RNA,并通过超微紫外光分光光度计在260和280 nm处测定吸光度。按照试剂盒说明书,使用Super RT cDNA试剂盒合成cDNA,之后进行real time RT-PCR。取1 μl cDNA为模板加入2×SYBR Green qPCR预混液5 μl,配制10 μl PCR体系。miR-148b-3p 上游引物:5′-GCAGTCAGTGCATCACAGA-3′,下游:5′-GGTCCAGTTTTTTTTTTTTTTTACAAAG-3′;β-actin上游引物:5′-CGTGCGTGACATC AAAGAGAA-3′,下游:5′-TGGATGCCACAGGATTCCAT-3′。反应条件为:94℃预变性4 min,94 ℃变性30 s,58℃退火30 s,72℃延伸45 s,循环30次,72℃延长5 min。按照2-ΔΔCt法计算miR-148b-3p表达量。
1.2.3HE染色 取部分大脑皮层组织放入含4%多聚甲醛的磷酸缓冲液(PBS)进行固定,24 h后脱水,石蜡包埋、连续切片,切片厚度为4 μm;进行HE染色,将切片分别置于二甲苯Ⅰ和二甲苯Ⅱ、100%、95%、90%、80%和70%的酒精各10 min,自来水冲洗;苏木素染色、伊红染色;由低到高浓度酒精梯度脱水,二甲苯透明,中性树脂封片;光学显微镜拍照,观察其形态特征。
1.2.4Western印迹 每组各取5只大鼠,脱颈处死大鼠后取大鼠皮层组织,加入200 μl含0.01 mol/L苯甲基磺酰氟(PMSF)的放射免疫沉淀(RIPA)裂解液,冰上超声裂解后12 000 r/min离心30 min,并用BCA蛋白质测定试剂盒定量蛋白质浓度。每孔上样蛋白量为50 μg,于10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)中分离,然后转移到聚偏氟乙烯(PVDF)膜上。用5%脱脂牛奶室温封闭蛋白2 h,随后加入兔抗DUSP1单克隆抗体(1∶1 000)、兔抗cleaved caspase-3单克隆抗体(1∶1 000)和兔抗cleaved caspase-9单克隆抗体(1∶1 000)于4℃孵育过夜,TBST清洗3次,每次5 min,加入对应HRP标记的山羊抗兔IgG二抗(1∶10 000)室温下继续孵育2 h,PBST洗膜3次,每次5 min,最后滴加ECL,进行化学发光。
1.2.5荧光素酶报告实验 通过PCR扩增出含有miR-148b-3p结合位点的DUSP1 3′UTR序列,将该序列克隆到pGL3-basic载体中,命名为pGL3-DUSP1 3′UTR载体。通过基因定点诱变构建出pGL3-DUSP1 3′UTR mut载体,作为阴性对照,然后利用Lipofectamine3000将pGL3-DUSP1 3′UTR或pGL3-DUSP1 3′UTR mut载体与miR-148b-3p mimic或mimic NC,连同pRL-TK载体共转染至皮层神经元细胞。转染48 h后,收集细胞,通过双荧光素酶报告基因检测试剂盒检测荧光素酶活性。
1.2.6统计学方法 采用SPSS19.0软件进行t检验、方差分析。
2 结 果
2.1Sevo对脑缺血再灌注损伤大鼠中miR-148b-3p和DUSP1表达的影响 与Sham组相比,miR-148b-3p mRNA水平随再灌注处理时间的增加而增加(P<0.05);DUSP1蛋白表达水平随灌注处理时间的增加而降低(P<0.05)。见图1、表1。与Sham组相比,MCAO组miR-148b-3p mRNA水平升高(t=1.948,P<0.05);DUSP1蛋白表达水平降低 (t=1.279,P<0.05)。与MCAO组相比,miR-148b-3p antagomir组、Sevo组和antagomir+Sevo组miR-148b-3p mRNA水明显降低(F=45.83,P<0.05);DUSP1蛋白表达水平明显升高 (F=66.48,P<0.05)。见图2、表2。
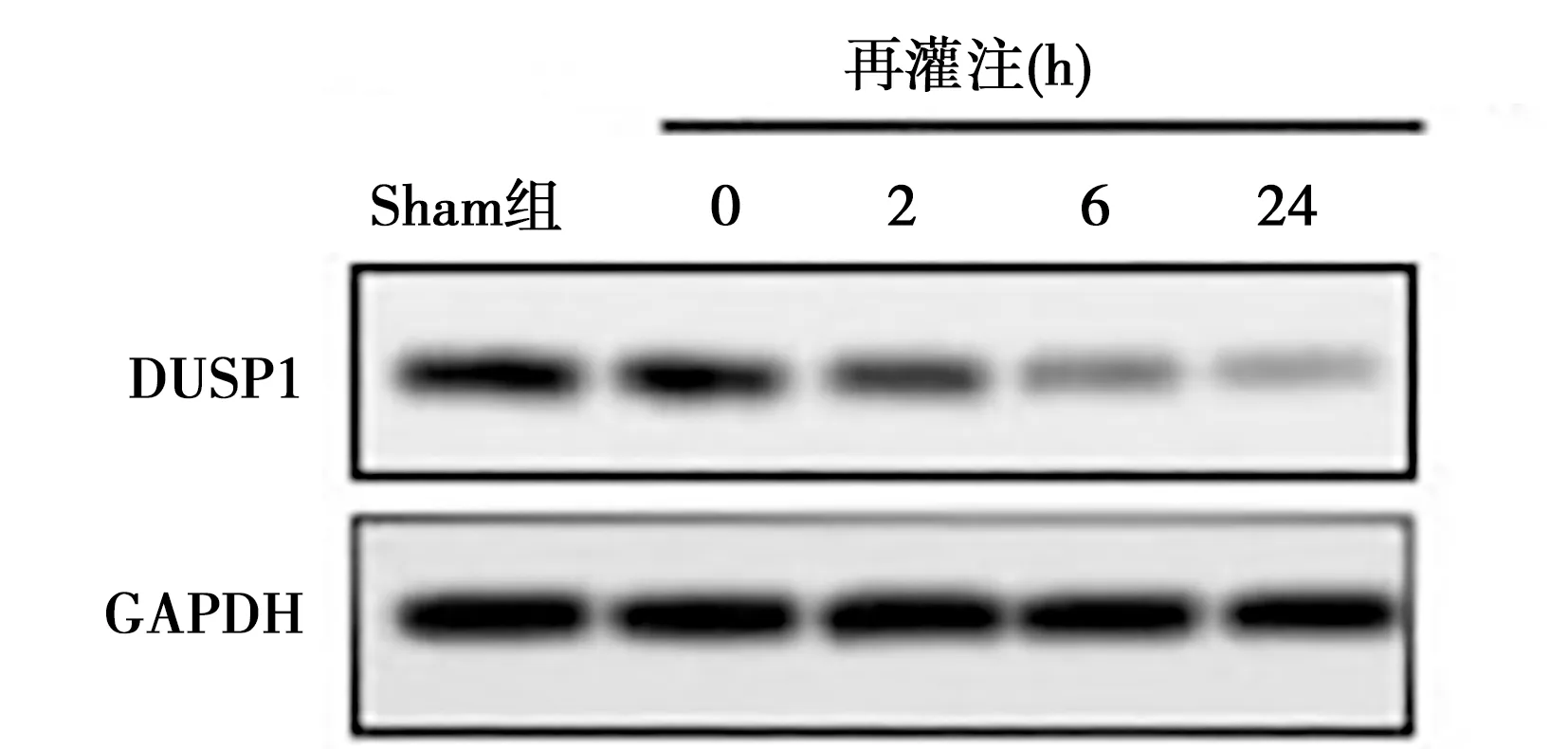
图1 再灌注处理24 h后DUSP1蛋白表达水平
表1 再灌注处理24 h后miR-148b-3p mRNA和DUSP1蛋白表达
1~5:Sham组,MCAO组,miR-148b-3p antagomir组,Sevo组、anagomir+Sevo组,图5同
2.2Sevo对脑缺血再灌注损伤大鼠神经损伤和脑损伤的影响 与Sham组相比,MCAO组犯错次数、神经功能评分和脑含水量均升高 (t=1.500、1.084、7.364,均P<0.05);与MCAO组相比,miR-148b-3pantagomir组、Sevo组和antagomir+Sevo组犯错次数、神经功能评分和脑含水量均降低(P<0.05)。与Sham组相比,MCAO组新异臂进入次数明显减少(P<0.05);与MCAO组相比,miR-148b-3p antagomir组、Sevo组和antagomir+Sevo组新异臂进入次数明显增加(P<0.05)。见表2。通过HE染色检测各组病理损伤程度见图3,Sham组脑皮质神经元排列结构正常,神经元胞核无固缩,散在小胶质细胞;MACO组缺血区皮质及基地节神经元数量减少,排列紊乱,神经元胞核固缩、颗粒细胞空泡性变,神经纤维肿胀、小胶质细胞浸润增多。miR-148b-3p antagomir组、Sevo组和antagomir+Sevo组脑组织缺血性损伤有明显的改善。
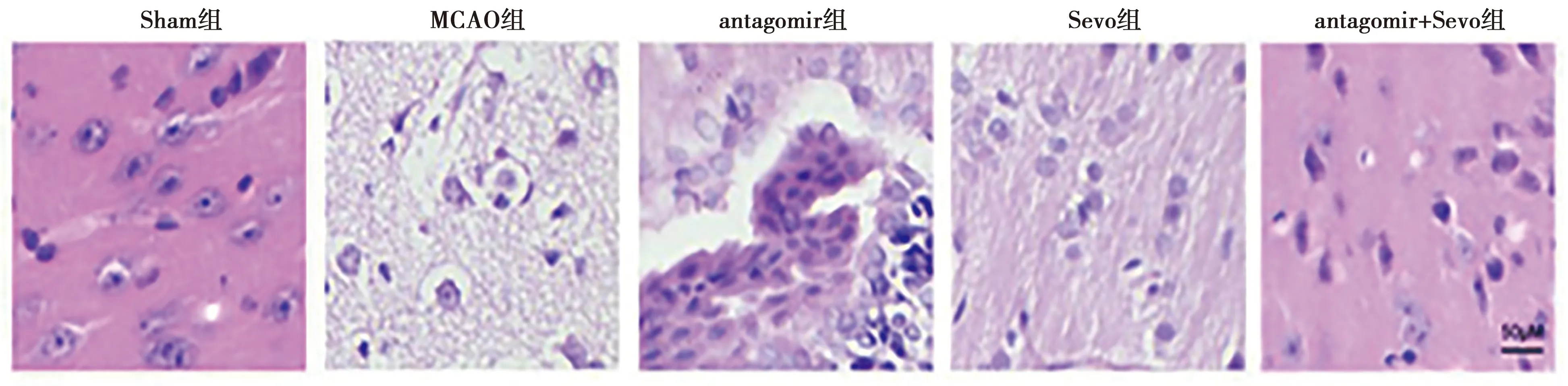
图3 HE染色检测各组脑组织病理损伤程度(×400)
2.3Sevo对I/R损伤大鼠大脑皮层细胞凋亡的影响 与Sham组相比,MCAO组细胞凋亡率,cleaved caspase-3和cleaved caspase-9蛋白表达水平均明显升高 (t=1.359、1.405、1.349,P<0.05);与MCAO组相比,miR-148b-3p antagomir组、Sevo组和antagomir+Sevo组MCAO组细胞凋亡率,cleaved caspase-3和cleaved caspase-9蛋白表达水平均明显降低 (F=39.58、23.54、31.24,P<0.05)。见表2,图4、图5。
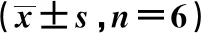
表2 各组miR-148b-3p、DUSP1表达、犯错次数、神经功能评分、脑含水量和新入臂进入次数及大脑皮层细胞凋亡比较
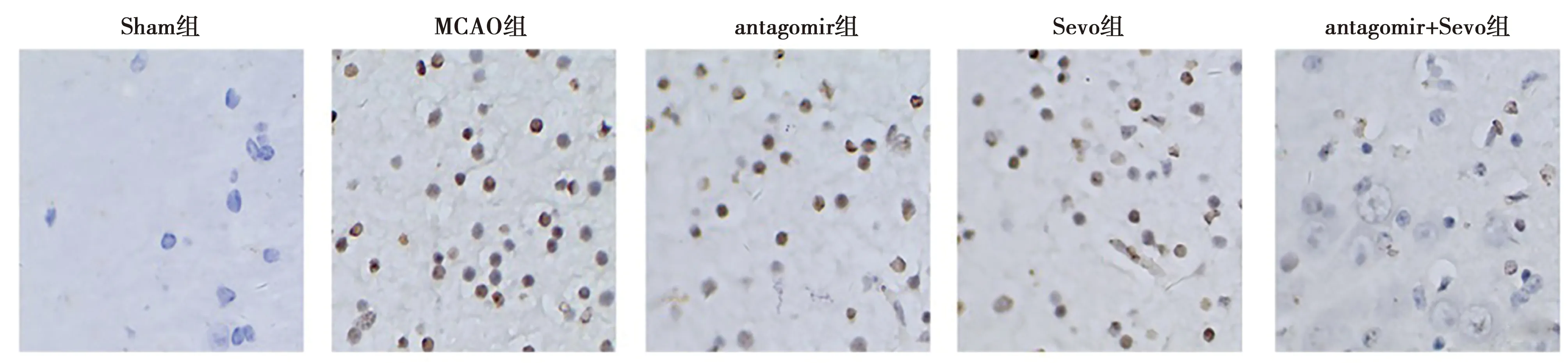
图4 各组大脑皮层细胞凋亡的变化(×400)

图5 凋亡相关蛋白cleaved caspase-3和cleaved caspase-9在大脑皮层组织中的表达变化
2.4miR-148b-3p和DUSP1的靶向关系 对照组、NC mimic组和miR-148b-3p mimic组中miR-148b-3p表达量分别为1.00±0.12、1.02±0.15和42.11±3.36。与对照组比较,miR-148b-3p mimic组miR-148b-3p水平显著升高(t=1.049,P<0.05)。对照组、LV-vector组和LV-DUSP1组中DUSP1 mRNA的表达量分别为1.00±0.03、1.02±0.12和3.39±0.18。与对照组比较,LV-DUSP1组中DUSP1 mRNA水平显著升高(t=1.837,P<0.05)。利用TargetScan网站生物信息学分析发现,DUSP1可能是miR-148b-3p的直接靶点(图6)。荧光素酶报告实验结果表明,DUSP1-WT+NC mimic组、DUSP1-WT+miR-148b-3p mimic组、DUSP1-MUT+NC mimic组和DUSP1-MUT++miR-148b-3p mimic组荧光素酶活性分别为1.89±0.13、1.16±0.15、1.92±0.18和1.95±0.14;与DUSP1-WT+NC mimic组比较,过表达miR-148b-3p导致DUSP1野生型3′UTR 报告基因的荧光素酶活性降低(t=4.178,P<0.05)。如图7所示,对照组、miR-148b-3p mimic组、LV-DUSP1组和miR-148b-3p+DUSP1组DUSP1蛋白表达分别为0.75±0.16、0.08±0.03、2.14±0.18和0.82±0.12。与对照组比较,miR-148b-3p mimic组DUSP1蛋白表达水平显著降低(t=1.239,P<0.05),LV-DUSP1组DUSP1蛋白表达水平显著升高(t=2.079,P<0.05)。与LV-DUSP1组比较,miR-148b-3p+DUSP1组DUSP1蛋白水平显著降低(t=2.242,P<0.05)。

图6 TargetScan预测miR-148b-3p与DUSP1靶向关系
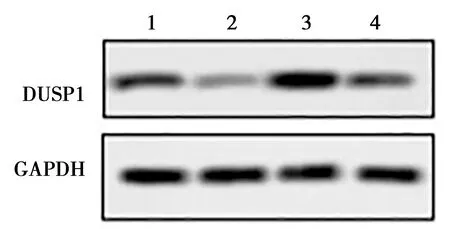
1~4:Control组,miR-148b-3p mimic组,LV-DUSP1组,miR-148b-3p+DUSP1组
3 讨 论
Sevo是一种较好的麻醉吸入性麻醉剂,广泛应用于临床。Sevo预处理或早期后处理已被证明对缺血性脑损伤具有直接的神经保护作用〔14〕。然而,Sevo预处理对I/R的神经保护作用机制尚不清楚。本研究发现Sevo预处理抑制了体内和体外I/R实验模型中miR-148b-3p的表达。此外,miR-148b-3p过表达诱导的MACO处理大鼠缺血性脑损伤的神经元细胞损伤增强,经Sevo预处理后逆转。此外, DUSP1被鉴定为miR-148b-3p的靶基因,而Sevo处理通过抑制miR-148b-3p,促进DUSP1表达。结果表明,Sevo预处理可通过下调miR-148b-3p和上调DUSP1来防止I/R。
已有证据表明,超过20%的miRNAs在缺血脑中异常表达,并参与I/R发病和发展〔15〕。研究发现,miR-148b-3p过表达降低了氧糖剥夺/复氧(OGDR)暴露神经元的细胞活力,加剧了细胞凋亡和活性氧的产生。相比之下,miR-148b-3p的抑制提高了OGDR暴露神经元的细胞活力,减少了凋亡和活性氧的产生〔16〕。本研究发现miR-148b-3p在MCAO处理的大鼠大脑皮层神经元中表达上调。此外,miR-148b-3p的抑制通过降低脑含水量,细胞凋亡率,增加新异臂进入次数来减轻I/R大鼠模型的脑缺血,这与之前研究一致〔16〕。此外,Sun等〔11〕报道称miR-148b-3p通过靶向SIRT7和调节p53介导的促凋亡信号,在体外调节缺氧/复氧诱导的心肌细胞凋亡。miRNA在由预处理(如暴露于麻醉剂)引起的局部缺血耐受中起重要作用〔17〕。研究发现,在神经发育早期暴露于Sevo会改变与神经发育相关的miRNA表达,并可能引发大鼠的后续行为障碍〔18〕。有报道称,miR-34c(p53的直接下游靶标)可能通过线粒体途径参与了发育中的大鼠大脑海马体中神经诱导的神经细胞凋亡〔19〕。Zhong等〔20〕研究发现,Sevo通过靶向MyD88,上调miR-203表达,减轻I/R引起的神经炎症。本研究结果表明,Sevo预处理通过下调miR-148b-3p表达来减弱I/R。
DUSP1可在多种组织中表达,在心脏,肺和肝脏中可观察到最高水平〔21〕。研究发现,DUSP1通过失活JNK-Mff途径和抑制线粒体裂变来减轻脑缺血再灌注损伤〔22〕。本研究结果表明,Sevo预处理通过靶向miR-148b-3p促进DUSP1在体外I/R模型中的表达。
