棉籽糖家族寡糖的提取方法及功能性研究进展
2022-12-06赵若琪程永霞宋莲军黄现青乔明武
赵若琪,程永霞,宋莲军,*,马 燕,黄现青,乔明武
(1.河南农业大学食品科学技术学院,河南 郑州 450002;2.河南省食品加工与流通安全控制工程技术研究中心,河南 郑州 450002;3.郑州市大豆深加工重点实验室,河南 郑州 450002)
棉籽糖家族系列寡糖(Raffinose family of oligosaccharides,RFOs)在植物界广泛存在,是植物界中特有的一类水溶性糖,含量仅次于蔗糖[1]。RFOs 是葡萄糖基C6 位的一分子蔗糖通过α-1, 6 糖苷键逐级连接一个或多个半乳糖苷基而成(图1),以棉籽糖(三聚体)为代表,除棉籽糖外,还包括水苏糖(四聚体),毛蕊花糖(五聚体),筋骨草糖(六聚体)和迄今尚未命名的长链寡糖,直至九糖,都属于蔗糖的衍生物[2]。传统的观点认为,因人体不含能够水解RFOs 的半乳糖苷酶,食用富含RFOs 的食物后,RFOs 不能被胃和小肠消化吸收,到达结肠后会被微生物分解产生的二氧化碳、氢气和少量的甲烷等气体造成机体胃肠胀气[3]。因此,早期棉籽糖和水苏糖常被当作“胀气因子”从食品原料中去除。进一步的研究发现,RFOs因具有半乳糖苷键,可以极大地促进双歧杆菌(Bifidobacterium)的生长[4],而被视为功能性低聚糖,有关RFOs 一些功能性机制研究尚未成熟。本文通过介绍自然界和人工合成的棉籽糖家族寡糖,棉籽糖家族寡糖提取、分离、纯化的方法,可为如何提取和从哪里可提取较多RFOs 提供参考;以及棉籽糖家族寡糖调节肠道菌群、预防炎症性肠病、降血糖等功能性研究,旨在为棉籽糖家族寡糖的开发利用提供一定的理论参考。
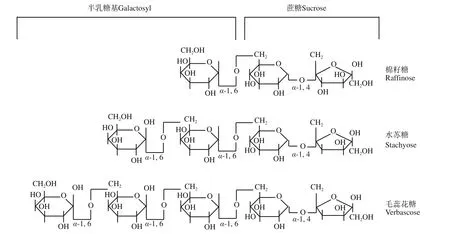
图1 常见棉籽糖家族低聚糖的分子结构Fig.1 Molecular structure of common raffinose family oligosaccharides
1 RFOs 的主要来源
1.1 植物中的RFOs
RFOs 广泛存在于葫芦科、豆科、唇形科、木犀科、玄参科等多类植物中。植物生理学研究发现高等植物体内的RFOs 是叶绿素在叶片中进行光合作用的产物,并被输导组织运输到根、果实、种子等器官进行储存[5]。其经典合成途径是由几种α-半乳糖苷转移酶的顺序反应进行的,首先,半乳糖基由半乳糖肌醇转移到蔗糖,经棉籽糖合酶催化生成棉籽糖,再经水苏糖合酶催化生成水苏糖,最后经毛蕊花糖合成酶催化生成毛蕊花糖[6]。RFOs 在种子发育成熟过程中逐渐积累,并在其干燥耐性和耐贮藏性方面发挥着重要作用,而在种子萌发过程中RFOs 会因提供能量而被迅速消耗[7]。有研究表明,RFOs 参与植物中一些重要的细胞功能,如充当韧皮部中的运输碳水化合物,抗冻植物器官中的储藏储备和防冻剂,膜运输和mRNA 出口[8]等。近年来,关于玉米、拟南芥[9]、黄瓜[10]、番茄[11]等植物中RFOs 的大量研究表明在低温、干燥等逆境条件下,RFOs 会在植物体内积累,并起到生长保护的作用。
大量的研究发现不同植物体内RFOs 含量及种类存在着显著差异(表1),大多数单子叶植物种子中的RFOs 以棉籽糖为主,而水苏糖和毛蕊花糖主要在双子叶植物中积累[12]。目前关于植物中RFOs 含量的研究主要集中在豆科植物的种子。根据豆科种类的不同,RFOs 的含量也存在差异,一般在2%~9%之间[3]。KOTHA 等[13]对23 种菜豆可溶性单糖、二糖和低聚糖含量的测定,发现总糖和棉籽糖含量最多的是黄豌豆,分别达到8.36%和1.34%左右,黑眼豌豆中的水苏糖含量最多在5.11%左右,绿豆中毛蕊花糖含量最多为1.56%。然而,同一种科属下不同品种的豆中RFOs 含量也会存在差异,比如绿豌豆、黄豌豆、黑眼豌豆、奶油豌豆等种子中RFOs 含量在4.2%~6.3%之间不等[13]。除了豆科植物的种子,水苏[14]、生地黄[14]、草石蚕[15]及莲子[16]中也含有丰富的RFOs,含量分别为42.62、37.34、46.10、44.68 g/100 g。水苏、生地黄、草石蚕等植物中的RFOs 均以水苏糖为主,分别占低聚糖含量的85.53%、64.90%和43.38%。莲子中的RFOs 主要有棉籽糖和水苏糖,分别占RFOs 含量的39.10%和60.90%。
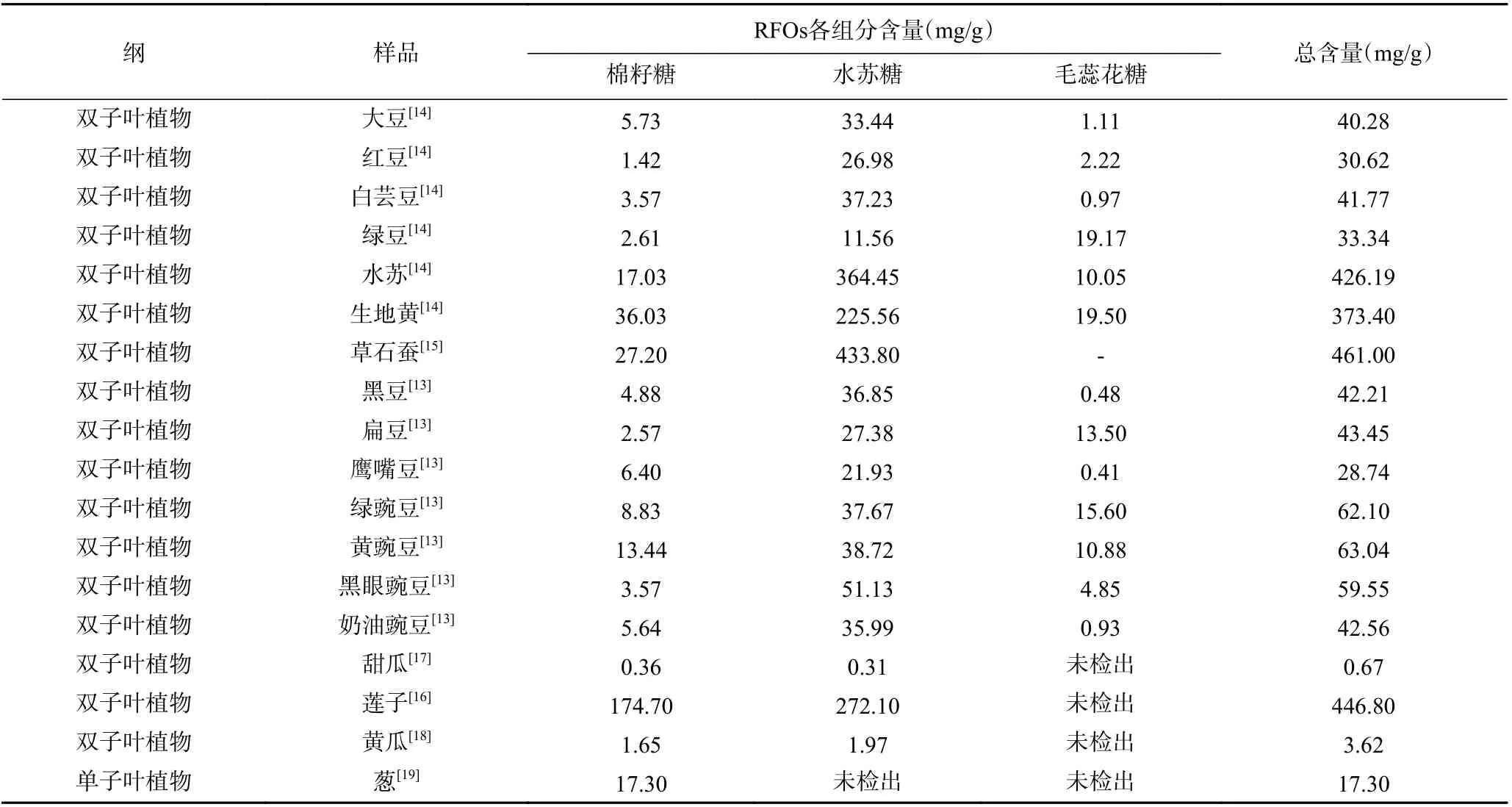
表1 不同植物中RFOs 的种类及含量Table 1 Species and content of RFOs in different plants
综上所述,自然界中RFOs 在豆科植物中含量较多,大部分豆科植物中水苏糖占比较大,只有绿豆中毛蕊花糖占比较大。此外,水苏糖在玄参科地黄和唇形科水苏、草石蚕中含量较多。目前用于工业生产的RFOs 也主要是从大豆、豌豆、鹰嘴豆等豆类的加工废弃物中以及地黄、草石蚕等植物中分离提取得到的。
1.2 酶法制备RFOs
天然植物来源的RFOs 因原料来源丰富,且可以提取、分离、纯化得到不同组分的RFOs,故而在食品工业中的应用更为广泛。除了从天然植物中提取,酶法合成也是制备RFOs 的一个有效途径。目前对棉籽糖酶法合成的研究较为成熟,主要以半乳糖为底物,通过α-半乳糖苷酶(α-Galactosidase EC 3.2.1.22)催化合成[20]。在合成过程中通过调整初始的底物浓度、体系pH、反应温度、离子强度以及溶液组成等因素对热力学反应加以控制进而对RFOs 的产率进行调控。α-半乳糖苷酶存在于植物、动物和微生物体内。糖苷酶之所以被应用于低聚糖的合成反应是因其在适合的反应条件下,可将正常的水解反应逆转为糖苷的合成反应。目前研究中用到的α-半乳糖苷酶多是从真菌中提取得到的,例如,在30 ℃黑曲霉中α-半乳糖苷酶可催化半乳糖和蔗糖溶液合成棉籽糖[21]。此外,BAIK[22]用在分枝犁头霉IFO8084 中分离得到的α-半乳糖苷酶,在37 ℃下催化蔗糖和D-半乳糖反应48 h 制得了棉籽糖。PETERBAUER等[23]从豌豆种子中纯化出水苏糖合成酶,能催化肌醇半乳糖苷转移到棉籽糖上形成水苏糖。虽然酶法合成RFOs 的理论和实践均被证明可行,但这方面的研究报道远少于从天然植物中提取RFOs 的相关报道。但酶法合成具备专一性强的特点,更利于制备高纯度的单一组分低聚糖,若能将酶法制备RFOs 的相关研究进行工业化推广,应用前景将较为广阔。
2 植物中RFOs 的提取、分离纯化方法
目前关于RFOs 提取的研究主要集中于豆类和地黄等原料,具体的提取技术相对成熟,常用的提取方法包括溶剂提取法、微波提取法和超声提取法,而最新的研究中常将微波、超声等辅助提取技术进行联合使用,具备提取效率更高、耗时较短的优点,可应用于大规模生产。提取得到的粗RFOs 中常含有杂质成分,而RFOs 的功能特性与其纯度有着密切的关系,所以对制备出的粗RFOs 进行分离纯化得到高纯度的RFOs 非常重要。低聚糖分离纯化的依据主要包括以下几种:一是低聚糖所处的混合体系中各组分分子量的差异;二是混合体系中各组分在溶剂中溶解度的差异;三是某些带有可电离基团的酸性或碱性糖所带电荷的质和量的差异。根据RFOs 各组分的特点,其分离纯化的方法主要包括色谱分离法、膜分离技术以及发酵分离法,它们都有各自的优势,可根据产业化生产的实际情况选择合适的方法和条件。
2.1 提取方法
2.1.1 溶剂提取法 溶剂提取法是较为传统的提取方法,其最先考虑的因素是溶剂的选择,提取溶剂有乙醇,蒸馏水等,同时要考虑极性溶剂的浓度。影响提取率的主要因素有提取时间、温度、pH 和料液比。有学者以乙醇为溶剂,提取豌豆中的棉籽糖家族寡糖,乙醇浓度为50%,在40 ℃下水浴提取30 min,经过离心分离和纯化,得出的豌豆中棉籽糖家族纯度可达80%[2]。钱艳艳等[24]对地黄采用水浸提,得出最佳条件为液料比20:1,提取2 次,提取时间4 h,地黄低聚糖得率为68.27%。卢旭等[25]对莲子低聚糖进行热水浸提,采用响应面法优化得到水浴浸提莲子低聚糖的最佳条件为温度81 ℃,提取时间66 min,液料比80:1,低聚糖得率为8.09%。XIANG 等[26]提取19 种鹰嘴豆的低聚糖,采用乙醇浓度50 %、液料比10:1、提取温度50 ℃、提取时间30 min 的条件,19 种鹰嘴豆中,低聚糖得率最低为6.35%,最高为8.68%。传统溶剂提取的方法工艺相对成熟,但其在工业化应用中存在耗能高、提取率相对较低的缺陷。为解决这一产业难题,微波、超声波辅助提取等新型提取方式被开发利用。
2.1.2 辅助提取法 微波辅助提取是一种非常有潜力的新型提取技术。它将微波和溶剂提取相结合,通过溶剂使物料直接被加热,具有提取率高、速度快、溶剂用量少等优点。WAN 等[27]用微波辅助提取地黄中的RFOs,在500 W 和80 ℃下进行10 min 的微波辅助提取,RFOs 粗粉的得率为24.3%。栾凯雯等[28]用微波辅助法提取草石蚕中水苏糖,在微波功率400 W、微波时间5.6 min、温度60 ℃、液料比25:1,水苏糖得率为41.18%。SOLARTE 等[29]以固液提取和微波辅助提取从苜蓿叶片、茎和种子中提取碳水化合物并进行了优化,其种子提取物富含α-GOS,主要是水苏糖。相比固液提取,微波辅助提取使时间缩短6.5 倍,得率提高7 倍。由此可见,微波法具有提取时间短、效率高的优势。
与微波相比,超声辅助提取更简单、快速。超声提取使提取溶剂快速地进入固体物质中,将目标成分尽可能完全地溶于溶剂之中,达到提高提取率,缩短提取时间、节约成本的目的。周泉城等[30]研究超声波辅助提取对挤压膨化后大豆低聚糖提取率的影响,最佳条件为:超声波功率200 W,乙醇浓度31.3%、超声时间34 min、液料比20.4 mL/g,此时得率为11.95%。相同条件下直接用乙醇提取挤压膨化后的大豆低聚糖得率仅为9.83%。RUZICA 等[19]研究了超声辅助提取水果和蔬菜中的低聚糖,当乙醇浓度63 %,超声时间10 min,超声温度40 ℃时,低聚糖得率最高。其中,葱中RFOs 的得率最高,以棉籽糖为主,为1.73±0.061 g/100 g 鲜重,水苏糖仅存在于菊芋中,为1.29±0.053 g/100 g 鲜重,与传统水浴提取相比,超声辅助提取使所有水果和蔬菜中低聚糖的提取率提高了2~4 倍。ANH 等[31]采用超声法提取玫瑰籽中的糖,并与水浴法进行比较,其中棉籽糖和水苏糖的浓度分别为17.9 和11.0 mg/g,超声法提取总糖含量比水浴法高13.1%。
有研究者将超声-微波联合辅助提取应用于低聚糖的提取中,很好地结合两种技术的优点、弥补各自的不足。XU 等[16]用超声-微波辅助提取莲子中的RFOs,其中总低聚糖、三糖和四糖的提取率分别提高了76.59%、17.47%和27.21%,与热水、超声辅助、微波辅助提取相比,提取时间分别缩短了12.18、8.92 和1.16 倍。GUO 等[32]采用超声-微波辅助法对甘薯中RFOs 进行提取,采用响应面设计,得出最优条件为:提取时间100 s,超声功率300 W,微波功率200 W,甘薯RFOs 得率为6.948%。超声波-微波辅助提取充分利用了微波和超声空化的高能量效应,克服了常规超声和微波提取的缺点。
综上所述,单纯溶剂提取具有耗时长、提取率低的缺点,微波超声辅助提取技术可以显著地缩短提取时间并提高效率,可以更好地应用于工业化生产。但在提取过程中,要控制好时间,时间过长会破环多糖的结构,使糖链断裂,降低提取率。
2.2 分离纯化方法
2.2.1 色谱分离法 色谱分离法是利用要分离的各种物质在两相中的分配系数、吸附能力等亲和能力的不同来进行分离。其中,活性炭是一种常用的分离糖类的非极性吸附剂,GULEWICZ 等[2]用活性炭柱层析法对豌豆中的RFOs 进行分离纯化,将粗制RFOs 提取物溶于蒸馏水(25 mL)中,后置于烧结玻璃漏斗中的硅藻土和木炭(1:1 w/w)上,并连接至真空,将漏斗用200 mL 蒸馏水洗涤。并用70 %乙醇(500 mL)洗脱RFOs。苏娣[33]利用活性炭和硅藻土(1:1 w/w)中压柱对绿豆中的毛蕊花糖进行分离蔗糖,以5%~50%的乙醇-水进行线性洗脱,发现乙醇浓度5%时单糖首先被洗出,当乙醇浓度略高于10%时,棉籽糖可被洗脱;当乙醇浓度达到15%时,水苏糖可被洗脱;当乙醇浓度为20%时,毛蕊花糖可被洗脱,随后利用Bio-gelp2 凝胶层析柱进一步纯化,最终所得毛蕊花糖纯度为93.85%。活性炭分离效率高、价格低廉、吸附量大,易于进行工业化推广。常见的极性吸附剂是大孔树脂、硅胶。崔希庆[34]利用AB-8 大孔树脂对大豆糖蜜中的功能性低聚糖进行分离纯化,在最佳条件下的脱色率可达92%,总糖保留率为98.3%,总糖占总固形物的75.40%,洗脱液中棉籽糖为5.31 mg/mL,水苏糖为20.51 mg/mL。马璇[35]采用AB-8 大孔树脂对草石蚕多糖进行纯化,当温度30 ℃、径高比1:4、流速2 BV/h、pH 为5 时,水苏糖保留率为82.51%,脱色率为75.34%。与活性炭方法相比,树脂处理技术具有精密度高、易再生、使用周期长等优势。目前,硅胶柱层析法有应用到甘露寡糖的分离,而凝胶柱层析法在多糖的分离中应用较多。离子交换树脂也是RFOs 分离纯化中常用的,此方法分离纯化糖类主要受树脂特性、分离糖类混合物的组成、给料浓度、分离温度、溶剂种类等方面的影响。田原等[36]选取对大豆糖蜜脱色能力较好的6 种离子交换树脂,其中,阴离子树脂LS-21 和阳离子树脂LS-12 组成混床树脂效果最好,脱色率可达90%以上。
2.2.2 膜分离法 膜分离法是利用天然或合成的高分子薄膜,在膜两边施加一个推动力,原料侧组分会选择性地透过膜,以达到分离纯化的目的[37]。其选择性强、操作过程简单、适用范围广、能耗低,比较常用的膜分离技术有超滤和纳滤。张敏等[38]采用纳滤膜分离技术对地黄中的水苏糖进行分离纯化,使水苏糖含量达到了58.84%。王兴国等[39]发现以0.005 μm的陶瓷有机膜作为试验膜,在料液温度50 ℃、浓缩比4.5、时间控制在120~150 min,棉籽糖提取液中的蛋白质等大分子物质可有效脱除,蛋白质脱除率可达87.4%,且没有损失透过液中的棉籽糖。在工业生产中,如分离大豆低聚糖,残留蛋白通过超滤法后,反渗透除盐,最后纳滤精制分离低聚糖。
2.2.3 发酵分离法 发酵分离法利用低聚糖难以被微生物发酵的特点,选取特定的微生物菌株选择性地去除低聚糖混合体系中的非功能性杂质成分。刘玉兰等[40]去除大豆糖蜜中的蔗糖,以制备大豆功能性低聚糖,采用啤酒酵母发酵去除,其中蔗糖去除率可达90%,棉籽糖保存率为85.7%,水苏糖保存率为94.3%。此外,崔希庆等[41]用7 号酵母菌对大豆糖蜜中低聚糖进行分离,分离条件为发酵pH5.0、接种量为2%、发酵温度28 ℃、发酵时间12 h、大豆糖蜜稀释8 倍。大豆糖蜜发酵液中RFOs 的保留率为:棉籽糖99.61%、水苏糖95.72%。随着现代生物技术的发展,有望通过诱变、驯化等技术手段,培育出对功能性低聚糖中非功能性成分特异性去除的异变菌株,这对低聚糖的纯化具有重要的作用。
综上所述,色谱分离法的效果最好,分离的准确度较高,操作简单。膜分离法虽分离效率高,但是膜易受损坏或污染、更换不方便,并且成本较高。发酵分离法虽分离纯度率较高,但分离时间较长,并且在发酵过程中影响因素较多。
3 功能性研究
虽然RFOs 曾被认为是引起肠胃胀气的重要因素,但近年来大量研究认为其可以作为一种益生元用于开发潜在的健康促进剂,生理功能主要包括调节肠道菌群、预防炎症性肠病、保护肝脏、降血糖、降血脂、防止龋齿、促进矿物质吸收、保护神经细胞等。
3.1 调节肠道菌群
人体肠道特别是大肠中栖居着数量众多的微生物,其中,细菌的数量可达1014个,微生物种类超过160 种,它们与机体的健康有着紧密的联系[42]。RFOs能够刺激双歧杆菌增殖产生短链脂肪酸(SFCA),同时抑制腐败菌及相关有害物质产生;并通过菌体大量生长保持肠内渗透压,刺激肠道蠕动,粪便湿润度增加,进而起到防止便秘及减少结肠癌发病率的作用。XI 等[43]研究了水苏糖对断奶小鼠肠道菌群的影响,并评估了水苏糖是否能改善抗生素摄入后早期的肠道菌群,发现服用水苏糖能够增加断奶小鼠肠道菌群中阿克曼菌的丰度,提高肠内容物乙酸和丙酸水平。姜宝森[44]发现,在小鼠日粮中添加0.3%棉籽糖,与对照组相比,小鼠盲肠乳酸菌和双歧杆菌数分别增加了119.14%和289.51%(P<0.05),肠杆菌和肠球菌数分别减少了46.27%(P>0.05)和62.02%(P<0.05),说明棉籽糖具有调节小鼠肠道菌群的作用。SARINA等[45]通过羊膜给药程序,将不同浓度的水苏糖和棉籽糖溶液注入孵化第17 d 的肉鸡蛋卵内,与对照组相比,棉籽糖和水苏糖增加了孵化后小鸡肠道内双歧杆菌和乳酸杆菌的相对丰度(P<0.05),降低了致病菌的相对丰度。此外,苏娣[33]研究了毛蕊花糖对肠道菌群的影响,发现毛蕊花糖显著促进双歧杆菌和乳酸菌(Lactobacillus)的增殖。目前关于RFOs 调节肠道菌群方面的研究已证明RFOs 具备促进肠道益生菌增殖和改善肠道免疫屏障的效果。但除了双歧杆菌、乳杆菌外,能利用RFOs 的肠道菌群的种类目前尚未有深入研究。因此,除了双歧杆菌外,其它能够利用棉籽糖家族的菌群还有待进一步深入研究,以揭示肠道菌群利用RFOs 的机制,阐明RFOs 与肠道细菌的关系。目前对水苏糖和棉籽糖的研究较多,对于毛蕊花糖的研究较少,这可能与植物中水苏糖和棉籽糖的含量相对于毛蕊花糖高,更容易实现工业化生产有关。但水苏糖、棉籽糖和毛蕊花糖等不同组分配比的RFOs 与肠道菌群的剂效关系尚不清楚,摸清不同组分配比的RFOs 对肠道菌群的作用效果及机制对开发RFOs 益生元的应用具有十分重要的指导意义。
3.2 保护肠道,预防炎症性肠病
炎症性肠病(Inflammatory bowel disease,IBD)是特征为肠道慢性炎症性疾病,主要包括溃疡性结肠炎(Ulcerative colitis)和克罗恩病(Crohn's disease),其典型特征之一是Treg 细胞数量减少,其确切病因和发病机制至今不明,可能由遗传、肠道屏障功能障碍、免疫系统疾病以及宿主与肠道微生物群之间的异常串扰驱动[46]。有研究认为,膳食多糖在体内被肠道微生物先分解为寡糖,进一步分解产生短链脂肪酸,促进肠道Naive CD4+T 细胞向Treg 细胞的分化,进而改善IBD[47]。目前普遍认为改善IBD 的途径有直接干预和间接干预[48]。直接干预是通过调节相关细胞因子或调节信号通路实现。苏娣[33]用巨噬细胞RAW264.7 研究毛蕊花糖的体外免疫调节能力,发现毛蕊花糖浓度为200 μg/mL 时,细胞增殖的效果最好,其吞噬中性红的能力增强,促进NO 和免疫活性分子IL-6、IL-1β等的释放。HE 等[49]研究水苏糖对急性结肠炎小鼠炎症水平和肠道微生物群的影响,结果表明,水苏糖处理可显著抑制右旋糖酐硫酸钠(DSS)诱导的炎症细胞因子的上调,并改变了肠道菌群的组成,提高了阿克曼氏菌(Akkermansia muciniphila)的水平。也有研究发现其它寡糖2'-岩藻糖处理感染空肠梭菌毒株的人上皮细胞HT-29,可抑制白细胞介素IL-8、IL-1β促炎信号释放[50]。近年来关于IBD 的信号通路研究,主要集中在核因子-κB(NF-κB)、丝裂原活化蛋白激酶(MAPK)和过氧化物酶体增殖剂激活受体(PPARs)等。NF-κB 表达的增加伴随着IL-6、TNF-α、IL-1 等炎性因子分泌能力的增加,且作为控制促炎细胞因子分泌的重要因素,直接参与黏膜组织损伤的发生[51]。MAPK 包括3 个亚族(ERK、p38 和JNK),被称作是炎症和凋亡过程中的“上游里程碑”,且MPAK 的抑制可有效改善IBD 的炎性[52]。PPARs 包含3 个亚型(α、β/δ、γ),PPARs 参与糖脂代谢调节、炎症调控等多种生理反应[53]。XI 等[43]研究发现水苏糖能够在小鼠服用抗生素初期过NF-κB 途径改善脂多糖介导的炎症,并降低代谢性疾病的风险。也有研究发现非RFOs 寡糖新琼脂寡糖可通过MAPK 通路改善IBD,通过下调脂多糖刺激的巨噬细胞(mø)的MAPK 和NF-κB信号通路来减轻炎症反应[54]。在抗炎作用中,PPAR与MAPK 等信号通路有着密切的关系,但RFOs 是否可以通过这一途径来抑制炎症,进而改善IBD 尚不清楚。
以上是可能进行直接干预IBD 的途径,间接干预IBD 的途径有以下两种。一是通过肠道菌群进行干预。有研究发现水苏糖可以通过肠道菌群中阿克曼菌来干预IBD[43];二是通过菌群发酵产物SCFAs来发挥作用。SCFAs 是一种脂肪尾部由1~6 个碳组成的羧酸,包括甲酸、乙酸、丙酸和丁酸等,在肠道总浓度约为0.5~0.6 mol/L[55],研究发现[56]IBD 患者粪便中的丁酸和丙酸水平显著低于正常人。研究发现水苏糖可增加体外培养液中肠内容物中丁酸和乙酸的浓度[57]。IBD 与肠道稳态关系密切,肠道菌群失调和肠道屏障受损都会引起炎症。已有研究表明RFOs 可通过调节相关细胞因子和NF-κB 途径抑制肠道炎症,并可能通过调节肠道菌群及其产物SCFA等改善IBD。但大量研究集中在水苏糖,系统探究RFOs 各组分改善IBD 的机制的研究尚需进一步深入。
3.3 保护肝脏
肝脏是参与生物毒素和药物代谢的主要器官。这种代谢(CRP 代谢)总是伴随着肝细胞生物化学的紊乱和活性氧的产生,很多肝脏损伤都与氧化还原失衡和氧化应激有关。许多抗氧化剂和植物提取物对化学性肝损伤具有保护和抗氧化作用[58]。有研究者[59]从一种新植物地黄中分离和鉴定得到了主要由水苏糖和棉籽糖组成的棉籽糖族低聚糖,评价其对CCl4诱导的小鼠氧化应激和肝脏病变的保护作用,结果表明,连续21 d 每天口服RFOs 可显著降低血清丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、总胆固醇(TC)和甘油三酯(TG)的水平。小鼠实验发现水苏糖可以有效降低由High Fructose 诱导肝损伤的潜在生物标志物β-羟基丁酸的水平[60],起到预防HF 饮食性肝损伤的作用。在高脂饮食喂养的大鼠中,12α-羟基化胆汁酸(12αOH-BA)的肠肝循环因能量摄入而增强。这种胆汁酸代谢可以通过补充胆酸(CA)的饮食进行复制,MAEGAWA 等[61]研究了饮食中添加棉籽糖是否能改善CA 喂养条件下诱导的大鼠肝脏脂质积累,结果表明,饮食补充棉籽糖可降低肝脏12αOH-BA 浓度,增加盲肠内容物中的乙酸浓度。即棉籽糖可通过抑制肠肝12αOH-BA 循环使肝脏脂质积累正常化。有研究认为肠道微生物代谢产物氧化三甲胺(TMAO)可抑制SIRT3-SOD2-线粒体活性氧信号通路并触发氧化应激,血栓素NIPNLRP3型炎症小体被激活[62],细胞表面CD36 受体表达增加,巨噬细胞、胆固醇加速积累[63],释放炎症细胞因子白细胞介素1、β和18,一氧化氮和一氧化氮合酶生成被抑制,诱发炎症和内皮功能障碍[64]。RFOs 具有调节肠道微生物的作用,但其是否通过上述途径来发挥保护肝脏的作用,仍需进一步的研究和验证。
3.4 降血糖、降血脂
在世界范围内,糖尿病(DM)的发病率呈上升趋势,已成为21 世纪主要健康问题之一。RFOs 热量低,约为蔗糖热量的50%,是一类低热量并且具有保健功能的膳食纤维,可作为甜味剂使用,服用后血糖值和胰岛素浓度不易升高。在降血糖食品开发中作为潜在应用价值广泛。有研究者评估水苏糖对2 型糖尿病(T2DM)小鼠的影响,发现水苏糖通过调控肠道拟杆菌门微生物丰度降低胰腺炎性细胞因子,并且促进糖脂代谢,降低了高脂喂养小鼠的血清TC 和TG 水平[65]。LIANG 等[66]通过尿代谢组学分析水苏糖对高脂饮食和低剂量链脲子菌诱导的T2DM 大鼠的干预效果,发现水苏糖干预可调节T2DM 大鼠的胰岛素、低密度脂蛋白胆固醇和甘油三酯水平。RFO作为益生元,不能被胃肠道消化吸收,调节肠道菌群可能是其发挥生理功效的重要途径。近年来维持菌群稳态作为T2DM 的新型治疗方法备受关注,干预调节肠道菌群及其代谢产物SCFA、胆汁酸、脂多糖(LPS)等途径来预防T2DM(图2)。主要机制如下:a. SCFAs 可能通过与G 蛋白偶联受体GPR41、GPR43结合或抑制组蛋白去乙酰化酶活性,从而激活宿主的信号传导,促进机体释放胰高血糖素样肽-1(GLP-1)[67],SCFA 与GPR41 和GPR43 结合也抑制了宿主免疫细胞核因子κB 的活化,减轻了炎症反应,从而保护胰岛β细胞[68];b.胆汁酸是胆固醇在肝脏中经过多种酶催化形成的代谢产物。初级胆汁酸在葡萄糖代谢中的作用可能是通过法尼醇X 受体(FXR)介导的。研究表明,抑制FXR 可促进GLP-I 的分泌,从而促进胰岛素的合成,调节糖脂代谢[69]。当FXR 被初级胆汁酸激活时,血浆葡萄糖的水平下降,并伴有糖异生基因表达下降。初级胆汁酸在肠道菌群的作用下被转化为次级胆汁酸,次级胆汁酸主要激活GPR5,两者在维持葡萄糖代谢稳态和改善胰岛素抵抗中起重要作用;c.脂多糖是体内重要的炎症刺激物。当肠道菌群紊乱时,会产生大量的脂多糖,脂多糖进入血液循环后,可先与脂多糖结合蛋白相结合,然后与CD14 细胞相结合,并可激活Toll 样受体-4(TLR-4)信号通路,使机体出现不同程度的炎症反应,引发胰岛素抵抗[70]。以上是通过肠道菌群代谢物来抑制糖尿病的几个通路,也有研究发现,壳寡糖可通过抑制肠道α-葡萄糖苷酶和葡萄糖转运蛋白SGLT1 和GLUT2 表达,逆转胰岛素抵抗,发挥抗糖尿病作用[71],但RFOs 是否可以通过肠道菌群代谢物以及抑制肠道α-葡萄糖苷酶和葡萄糖转运蛋白的表达这几种途径来抑制2 型糖尿病的研究尚未见报道。RFOs 调控血糖、血脂的作用机制还有待进一步深入研究。RFOs 中的水苏糖已被证明具有改善糖脂代谢的作用,但棉籽糖和毛蕊花糖在这方面的作用尚不可知,探究RFOs 其它组分及各组分配比与降血糖、降血脂作用的剂效关系对开发RFOs 抗糖尿病产品具有重要的指导意义。
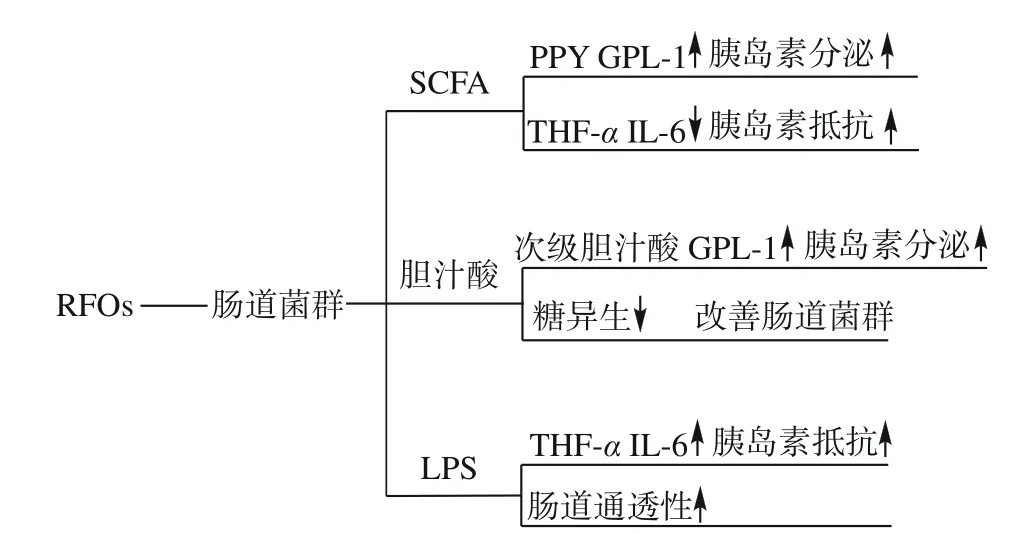
图2 肠道菌群调节宿主血糖的信号机制Fig.2 Signaling mechanism of intestinal flora regulating host blood glucose
3.5 其他功能
变形链球菌是龋病的主要致病菌,能迅速发酵单糖和二糖产酸,人和动物体内不存在α-半乳糖苷酶系统,致使RFOs 不能在口腔被分解成果糖、葡萄糖、半乳糖等单糖,因而RFOs 不会被变异链球菌分解利用,从而起到抗龋齿的作用[72]。结肠的pH 对矿物质的吸收有着重要的影响,RFOs 会使结肠微生物产生大量的SCFA,结肠内的pH 降低,钙离子浓度提高,加速钙、钾等矿物质的吸收,使骨骼矿物质的密度增强,以缓解骨质疏松症[73]。此外,研究发现当铅进入人体后,会干扰人体对铁、锌、钙离子的吸收,水苏糖对铅有一定的螯合能力,可以通过促进铅排出,缓解因铅过量而导致的机体缺钙、铁、锌等症状[35]。另有研究发现地黄中的水苏糖和棉籽糖能够起到治疗和预防慢性肺阻塞的作用[74],其他来源的RFOs 是否可以保护神经细胞和预防慢性肺阻塞的研究还未曾发现。
4 总结和展望
棉籽糖家族系列寡糖普遍存在于自然界,但在豆类种子、莲子及水苏、地黄、草石蚕等植物中含量较为丰富。目前工业中用于提取RFOs 的原料多为豆类和地黄等。提取工艺相对成熟,多为微波、超声辅助溶剂提取的方法。但高纯度RFOs 的生产仍面临着耗材成本高等难题。因此,高效、低成本的RFOs工业化生产技术仍待进一步的研究开发。RFOs 作为一种功能性寡糖,已被证实可以促进机体内有益菌的增殖,并具有改善免疫系统的能力、保护肝脏及调节糖脂代谢的潜在功能。目前,棉籽糖家族低聚糖已经作为益生元添加到多种食品中,例如婴儿奶粉、保健饮料、面包、糕点糖果等。RFOs 因不能被人体胃肠道吸收,其保健功能通常被认为是通过调节肠道菌群实现的。但其在机体内发挥活性功能的具体机制尚不清楚,有待进一步深入研究。随着食品科技和工业的发展,人们对RFOs 的认识水平的不断提高,其潜在的应用价值和经济效益会受到越来越多的重视,开发和应用领域也会更加广阔。
