响应面法优化蒲桃籽中三萜类化合物的提取工艺及其抗氧化活性分析
2022-12-06刘嘉鑫陈小梅王淑美向丽敏
刘嘉鑫,陈小梅,曾 慧,王淑美,3,4,*,向丽敏,3,4,*
(1.广东药科大学中药学院,广东 广州 510006;2.广东药科大学药学院,广东 广州 510006;3.国家中医药管理局中药数字化质量评价技术重点研究室,广东 广州 510006;4.广东中药质量工程技术研究中心,广东 广州 510006)
由于不健康的饮食及生活习惯,糖尿病已成为全球主要的公共卫生问题[1],患病人数逐年上升[2]。糖尿病及其并发症的发生、发展与氧化应激密切相关[3-5],应用抗氧化治疗可逆转氧化应激对组织的损伤,从而阻止或延缓糖尿病及其并发症的发生、发展,从天然产物中寻找有效的抗氧化剂将成为预防和治疗糖尿病及其并发症药物开发的有效策略[6]。
蒲桃(Syzygium jambosL. Alston),又称香果、响鼓等,为桃金娘科(Myrtaceae)蒲桃属植物,在我国福建、广东等地有栽培[7]。除了可作为热带水果食用外,蒲桃药用历史也较为悠久。据《中华本草》记载,蒲桃种子可健脾止泻,多用于脾虚泄泻及糖尿病的治疗;现代药理学研究表明蒲桃不同部位均有降血糖作用,尤以种子的降糖作用最强[8-9]。三萜类化合物是许多具有降血糖中药的有效成分[10-11],具有显著的抗氧化活性,在糖尿病防治方面具有巨大的潜力。三萜类化合物是蒲桃的主要化学成分之一[12],也是其发挥降糖活性的有效成分之一[13]。蒲桃不同药用部位均含有乌苏烷型三萜[12,14-15]。但目前国内外对蒲桃属植物三萜成分的研究主要集中在果实和茎叶部位[12-15],对蒲桃籽三萜的研究罕见报道。
一般来说,三萜类化合物常用的提取方法有碱水提取法、超临界CO2提取法、超声辅助提取法、有机溶剂提取法等[16-17]。某些皂苷含有羧基,可溶于碱水,可以采用碱水提取法提取,但是该法提取效率低[16]。超临界CO2提取法及超声辅助提取法提取效率高,能耗低,但对设备要求较高,提取成本高,不适合规模化生产[17-18]。与其他提取方法相比,有机溶剂提取法具有提取周期短、操作简便,适应性广的优点[16],因此本文选择有机溶剂提取法来研究蒲桃籽三萜的提取工艺,在单因素实验考察甲醇体积分数、料液比、提取时间对蒲桃籽三萜得率影响的基础上,采用响应面试验优化其提取工艺,并采用DPPH 和ABTS 法评价了其体外抗氧化活性,为后续蒲桃资源的开发利用、糖尿病的防治及天然食品抗氧化剂的开发奠定了一定的理论基础。
1 材料与方法
1.1 材料与仪器
蒲桃籽 2019 年6 月在广东药科大学大学城校区的校园内采摘,经广东药科大学中药学院向丽敏博士鉴定为蒲桃(Syzygium jambosL. Alston);乌苏酸对照品 纯度95%,实验室自制;石油醚 分析纯,天津市百世化工有限公司;甲醇、冰乙酸 分析纯,天津市致远化学试剂有限公司;高氯酸 分析纯,广州市安捷汇贸易有限公司;香草醛(香兰素) 分析纯,天津市科密欧化学试剂有限公司;2, 2-联苯基-1-苦基肼基、2, 2'-联氨-双(3-乙基苯并噻唑啉-6-磺酸)二胺盐、抗坏血酸、过硫酸钾 分析纯,上海麦克林生化科技有限公司;5%的香兰素-冰乙酸溶液 精密称取香兰素2.5 g,于50 mL 的棕量瓶,加冰乙酸定容至刻度线,摇匀即得。
DFY-200C 摇摆式高速粉碎机 温岭市林大机械有限公司;JM-B2002 电子天平 余姚市纪铭称重校验设备有限公司;ME104 万分之一天平 梅特勒-托利多仪器上海有限公司;HH-4 数显恒温水浴锅国华电器有限公司;SB-1300 旋转蒸发仪 广州腾朗科技仪器有限公司;SHZ-D(III)循环水式真空泵巩义市予华有限责任公司;DLSB-5110 低温冷却液循环泵 郑州长城科工贸有限公司;KQ-500DE 数控超声清洗器 昆山市超声仪器有限公司;UV-2600紫外可见分光光度计 岛津仪器苏州有限公司。
1.2 实验方法
1.2.1 蒲桃籽前处理 取适量干燥的蒲桃籽药材粉粹,过1 号筛,得到蒲桃籽粗粉。取100 g 蒲桃籽粗粉与5 倍量石油醚于65 ℃的水浴锅中加热回流脱脂1 h,重复操作2 次。过滤,将脱脂后的蒲桃籽粗粉平铺于法兰盘中,在通风橱放置过夜,期间时常翻动,待其彻底挥去石油醚后过2 号筛,所得蒲桃籽粉末保存备用[19-20]。
将未脱脂蒲桃籽粗粉、脱脂蒲桃籽粗粉在50 ℃下加热回流30 min,得到醇提物过滤,在550 nm 下测其吸光度值A。由于A脱脂样品>A未脱脂样品,所以选择脱脂粉末作为本实验的研究对象。
1.2.2 蒲桃籽三萜提取工艺 称取0.5 g 蒲桃籽脱脂粉末,根据后续不同实验参数条件,加入不同体积分数的甲醇溶液,在不同的提取温度、时间、料液比下进行回流提取。提取结束后室温冷却10 min 定容,移取上清液,过滤,即为蒲桃籽三萜类化合物提取液。
1.2.3 单因素实验 精密称取0.5 g 蒲桃籽粗粉,按照设定条件进行提取,分别考察甲醇体积分数、提取温度、提取时间以及料液比对蒲桃籽三萜得率的影响:固定料液比1:10 g/mL,提取温度50 ℃,提取时间30 min 下,考察甲醇体积分数(10%、30%、50%、70%、80%、95%)对蒲桃籽三萜得率的影响;固定料液比1:10 g/mL,甲醇体积分数50%,提取时间30 min下,考察提取温度(40、50、60、70、80、90 ℃)对蒲桃籽三萜得率的影响;固定料液比1:10 g/mL,甲醇体积分数50%,提取温度50 ℃下,考察提取时间(20、40、60、90、120 min)对蒲桃籽三萜得率的影响;固定甲醇体积分数50%,提取温度50 ℃,提取时间30 min 下,考察料液比(1:10、1:40、1:50、1:70、1:80 g/mL)对蒲桃籽三萜得率的影响。
1.2.4 响应面法优化提取工艺 上述实验结果显示蒲桃籽中三萜类化合物的得率随着温度的升高而逐渐上升,但是由于甲醇的沸点为64.7 ℃,而且温度过高会引起部分三萜类化合物结构发生变化,本实验将60 ℃作为最佳提取温度(固定温度)。
选取甲醇体积分数(A)、提取时间(B)、料液比(C)三个因素为自变量,以蒲桃籽中三萜类化合物得率(D)为响应值,运用Design-Expert 12 软件进行三因素三水平的Box-Behnken 响应面设计,试验因素水平见表1。

表1 Box-Behnken 试验设计因素和水平Table 1 Test factors and levels of Box-Behnken design
1.2.5 三萜类化合物含量测定 取1 mg/mL 乌苏酸对照品溶液0.2 mL 于80 ℃下蒸干。依次加入0.3 mL 5%的香兰素-冰乙酸溶液和1 mL 高氯酸,混匀。60 ℃恒温加热20 min,取出后立即置于冷水中冷却5 min,最后加入5 mL 冰乙酸稀释摇匀,以空白试剂(0.3 mL 5%的香兰素-冰乙酸溶液+1 mL 高氯酸+5 mL 冰乙酸,混匀)为参比,在400~800 nm 下扫描吸收图谱,选择其最大吸收峰550 nm 为检测波长[21]。将对照品分别配制成100、200、400、600、800、1000 μg/mL,根据上述方法测得吸光度值A,并得到回归方程Y=0.0011x+0.0239,R2=0.9995。
根据上述方法测得样品吸光度值,并结合回归方程及以下公式计算得到蒲桃籽中三萜类化合物得率W:
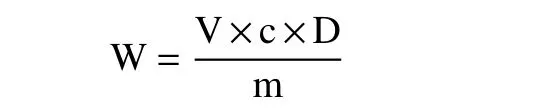
式中:W 表示蒲桃籽中三萜类化合物的得率,mg/g;V 表示吸取的蒲桃籽样品溶液的体积,mL;c 表示提取液中三萜的浓度,mg/mL;D 表示稀释倍数;m 表示粉末的重量,g。
1.2.6 抗氧化活性试验
1.2.6.1 DPPH 自由基清除能力的测定 取14 g 脱脂粉末,按上述试验所得最优工艺提取,蒸干后得1.5 g 浸膏。配制为15、20、25、30、35、40、45 μg/mL的样品溶液,各取20 μL,加入20 μL 0.2 mmoL/L DPPH 溶液,摇匀后避光30 min 后,以甲醇为空白对照,VC为阳性对照,在517 nm 下测定其吸光度,进行3 次平行实验[18,22]。按照以下公式计算其DPPH·清除能力。
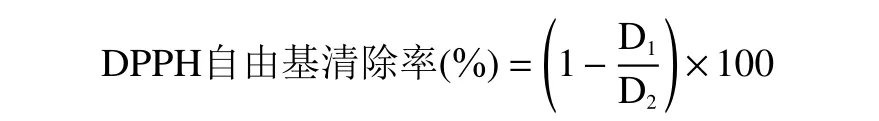
式中:D1表示样品或阳性对照吸光度;D2表示空白对照吸光度。
1.2.6.2 ABTS+·清除能力的测定 7 mmoL/L 的ABTS溶液和2.45 mmoL/L 的过硫酸钾溶液等体积(5 mL)混合,室温避光条件下反应14~16 h 制得ABTS 储备液。将储备液用pH 为7.4 的磷酸盐缓冲液稀释(约40~45 倍),直至测得其在734 nm 下吸光度为0.700±0.020。各取0.5 mL 浓度为1、5、10、15、20、25 μg/mL 的样品溶液,加3 mL ABTS 工作液振荡摇匀,黑暗反应8 min,检测其在波长734 nm 处的吸光度值A1,纯水代替ABTS 工作液测得吸光度值A2,同样用纯水代替样品溶液测得其吸光度值A0。以VC为阳性对照,进行3 次平行实验[21,23],按照以下公式计算其ABTS+·清除能力。
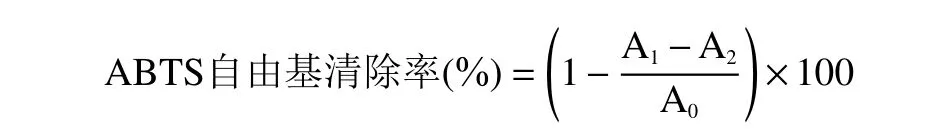
式中:A1表示样品/阳性对照+ABTS 工作液的吸光度值;A2表示样品/阳性对照+纯水的吸光度值;A0表示纯水/阳性对照+ABTS 工作液的吸光度值。
1.3 数据处理
所有试验平行测定3 次,取平均值。数据采用Graphpad prism 8 进行统计整理和绘图。采用Design-Expert 12 软件进行响应面优化及方差分析;P<0.05 表示差异显著,P<0.01 表示差异极显著。
2 结果与分析
2.1 单因素实验
2.1.1 甲醇体积分数对三萜得率的影响 由图1 可知,三萜类化合物得率随甲醇体积分数的增加,呈现出先上升后下降的趋势。甲醇体积分数为50%时,其得率达到最大值9.90 mg/g,说明蒲桃籽三萜类成分在甲醇体积分数为50%时溶解度最大。而甲醇体积分数超过50%后,三萜的得率逐渐降低。一方面可能与三萜的极性有关[24],随着甲醇体积分数的增加,部分三萜类化合物的溶解度下降而导致总三萜类化合物的得率降低;另一方面则是因为一些醇溶性杂质、脂溶性杂质等随之溶出[25],与三萜类成分产生了竞争[26],从而导致了蒲桃籽中三萜类成分的得率下降。综上,应选择甲醇体积分数为30%、50%、70%的溶剂进行响应面优化。
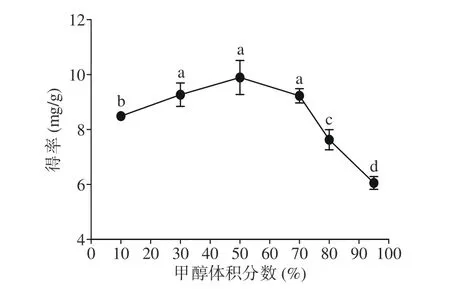
图1 甲醇体积分数对三萜类化合物得率的影响Fig.1 Effect of methanol volume fraction on the yield of triterpenoids
2.1.2 提取温度对三萜得率的影响 由图2 可知,随着温度的升高,其得率逐渐上升。可能是由于随着温度的升高,高分子的热运动加剧,使得甲醇溶液更容易渗透、扩散进入药粉组织细胞内,而有利于三萜类化合物的提取[25],但是超过80 ℃可能会引起部分三萜类化合物结构的变化。且考虑到甲醇的沸点为64.7 ℃[27],将60 ℃作为最佳提取条件。

图2 提取温度对三萜类化合物得率的影响Fig.2 Effect of extraction temperature on the yield of triterpenoids
2.1.3 提取时间对三萜得率的影响 由图3 可知,在本试验条件范围内,提取时间对蒲桃籽中三萜类化合物的得率影响较小,总体来看得率随时间的变化呈现出平缓-上升-再下降的趋势。提取时间为90 min 时,得率达到最大值10.22 mg/g。说明在提取90 min时,蒲桃籽粉末与甲醇溶液可以充分接触,其组织细胞基本破裂,三萜类化合物的溶出已经达到最大的限度。而继续延长加热提取时间,不仅不会提高三萜类化合物的得率,反而会使某些三萜成分的稳定性降低[25]。甚至随着时间的延长,会有更多的杂质产生,这些杂质可能与三萜类化合物产生反应,形成吸附作用或者与三萜类化合物竞争溶剂,使得三萜类化合物的得率降低[28]。综上,应选择60、90、120 min 的提取时间进行响应面优化。
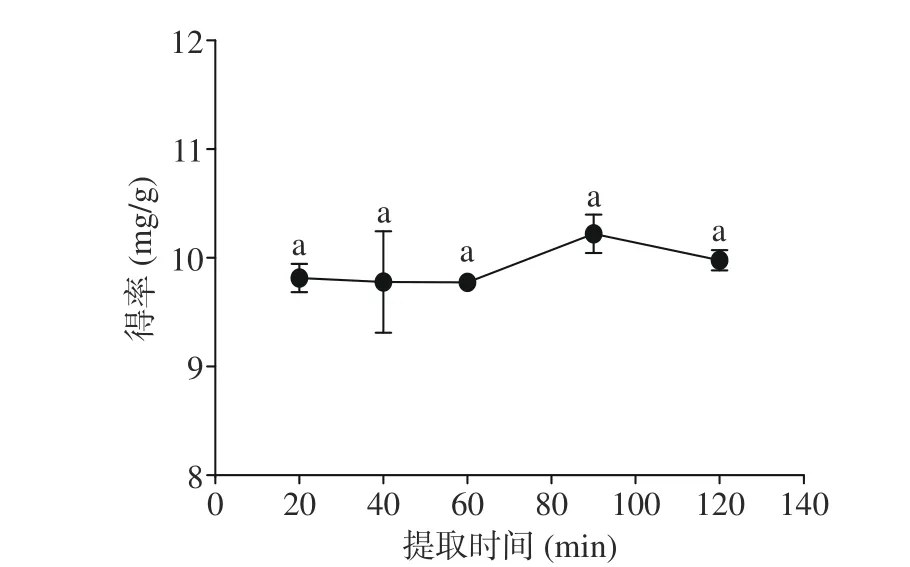
图3 提取时间对三萜类化合物得率的影响Fig.3 Effect of extraction time on the yield of triterpenoids
2.1.4 料液比对三萜得率的影响 由图4 可知,得率随料液比的增加呈现出先上升后下降的趋势。料液比达到1:40 时,蒲桃籽中三萜类化合物的得率达到了最大值11.97 mg/g。可能是不同的料液比会对蒲桃籽粉末产生不同的细胞外渗透压[24],从而导致其细胞破裂程度不同,进而使得三萜得率不同。当其料液比较小时,由于其粉末与溶剂之间的浓度梯度较小,使得甲醇溶液与蒲桃籽粉末的接触面积较少,加热回流受限,甲醇溶液不能完全渗透扩散进入药粉的组织细胞内,从而使其三萜类化合物不能全部提出。而当其料液比增加时,甲醇溶液与蒲桃籽粉末的接触面积增加,三萜的得率逐渐增加;直至料液比达到1:40时,其三萜的提取达到上限饱和。此后,溶剂继续增加,反而会形成稀释,其甲醇溶液与蒲桃籽粉末的有效碰撞面积减少,三萜得率下降[21,26]。同时,由于其甲醇溶液增加,杂质也随之增加,杂质既可能影响三萜类化合物的提取,也能吸附三萜类化合物或者与其发生反应,使之得率降低。且料液比增大,不仅产生浪费,还会对之后的富集纯化等实验加大难度。综上,应选择1:10、1:40、1:70 g/mL 的料液比进行响应面优化。
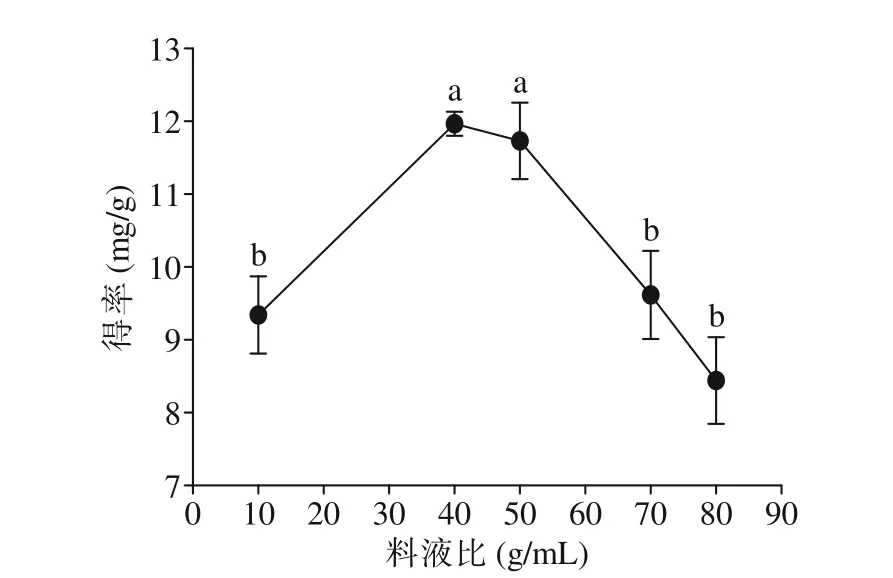
图4 料液比对三萜类化合物得率的影响Fig.4 Effect of material-liquid ratio on the yield of triterpenoids
2.2 响应面试验优化提取工艺
2.2.1 响应面试验设计 运用Design-Expert 12 软件对蒲桃籽中三萜类化合物的提取工艺进行优化,共产生17 组实验(包括5 组零点实验进行误差校正),其设计结果见表2。
2.2.2 建立回归模型及方差分析 运用Design-Expert 12 软件对表2 的数据进行二次多项式回归拟合,并进行方差分析,结果见表3。得到二次多项回归方程为(A:甲醇体积分数;B:提取时间;C:料液比;D:得率;以下均同):
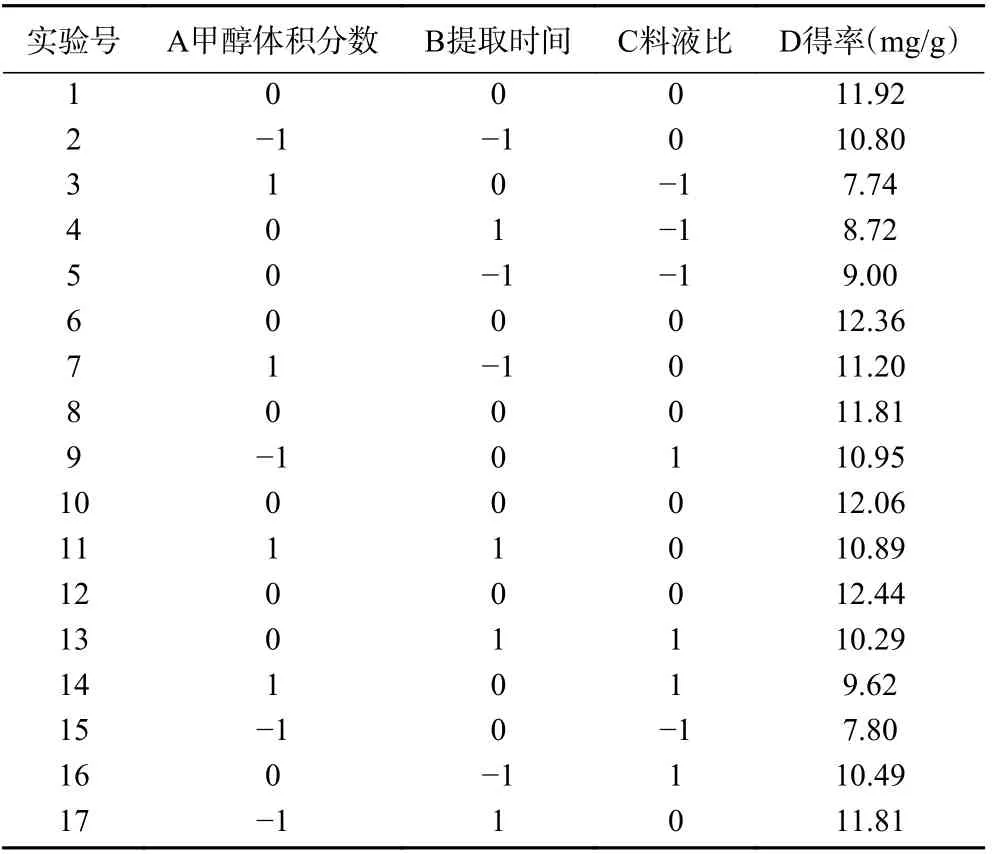
表2 Box-Behnken 试验设计和结果Table 2 Box-Behnken experimental design and results

表3 回归方程方差分析Table 3 Analysis of variance of regression equation

其中,模型的决定系数R2=0.9717,表明模型拟合情况良好,试验因素与得率之间的关系较为明显,蒲桃籽中三萜类化合物的得率的变化中,97.17%来自于试验因素[25]。因此,此模型可以很好地解释得率与三个因素的关系。调整系数R2Adj=93.53%,表明此模型误差较小,能很好地解释93.53%的得率的变化,可以用模型来代替实际值,所以此模型可以进行蒲桃籽中三萜类化合物提取的工艺优化[25-26]。变异系数CV(%)代表试验结果的精度,其CV 值越小,实验结果越可靠[26]。本模型的CV(%)=3.66%,重现性较好,可以用于蒲桃籽中三萜类化合物提取的工艺预测与优化。
由表3 可知,模型P=0.0001,<0.01,差异极显著,说明实验方法可靠。失拟项P=0.1351,>0.05,差异不显著,说明本数据模型拟合良好,预测值与真实值之间的偏差较小[26],模型可以用来描述各因素与得率之间的关系。
因素C(料液比)P<0.01,差异极显著,说明料液比对蒲桃籽中三萜类化合物的得率有极显著的影响;而A(甲醇体积分数)和B(提取时间)P>0.05,无显著性,说明二者对蒲桃籽三萜得率的影响不显著。试验因素的F值越大,说明其对响应值得率的影响越大[25]。因此,影响蒲桃籽中三萜类化合物得率的因素由大到小是:C>A>B,即料液比>甲醇体积分数>提取时间。交互项AB、AC、BC 均不显著(P>0.05),说明这些因素之间的内在联系不大。A2、C2的P<0.01,差异极显著。
2.2.3 模型诊断 拟合得到的模型可以通过残差分析来进行诊断。这种方法主要是建立在模型无法完全解释的变异基础上,通过图形来诊断的。在诊断过程中,有两个判断极其重要,即残差方差齐性与正态分布。首先判断残差方差齐性,若预测值的内部t化残差呈随机分布,则其残差方差齐性符合要求。由图5(a)可以看出,其呈散点分布,符合要求。其次判断正态分布,若残差呈正态分布,则其拟合的曲线呈线性。由图5(b)可以看出,其残差呈正态分布。因此,可以诊断得出本试验实验值与实际值偏差较小,拟合的模型有价值[29]。
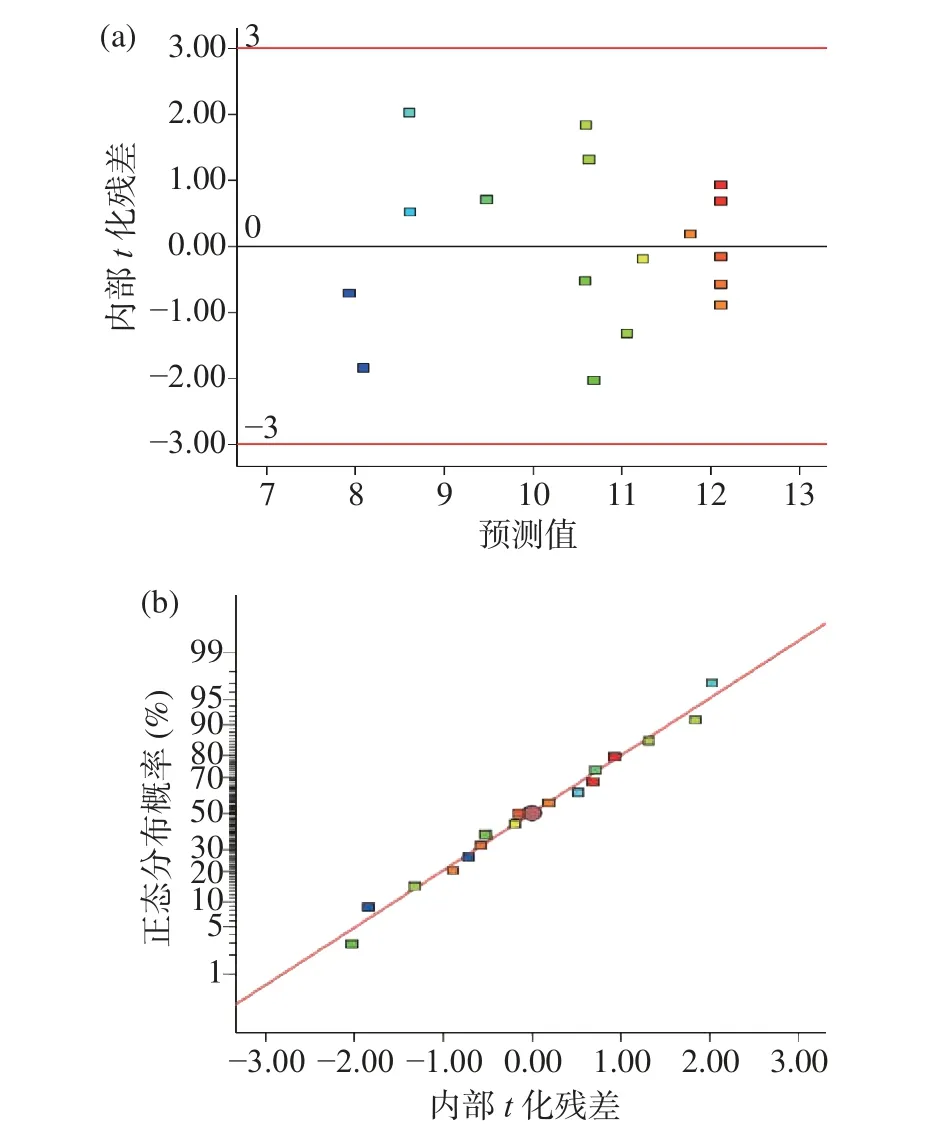
图5 模型诊断工具图Fig.5 Diagnostic tool diagram of the model
2.2.4 工艺优化 运用Design-Expert 12 软件得到蒲桃籽中三萜类化合物的最佳提取工艺是:甲醇体积分数44.30%、料液比1:47.18、提取时间101.07 min(实验时调整为101 min),此条件下的理论得率为12.28 mg/g。
根据以上条件进行三组平行实验提取蒲桃籽中的三萜类化合物,得到的平均浓度为256.76 μg/mL,得率为12.11 mg/g,其RSD(%)为0.82%,实际的得率与理论得率之间的偏差仅为1.26%(<5%),偏差较小,说明用此方法优化后的蒲桃籽中三萜类化合物的提取工艺可行。
2.3 抗氧化活性试验
2.3.1 DPPH 自由基清除能力的测定结果 由图6可见,蒲桃籽中三萜类化合物对DPPH·的清除能力与三萜类化合物浓度有一定的量效关系,IC50值为24.93 μg/mL。在15~30 μg/mL 的浓度范围内,随着蒲桃籽中三萜类化合物浓度的增大,其对DPPH 自由基的清除能力增强,且各浓度间清除能力具有显著差异(P<0.05),当蒲桃籽中三萜类化合物浓度为30 μg/mL 时,DPPH·清除率为83.90%,清除能力显著,与VC相近。
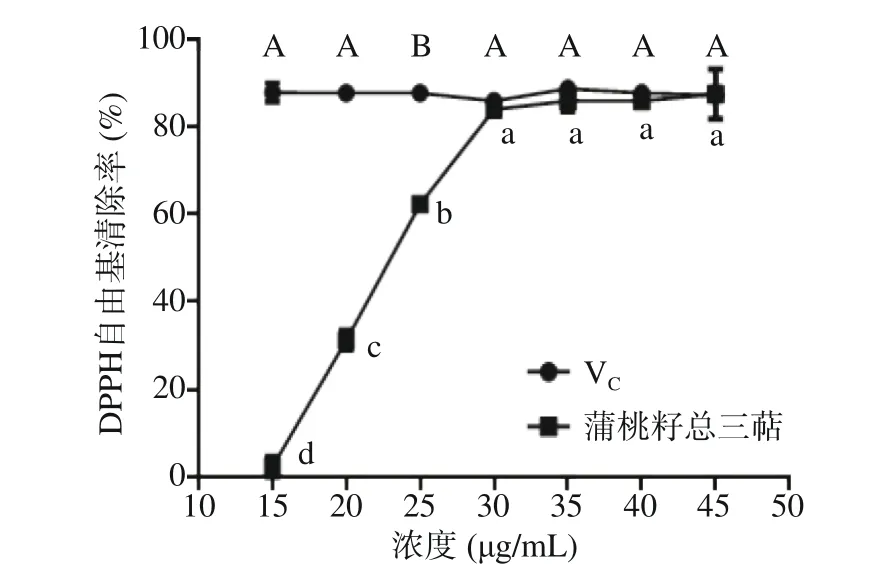
图6 蒲桃籽总三萜、VC 的DPPH·清除能力测定结果Fig.6 Results of DPPH scavenging ability of total triterpenoids in the seeds of S. jambos L. Alston and VC
2.3.2 ABTS+·清除能力的测定结果 由图7 可见,蒲桃籽中三萜类化合物对ABTS+·的清除率呈现一定的量效关系,IC50值为12.16 μg/mL。在1~25 μg/mL的浓度范围内,随着蒲桃籽中三萜类化合物浓度的增大,其对ABTS+·的清除能力增强,且各浓度间清除能力具有显著差异(P<0.05),当蒲桃籽中三萜类化合物浓度为25 μg/mL 时,清除能力达到91.29%,略低于VC,表现出很强的清除能力。与上述三萜类化合物对DPPH·清除能力相比,其对ABTS+·的清除能力更强,这可能是由于三萜类化合物具有较高的供氢能力,结果与灵芝三萜类化合物类似[30]。
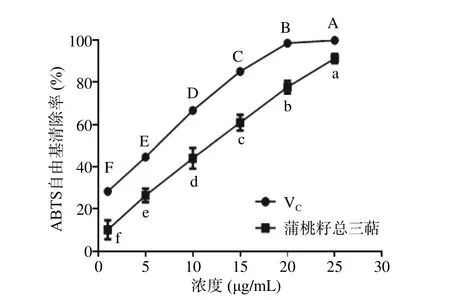
图7 蒲桃籽总三萜、VC 的ABTS+·清除能力测定结果Fig.7 Results of ABTS+· scavenging ability of total triterpenoids in the seeds of S. jambos L. Alston and VC
从上述结果可以看出蒲桃籽中三萜类化合物对不同的自由基(DPPH·、ABTS+·)均有较强的清除能力,与VC相近或略低,抗氧化活性强,可以作为潜在的抗氧化剂。
3 结论
本研究以蒲桃籽为原料,通过响应面优化得到蒲桃籽中三萜类化合物的最优提取工艺为:甲醇体积分数44.30%、料液比1:47.18 mg/L、提取时间101 min。在该工艺下,实际得率(12.11 mg/g)与理论得率(12.28 mg/g)之间的偏差仅为1.26%(<5%)。且蒲桃籽中三萜类化合物具有较强的DPPH·、ABTS+·清除能力(与VC相近或略低),IC50值分别是为24.93、12.16 μg/mL,抗氧化活性较强。本研究为今后蒲桃资源的综合开发利用奠定了基础,也为其日后作为天然糖尿病防治资源或者食品天然抗氧化剂等提供了数据支撑。
