致密细斑点型抗核抗体及其特异性自身抗体在自身免疫病的临床意义
2022-12-06陈彬萱马丽莎周仁芳
陈彬萱,马丽莎,周仁芳
自身免疫病(autoimmune diseases,AID)泛指机体免疫效应细胞或效应分子针对自身组织或细胞产生病理性免疫应答反应,由自身免疫反应参与发病机制,导致组织损伤或功能障碍的疾病。AID根据临床表现、病变累及的范围,通常分为器官特异性AID和系统性AID。在世界范围内,7%~10%的人群受AID困扰,尤以女性多见[1]。AID的临床表现具有广泛性、复杂性,几乎可涉及到各临床专科,临床医生往往难以明确诊断。对此,临床需要大量的生物标志物,而自身抗体作为AID最具有特异性的生物标志物,且多数AID伴有特征性的自身抗体谱,通过检测自身抗体可为自身免疫病诊疗提供重要依据。 抗核抗体(antinuclear antibodies,ANA)作为AID患者最常见的一类自身抗体,主要见于系统性AID,如系统性红斑狼疮(systemic lupus erythematosus,SLE)、干燥综合征(Sjogren’s syndrome,SS)、系统性硬化症(systemic sclerosis,SSc)、特发性炎性肌病(idiopathic inflammatory myopathies,IIM)及混合结缔组织病(mixed connective tissue disease,MCTD)等,也可见于器官特异性AID、感染性疾病、肿瘤及健康人群中。ANA及其特异性自身抗体的临床检测,对相关疾病的分类、鉴别、分型、预测、预后及预防等具有重要的临床意义[2]。在欧洲抗风湿病联盟/美国风湿病学会(EULAR/ACR)发布的2019年SLE分类标准中,ANA作为分类标准的前提条件[3]。
目前,以人喉癌上皮细胞(HEp- 2)作为实验基质的间接免疫荧光法(indirect immunofluorescence,IIF)是检测ANA最为常见的方法,可观察到各种特征性的荧光模式,其中核斑点型、核均质型、核仁型等常见荧光模型ANA的相关临床意义已被广泛接受和深入研究。而近年不断被重视的致密细斑点型(dense fine speckled,DFS)ANA,于1994年首先在间质性膀胱炎患者中发现此特征性的ANA荧光模型[4]。其相应靶抗原,最初根据荧光模型和免疫印迹法出现分子量为70×103g/mol的复合物,而被命名为DFS70。随后鉴定为晶状体上皮细胞衍生生长因子(lens epithelium derived growth factor,LEDGF)、DNA结合转录共激活因子p75等[5- 6]。致密细斑点型ANA及其相应的特异性自身抗体(抗DFS70抗体)可见于多种疾病患者,如功能性、代谢性、慢性炎症性、肿瘤、AID等患者,以及健康人群[6-11]。迄今为止尚未证实致密细斑点型ANA、抗DFS70抗体与疾病特定的临床相关性,但已有国外临床研究表明,抗DFS70抗体单独阳性有助于ANA相关AID的排除。本文就致密细斑点型ANA及抗DFS70抗体的靶抗原特征、临床检测及临床意义进行综述,为AID诊疗提供新思路。
1 靶抗原生物学特性
1.1 靶抗原鉴定
根据以HEp- 2细胞为实验基质的IIF检测ANA呈现的致密细斑点型荧光模型(DFS),结合靶抗原在免疫印迹法中呈现分子量约为 70×103g/mol的复合物,靶抗原被称为DFS70。后来被鉴定为晶状体上皮细胞衍生生长因子75×103g/mol(LEDGF/p75)、DNA结合转录共激活因子p75(TCP75),以及转录共激活因子PC4和SFRS的相互作用蛋白(PSIP1)[6]。DFS70广泛表达于哺乳动物的细胞和组织中,通过免疫电镜发现靶抗原定位于细胞分裂间期染色质,集中于浓缩染色质区域和核仁周围染色质(不包括核仁区),以及细胞分裂中期、后期的浓缩染色质区域[12]。
1.2 靶抗原结构
DFS70靶抗原的氨基端(N端)存在约93个氨基酸组成的PWWP(脯氨酸-色氨酸-色氨酸-脯氨酸)结构域,具有肝癌衍生生长因子(hepatoma-derived growth factor,HDGF)蛋白家族的共同特征。PWWP由β折叠区域和螺旋区域组成,可结合修饰的核小体中的组蛋白赖氨酸残基,也可以通过其带正电荷(阳离子)的表面区域与DNA结合[13-15]。PWWP区域后面包括3个电荷区域(CR1、CR2、CR3)、核定位信号(nuclear localization signal,NLS)、AT-hook DNA结合基序的串联拷贝(ATH)区域,上述结构域对染色质活性位点的识别至关重要[16-17]。靶抗原的羧基端(C端)包含一个高度保守的结构域,为HIV整合酶结合区域(integrase binding domain,IBD),可促进HIV DNA整合到转录活性的染色质中。IBD为靶抗原主要的免疫原性区域,是结合抗DFS70抗体的抗原表位。
1.3 靶抗原功能
DFS70靶抗原的N端主要与DNA结合,C端作为转录激活区域,具有保护细胞免受环境应激的潜在作用,对促进细胞存活、转录调控、炎症通路及肿瘤的细胞信号转导等具有重要的作用[18- 21]。DFS70靶抗原产生自身免疫应答的确切机制仍未明确,但研究发现DFS70在细胞凋亡过程中产生的片段(主要是IBD区域),可能在炎症条件下促发机体的自身免疫反应机制,从而产生相应的自身抗体[18]。IBD参与HIV与宿主染色质的整合和复制[21],通过对敲除DFS70表达的缺失细胞研究,证明了DFS70在HIV整合中发挥关键作用,特别是IBD区域。通过RNA干扰(siRNA)技术,短暂和稳定的IBD抑制作用导致HIV载量的显著减少[22- 23]。DFS70在前列腺、结肠、乳腺、甲状腺等肿瘤患者中的表达明显增加[18],如前列腺癌中DFS70的异位过度表达与特异性应激、抗氧化蛋白的上调及抵抗非凋亡细胞死亡等有关[24- 26]。DFS70也可促进肿瘤形成,如细胞增殖、细胞迁移、细胞侵袭、血管生长、DNA修复及化疗耐药性等[27- 29]。另外,研究表明DFS70在正常细胞分化中发挥作用,可能通过组蛋白修饰来维持特定细胞中的染色质处在正常转录状态[30]。
上述DFS70靶抗原的结构特点及功能,对致密细斑点型ANA、抗DFS70抗体的各种免疫学检测方法的设计、选择及临床意义具有一定的相关性(图1)[31]。
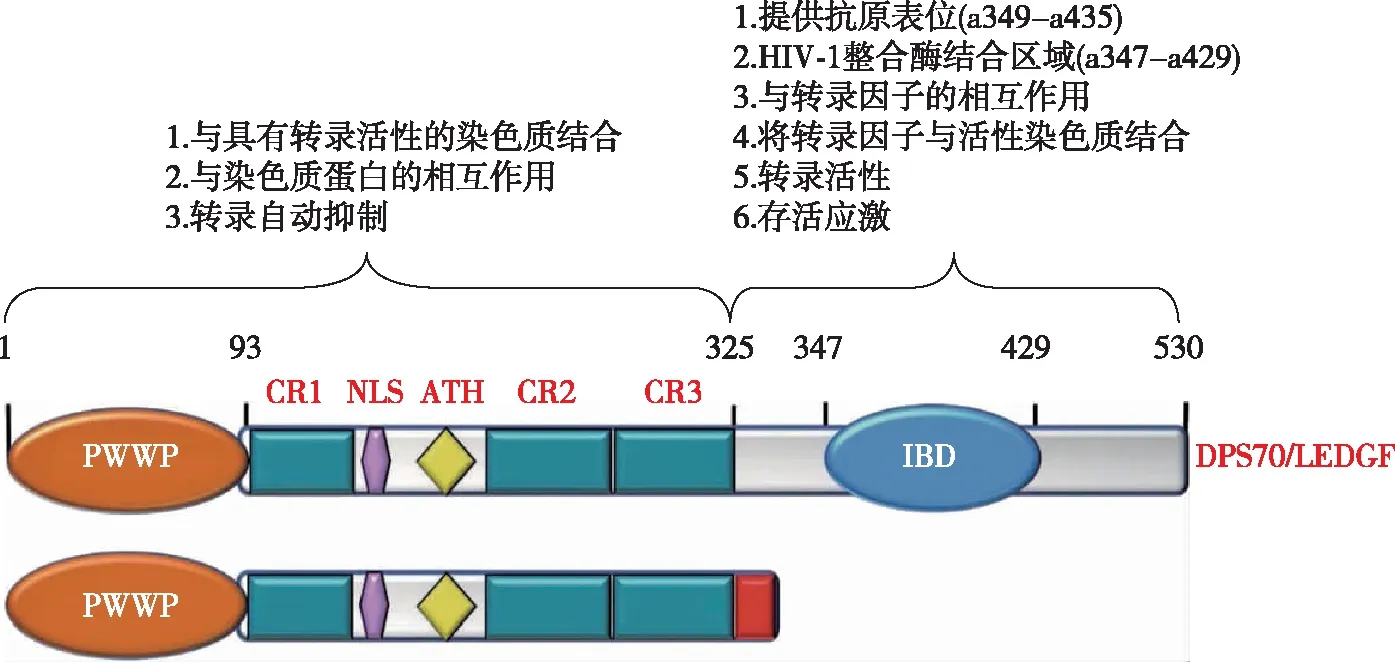
图1 DFS70/p52靶抗原的结构域和功能[31]
2 致密细斑点型ANA及其特异性自身抗体(抗DFS70抗体)临床检测
2.1 间接免疫荧光法(IIF)检测致密细斑点型ANA
目前,对于ANA的实验室检测,主要采用以HEp- 2细胞为实验基质的间接免疫荧光法(IIF)。由于此检测技术具有诸多优点,因此被国内外的专业学会推荐为ANA检测的“金标准”、“参考方法”、“首选方法”[32- 35]。ANA-IIF荧光模型作为ANA检测结果的重要参数,通常根据靶抗原在实验基质中的分布,呈现形态各异的荧光模型。其特征性的荧光模型与ANA特异性自身抗体存在一定的相关性,荧光模型结果对进行下一步特异性抗体的检测具有一定的指导意义,且与AID具有一定的临床相关性。
ANA常见的荧光模式(核斑点型、核均质型、核仁型等)已被广泛接受和研究,而近年国外研究报道的致密细斑点型(DFS),已被ANA荧光模型国际共识(international consensus on antinuclear antibody pattern,ICAP)、国内ANA检测的临床应用专家共识列入必报的荧光模型[35- 36]。在前期的临床研究中发现典型的DFS荧光模型为[37]:(1)HEp- 2细胞:分裂间期HEp- 2细胞核呈现均匀一致的致密细斑点型的荧光染色,核仁区荧光染色与核浆类似或阴性;分裂期细胞浓缩的染色体区也呈现均匀一致的致密细斑点型荧光染色,染色体区域外荧光染色阴性。(2)肝组织冰冻切片:肝细胞核常呈现荧光染色阴性或细颗粒型荧光染色模型,荧光强度弱于HEp- 2细胞(图2a,b)。与ANA-IIF常见的细胞核均质型荧光模型鉴别要点:细胞核均质型在分裂间期HEp- 2细胞呈均质型或均质周边型荧光染色模型,肝组织冰冻切片中肝细胞核常呈现均质型荧光染色模型,荧光强度与HEp- 2细胞荧光强度基本一致;与ANA-IIF常见的典型的细胞核斑点型荧光模型鉴别要点:典型的细胞核斑点型在分裂期HEp- 2细胞的浓缩染色体荧光染色阴性(图2c,d)。
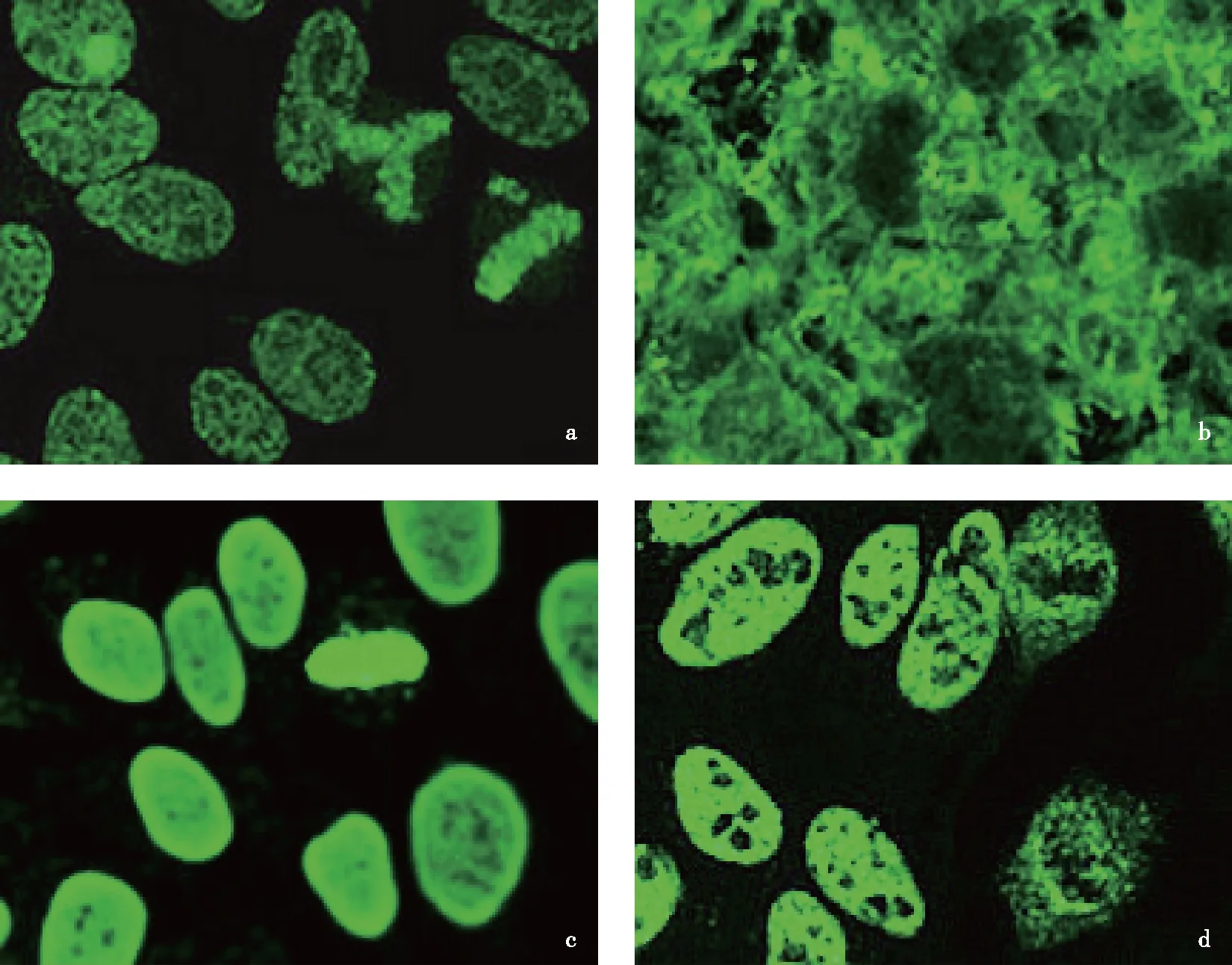
图2 致密细斑点型、核均质型、核斑点型免疫荧光染色图(×400)
对于DFS的正确判读,在一项国际调查中,参与者对经典的ANA荧光模型识别的准确率较高(74.4%~95.2%),而对单独的DFS识别的准确率明显偏低(约50%),对于ANA混合型中的DFS识别的准确率不到10%[38]。因此,在临床实践中如何正确判读DFS 仍是一个重大挑战,开展其特异性自身抗体(抗DFS70抗体)的临床检测显得尤为重要。
2.2 免疫学方法检测抗DFS70抗体
抗DFS70抗体的检测包括多种免疫学方法[39- 43],如改良的IIF、酶联免疫吸附试验(ELISA)、斑点免疫印迹法(DIA)、线性免疫印迹法(LIA)、化学发光法(CLIA)等。在改良IIF中,可使用靶抗原(DFS70)与待检测血清标本进行免疫吸附,根据吸附前后HEp- 2细胞上呈现DFS荧光模型的变化,判断抗DFS70抗体的存在与否[40- 41]。另一种改良IIF对HEp- 2细胞中表达DFS70的基因进行敲除,通过野生型、基因敲除的HEp- 2细胞(1∶9混合)作为IIF检测ANA的实验室基质,通过不同细胞呈现的DFS差别,以判断抗DFS70抗体。对于上述两种改良IIF检测抗DFS70抗体,由于采用不同的实验基质、检测方法及针对不同的抗原表位等,检测结果相关性较低(kappa=0.22)[44]。另外,根据DFS70靶抗原的不同氨基酸序列设计的ELISA、LIA、CLIA等,临床研究显示具有不同的临床诊断效能、方法学特点[45]。如ELISA具有高敏感性、定量,但适合于集中批量检测的特点。LIA具有高敏感性、易操作、自动化及随机组合的特点,但其检测结果为半定量。CLIA具有高敏感性、高特异性、定量及自动化的特点,已广泛应用于自身抗体的临床检测。因此,筛选出针对特异性抗原表位、高敏感性、高特异性、简单快速及易自动化的抗DFS70抗体检测方法,具有重要的临床意义。
2.3 致密细斑点型ANA及其特异性自身抗体(抗DFS70抗体)检测策略
在ANA检测的临床应用专家共识中,建议在ANA的临床检测策略中可先用IIF进行ANA检测,若结果为阳性,需进一步进行ANA针对靶抗原的特异性自身抗体检测,为疾病确诊提供依据[35]。同样,对于致密细斑点型ANA及其特异性自身抗体(抗DFS70抗体)的检测策略,可先用IIF进行DFS的检测,阳性后进一步采用各种免疫学方法进行抗DFS70抗体的检测。但由于DFS的正确判读仍存在诸多困难,另外其他特异性自身抗体也会呈现DFS的荧光模型。因此,对于采用临床专家共识中的检测策略,或IIF检测DFS联合各种免疫学方法检测抗DFS70抗体的策略,仍存在争议,需要进行深入的临床研究[46- 47]。
3 致密细斑点型ANA及其特异性自身抗体(抗DFS70抗体)的临床意义
致密细斑点型ANA及其特异性自身抗体(抗DFS70抗体)最初发现于间质性膀胱炎[4],随后报道见于炎症性疾病、恶性肿瘤、自身免疫病及健康人群等[48]。
课题组在前期的临床研究中,对临床就诊患者中的DFS阳性检出率,以及DFS阳性的AID患者中的相关临床信息和实验室特征进行分析[37]。发现DFS在ANA常规检测标本中的阳性率为1.81%,在ANA阳性者中的阳性率为8.79%。男、女性别者在不同年龄组间的DFS阳性率差异均有统计学意义(P<0.01),以≥50岁组的DFS阳性率为最高。ANA阳性检出率以风湿免疫科就诊患者为最高,但DFS阳性主要见于感染科、皮肤科、神经科、肾内科等就诊患者。DFS阳性者包括AID患者(16.53%)和非AID患者(83.47%)。其中系统性AID中以类风湿关节炎患者构成比最高(29.27%),器官特异性AID中以自身免疫性甲状腺炎患者构成比最高(31.71%)。DFS阳性滴度1∶100在非AID患者中的阳性率高于AID者(P<0.05),DFS阳性滴度1∶320则在AID患者中的阳性率高于非AID者(P<0.05)。DFS阳性的AID患者存在不同的临床表现,而实验室以抗核抗体谱(ANAs)中的15项特异性抗体均阴性为主要特征,对于DFS阳性者需进一步检测其特异性的抗DFS70抗体。而在国内的其他研究报道中,DFS在ANA阳性者中的阳性率分别为2.31%[46]、1.69%[49]、1.27%[50],且抗DFS70抗体阳性者在成人自然流产(28.0%)、幼年型特发性关节炎(22.5%)患者中多见。近期的一项国内大样本分析中显示,DFS占ANA阳性者的3.10%[51],DFS阳性者与皮肤病、脱发、不明原因的血栓和产科并发症相关。另外,在日本的研究报道中,抗DFS70抗体在健康人群的阳性率为16.4%,在系统性红斑狼疮(SLE)、混合结缔组织病(MCTD)、系统性硬化症(SSc)、多发性肌炎/皮肌炎(PM/DM)、干燥综合征(SS)、类风湿关节炎(RA)的阳性率分别为22.1%、14.3%、14.3%、3.0%、21.3%、18.1%,AID(除PM/DM以外)与健康人群的抗DFS70抗体阳性率差异无统计学意义[11]。但单独抗DFS70抗体在健康人群的阳性率高于上述AID(除RA以外)[11]。
在健康人群中,对不同种族和地理区域的7个国家的献血者中的抗DFS70抗体进行分析,抗DFS70抗体的阳性率为1.2%~8.2%,以年轻女性者中为多见[52]。且对40例抗DFS70抗体阳性的健康者随访4年,3例抗DFS70抗体阳性的健康儿童随访3年,均无随访者进展为系统性AID[53- 54]。在SLE的国际队列研究中,抗DFS70抗体的阳性率为7.1%,并与肌肉骨骼的活动性、抗β2糖蛋白Ⅰ抗体有关,但单独抗DFS70抗体的阳性率仅为1.1%[55]。在一项对PLN和肾病理性活动的研究中发现,经活检证实的LN患者中抗DFS70抗体的阳性率(19.6%)与NLN-SLE患者 (19.8%)相当,但显著高于CKD患者(13.4%)和健康者(9.0%),且抗DFS70抗体与抗dsDNA抗体滴度相关,这表明抗DFS70抗体在LN患者中可能不具有保护作用,但可能具有作为反映LN亚类和病理活性的非组织学生物标志物的潜在作用[56]。在其他AID的临床研究中,SS患者中的抗DFS70抗体阳性率为9.7%,但对于不同的检测方法具有不同的阳性检出率[47]。在27例抗DFS70抗体阳性的SS患者中,21例合并抗SSA抗体阳性,单独的抗DFS70抗体阳性率仅为1.0%。在SSc患者中的抗DFS70抗体阳性率为1.5%,通常合并SSc相关自身抗体,单独抗DFS70抗体未见。PM/DM患者中的抗DFS70抗体阳性率为3.5%,通常合并肌炎特异性自身抗体,单独抗DFS70抗体阳性率为0.9%。有文献报道抗DFS70抗体可能与DM的预后相关,在抗DFS70抗体合并抗MDA5抗体的3例DM患者中,1例死亡患者的抗DFS70抗体滴度下降,但确切的相关性未明。UCTD患者的抗DFS70抗体阳性率为8%~40%,在一项单中心的91例UCTD患者中,使用CLIA、LIA检测抗DFS70抗体,阳性者以年轻者多见,但与抗ENA抗体、抗dsDNA抗体无相关性。另外,抗DFS70抗体在UCTD患者中的临床特征未见差异。抗DFS70抗体阳性能否作为UCTD患者进展为系统性AID的潜在生物学标志物,仍有待进一步深入研究。
另外,抗DFS70抗体可见于特应性皮炎、慢性疲劳综合征、纤维肌痛、视网膜变性、白内障及肿瘤等患者[48,57]。如在ANA阳性的前列腺癌患者DFS的阳性率为14%,抗DFS70抗体的阳性率为18.4%[57]。而在其他肿瘤患者(如乳腺癌、结直肠癌、肺癌、白血病、淋巴瘤)DFS的阳性率为1.8%(6/334)[58]。
总之,临床研究初步明确单独的抗DFS70抗体阳性可作为系统性AID的排除指标,但由于DFS、抗DFS70抗体可存在于多种疾病中,不同研究报道仍存在不同的研究结论,确切的临床相关性仍有待深入研究。
