多囊卵巢综合征患者卵巢间质血流变化及其与胰岛素抵抗、VEGF、ES的相关性
2022-12-05李淑清
李淑清,聂 莉
多囊卵巢综合征 (polycystic ovary syndrome,PCOS)是育龄期女性常见的代谢紊乱和生殖障碍并存的妇科疾病,约5%~10%的育龄期女性罹患该病[1,2]。PCOS主要临床特征为内分泌紊乱、糖脂代谢紊乱、胰岛素抵抗(insulin resistance,IR)、生殖功能障碍、高雄激素血症等,远期还可缓慢发展为2型糖尿病、心脑血管疾病等[3],影响患者的生育健康和身体健康。近年的研究发现,PCOS患者多存在卵巢血管生成异常,同时卵巢间质血流显著增加[4],而血管生成失调可能是这个病理变化的重要机制[5]。血管内皮生长因子(vascular endothelial growth factor,VEGF)是调节血管生成的因子,可促进血管新生,增加血管通透性[6]。内皮抑素(endostatin,ES)是对VEGF具有抑制作用的小分子蛋白,可抑制血管内皮的增殖和新生血管的形成[7]。IR是PCOS重要的生理病理因素,在PCOS患者中普遍存在[8,9],研究表明PCOS患者IR对卵巢间质异常血管形成有一定关系[10],但VEGF、ES、IR与PCOS患者卵巢间质血流变化的相关性尚不得而知。笔者对148例PCOS患者进行VEGF、ES和稳态模型的胰岛素抵抗指数(homeostasis model assessmentinsulin resistance index,HOMA-IR)检测,并应用彩色多普勒超声检测卵巢间质血流变化,分析各指标的相关性,探讨PCOS患者VEGF、ES和IR卵巢间质血流变化的影响。
1 资料与方法
1.1 临床资料
选择2018年6月至2021年6月在深圳市前海蛇口自贸区医院收治的PCOS女性患者148例(疾病组),年龄22~35岁,平均年龄28.98岁(标准差5.41岁);体质量指数19.89~29.30 kg/m2,平均体质量指数25.03 kg/m2(标准差3.96 kg/m2)。
疾病组选择标准:①符合鹿特丹国际会议制定PCOS诊断标准[11];②年龄18~35岁;③入组前12周内未应用可能影响VEGF、ES血液含量的药物;④签署知情同意书。
另外选择同期在医院就诊的由于男方因素所致不孕的健康女性82例(对照组),年龄21~35岁,平均年龄29.33岁(标准差5.12岁);体质量指数20.09~29.12 kg/m2,平均体质量指数24.76 kg/m2(标准差4.05 kg/m2)。
对照组选择标准:①年龄18~35岁;②无PCOS相关临床表现;③有规律的月经周期;④内分泌激素水平正常;⑤超声检查显示两侧卵巢大小、形态正常;⑥签署知情同意书。
两组排除标准:①合并全身任一器官、系统的严重炎症;②合并其他内分泌系统疾病、恶性肿瘤、血液病及神经、精神系统疾病;③入组前12周内曾应用激素类药物;④心肝肾功能异常。
1.2 方法
1.2.1 超声检查
所有患者均接受经阴道超声检查,仪器应用美国GE Voluson E10数字化彩色多普勒超声诊断仪,探头频率4~9 MHz。患者仰卧于检查床,探头外套避孕套后插入阴道,观察子宫、卵巢形态,应用多普勒血流显像模式检测卵巢间质血流,记录两侧卵巢动脉搏动指数(pulsatility index,PI)和阻力指数(resistance index,RI)。所有患者的超声检查均由同一位具有主治医师资格以上的超声影像医师完成,每1例患者均检测3次,取均值,并计算两侧卵巢动脉PI、RI。
1.2.2实验室检查
患者月经周期第2天~第4天清晨抽取空腹静脉血,如PCOS患者闭经时间>2个月,且超声检查无优势卵泡,可直接采集清晨空腹静脉血。将所得标本以3 000 r/min转速离心10 min,离心半径为7 cm,室温下静置60 min,收集血清置于-70℃冰箱内待测。电化学发光法测定血清促卵泡刺激素(follicle stimulating hormone,FSH)、黄体生成素(luteinizing hormone,LH)、雌 二 醇(estradiol,E2)、睾 酮(total testosterone,T)、空腹胰岛素水平;葡萄糖氧化酶法测定空腹血糖水平,计算HOMA-IR,HOMA-IR=(空腹血糖×空腹胰岛素)/22.5。应用酶联免疫吸附分析法测定血清VEGF、ES水平。上述检测过程均严格按照试剂盒说明书进行。
1.2.3 观察指标
比 较 疾 病 组 和 对 照 组 血 清FSH、LH、E2、T、VEGF、ES水平及HOMA-IR、PI、RI,并比较IR组、非胰岛素抵抗(non-insulin resistance,NIR)组上述指标,分析PCOS患者卵巢动脉PI、RI与其他指标的相关性。
1.2.4 分组
疾病组患者按照HOMA-IR大小分为IR组(HOMA-IR≥2.69)和NIR组(HOMA-IR<2.69)。
1.3 统计学方法
应用SPSS 23.0软件分析统计数据。计量资料符合正态分布,以均数±标准差表示,组间比较应用t检验,各指标的相关性应用Pearson相关分析。P<0.05为差异有统计学意义。
2 结果
2.1 分组情况
根据HOMA-IR大小,将疾病组患者分为IR组72例,NIR组76例。
2.2 各组性激素水平比较
疾病组血清FSH、E2水平低于对照组 (P<0.05),LH、T水平均高于对照组(P<0.05),差异均有统计学意义;IR组血清T水平高于NIR组,差异有统计学意义(P<0.05)。见表1。
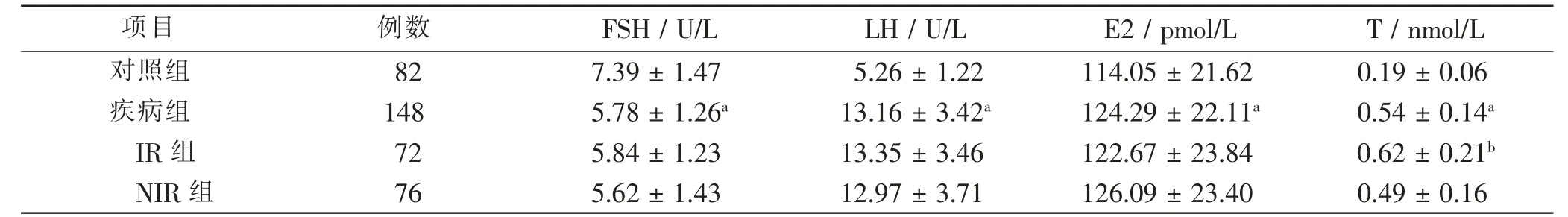
表1 各组性激素水平比较Tab.1 Comparison of gonadal hormone levels in each groups
2.3 各组超声检查指标比较
疾病组卵巢体积、卵泡体积大于对照组(P<0.05),卵泡个数多于对照组(P<0.05)(图1),PI、RI均低于对照组(P<0.05)。IR组卵巢体积、卵泡体积大于NIR组(P<0.05),PI、RI均低于NIR组,差异均有统计学意义(P<0.05)。见表2。

表2 各组超声检查指标比较Tab.2 Comparison of ultrasonic examination indexes in each groups
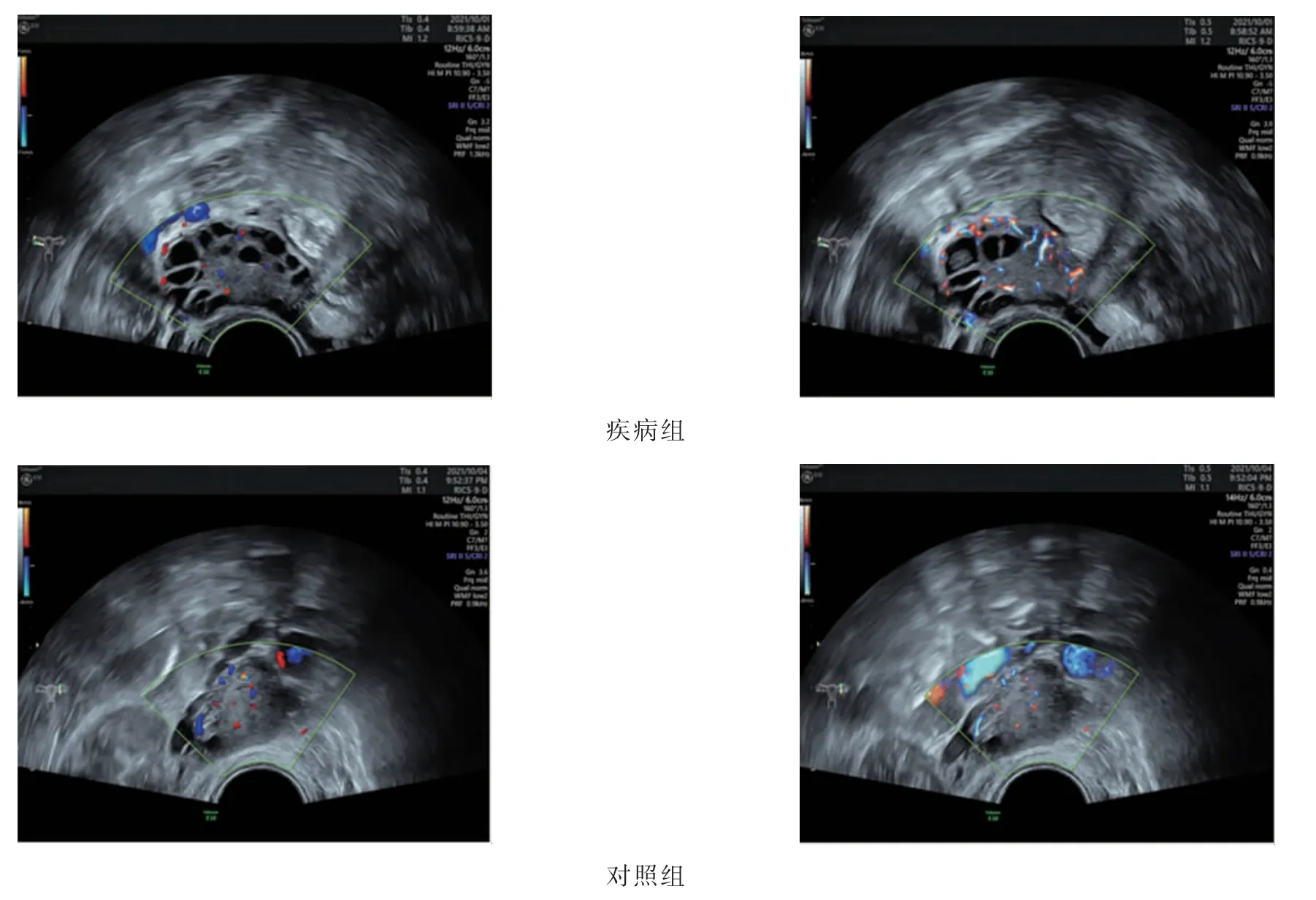
图1 两组卵巢间质血流超声声像图Fig.1 Ultrasound images of ovarian stroma in 2 groups
2.4 各组血清VEGF、ES水平及HOMA-IR比较
疾病组血清VEGF、ES水平及HOMA-IR均高于对照组(P<0.05);而IR组血清VEGF、ES水平及HOMA-IR均高于NIR组,差异均有统计学意义(P<0.05)。见表3。
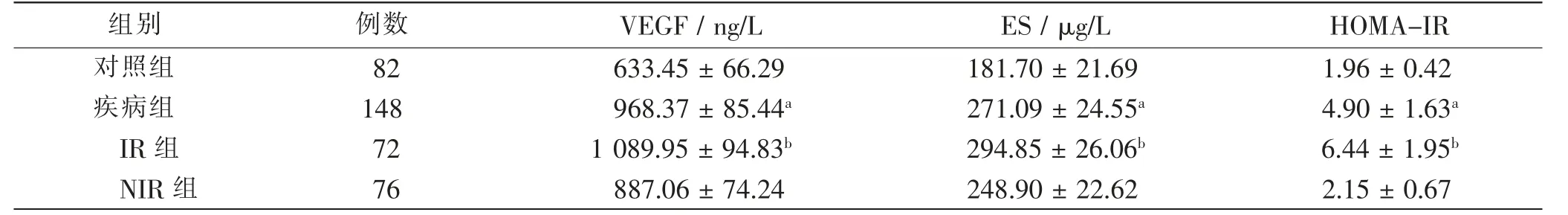
表3 各组血清VEGF、ES水平及HOMA-IR比较Tab.3 Comparison of serum VEGF,ES and HOMA-IR in each groups
2.5 PCOS患者PI、RI与其他指标的相关性
相关性分析显示,PCOS患者卵巢间质血流PI、RI与VEGF、ES、HOMA-IR均呈负相关(P<0.05)。见表4。
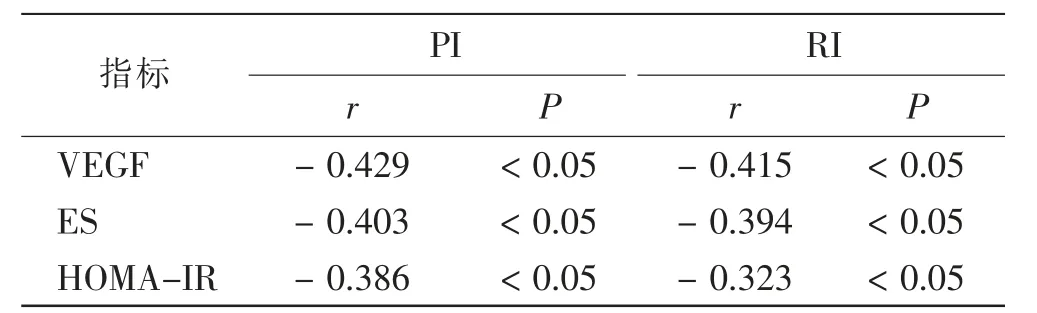
表4 PCOS患者PI、RI与其他指标的相关性Tab.4 Correlation between PI,RI and other indexes in PCOS patients
3 讨论
PCOS主要为代谢异常和生殖内分泌障碍,FSH和LH的异常分泌抑制卵泡的发育,出现月经稀发等临床表现,进而导致PCOS的发生[12]。性激素水平异常使卵巢的敏感性降低,进而对排卵产生影响,大量LH刺激卵泡膜细胞增生,血液中雄激素含量增加,促进了PCOS病理改变的进一步发展。李雪松等[13]研究发现,内分泌紊乱是PCOS发生的重要因素,控制内分泌激素指标有利于提高治疗效果。
笔者研究结果显示,疾病组血清FSH水平低于对照组,LH、T、E2水平均高于对照组,也进一步证实激素水平紊乱在PCOS发病中的重要作用。阴道超声是PCOS常用的检查方法,不仅可准确测量子宫内膜、卵巢体积、卵泡体积,还可精确计数卵泡数量。笔者研究发现疾病组患者卵巢体积、卵泡体积较大,卵泡数较多,与许莉等[14]的研究结果一致。其原因可能为高雄激素水平的长期刺激下,PCOS患者卵巢间质血管扩张,血液供应量增加,促进卵巢间质细胞的增殖,卵巢和卵泡体积相应增大。PI、RI是反映动脉血流阻力和动力学参数指标,数值越低表明血流越丰富,笔者研究发现疾病组PI、RI值均低于对照组,进一步表明PCOS患者卵巢间质血液供应量更多,与王静等[4]的研究结果一致。
卵巢间质内血管异常生成与血液灌注量密切相关,而多种细胞因子参与了血管的异常生成。VEGF是功能最强大的促血管生成因子,作为内皮细胞的有丝分裂原,VEGF可通过酪氨酸激酶受体诱导血管内皮细胞增殖、分裂,进而形成管状结构,促进血管新生[15]。有研究认为女性生殖系统VEGF不仅可维持卵泡周围血流,还可使毛细血管通透性增加,有利于血浆蛋白向外渗出,进而导致卵巢基质增大,影响卵泡的发育和成熟[16]。ES为血管生成抑制因子,可抑制血管内皮细胞增殖,促进血管内皮细胞凋亡,抑制血管内皮细胞迁移和新生血管形成[17]。笔者研究结果显示,疾病组血清VEGF、ES水平均高于对照组,与陈凤英等[18]研究结果一致,表明VEGF、ES的异常分泌在PCOS病理进展中具有重要作用,PCOS患者卵巢组织通过增加VEGF的合成和分泌以促进新生血管形成,同时机体会增加ES的合成以拮抗VEGF的促血管生成作用,这种代偿机制导致了卵巢微环境的紊乱,加重了PCOS病情进展。笔者研究发现疾病组卵巢间质血流PI、RI与VEGF、ES均呈负相关,表明VEGF、ES均参与了PCOS患者卵巢间质血流动力学改变,VEGF促进血管生成和修复,增加卵巢间质内新生血管数量,从而降低卵巢间质动脉血流PI、RI,而VEGF的大量生成也刺激机体不断合成ES,以抑制新生血管的快速增加。
PCOS患者多存在着IR,笔者研究发现IR组T水平高于NIR组,卵巢体积、卵泡体积大于NIR组,PI、RI均低于NIR组,表明IR与PCOS的代谢紊乱和卵巢间质血流的异常灌注密切相关。有报道显示PCOS卵巢间质血流变化与体内高胰岛素水平和高雄激素水平有关,IR加重了机体代谢紊乱,也加重了卵巢间质血流的异常灌注[19]。笔者研究还发现PCOS患者卵巢间质血流PI、RI与HOMA-IR呈负相关,进一步表明PCOS卵巢间质血流异常灌注与机体IR状态密切相关。胰岛素可刺激血管内皮细胞的活动,促进内皮素、VEGF的合成和分泌,使肾素-血管紧张素-醛固酮系统过度活跃,激素、细胞因子合成异常,VEGF、ES的合成增加,进而增加了卵巢间质血流灌注[20]。国外有研究发现对PCOS大鼠进行二甲双胍治疗后,随着大鼠体内胰岛素含量的降低,VEGF、卵巢间质血管密度也明显下降,血流量也明显减少,表明IR在PCOS血管因子异常表达及卵巢间质异常血流灌注存在着密切的关系。
综上所述,PCOS患者存在着卵巢间质血流异常灌注,血液中VEGF、ES表达失衡及IR可能是卵巢间质血流动力学改变的重要因素。PCOS患者卵巢间质血流动力学指标的变化可能受到多种因素的影响,进一步的研究中应充分排除其他因素的干扰,以证实笔者研究所得结论的正确性。
