腹炎消通过调控Notch2/Hes-1通路对重症胰腺炎大鼠急性肺损伤的影响
2022-12-05陈玉梅王丽华
陈玉梅, 杨 静, 苏 淼, 董 梁, 王丽华
(衡水市人民医院消化内科,河北 衡水 053000)
重症急性胰腺炎是一种严重的胰腺炎性疾病,可以从胰腺的局部损伤发展为全身性炎症反应综合征和多器官功能障碍综合征[1]。急性肺损伤是重症急性胰腺炎最严重的并发症之一,可导致急性呼吸窘迫综合征的发展并导致高死亡率[2]。目前,重症急性胰腺炎相关急性肺损伤的主要治疗方法是药物治疗,但治疗药物有限,效果不令人满意,故开发新的有效治疗药物至关重要。根据重症急性胰腺炎的发病部位及临床特点,中医将其归属于“脾心痛”“胰瘅”范畴,其基本病机为腑气不通,瘀毒内蕴[3]。中医药治疗急性胰腺炎是我国临床特色,不少中药方剂及其提取物具有治疗重症急性胰腺炎,并减轻与其相关急性肺损伤的功效[4-5]。腹炎消由大黄、连翘、蒲公英、银花、厚朴、炒莱菔子、桃仁、红花、败酱草等组成,具有通里攻下、清热解毒、行气消积、消肿散痈的功效,但其对重症急性胰腺炎及其并发症急性肺损伤是否具有保护作用尚不清楚。因此,本研究通过建立重症急性胰腺炎大鼠模型,观察腹炎消对其并发症急性肺损伤的影响并初步探讨其机制,为重症急性胰腺炎及其并发症的治疗提供理论依据。
1 材料
1.1 动物 SPF级SD大鼠76只,雄性,体质量(220±20)g,购自河北伊维沃生物科技有限公司,实验动物生产许可证SCXK(冀)2020-002。饲养环境为相对湿度45%~55%,温度(20±2)℃,12 h/12 h光照/黑暗,自由获取食物和水。本研究中涉及活体动物的所有实验程序均经衡水市人民医院伦理委员会批准,并严格遵守《实验动物的护理和使用指南》的指导原则进行。
1.2 药物制备 腹炎消由蒲公英30 g,银花30 g,厚朴12 g,炒莱菔子30 g,桃仁12 g,连翘12 g,薏苡仁30 g,甘草6 g,败酱草30 g,元胡15 g,白芍15 g,姜半夏10 g,黄芩15 g,柴胡15 g,生大黄15 g(后下)组成,上述药材经衡水市人民医院赵卫国主任中医师鉴定为正品,加入8倍量的水充分浸泡30 min,煎煮40 min,过滤药液,药渣再加入6倍量的水继续煎煮40 min,过滤药液,合并2次药液,煎煮浓缩至1 mL,相当于生药2 g/mL。
1.3 试剂 3.5%牛磺胆酸钠、DAPT(γ-分泌酶抑制剂,可抑制Notch信号通路)(货号T7515、D5942)购自美国Sigma-Aldrich公司;HE染色试剂、RIPA裂解液、BCA试剂盒(货号C0105、P0013B、P0010)均购自上海碧云天生物技术有限公司;大鼠白介素-6(interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、细胞间黏附分子-1(intercellular adhesion molecule-1,ICAM-1)ELISA检测试剂盒(货号RA20607、RA20035、RA20614)均购自武汉贝茵莱生物科技有限公司;淀粉酶(amylase,AMY)检测试剂盒(货号C016-1-1)购自南京建成生物工程研究所;RT-qPCR引物由上海吉玛制药技术有限公司设计和合成;兔源一抗Hes家族BHLH转录因子1(Hes family BHLH transcription factor 1,Hes-1)、Notch2、β-actin、HRP标记的山羊抗兔IgG(H+L)(货号PA5-28802、PA5-87455、MA5-32479、65-6120)均购自美国Thermo Fisher Scientific公司。
1.4 仪器 ABL90 FLEX血气分析仪(丹麦Radiometer公司);iMark680多功能酶标仪、蛋白转膜装置(美国Bio-Rad公司);BX51电动显微镜(日本Olympus公司)。
2 方法
2.1 模型建立 大鼠适应性饲养1周后,随机选取12只作为假手术组,其余64只采用3.5%牛磺胆酸钠诱导重症急性胰腺炎[6-7]。大鼠术前禁食12 h,不禁水,用2%戊巴比妥钠(40 mg/kg)腹腔注射麻醉后,暴露腹腔,在腹部切开1个切口,将胰十二指肠分离到十二指肠内侧后,用金属夹夹住胰胆管,将4.5号针逆行刺进距十二指肠壁2 mm的胰胆管,然后用无创金属夹夹住十二指肠侧的胰管,使用微量输液泵将3.5%牛磺胆酸钠逆行注射入胰胆管(1 mL/kg,6 mL/h)诱导大鼠重症急性胰腺炎,观察大鼠胰腺变化,当确认胰腺囊膜下出现明显水肿和出血时,则说明造模成功;假手术组大鼠以相同的方式注射等量生理盐水。术后缝合大鼠腹部,未成功造模大鼠有4只,模型建立成功率为93.75%。
2.2 分组及给药 将造模成功的60只大鼠随机分为模型组,DAPT组,腹炎消低、高剂量组,腹炎消+DAPT组,每组12只。术后12 h,DAPT组大鼠腹腔注射5 mg/kg DAPT(溶于生理盐水)[8],腹炎消低、高剂量组大鼠灌胃给予17.8、35.6 g/kg腹炎消水煎液(相当于临床剂量1、2倍),腹炎消+DAPT组大鼠腹腔注射5 mg/kg DAPT 30 min后,灌胃给予35.6 g/kg腹炎消水煎液,24 h后到达实验终点。
2.3 大鼠肺功能检测 大鼠麻醉后腹主动脉取血,立即使用血气分析仪测定动脉血中氧分压(PaO2)和二氧化碳分压(PaCO2),计算氧合指数(PaO2/FiO2)。本实验大鼠吸入空气(氧气体积分数21%),故吸入氧气浓度(FiO2)为0.21。
2.4 血清AMY活性检测 全血1 500 r/min离心10 min,分离得到血清,按照试剂盒说明书,采用碘-淀粉比色法检测血清AMY活性。
2.5 肺组织湿/干质量比检测 取大鼠右肺中叶,生理盐水冲洗残留血迹后,滤纸吸干表面水分,称定质量,获得肺湿质量,然后将肺组织在60 ℃下烘烤48 h后称定质量,获得干质量,计算湿/干质量比。
2.6 ELISA法检测肺组织炎性因子水平 将剩余右肺组织,以1∶9比例加入预冷生理盐水,制备10%组织匀浆,研磨后离心取上清液,按照ELISA试剂盒说明书检测匀浆液中TNF-α、IL-6、ICAM-1水平。
2.7 HE染色观察胰腺、肺组织病理学变化 取出大鼠胰腺和肺组织,将左侧肺组织分为两部分,一部分放入冻存管中,液氮速冻后,移至-80 ℃冰箱保存,另一部分肺组织和胰腺组织于4%多聚甲醛中固定,石蜡包埋,切片。组织切片经二甲苯脱蜡、梯度乙醇脱水后,进行苏木精-伊红(HE)染色,光学显微镜下观察胰腺和肺组织的病理学变化。肺组织病理评分标准为(1)肺泡腔内是否有出血、充血;(2)肺泡壁或者血管壁中是否有炎性细胞聚集;(3)肺泡壁是否有明显增厚,上述每一项按照损伤的严重程度分为0分,无以上病理损伤;1分,局部有轻微损伤;2分,有中等损伤且局部显著;3分,有严重且广泛的损伤。胰腺组织病理评分标准见表1。

表1 胰腺组织病理评分标准
2.8 免疫组化法检测肺组织Notch2、Hes-1蛋白表达 取“2.7”项下石蜡切片,使用微波在柠檬酸钠缓冲液中进行抗原修复,3% H2O2封闭非特异性抗体结合位点,滴加一抗Notch2、Hes-1(1∶200)于4 ℃孵育过夜,洗去一抗后与HRP标记的山羊抗兔IgG于37 ℃孵育1 h,DAB显色,苏木精复染细胞核,在显微镜下观察和拍照。棕黄色或棕褐色沉积为阳性表达,使用Image-Pro Plus 6.0软件进行光密度(OD)值分析,每张切片选择3个不同区域,结果取平均值。
2.9 RT-qPCR法检测肺组织Notch2、Hes-1 mRNA表达 取-80 ℃冰箱保存的肺组织,使用TRIzol试剂提取总RNA,分光光度计测定总RNA浓度,使用PrimeScriptTMRT试剂盒将RNA反转录为互补DNA(cDNA),根据扩增试剂盒的说明,进行RT-qPCR反应。反应体系为Premix Ex TaqTM(2×)10 μL、正反向引物各0.8 μL,cDNA(200 ng/μL)2 μL,ddH2O 6.4 μL。反应条件为95 ℃预变性1 min;95 ℃变性18 s,60 ℃退火55 s,72 ℃延伸2 min,共40个循环。实验重复3次。采用2-ΔΔCT法,β-actin为内参,计算Notch2、Hes-1 mRNA相对表达。引物序列见表2。

表2 引物序列
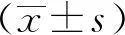
3 结果
3.1 腹炎消对重症急性胰腺炎大鼠肺功能的影响 与假手术组比较,模型组大鼠PaO2、PaO2/FiO2降低(P<0.05),PaCO2升高(P<0.05);与模型组比较,DAPT组和腹炎消各剂量组大鼠PaO2、PaO2/FiO2升高(P<0.05),PaCO2降低(P<0.05);与DAPT组和腹炎消高剂量组比较,腹炎消+DAPT组PaO2、PaO2/FiO2升高(P<0.05),PaCO2降低(P<0.05),见表3。
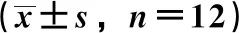
表3 腹炎消对大鼠肺功能的影响
3.2 腹炎消对重症急性胰腺炎大鼠血清AMY活性和肺组织湿/干质量比的影响 与假手术组比较,模型组大鼠血清AMY活性、肺组织湿/干质量比升高(P<0.05);与模型组比较,DAPT组和腹炎消各剂量组大鼠血清AMY活性、肺组织湿/干质量比降低(P<0.05);与DAPT组和腹炎消高剂量组比较,腹炎消+DAPT组大鼠血清AMY活性、肺组织湿/干质量比降低(P<0.05),见表4。
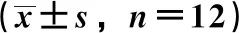
表4 腹炎消对大鼠血清AMY活性和肺组织湿/干质量比的影响
3.3 腹炎消对重症急性胰腺炎大鼠肺组织TNF-α、IL-6、ICAM-1水平的影响 与假手术组比较,模型组大鼠肺组织匀浆液中TNF-α、IL-6、ICAM-1水平升高(P<0.05);与模型组比较,DAPT组和腹炎消各剂量组大鼠肺组织TNF-α、IL-6、ICAM-1水平降低(P<0.05);与DAPT组和腹炎消高剂量组比较,腹炎消+DAPT组大鼠肺组织TNF-α、IL-6、ICAM-1水平降低(P<0.05),见表5。
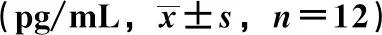
表5 腹炎消对大鼠肺组织TNF-α、IL-6、ICAM-1水平的影响
3.4 腹炎消对重症急性胰腺炎大鼠胰腺、肺组织病理学变化的影响 假手术组大鼠胰腺和肺组织没有明显的病理形态学变化;模型组大鼠胰腺组织细胞坏死、胞质空泡、水肿严重、炎性细胞浸润,肺组织有炎性细胞浸润,出血,肺泡间隔增厚,与假手术组比较,胰腺和肺组织损伤病理评分增加(P<0.05);与模型组比较,DAPT组和腹炎消各剂量组大鼠胰腺和肺组织上述病理损伤减轻,炎性细胞浸润减少,胰腺和肺组织损伤病理评分降低(P<0.05);与DAPT组和腹炎消高剂量组比较,腹炎消+DAPT组大鼠胰腺和肺组织上述病理损伤进一步减轻,胰腺和肺组织损伤病理评分降低(P<0.05),见图1、表6。
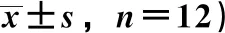
表6 腹炎消对大鼠胰腺和肺组织病理评分的影响(分,
3.5 腹炎消对重症急性胰腺炎大鼠肺组织Notch2、Hes-1蛋白表达的影响 与假手术组比较,模型组大鼠肺组织Notch2、Hes-1蛋白表达升高(P<0.05);与模型组比较,DAPT组和腹炎消各剂量组大鼠肺组织Notch2、Hes-1蛋白表达降低(P<0.05);与DAPT组和腹炎消高剂量组比较,腹炎消+DAPT组大鼠肺组织Notch2、Hes-1蛋白表达降低(P<0.05),见图2、表7。
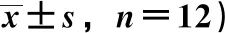
表7 腹炎消对大鼠肺组织Notch2、Hes-1蛋白表达的影响(OD值,
3.6 腹炎消对重症急性胰腺炎大鼠肺组织Notch2、Hes-1 mRNA表达的影响 与假手术组比较,模型组大鼠肺组织Notch2、Hes-1 mRNA表达升高(P<0.05);与模型组比较,DAPT组和腹炎消低、高剂量组大鼠肺组织Notch2、Hes-1 mRNA表达降低(P<0.05);与DAPT组和腹炎消高剂量组比较,腹炎消+DAPT组大鼠肺组织Notch2 mRNA和Hes-1 mRNA表达降低(P<0.05),见表8。
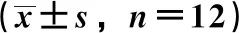
表8 腹炎消对重症急性胰腺炎大鼠肺组织Notch2、Hes-1 mRNA表达的影响
4 讨论
近年来研究证明,中医药治疗重症急性胰腺炎可改善患者症状,减少并发症,防止复发[9-10]。祖国医学认为重症急性胰腺炎应以“益气养阴、清热解毒、活血化瘀、通里攻下”为主要治则。腹炎消方中生大黄、连翘、蒲公英、银花有清热解毒、消肿散结、荡涤肠胃的功效,且大黄可促进肺泡巨噬细胞凋亡,抑制炎症因子分泌,减轻重症急性胰腺炎大鼠肺部炎症[11];大黄素可抑制NLRP3炎性小体活化,并抑制肺组织中NF-κB核积累,保护大鼠免受重症急性胰腺炎相关肺损伤[12-13]。厚朴、炒莱菔子可行气消积、消食除胀、降逆平喘;厚朴酚能减轻重症急性胰腺炎大鼠急性肺损伤[5]。桃仁、红花可活血祛瘀、活血通经、散瘀止痛,也是治疗重症急性胰腺炎方剂中的常用中药[14];桃仁提取物对急性胰腺炎大鼠肠道屏障功能具有保护作用[15]。薏苡仁清热利湿、排脓消肿,败酱草清热解毒、消痈排脓、祛瘀止痛,何俊余等[16]发现在大承气汤的基础上加薏苡仁、败酱草治疗急性胰腺炎,契合其邪实热盛、腑气不通、热毒炽盛、血败肉腐以致成痈的病机。因此,腹炎消可能是减轻与重症急性胰腺炎相关急性肺损伤的有效方剂。
TNF-α、IL-6是重症急性胰腺炎严重程度和预后评估的早期指标[13];ICAM-1在重症急性胰腺炎相关急性肺损伤中表达升高,是预测严重病程的良好标志物,并且TNF-α与ICAM-1在急性肺损伤的病程中可相互促进[17-18];血清AMY活性是诊断急性胰腺炎的重要指标[19]。在本研究中,重症急性胰腺炎模型大鼠PaO2、PaO2/FiO2降低,PaCO2,血清AMY活性,肺组织湿/干质量比,肺组织TNF-α、IL-6、ICAM-1水平升高,说明模型大鼠肺功能受损,肺组织出现严重炎症反应。经腹炎消干预后,大鼠的血氧状态明显改善,血清AMY活性、肺组织湿/干质量比和肺组织炎性因子水平降低,且胰腺和肺组织水肿、炎性细胞浸润和出血等病理损伤减轻,提示腹炎消可降低肺部炎症反应,改善重症急性胰腺炎大鼠肺功能。
Notch/Hes通路调控炎症细胞的凋亡,Notch2广泛表达于血管内皮细胞、肺泡上皮细胞和间质成纤维细胞,参与早期肺部发育[20];Hes-1是Notch2的效应子,在肢体缺血/再灌注诱发肺损伤后Notch2被激活,位于下游的Hes-1上调,刺激炎性细胞因子释放,导致肺损伤[21]。有研究发现,在重症急性胰腺炎早期肺组织中Notch/Hes1通路被激活,可导致下游IL-6、TNF-α上调,与急性肺损伤的进展密切相关[22]。Notch2的敲低对肺组织具有保护作用,DAPT可通过抑制Notch通路减轻LPS诱导的小鼠急性肺损伤[23-24]。本研究结果显示,DAPT和腹炎消干预均可降低重症急性胰腺炎大鼠肺组织Notch2和Hes-1表达,且两者联合应用后,Notch2和Hes-1表达较单独使用降低,说明腹炎消可抑制Notch2/Hes-1通路的激活。
综上所述,腹炎消可降低大鼠肺部炎症,改善与重症急性胰腺炎相关的急性肺损伤,其机制可能与抑制Notch2/Hes-1通路的激活有关。
