QuEChERS结合GC-MS/MS法同时测定陈皮中215种农药残留
2022-12-04马桂娟王紫昕吴龙国
张 瑶, 高 琳, 马桂娟, 王紫昕, 吴龙国
(1.宁夏食品检测研究院,宁夏 银川 750021;2.宁夏大学农学院,宁夏 银川 750021)
陈皮为芸香科植物橘及其栽培变种的成熟果皮[1-2],具有理气健脾、燥湿化痰的功效,是国内市场需求量较大的常用药材[3]。柑橘作为陈皮的原产植株,因其易患疮痂病、炭疽病、黄龙病等,需要喷洒苯醚甲环唑、戊唑醇、肟菌酯等农药[4],但由于大量农药喷洒集中于果皮,导致陈皮质量存在较大安全隐患[5-7],故建立陈皮中多种农药残留的快速检测方法以促进其产业发展是有必要的。目前,虽然柑橘果肉中农药残留检测已有报道,但鲜有涉及陈皮。
与高效液相色谱技术[8-14]比较,色谱-质谱联用技术具有高通量、灵敏度高、可同时准确定性定量的优势,是多农药残留应用最广泛的检测技术[15-16]。另外,基于中药材药效成分多、基质复杂、不易净化的特点,耿昭等[17]采用QuEChERS样品的前处理法,并优化净化填料,成本低廉,操作简便,可对陈皮中多种农药残留进行检测。因此,本实验建立QuEChERS结合气相色谱串联质谱(GC-MS/MS)法同时测定陈皮中215种农药残留,可为建立相关快速筛查与定量检测技术提供支撑。
1 材料
215种农药对照品分别购自上海安普科技有限公司、农业部环境保护科研检测所,乙腈制成质量浓度均为10 μg/mL的溶液,置于-18 ℃冰箱中保存。GCMS-TQ8040质谱仪(日本Shimadzu公司);HP-5MS色谱柱(30 m×0.25 mm,0.25 μm,美国Agilent公司);3K15台式高速冷冻离心机(美国Sigma公司);Milli-Q Direct纯水化仪(美国Millipore公司)。乙腈(美国赛默飞公司);无水MgSO4、无水乙酸钠、氯化钠、柠檬酸氢二钠盐(国药集团化学试剂有限公司);N-丙基乙二胺吸附剂PSA、石墨化炭黑GCB(天津博纳艾杰尔科技有限公司);水为Milli-Q超纯水。
2 方法
2.1 样品提取 药材粉碎后过3号筛,称取2 g,置于50 mL离心管中,加入10 mL水,涡旋混匀以使药材充分浸润,静置30 min,加入1%乙酸-乙腈15 mL,涡旋30 s,加入5.0 g无水MgSO4与无水乙酸钠的混合粉末(4∶1)、1.0 g氯化钠、0.5 g柠檬酸氢二钠、1颗陶瓷均质子,立即摇散,2 500 r/min振荡5 min,在-18 ℃下放置10 min,8 000 r/min离心5 min,取8 mL上清液待净化。
2.2 样品净化 将“2.1”项下上清液转移至含800 mg MgSO4、150 mg PSA、15 mg GCB的15 mLQuEChERS净化管中,2 500 r/min振荡5 min,8 000 r/min离心5 min,取上清,过0.22 μm有机膜。
2.3 色谱条件 HP-5MS色谱柱(30 m×0.25 mm,0.25 μm);程序升温(初始温度40 ℃,保持1 min,40 ℃/min升至120 ℃,5 ℃/min升至240 ℃,12 ℃/min升至300 ℃,保持6 min);进样量1 μL,不分流;体积流量1.2 mL/min;进样口温度240 ℃。
2.4 质谱条件 电子电离源,电子能量70 eV;离子源温度280 ℃;多反应监测模式;碰撞气氩气;溶剂延迟时间2.5 min。
3 结果
3.1 仪器条件确定 选择温度上限高、含5%苯基-甲基聚硅氧烷的高性能通用弱极性色谱柱,其应用范围广,柱流失较低[18];通过SCAN模式扫描及NIST谱库查询,确定215种农药对照品的保留时间,通过对定性定量离子的确定及碰撞电压的优化后[19],建立MRM模式,每种农药选择定量、定性离子各1对,按照保留时间顺序进行进样[20],具体检测参数见表1,总离子流图见图1。
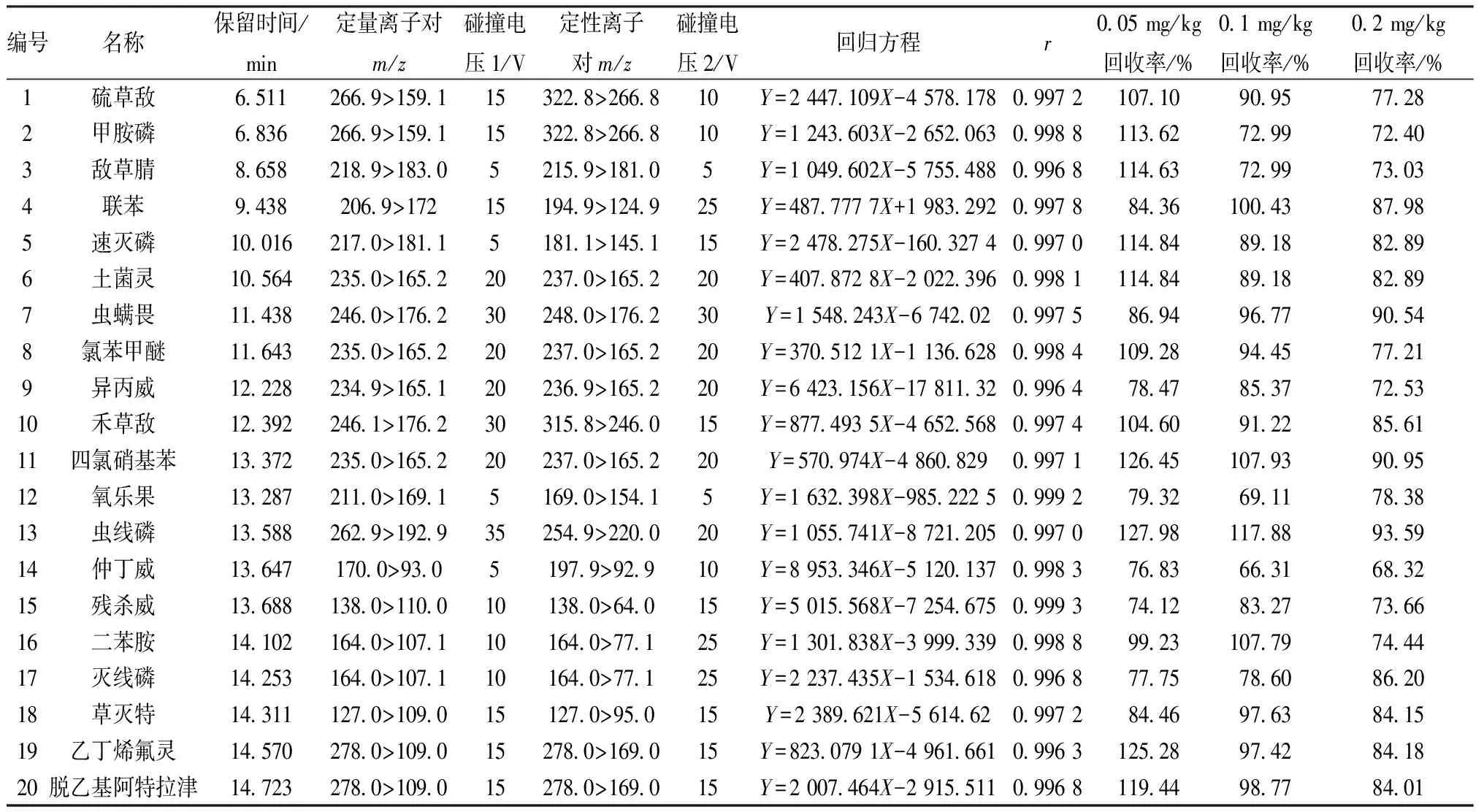
表1 215种农药检测参数、线性关系、加样回收率试验结果
3.2 样品前处理条件优化
3.2.1 提取溶剂 由于农药含有机磷、有机氯、氨基甲酸酯类、拟除虫菊酯类、三唑类、三嗪类、酰胺类、苯氧羧酸类化合物,故选择合适的提取试剂以确保检测过程回收率尤为重要。常用的提取试剂有正己烷、丙酮、二氯甲烷、乙腈等[21-23],其中正己烷极性较弱,不能完全提取陈皮组织中的农药残留;丙酮能与水互溶,极性较强,但同时也会将陈皮组织中色素、脂肪大量提取出来,对后期净化带来干扰;二氯甲烷在提取有机磷农药时效果显著,但对其他类型农药的提取效率较低;陈皮组织中含有挥发油、果胶、多糖等,而乙腈溶解性好,挥发性低,可有效去除脂肪和色素,渗透力强,适合提取的农药极性范围广,对大多数农药的提取效率高[24],但陈皮含水量较低,若直接加入该溶剂会导致提取效率较低,故在提取前加入水,使部分水溶性农药及多糖、色素浸出以提高提取效率[25]。另外,QuEChERS提取包最佳使用环境为弱酸性,而且挥发性酸的加入在一定程度上可促进农药化合物的离子化,防止对酸碱较为敏感的农药产生降解[26],使部分农药化合物的峰形得到改善,故添加1%乙酸。
3.2.2 提取温度 由于QuEChERS净化管含有MgSO4,在提取过程中会放出大量的热量,部分化合物受热易分解[27],使MgSO4、氯化钠等结成块状,故加入陶瓷均质子,将结块的提取体系打散以促进均匀提取。另外,样品在-18 ℃冰箱中放置10 min后再进行提取,可使降温速率更快,从而节省实验时间。
3.2.3 净化填料 选择不同填料和配比的QuEChERS净化管(A为800 mg MgSO4,150 mg PSA,15 mg GCB;B为800 mg MgSO4,300 mg PSA,50 mg GCB;C为800 mg MgSO4,400 mg PSA,100 mg GCB),对215种农药提取液进行净化处理,通过回收率确定最佳净化方案,结果见图2。由此可知,A中绝大多数化合物的回收率范围为80%~120%,B中回收率小于60%的化合物占所测化合物比例为10.18%,而C中占12.04%,其中甲胺磷、敌草腈、六氯苯等回收率均在50%以下,回收率高于120%的化合物占所测化合物比例分别为1.85%、0.46%。由于PSA用于去除样品中的极性有机酸和糖类,GCB主要去除色素[28],在萃取极性化合物净化效果较C18更好更稳定[29],故选择A对样品进行处理。
3.3 方法学考察
3.3.1 基质效应 215种农药中仅有1.8%存在基质抑制,17.7%基质效应不明显,80.5%具有基质增强效应,为减少基质效应对定量准确度的影响,采用基质匹配标法配制标准曲线。
3.3.2 线性关系考察 取空白基质样品2 g,经净化后取上清液1.0 mL,在氮吹仪上40 ℃浓缩至近干,分别加入标准工作液200、150、100、50、20、10、5 μL,乙腈定容至1 mL,摇匀,滤过,在“2.3”“2.4”项条件下进样测定。以农药峰面积为纵坐标(Y),质量浓度为横坐标(X)进行回归,结果见表1,可知各农药在各自范围内线性关系良好。以信噪比(S/N)大于3为检出限,测得其范围为0.13~22.79 μg/kg。
3.3.3 加样回收率试验 选取3个水平(0.05、0.1、0.2 mg/kg),在“2.3”“2.4”项条件下进样测定,计算回收率,结果见表1。
3.4 农药残留测定 共检出12种农药,其中毒死蜱检出率最高,为41.7%,并且检出量也最高,为0.316 mg/kg;苯醚甲环唑、戊唑醇检出率为33.3%,最高检出量分别为0.029、0.682 mg/kg;丙溴磷检出率为25%,最高检出量为0.125 mg/kg;哒螨灵、苯硫威、三氯杀螨醇、甲拌磷砜、水胺硫磷、三唑磷、氰戊菊酯、甲基对硫磷检出率均低于20%,检出量均较低。
4 结论
本实验建立QuEChERS结合GC-MS/MS法同时测定陈皮中215种农药残留,并对提取试剂、提取温度进行优化,该方法具有简便经济快速、高灵敏度、高通量等优点,可实现大批量该药材中多农药残留的检测,也适用于其相关快速筛查与定量检测。
