口腔癌和口咽癌病人治疗相关味觉障碍的研究进展
2022-12-02唐涵尚磊
唐涵,尚磊
·科研综述·
口腔癌和口咽癌病人治疗相关味觉障碍的研究进展
唐涵1,2,尚磊1*
1.空军军医大学卫生统计学教研室,陕西 710032;2.空军军医大学护理系
对不同治疗方式引发的味觉障碍、味觉障碍的评估方法、味觉障碍的管理策略进行综述,以期为今后口腔癌和口咽癌病人治疗相关味觉障碍的管理提供参考。
口腔癌;口咽癌;味觉障碍;护理;综述
头颈癌是全球最常见的恶性肿瘤之一,90%以上的头颈癌为口腔癌和口咽鳞状细胞癌,其恶性程度较高[1]。已有研究显示,口腔癌及口咽癌发病呈低龄化趋势,其易发生颈淋巴结转移和人乳头瘤病毒感染等,需要多种治疗方式配合[2]。当前,口腔癌和口咽癌的治疗主要基于外科技术和辅助治疗[3]。由于与味觉功能相关的黏膜、肌肉、神经、唾液腺等都集中在口腔和咽部,手术、放疗等抗肿瘤治疗均会直接或间接破坏味蕾和味觉神经通路,改变病人味觉,影响病人味觉感知和功能[4]。味觉改变又称味觉障碍[5],其包括味觉缺失、减退、不良、倒错和幻味觉等[6]。治疗相关味觉障碍会使口腔癌和口咽癌病人的进食体验和食物感知改变,发生吞咽困难和营养状况恶化,对病人生活质量产生负面影响[7]。现对不同治疗方式引发的味觉障碍、味觉障碍的评估方法、味觉障碍的管理策略进行综述,以期为今后口腔癌和口咽癌病人治疗相关味觉障碍的管理提供参考。
1 不同治疗方式引发的味觉障碍
1.1外科治疗手术切除是治疗口腔癌和口咽癌的有效治疗方法。Tomita等[8]的研究显示,50%接受部分或次全舌切除术的口咽癌病人存在味觉障碍,其味觉阈值显著高于非肿瘤病人。可能与手术和肿瘤均会破坏包围味蕾的口腔黏膜,阻止味觉传递有关[1]。切除范围和重建方式会影响味觉障碍严重程度、术后味觉恢复能力等。研究显示,50%以下的舌根切除与更好的味觉功能和更低的检测阈值有关[8]。此外,针对手术导致的味觉障碍,皮瓣重建可以更好地保留味觉[9]。在重建方式方面,与无游离皮瓣重建相比,游离皮瓣在提高口腔癌病人味觉评分中的效果更好[10]。关于游离皮瓣的类型,在口咽癌病人中,大腿前外侧穿支游离皮瓣(ALTFF)和前臂桡侧游离皮瓣(RFFF)重建后的病人味觉障碍差异不明显,是否使用微血管游离皮瓣治疗的口腔癌病人间也未发现显著差异[11]。Elfring等[12]表示,尽管对口咽癌病人味觉进行了重建,但与未受影响一侧相比,重建一侧舌部味觉敏感性显著降低,味觉测试结果并不乐观,表明皮瓣重建在恢复味觉功能方面效果有限。
1.2放疗放疗对口腔癌和口咽癌病人的味觉影响十分显著。Sapir等[13]的研究显示,放疗开始前,病人将潜在的味觉障碍列为最不重要的副作用,放疗结束和随访期间,味觉障碍成为影响病人生活质量的主要问题。这可能与放疗会直接损伤基底和分化味觉细胞有关[1]。在发生率方面,已有研究显示,放疗前后分别有40%和88%的病人会出现味觉障碍,且70%接受放疗的口腔癌病人会出现长期的客观味觉障碍[13⁃14]。在发生时间和持续时间方面,Asif等[15]的研究显示,味觉障碍通常发生在放疗后3~4周内,可在放疗后3~12个月内恢复。40%的病人报告称,中度味觉改变从放疗第2周开始,重度味觉障碍从放疗第3周开始,在放疗第5周症状发生率和严重程度达到峰值[16]。一些味觉障碍病人甚至在结束放疗几年后仍不能完全康复。已有研究表明,辅助放疗后6~12个月的口腔癌[17]和口咽癌[18]病人味觉功能比基线测量时明显恶化,这种恶化可能是放疗的后遗症,而不是疾病进展所致。此外,放疗方法、口腔辐射剂量不同也可能影响味觉障碍的发生,如适形和调强放疗似乎比传统放疗更能有效降低辐射剂量,使唾液腺避免高剂量辐射,在不影响控制效果的情况下减少毒性[1]。Sapir等[13]发现,味觉障碍与平均口腔辐射剂量显著相关,在放疗开始后1个月,味觉障碍严重程度由轻度转为重度;3个月后,口腔辐射剂量下降,味觉障碍症状逐渐改善。
1.3化疗多项研究表明,味觉障碍多为化疗后的早期症状[6,19⁃20]。化疗药物会导致味觉细胞增殖和修复受损,使唾液分泌细胞毒性物质,还会使鼓索神经异常致敏并导致味觉感受变化,而无须刺激味觉受体[14]。46%~77%接受过化疗的口腔癌和口咽癌病人会出现味觉障碍,味觉障碍也是化疗后最严重的副作用之一[21]。也有研究显示,多数病人于化疗后4~7 d味觉改变程度最严重,在下次化疗前逐渐缓解,且9.7%~78.0%的化疗病人口腔中会出现金属味[22]。化疗所致的严重味觉障碍会进一步导致口腔癌和口咽癌病人出现营养相关症状、饮食行为改变,从而降低病人抵抗力和治疗依从性,增加病人心理负担和负面情绪,最终影响病人短期和长期生活质量[23]。
1.4多模态治疗(multimodality therapy)为了达到精准、高效的治疗目标,抗肿瘤治疗已由单一的治疗方法转化为多种优势方法相结合的多模态治疗。早期口腔癌和口咽癌病人多采用手术加放疗的方式,而已发生颈部淋巴结转移的中晚期病人,多接受颈淋巴清扫术结合放疗和/或化疗[1]。多模态治疗相关的味觉障碍可能是由受体细胞周转减少、受体细胞和神经元间缺乏连接以及神经元损伤等多种原因导致[14]。Nicolatou⁃Galitis等[24]表示,味觉障碍是接受术后放疗加化疗的口腔癌病人报告的最重要症状之一。据估计,约76%接受放疗加化疗的头颈癌病人出现了味觉障碍。在放疗加化疗的第4周~第8周,病人味觉功能似乎明显恶化,在治疗第8周达到峰值。此外,病人报告的主观味觉症状与所接受的治疗类型、累积辐射剂量和吸烟状态有关[25]。术后接受过放疗加化疗的吸烟者,味觉障碍发生率比非吸烟者高64%,味觉障碍严重程度高91%[14]。可见,多模态治疗会显著影响口腔癌和口咽癌病人的味觉敏锐度。
总之,不同治疗方式引起口腔癌和口咽癌病人味觉障碍发生率、持续时间、影响因素等的情况可能不同,护士需要根据病人治疗特点以及味觉障碍表现等,为其提供特异性的味觉障碍评估工具以及针对性的管理策略,并联合肿瘤医生与病人进行信息互动和共享,从而在保障抗肿瘤治疗效果的基础上,最大限度地减轻病人治疗副作用,提升病人感官功能,优化病人生活质量。
2 味觉障碍的评估方法
2.1客观评估目前常使用的口腔癌和口咽癌病人味觉障碍客观评估方法为化学味觉测定法[14,26⁃27]和电味觉测定法。化学味觉测定法是通过纸条或水溶液向病人提供不同浓度的物质,以便对味道进行定性和定量分析,评估病人敏感性损失的类型及其强度,其常用物质为感知甜味的蔗糖、咸味的氯化钠、酸味的柠檬酸、苦味的硫酸奎宁或咖啡因。对于鲜味香精,通常使用味精和肌苷一磷酸⁃3的组合。电味觉测定法是通过对味觉感受器的电刺激,确定产生味觉所需的电密度,电密度越大表示味觉阈值越高。客观评估法虽然可以获取病人味觉障碍的定量数据,但需要经过培训的专业技术人员花费较多时间实施,且味觉改变是一种主观感受,不同病人会感知到不同的症状和体验,因此,与客观评估方法相比,基于病人自我报告的主观评估工具更适合成为判断味觉障碍的评价标准。
2.2主观评估
2.2.1单条目在口腔癌和口咽癌病人中最常使用的味觉障碍评估单条目为常用不良事件评价标准4.0版(the Common Terminology Criteria for Adverse Events Version 4.0,CTCAE v4.0)中的味觉障碍程度条目[28⁃29],详见表1。
2.2.2头颈癌特异性生活质量和症状评估量表头颈癌特异性生活质量和症状评估量表中涉及的评估治疗相关味觉障碍的工具包括华盛顿大学生存质量问卷(University of Washington Quality of Life Questionnaire,UW⁃QOL)、欧洲癌症研究与治疗组织生命质量量表⁃头颈部模块(European Organization for Research and Treatment of Cancer Quality of Life Questionnaire Head & Neck Cancer Module,EORTC QLQ⁃H & N35)、范德堡症状调查量表版本2.0(Vanderbilt Head and Neck Symptom Survey Version 2.0,VHNSS 2.0)、口腔健康影响程度量表(Oral Health Impact Profile⁃14,OHIP⁃14)[30],详见表1。
2.2.3多条目评估工具有学者开发了味觉主观评估量表,常见的为味觉和嗅觉调查表(Taste and Smell Survey,TSS)[31]和味觉改变调查表(Taste Change Survey,TCS)[32],其已在口腔癌和口咽癌病人[33⁃34]中进行了验证。此外,还有针对头颈癌病人的味觉量表(Taste Questionnaire,TQ)[35]、化学感觉量表(ChemoSensory Questionnaire,CSQ)[36]、标准化问卷(Standardized Questionnaire,SQ)[37]等,但其研究数量较少,需扩大验证范围。各多条目评估工具信息详见表1。
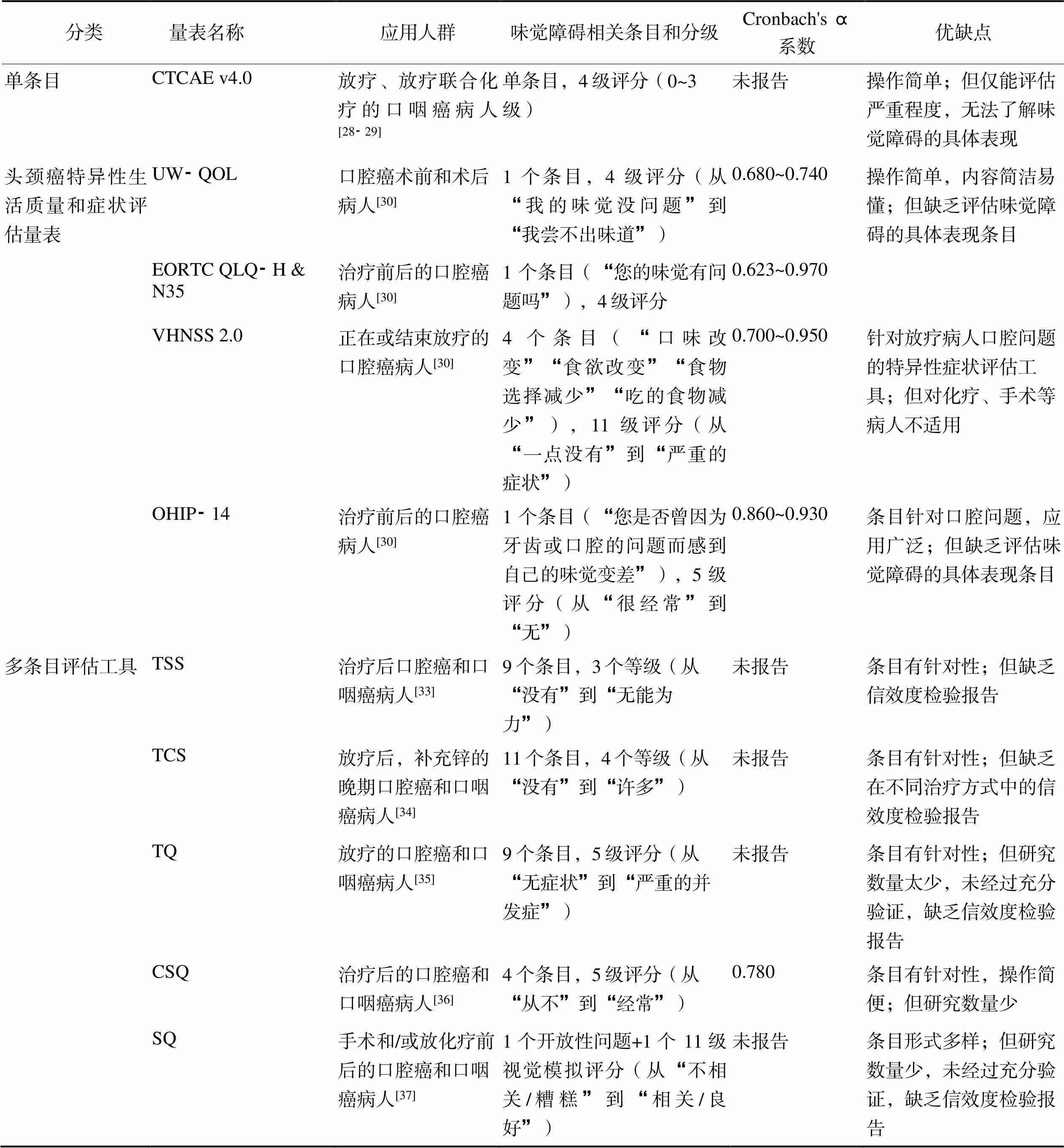
表1 口腔癌和口咽癌病人治疗相关味觉障碍主观评估量表
3 味觉障碍的管理策略
3.1预防策略硒和氨磷汀等射线保护剂可用于预防口腔癌和口咽癌病人治疗相关味觉障碍的发生。硒是负责细胞抗氧化的必要辅助因子。在一项随机对照试验中,干预组对要接受放疗的22例病人预防性给予硒,结果显示,与未补充硒的病人相比,其呈现出轻度的味觉下降趋势[38]。Büntzel等[39]在研究中检测了氨磷汀对接受治疗的头颈癌病人的保护作用,放化疗前服用氨磷汀的病人与单纯接受放化疗的病人相比,黏膜炎、口干症和味觉丧失主观感受减轻。但氨磷汀具有恶心、呕吐和低血压等副作用。
3.2支持策略
3.2.1支持性唾液替代品口干症是口腔癌和口咽癌病人治疗相关味觉障碍的重要表现之一。Apperley等[40]在一项针对40例放疗后患有口干症的头颈癌病人的随机对照研究中比较了不同人造唾液成分产品对病人味觉的主观影响,并测量静息和咀嚼时的唾液流量,结果显示,两种唾液替代品均能减缓病人口干,并报告病人味觉障碍有所改善。Lam⁃Ubol等[41]研究表明,可食用人工唾液凝胶改善放疗后口腔癌和口咽癌病人的口干症状,改善唾液pH值,减少念珠菌感染。
3.2.2口腔护理口腔黏膜炎是病人头部放疗的常见不良反应之一,辐射诱发的口腔黏膜炎可导致味觉障碍、疼痛并影响治疗结果[42],高质量的口腔护理有利于提高病人味觉敏锐度。Wilhelm⁃Buchstab等[43]将接受放疗的头颈癌病人随机分为3组,分别为接受常规口腔护理组、常规口腔护理加右泛醇漱口液组、常规口腔护理加右泛醇漱口液加牙科水射流系统组,由放射肿瘤学家根据CTCAE v4.0对味觉变化进行评估,结果显示各组均出现味觉下降,但常规口腔护理加右泛醇漱口液加牙科水射流系统组的味觉障碍延迟。还有研究者评估了蜂蜜柠檬喷雾剂[44]、姜黄素[45]、盐酸苄达明漱口水[44]等对口腔癌和口咽癌病人味觉和口腔黏膜炎的改善作用,但由于样本量、人群特征异质性等,结论尚不统一。
3.2.3主动吞咽训练Carnaby⁃Mann等[46]开创的高强度吞咽疗法也称咽运动,其在20例放化疗后头颈部癌症病人中进行效果验证,6周后使用味觉功能试剂盒评估病人味觉障碍程度,结果表明,咽运动组出现味觉障碍的病人少于常规护理组,说明吞咽训练或可改善头颈癌病人的味觉功能。
3.2.4营养干预多项研究评估了营养干预对味觉障碍的影响,但由于异质性较大,结论尚需进一步验证。Hopanci Bicakli等[47]对59例接受放疗的I~Ⅳ期口腔癌和口咽癌病人进行研究,评估营养咨询加口服膳食补充剂对身体成分的影响,由于病人味觉障碍较严重,因此干预依从性不高。
3.2.5自我照护口腔癌和口咽癌病人定期向医生报告其味觉障碍症状有利于医生及时调整治疗方案。病人也应实施自我照护策略[4,48],如食用冷或温的食物和水果、选择风味温和的蛋白质产品、减少苦或酸或金属味食物的摄入、多喝水、避免摄入强烈气味的食物等。
3.3治疗策略
3.3.1光生物调节疗法Mobadder等[49]的研究中,1例42岁男性病人接受头部放疗时接受光生物调节疗法,基线测量发现,病人对5种味道存在味觉障碍,之后每24 h进行1次调节疗法,连续5 d,休息48 h后再重复,治疗结束时,病人能够识别所有味道。Morais等[50]对接受单独放疗或联合化疗的头颈癌病人进行前瞻性研究,结果发现病人接受光生物调节治疗期间味觉仍在恶化,但由于缺乏对照组,故其研究无法确定接受光生物调节治疗改善味觉障碍的效果。
3.3.2锌和聚普瑞锌多项研究致力于研究补充锌对减轻口腔癌和口咽癌病人味觉改变的效果,但其研究结果不一致[51⁃52]。有研究者开展了针对多种癌症类型并伴有嗅觉障碍病人的回顾性研究[53]以及针对放化疗头颈癌病人的前瞻性试验[54],干预组病人每日接受聚普瑞锌治疗,对照组每天使用标准漱口液,通过CTCAE v4.0评估,结果显示,聚普瑞锌组嗅觉障碍中位持续时间为63 d,对照组为112 d[53],且研究显示聚普瑞锌显著降低了病人黏膜炎和继发性疼痛[54]、口干和味觉障碍发生率[53]。
虽然目前口腔癌和口咽癌病人味觉障碍的管理策略较多,但高质量研究数量较少、样本量较小、缺乏前瞻性和多中心研究、研究开展的文化背景存在差异,且研究结果推广性不足。我国缺乏口腔癌和口咽癌味觉障碍管理策略的实验性研究,护理人员可借鉴国外经验,结合我国文化背景和病人特点,制定并尝试开展有效的干预,并根据研究结果进行策略调整,从而提升护理质量,切实解决我国口腔癌和口咽癌病人味觉障碍问题。
4 小结
口腔癌和口咽癌是最常见、恶性程度较高的头颈癌之一。由于其病变集中于口腔,治疗会显著影响味觉感知和功能。外科、放疗、化疗和多模态治疗对病人味觉障碍的影响机制不同,导致味觉障碍的严重程度、持续时间和影响因素等也不同。需要根据研究目的,选择、验证或编制针对口腔癌和口咽癌病人不同治疗方式的味觉障碍主客观评估工具。还应结合病人治疗方式、营养状态、临床状况和预期结果等,提供特异性的预防、支持和治疗策略,从而减轻病人味觉障碍,优化病人食物感知和进食体验,保障能量供应,提升病人生活质量和治疗依从性。未来研究还需结合我国饮食文化和病人特点,扩大样本量,进一步探索口腔癌和口咽癌病人治疗相关味觉障碍发生的原因、影响因素和干预措施等,并制定预防、支持和治疗指南。
[1] 潘梦琪,李志勇,赵文权.ASCO指南解读:“口腔和口咽鳞状细胞癌颈部管理”[J].中国口腔颌面外科杂志,2021,19(2):177-180.
[2] 林山峰.远程监督指导模式对口腔癌及口咽癌患者术后吞咽功能及生活质量的影响研究[D].沈阳:中国医科大学,2020.
[3] PFISTER D G,SPENCER S,ADELSTEIN D,.Head and neck cancers,version 2.2020,NCCN clinical practice guidelines in oncology[J].J Natl Compr Canc Netw,2020,18(7):873-898.
[4] 王娜,谭丽双,李宇.口腔癌患者术后吞咽障碍评价与其早期预后的相关性研究[J].中国实用口腔科杂志,2021,14(1):81-84.
[5] ANDRADE C L,DANTAS J B D L,MELO A D S,.Dysgeusia in cancer patients undergoing radiotherapy:etiology,diagnosis and therapy[J].Oral Diag,2019,4:e20190013.
[6] 钱立晶,路潜.肿瘤患者化疗相关性味觉改变的研究进展[J].中华护理杂志,2016,51(5):547-550.
[7] 薛伶俐.经首次手术治疗口腔鳞状细胞癌患者生存及相关影响因素分析[D].重庆:重庆医科大学,2020.
[8] TOMITA S,TERAO Y,HATANO T,.Subtotal glossectomy preserving half the tongue base prevents taste disorder in patients with tongue cancer[J].Int J Oral Maxillofac Surg,2014,43(9):1042-1046.
[9] FANG Q G,SHI S,ZHANG X,.Assessment of the quality of life of patients with oral cancer after pectoralis major myocutaneous flap reconstruction with a focus on speech[J].J Oral Maxillofac Surg,2013,71(11):2004.e1-2004.e5.
[10] FANG Q G,SHI S,LI M J,.Free flap reconstruction versus non-free flap reconstruction in treating elderly patients with advanced oral cancer[J].J Oral Maxillofac Surg,2014,72(7):1420-1424.
[11] YUE J,ZHUO S,ZHANG H,.Long-term quality of life measured by the University of Washington QoL questionnaire(version 4) in patients with oral cancer treated with or without reconstruction with a microvascular free flap[J].Br J Oral Maxillofac Surg,2018,56(6):475-481.
[12] ELFRING T T,BOLIEK C A,SEIKALY H,.Sensory outcomes of the anterior tongue after lingual nerve repair in oropharyngeal cancer[J].J Oral Rehabil,2012,39(3):170-181.
[13] SAPIR E,TAO Y B,FENG F,.Predictors of dysgeusia in patients with oropharyngeal cancer treated with chemotherapy and intensity modulated radiation therapy[J].Int J Radiat Oncol Biol Phys,2016,96(2):354-361.
[14] EPSTEIN J B,VILLINES D,EPSTEIN G L,.Oral examination findings,taste and smell testing during and following head and neck cancer therapy[J].Support Care Cancer,2020,28(9):4305-4311.
[15] ASIF M,MOORE A,YAROM N,.The effect of radiotherapy on taste sensation in head and neck cancer patients--a prospective study[J].Radiat Oncol,2020,15(1):144.
[16] PALMIERI M,SARMENTO D J S,FALCÃO A P,.Frequency and evolution of acute oral complications in patients undergoing radiochemotherapy treatment for head and neck squamous cell carcinoma[J].Ear Nose Throat J,2021,100(5_suppl):449S-455S.
[17] AGARWAL S K,MUNJAL M,KOUL R,.Prospective evaluation of the quality of life of oral tongue cancer patients before and after the treatment[J].Ann Palliat Med,2014,3(4):238-243.
[18] NAQVI S U,ZIA S,FARRUKH M S,.Quality of life in survivors of squamous cell carcinoma of oral and oropharyngeal patients in Karachi,Pakistan[J].Rawal Medical Journal,2017,42(2):176-180.
[19] 张婷婷,张丽燕.肿瘤患者化疗相关性味觉改变干预的研究进展[J].护理学杂志,2020,35(12):99-102.
[20] 熊训雅,胡君娥,严妍.肿瘤患者化疗相关味觉改变的研究进展[J].长江大学学报(自然科学版),2019,16(6):81-84.
[21] BRAUD A,BOUCHER Y.Taste disorder's management:a systematic review[J].Clin Oral Investig,2020,24(6):1889-1908.
[22] IJPMA I,RENKEN R J,TER HORST G J ,.Metallic taste in cancer patients treated with chemotherapy[J].Cancer Treat Rev,2015,41(2):179-186.
[23] DRARENI K,BENSAFI M,GIBOREAU A,.Chemotherapy-induced taste and smell changes influence food perception in cancer patients[J].Support Care Cancer,2021,29(4):2125-2132.
[24] NICOLATOU-GALITIS O,PSYRRI A.Trismus and reduced quality of life in patients with oral squamous cell carcinoma who received postoperative radiotherapy alone or combined with chemotherapy[J].J Clin Oncol,2017,35(31_suppl):222.
[25] ABBAS S,TARIQ M,RAHEEM A,.Assessment of factors affecting quality of life in oral squamous cell carcinoma patients using University of Washington Quality of Life Questionnaire[J].Cureus,2019,11(1):e3904.
[26] CUNHA M,TERTO D S,DINIZ J,.Assessment of the gustatory function in patients with advanced oral cavity and oropharyngeal cancer[J].CoDAS,2020,32(6):e20190122.
[27] KHAN A H,SAFDAR J,SIDDIQUI S U.Efficacy of zinc sulfate on concurrent chemoradiotherapy induced taste alterations in oral cancer patients:a double blind randomized controlled trial[J].Pak J Med Sci,2019,35(3):624-629.
[28] MORONEY L B,HELIOS J,WARD E C,.Helical intensity-modulated radiotherapy with concurrent chemotherapy for oropharyngeal squamous cell carcinoma:a prospective investigation of acute swallowing and toxicity patterns[J].Head & Neck,2018,40(9):1955-1966.
[29] VEMPATI P,HALTHORE A N,TECKIE S,.Phase I trial of dose-escalated stereotactic radiosurgery(SRS) boost for unfavorable locally advanced oropharyngeal cancer[J].Radiat Oncol,2020,15(1):278.
[30] 郭倩,李丽,侯黎莉.口腔癌病人报告结局测评工具的研究进展[J].护理研究,2019,33(24):4261-4266.
[31] HEALD A E,PIEPER C F,SCHIFFMAN S S.Taste and smell complaints in HIV-infected patients[J].AIDS,1998,12(13):1667-1674.
[32] WICKHAM R S,REHWALDT M,KEFER C,.Taste changes experienced by patients receiving chemotherapy[J].Oncol Nurs Forum,1999,26(4):697-706.
[33] ALVAREZ-CAMACHO M,GONELLA S,GHOSH S,.The impact of taste and smell alterations on quality of life in head and neck cancer patients[J].Qual Life Res,2016,25(6):1495-1504.
[34] HALYARD M Y,JATOI A,SLOAN J A,.Does zinc sulfate prevent therapy-induced taste alterations in head and neck cancer patients?Results of phase Ⅲ double-blind,placebo-controlled trial from the north central cancer treatment group(N01C4)[J].Int J Radiat Oncol Biol Phys,2007,67(5):1318-1322.
[35] MAES A,HUYGH I,WELTENS C,.De Gustibus:time scale of loss and recovery of tastes caused by radiotherapy[J].Radiother Oncol,2002,63(2):195-201.
[36] GOLDBERG A N,SHEA J A,DEEMS D A,.A ChemoSensory Questionnaire for patients treated for cancer of the head and neck[J].Laryngoscope,2005,115(12):2077-2086.
[37] HEISER C,HOFAUER B,SCHERER E,.Liposomal treatment of xerostomia,odor,and taste abnormalities in patients with head and neck cancer[J].Head & Neck,2016,38(Suppl 1):E1232-E1237.
[38] BÜNTZEL J,RIESENBECK D,GLATZEL M,.Limited effects of selenium substitution in the prevention of radiation-associated toxicities.Results of a randomized study in head and neck cancer patients[J].Anticancer Res,2010,30(5):1829-1832.
[39] BÜNTZEL J,GLATZEL M,MÜCKE R,.Influence of amifostine on late radiation-toxicity in head and neck cancer--a follow-up study[J].Anticancer Res,2007,27(4A):1953-1956.
[40] APPERLEY O,MEDLICOTT N,RICH A,.A clinical trial of a novel emulsion for potential use as a saliva substitute in patients with radiation-induced xerostomia[J].J Oral Rehabil,2017,44(11):889-895.
[41] LAM-UBOL A,MATANGKASOMBUT O,TRACHOOTHAM D,.Efficacy of gel-based artificial saliva on candida colonization and saliva properties in xerostomic post-radiotherapy head and neck cancer patients:a randomized controlled trial[J].Clin Oral Investig,2021,25(4):1815-1827.
[42] 陈晨,索菲娅,贾立群.中国头颈部癌症患者行放疗后放射性口腔黏膜炎影响因素的Meta分析[J].现代肿瘤医学,2022,30(3):422-428.
[43] WILHELM-BUCHSTAB T,THELEN C,AMECKE-MÖNNIGHOFF F,.Pilot study:protective effect on mucosal tissue using dental waterjet and dexpanthenol rinsing solution during radiotherapy in head and neck tumor patients[J].Oral Cancer,2019,3(3):59-67.
[44] AMERI A,POSHTMAHI S,HEYDARIRAD G,.Effect of honey-lemon spray versus benzydamine hydrochloride spray on radiation-induced acute oral mucositis in head and neck cancer patients:a pilot,randomized,double-blind,active-controlled clinical trial[J].J Altern Complement Med,2021,27(3):255-262.
[45] DHARMAN S,MARAGATHAVALLI G,SHANMUGASUNDARAM K,.A systematic review and Meta-analysis on the efficacy of curcumin/turmeric for the prevention and amelioration of radiotherapy/radiochemotherapy induced oral mucositis in head and neck cancer patients[J].Asian Pac J Cancer Prev,2021,22(6):1671-1684.
[46] CARNABY-MANN G,CRARY M A,SCHMALFUSS I,."Pharyngocise":randomized controlled trial of preventative exercises to maintain muscle structure and swallowing function during head-and-neck chemoradiotherapy[J].Int J Radiat Oncol Biol Phys,2012,83(1):210-219.
[47] HOPANCI BICAKLI D,OZKAYA AKAGUNDUZ O,MESERI DALAK R,.The effects of compliance with nutritional counselling on body composition parameters in head and neck cancer patients under radiotherapy[J].J Nutr Metab,2017,2017:8631945.
[48] 张静,李全,杨悦.口腔癌围手术期患者营养管理的证据总结[J].中华现代护理杂志,2021,27(13):1681-1688.
[49] MOBADDER M E,FARHAT F,MOBADDER W E,.Photobiomodulation therapy in the treatment of oral mucositis,dysgeusia and oral dryness as side-effects of head and neck radiotherapy in a cancer patient:a case report[J].Dent J,2018,6(4):64.
[50] MORAIS M O,MARTINS A F L,DE JESUS A P G,.A prospective study on oral adverse effects in head and neck cancer patients submitted to a preventive oral care protocol[J].Support Care Cancer,2020,28(9):4263-4273.
[51] NAJAFIZADE N,HEMATI S,GOOKIZADE A,.Preventive effects of zinc sulfate on taste alterations in patients under irradiation for head and neck cancers:a randomized placebo-controlled trial[J].J Res Med Sci,2013,18(2):123-126.
[52] LYCKHOLM L,HEDDINGER S P,PARKER G,.A randomized,placebo controlled trial of oral zinc for chemotherapy-related taste and smell disorders[J].J Pain Palliat Care Pharmacother,2012,26(2):111-114.
[53] FUJII H,HIROSE C,ISHIHARA M,.Improvement of dysgeusia by polaprezinc,a zinc-L-carnosine,in outpatients receiving cancer chemotherapy[J].Anticancer Res,2018,38(11):6367-6373.
[54] WATANABE T,ISHIHARA M,MATSUURA K,.Polaprezinc prevents oral mucositis associated with radiochemotherapy in patients with head and neck cancer[J].Int J Cancer,2010,127(8):1984-1990.
Research progress on treatment related taste disorder of patients with oral cancer and oropharyngeal cancer
TANGHan,SHANGLei
Health Statistics Department of Air Force Medical University,Shaanxi 710032 China
oral cancer;oropharyngeal cancer;taste disorder;nursing;review
SHANG Lei,E⁃mail:shanglei@fmmu.edu.cn
10.12102/j.issn.1009-6493.2022.22.021
唐涵,护师,博士研究生在读
尚磊,E⁃mail:shanglei@fmmu.edu.cn
唐涵,尚磊.口腔癌和口咽癌病人治疗相关味觉障碍的研究进展[J].护理研究,2022,36(22):4063⁃4068.

(收稿日期:2022-03-16;修回日期:2022-08-29)
(本文编辑 陈琼)
