工程益生菌用于疾病诊断治疗和细胞工厂的研究进展
2022-12-02李浩然贾敏君祁庆生
李浩然,贾敏君,张 健,祁庆生,王 倩
(山东大学 国家糖工程技术研究中心,山东 青岛 266237)
益生菌是一类在人体内定殖、能够改变机体某一部位菌群组成、并对机体有益的活性微生物[1]。目前,人或者动物机体内有益的细菌或者真菌主要有乳酸杆菌属(Lactobacillus)、双歧杆菌属(Bifidobacterium)、酵母菌等,其中,大肠杆菌Nissle1917、罗伊氏乳杆菌(Lactobacillusreuteri)、植物乳杆菌(Lactobacillusplantarum)、乳酸乳球菌(lactococcuslactis)等益生菌是临床与科研中较为常见的菌株。近年来,这些益生菌无论是单独使用还是联合使用,都已经在多种疾病的临床试验中进行了评估。从评估数据来看,益生菌在龋齿[2]、预防过敏[3]或治疗抑郁[4]和焦虑[5]等方面还未见明显效果,但在预防抗生素相关性腹泻和旅行者腹泻、缓解肠易激综合征症状、治疗儿科急性腹泻、根除幽门螺杆菌感染和预防特应性皮炎方面是非常有效的[6-7]。
天然益生菌功效的发挥依赖于多个方面,但主要受到菌株自身和疾病过程的共同影响[8],由于其作用机制还不十分明确,临床效果还需要进一步提升等因素,限制了其应用。因此,对天然益生菌进行工程化改造,将获得的工程益生菌应用于疾病的监测及靶向治疗,是非常有效且可行的策略,具有非常广阔的应用前景。基于工程益生菌的疗法优势明显,例如,成本低、副作用少以及治疗方式简单等等。能够靶向疾病的益生菌具有多种有益属性,因此,将重点阐述对天然及工程益生菌在肠道菌群微环境、代谢性疾病的监测以及肿瘤靶向治疗等方面的应用。
1 天然益生菌在食品及人体肠道健康等方面的应用
近年来,随着人们的生活水平的日益提高及益生菌益生元等相关概念的普及,益生菌商业价值被挖掘的力度大大增加。乳酸菌是目前人们生活中最为常见的益生菌之一,该菌属是较早作为食品发酵佐剂的肠道益生菌,包括Lactobacillus、Bifidobacterium、肠球菌属(Enterococcus)、链球菌属(Streptococcus)、片球菌属(Pediococcus)、明串珠菌属(Leuconostoc)[9]等。早在1999年,Christensen等[10]便发现了Lactobacillus可以降解蛋白质这一重要性质,而20年后,Iwamoto等[11]通过研究发现,Lactobacillus可以通过降解酪蛋白来降低乳制品中的过敏原。Lactobacillus不仅可以降解乳制品中的大分子蛋白质,还可以降解果蔬及谷物中的大分子蛋白质,从而将相关食品向趋于优良品质方向来改善,例如,提高食物中蛋白质的消化率、提高食物蛋白质的营养价值以及方便人体肠道吸收等[12]。
肠道微生物菌群在维持人类健康方面发挥着重要作用,肠道细菌与宿主长期共同进化,其组成受到遗传和环境因素的影响,从而显著影响宿主的代谢、免疫等生理功能和行为。例如,肠道细菌自身的成分或其衍生出的代谢物对维持上皮屏障的完整性和黏膜免疫系统至关重要。
益生菌可用于进行肠道靶向干预,来操纵肠道细菌与宿主的相互作用,从而应用于下游治疗[13]。例如,L.reuteriATCC6475菌株[14]可以通过抑制丝裂原活化蛋白激酶(MAPK)的活性来调控核转录激活蛋白Ⅰ(AP-Ⅰ)与c-Jun(AP-Ⅰ蛋白家族组成成员)转录因子的激活,从而下调了克罗恩疾病患者体内巨噬细胞中肿瘤坏死因子(TNF)的激活。益生菌有助于逆转肠道菌群失调,Yeung等[15]研究发现益生菌可以调节肠道菌群的丰富度和多样性,同时,肠道菌群中的群体感应系统(QS系统)也受到益生菌的调节。在啮齿动物模型中,益生菌与鼠伤寒沙门氏菌(Salmonellatyphimurium)竞争营养元素Fe,减少S.typhimurium在肠道中的数量。LuxS基因与S.typhimurium的运动和毒力息息相关。然而,S.typhimurium分泌的AI-2信号分子被益生菌抑制。Bifidobacterium含有LuxS基因,因此,可以产生AI-2分子来调节生物膜的形成。
2 工程益生菌在肠道细菌性疾病及肠道炎症中的改造应用
2.1 工程益生菌改造应用于肠道致病菌的监测及治疗
致病菌通过一系列严密调控的基因表达模式破坏机体的免疫反应,从而得以在机体内存活。因此,对益生菌菌株进行改造,使其功能化后靶向机体内特定致病菌,是一种有潜力的治疗方法。合成生物学则为解决这一问题提供了一种新的思路(图1(a))。与现有疗法相比,基于工程益生菌的疗法可提供多种优势,例如,更便宜的制剂、更高的功效以及更少的副作用。
Lubkowicz等[16]通过将金黄色葡萄球菌(Staphylococcusaureus)特有的agrQS系统改造到L.reuteri中,实现了致病菌自身诱导肽AIP-Ⅰ的检测。即,通过将S.aureus的群体感应系统(agrQS)整合进益生菌中,使改造后的L.reuteri可执行检测AIP-Ⅰ的功能,使其能够在纳摩尔至微摩尔范围内感应AIP-Ⅰ;Mao等[17]设计了一种乳酸杂交受体,将霍乱弧菌(Vibriocholerae)的传感器激酶CqsS的跨膜配体结合域与L.lactis反应调节剂NisK的信号转导域相结合,构建了一种能够检测V.cholerae特有信号分子CAI-Ⅰ的双组分系统,并将其引入L.lactis中,从而用于检测和报告小鼠肠道微环境中V.cholerae的存在,服用了改造后的L.lactis的小鼠能够在其粪便中检测出β-内酰胺酶报告蛋白阳性信号,该报告蛋白可通过显色底物硝基酚水解后由黄色变为红色来判断活性大小。Hwang等[18]将一种检测N-酰基高丝氨酸内酯(AHL)的群体感应系统引入大肠杆菌Nissle 1917中,同时,对趋化因子CheZ采用翻译后调节的方法,实现了大肠杆菌的趋化性行为,从而达到重编程的大肠杆菌能够特异性识别、迁移并杀伤铜绿假单胞菌(Pseudomonasaeruginosa)的目的。通过设计工程益生菌执行“感应和杀死”功能来特异性杀死病原体的功效已被证明可对抗传染性病原菌,如P.aeruginosa[19-20]、V.cholerae[21-22]和Enterococcus属[23]等。证明了工程益生菌可通过促进细胞因子的表达,直接抑制肠道病原菌,从而达到重新平衡免疫反应能力的目的。
工程益生菌除了特异性响应致病菌信号分子进行治疗外,还可以在宿主体内产生异源性蛋白或其他功能蛋白进行治疗。例如,有些工程益生菌产生一种糖基转移酶,该酶可以清除机体内产肠毒素致病菌产生的肠毒素,从而预防腹泻等胃肠疾病[24],显示出良好的中和功能。这一结果证明了此类工程菌同时具备递送和疾病治疗的功能。另外,工程乳杆菌和干酪乳杆菌分别被开发为针对幽门螺杆菌和产气荚膜梭菌的疫苗,工程乳杆菌和干酪乳杆菌可以表达病原体的抗原(幽门螺杆菌黏附素A蛋白和产气荚膜梭菌α毒素的类毒素),从而在小鼠模型中引发了免疫反应;Carvalho等[25]用肠道共生菌,如,拟杆菌在非人类灵长类动物的呼吸道中递送鼠疫保护性抗原,并观察到了能够杀死鼠疫耶尔森氏菌的血清抗体。
2.2 工程益生菌改造应用于肠道炎症
肠道菌群通过影响肠道通透性[26]、募集免疫细胞[27]和预防炎症来相互作用和调节免疫反应。肠道菌群和宿主免疫反应之间的干扰相互作用可导致慢性和复发性肠道炎症,如炎症性肠病(IBD)、溃疡性结肠炎和克罗恩病。另外,肠道菌群失调也容易引起炎症,肠道菌群的组成和活性差异,即肠道菌群本身的定性和定量变化、其代谢活动的变化和其局部分布的变化,都可能对宿主健康产生有害影响[28]。如果抗生素治疗破坏了原有的微生物种群,就易引起炎症。
益生菌可以产生具有一定抗炎作用并促进宿主的特定生理功能,从而改善宿主的健康的特定分子,但其具体机制尚未完全阐明,感兴趣的读者可以关注文献[14]中的具体论述。除了产生特定的分子,益生菌还可以影响参与先天免疫和后天免疫的不同细胞,如,树突状细胞、单核细胞、自然杀伤(NK)细胞、巨噬细胞、淋巴细胞和上皮细胞(图1(b))。特别是,它们可以激活免疫细胞和非免疫细胞上表达的识别受体(PRRs)。在PRRs中,研究最多的是Toll样受体家族,它可以激活信号级联,导致细胞增殖和细胞因子释放,从而调节免疫系统[29]。益生菌最广为人知的作用之一是促进辅助性T细胞2向辅助性T细胞1转移,以减少过敏反应。在乳酸菌存在下,人外周血淋巴细胞和外周血单核细胞(PBMCs)能够增加T细胞和NK细胞产生的γ-干扰素(IFN-γ)[30-31]。
因此,益生菌已用于改造来调节改变肠道微生物菌群来减轻炎症。在工程化L.lactis产生抗炎细胞因子(如,IL-10[32])的例子中,虽然在1期治疗克罗恩病中显示出有希望的结果,但与2期临床研究中的对照组相比,工程化L.lactis未能显示出统计学上的显著益处。尽管如此,这项研究鼓励了其他研究来设计益生菌来表达抗炎分子,如,IL-27[33]、TGF-β1和丝氨酸蛋白酶抑制剂[34]。而Yeung等[15]则发现以L.reuteri为代表的益生菌菌群可以调节肠道屏障功能来改善肠道菌群的丰富度和多样性,从而治疗因化疗引起的肠道黏膜炎症,但其具体的治疗机制目前尚不清楚。
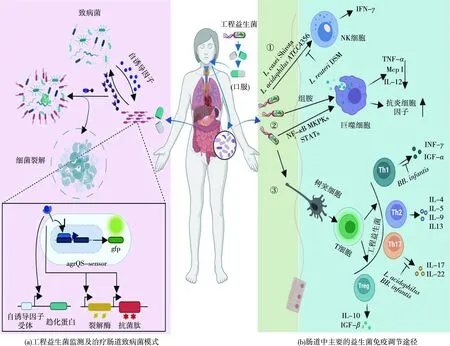
①—工程益生菌通过激活或抑制NK细胞来调控细胞因子IFN-γ的分泌;②—工程益生菌通过组胺代谢作用或MAPK影响免疫细胞(如巨噬细胞)从而抑制促炎因子分泌或促进抗炎因子的分泌;③—工程益生菌通过调控T细胞影响不同的促进或抑制炎症反应的途径;STATs—信号转导及转录激活蛋白;McpⅠ—单核细胞趋化蛋白Ⅰ;BB. infantis—婴儿双歧杆菌;NK细胞—自然杀伤细胞;IFN—γ(INF-γ)-γ干扰素;TNF-α—肿瘤坏死因子;IL-12—白介素12;NF-κB—核因子激活的B细胞的k轻链增强;TGF-α—转化生长因子α;TGF-β—转化生长因子β;IL-4—白介素4;IL-5—白介素5;IL-9—白介素9;IL-13—白介素13;IL-17—白介素17;IL-22—白介素22;IL-10—白介素10;Th1—辅助性T细胞1;Th2—辅助性T细胞2;Th17—辅助性T细胞17;Treg—调节性T细胞;L.casei Shirota—干酪乳杆菌;L. acidophilus—嗜酸乳杆菌;L. reuteri—罗伊氏乳杆菌图1 工程益生菌在肠道细菌性疾病及肠道炎症中应用模式Fig.1 Model diagram of an application of engineered probiotics in intestinal bacterial diseases and intestinal inflammation
Lin等[35]通过工程化改造L.reuteri得到L.reuteriATCC PTA6475菌株,发现该菌株可通过MAPK调控的c-Jun和AP-Ⅰ途径从而抑制脂多糖(LPS)诱导的TNF-α的产生;与调节性抗体CD11+和树突状细胞(DC)结合的益生菌混合物可以增强调节性T细胞(Treg细胞)群TGF-β、IL-10的分泌,环氧化改造L.reuteri,得到L.reuteriATCC PTA6475菌株,发现该菌株可通过MAPK调控的c-Jun和AP-Ⅰ途径从而抑制LPS诱导的TNF-α的产生酶COX-2的水平,同时还可以抑制促炎因子IL-17、IFN-γ和TNF-α的产生[36];L.reuteriLMG P27481是Sagheddu等[37]发现并通过工程化改造得到的一种新菌株,该菌株作用于人类未成熟树突状细胞,能够诱导大量IL-10因子分泌,与天然L.reuteri菌株相比,该菌株抗炎作用更强;而特定的益生菌菌株可以负性或正性刺激NK细胞,例如,鼠李糖乳杆菌(Lactobacillusrhamnosus)和L.reuteriDSM 17938可抑制S.aureus培养的PBMCs中的T细胞和NK细胞的激活以及IFN-γ的释放[38],与此相反,干酪乳杆菌(Lactobacilluscasei)Shirota、嗜酸乳杆菌(Lactobacillusacidophilus)ATCC 4356和短双歧杆菌(Bifidobacteriumbrevis) ATCC 15700NK能够增加NK细胞活性并增强其活化[39]。益生菌、树突状细胞和NK细胞之间不同的相互作用清楚地揭示了每个菌株如何不同地调节免疫系统和炎症反应,同时,NK/DC平衡也会在一定程度上影响益生菌发挥其有益的作用[29]。
3 工程益生菌在代谢性疾病上的应用
代谢紊乱是由参与宿主代谢的酶的异常引起的,导致特定代谢物的积累或缺乏[40]。这些疾病可能会导致宿主机体虚弱或者有潜在的致命影响,并且在一定程度上治疗困难,通常需要严格的生活方式限制和昂贵的治疗费用[41]。因此,工程益生菌的出现可以为代谢性疾病的治疗提供一种新的思路(表1)。

表1 工程益生菌靶向代谢疾病的生物实例Table 1 Biological examples of engineered probiotics targeting metabolic diseases
高草尿酸症是一种尿液中含有高浓度草酸盐的慢性疾病,因患者无法分解草酸盐,而导致其在患者肝脏和尿道中积累,从而形成结石。近日,美国Synlogic公司公布了SYNB8802治疗肠道高草酸尿症的数据。SYNB8802是一种工程化的非致病性大肠杆菌菌株(Nissle),该菌株可以消耗胃肠道中的草酸盐,并降低尿液中的草酸盐水平,从而减少因肠道高草酸尿引起的肾脏损伤。
苯丙酮尿症(PKU)是一种由苯丙氨酸羟化酶功能丧失而导致血液中L-苯丙氨酸(Phe)的积累所引起的遗传性疾病,当Phe积累到一定程度的时候会导致神经毒性。近年来,降低Phe以治疗PKU已成为工程益生菌治疗的首选目标。例如,L.reuteri经过基因改造产生Phe解氨酶(PAL),这是一种分解Phe的酶,能够降低PKU小鼠模型血液中的Phe水平[42];在另一项研究中,Isabella等[43]通过改造大肠杆菌Nissle 1917得到工程化SYNB1618菌株,该菌株可以使工程益生菌在缺氧条件下高度表达PAL和L-氨基酸脱氨酶(LAAD),从而降解Phe,经过验证后发现,SYNB1618成功地降低了PKU小鼠模型血清中的Phe水平。美国Synlogic公司近期公布了SYNB1618和 SYNB1934的阳性2期数据,在菌株SYNB1618的基础上,通过完善改进得到菌株SYNB1934,该菌株可以为PKU患者提供更佳的Phe降解活性,临床前体内和体外研究表明,与SYNB1618相比,SYNB1934分解Phe的能力大约提高了两倍。
高氨血症,即血液中的高氨水平,与尿素循环障碍(UCDs)和肝性脑病(HE)等疾病有关。Kurtz等[44]改造大肠杆菌Nissle 1917得到SYNB1020菌株,该菌株能够将氨转化为左旋精氨酸来上调精氨酸生物合成,并引入了胸腺嘧啶核苷营养缺陷型进行生物抑制,从而治疗高氨血症。SYNB1020降低了UCDs和HE小鼠模型的血液中的血氨水平,在健康小鼠、猴子和人类志愿者中耐受性良好。
在其他代谢疾病方面,例如在雌激素代谢紊乱疾病中,Shen等[45]利用工程化改造后的L.acidophilus菌株来调节肠道菌群结构来影响宿主体内β-葡萄糖醛酸酶的活性,从而稳定宿主体内的雌激素水平;Ozkinay等[46]研究发现,L.acidophilus对炎症反应具有调节作用,而雌激素可以加强阴道上皮细胞的防御功能,于是将L.acidophilus与低剂量的雌三醇混合后发现可以有效抑制多种促炎细胞因子的表达,并降低宿主机体的炎症反应。而在糖尿病及非酒精性脂肪肝(NAFLD)疾病中,Marazza等[47]发现,经过工程化的L.rhamnosusCRL981菌株中的β-葡萄糖苷酶具有较高的活性,可以完全水解葡萄糖苷并且提高大豆异黄酮的生物活性,从而降低胰岛素的拮抗作用,应用了该菌株的糖尿病模式小鼠,其体内的血糖、胆固醇及甘油三酯的含量显著降低;Monem等[48]发现L.acidophilus能够改善NAFLD患者体内的天冬氨酸转氨酶及丙氨酸转氨酶,从而治疗NAFLD。
同时,在合成代谢的过程中,工程益生菌可以提供合成代谢途径来修复宿主代谢的故障或功能障碍。例如,苯丙酮尿症是由苯丙氨酸代谢失败引起的。血液中积累的苯丙氨酸会导致严重的副作用,如智力残疾和癫痫[49]。为了解决这一代谢综合征,构建了一种含有Phe代谢途径的工程益生菌,该工程益生菌利用两种不同的代谢酶,即PAL和LAAD,分别将Phe转化为肉桂酸和苯丙酮酸[43],从而达到利用工程益生菌来防止Phe积累和Phe转化为其他代谢物的目的。综上所述,工程益生菌可以通过提供合成代谢途径来缓解宿主代谢功能障碍所导致的恶性效应。
4 工程益生菌在肿瘤治疗上的应用
基于微生物的肿瘤治疗(MBTT)方法旨在利用微生物作为癌症治疗的递送载体,并补充或协同现有的治疗方法。随着对宿主-微生物的相互作用(例如,代谢和免疫反应)和肿瘤生物学的认识不断深化,通过改造微生物用于基于微生物的靶向癌症治疗[50]已成为可能,基于微生物的抗癌治疗剂通过设计改造后可以影响癌症药物的代谢,诱导宿主免疫系统增强对抗肿瘤细胞的分化,并对肿瘤细胞执行杀伤作用(图2)。

图2 工程益生菌用于微生物肿瘤治疗的3种主要策略Fig.2 The three main strategies of engineering probiotics for microbial tumor treatment
用细菌治疗癌症的概念已经存在了几十年[51]。因为专性和兼性厌氧菌,例如,Clostridium、Salmonella、Bifidobacterium和Escherichia在实体瘤中可以稳定存活这一特征,同时伴随着基因工程多功能性的增加,对这些细菌进行定向癌症治疗的研究也越来越多,例如,针对肺癌模型的小鼠,用分泌IL-17的工程益生菌递送药物的模型小鼠,其肿瘤发生率显著低于野生型菌株,表明工程益生菌能够有效地递送蛋白分子至靶位[52];在益生菌酿酒酵母表面表达艾滋病病毒(HIV)Gag蛋白,发现其可以体外诱导特异性T细胞免疫反应。基于此使得利用工程益生菌治疗癌症这一方法变得可行。改造后的益生菌可用于递送抗癌化合物,引发针对癌症的免疫反应,或与现有疗法互补以获得更好的疗效[53]。
在许多情况下,大肠杆菌Nissle 1917和减毒S.typhimurium的肿瘤靶向能力已被用于在荷瘤小鼠体内递送抗肿瘤有效载荷。Li等[54]设计了大肠杆菌Nissle 1917以产生细胞毒性化合物,而He等[55]设计了该细菌以在肿瘤内分泌肿瘤抑制蛋白p53和抗血管生成蛋白Tum-5。鼠伤寒沙门氏菌还被用在肿瘤组织中分泌创伤弧菌鞭毛蛋白B,这种蛋白诱导先天免疫反应,导致动物模型中肿瘤生长和转移受到抑制,但没有观察到毒性[56]。Chowdhury等[57]对大肠杆菌进行了更巧妙的改造,使其在肿瘤内特异性裂解并释放免疫抑制信号分子(CD47)的纳米体拮抗剂,同时将噬菌体裂解蛋白fX174E置于由细菌产生的群体感应分子N-酰基高丝氨酸内酯(AHL)激活的启动子下从而在同基因小鼠肿瘤模型中产生抗癌效果。随着改造后的大肠杆菌在肿瘤中稳定存活,AHL浓度在增加至超过阈值后,细菌细胞的裂解和随后纳米体的释放将被触发。
为了增强益生菌与肿瘤的结合,Ho等[58]设计了大肠杆菌Nissle 1917来表达来自溶没食子链球菌的组蛋白样蛋白A (HlpA),这使得益生菌能够与结直肠癌细胞表面的硫酸乙酰肝素蛋白聚糖(HSPG)结合,同时,Ho等[58]还改造了大肠杆菌Nissle 1917用于分泌黑芥子酶,将十字花科植物中发现的无活性硫代葡萄糖苷转化为抗癌剂萝卜硫素,工程益生菌在体外诱导癌细胞死亡,并在结直肠癌小鼠模型中减少肿瘤大小和发生。
5 工程益生菌在工业生产上的改造应用
益生菌之所以成为我国近年来产品研发的主要热门方向,除了益生菌在医疗疾病领域的巨大潜力之外,在工业生产上同样具有较高的应用价值。随着代谢工程及合成生物学的迅猛发展,益生菌在工业生产上也会大大发挥其优势。
例如,乳酸菌,是一种广泛应用于食品工业,通过发酵碳水化合物生产乳酸的益生菌,乳酸菌不仅分解食品中的大分子物质,还可以降解不易消化的多糖和改善物质的适口性。目前,已经报道出的利用乳酸菌合成的产物有有机酸、γ-氨基丁酸(GABA)、维生素等化合物,例如,Qiu等[59]将谷氨酸棒状杆菌(Corynebacteriumglutamicum)编码的短链脱氢酶基因CGS9114_RS09725整合到乳酸片球菌(Pediococcusacidilactic)中,得到的工程益生菌可以加速香兰素的还原,香兰素可以解除酚醛对细胞生长的抑制从而提高D-乳酸的产量。Shi等[60]利用工程化的短乳杆菌(Levilactobacillusbrevis)将底物L-谷氨酸和谷氨酸钠转化为GABA,经测定终产物产量可达到约201 g/L。Hsueh等[61]还利用细胞固定化技术优化了GABA的生产,采用紫外光引发光聚合法制备了甲基丙烯酸-2-羟乙基(HEMA)/聚乙二醇二丙烯酸酯(PEGDA)共聚物水凝胶膜,利用水凝胶膜固定L.brevisRK03细胞将味精转化为GABA,发现当水凝胶中HEMA与PEGDA的质量浓度比为93∶3时,能最大限度地产生GABA。目前,乳酸菌已可用于生产维生素种类有叶酸、核黄素、维生素C等,以核黄素为例,Ge等[62]将长度1 059 bp的DNA片段插入L.plantarumrib操纵子的上游调节区,改造后的菌株与野生型菌株相比,核黄素产量显著提高;此外,Chen等[63]通过微流控液滴技术筛选得到L.lactis突变体菌株JC017,该突变体菌株可以诱导核黄素生物合成簇ribABGH的过度表达,发现抑制嘌呤生物合成的突变体可以有效地触发核黄素分泌。除了上述化合物,乳酸菌还可以产生一些风味物质,从而调节物质的口味,例如,Kuhl等[64]通过对变异株的筛选得到缺失β-半乳糖酶的保加利亚乳杆菌(Lactobacillusbulgaris)菌株,该菌株因为不发酵乳糖,所以不会酸化,从而改善产品的适口性。此外,利用乳酸菌还可以生产如细菌素、胞外多糖等物质[12]。
除将传统的代谢通路改造方式应用于工业生产外,CRISPR-Cas9和其他基因编辑系统的出现使多种代谢工程策略可用于满足工业生产中对微生物代谢物日益增长的需求,本课题组Zhou等[65]将CRISPR-Cas9辅助的双链DNA (dsDNA)和单链DNA (ssDNA)重组工程在L.plantarumWCFSⅠ中建立,所得到的菌株可大幅度提高N-乙酰神经氨酸的产量。Ou等[66]利用CRISPR-Cas9技术,在Pet启动子下,将可以生产肠毒素大肠杆菌(enterotoxigenicEscherichiacoli,ETEC)的F4(K88)和F18菌毛簇基因整合进益生菌Nissle 1917的yjcS、pcadA、lacZ、yieN/trkD、maeB和nth/tppB基因位点,构建出工程益生菌RIPSs,该工程菌株能够使仔猪体内产生抗F4(K88)及抗F18的IgG,并且该仔猪的血清抗体在体外可显著抑制F4+或F4+和F18+的ETEC野生型菌株与猪肠道细胞系的黏附,从而缓解断奶后仔猪腹泻的症状,这一研究表明RIPSs菌株有可能成为抗F4+/F18+ETEC感染的益生菌菌株和疫苗候选菌株,同时也为CRISPR-Cas9技术在制备工程菌疫苗的应用上奠定了研究基础。
6 结语
现如今,随着分子生物学技术的不断革新,为研究者们探究益生菌的功效提供了广阔的思路,这使得越来越多的科学家对于益生菌的研究从食品领域开始向生物医学领域转移。未来,随着研究的深入,益生菌相关的蛋白表达技术逐渐成熟,工程益生菌疫苗的研发一定会成为今后的研究热门,但是,用于构建疫苗的菌株以及疫苗所携带的外源基因进入胞外环境会对机体产生什么样的影响将是需要重点探讨的问题。除此之外,益生菌微胶囊也会从食品领域向着生物医学领域拓展,将一些天然药物的基因整合进特定的益生菌中,使得改造后的工程益生菌具有疾病预防、监测及治疗的功效,但是,活体微生物的治疗效果与个体差异之间仍然存在诸多的不确定性,这也成为目前亟待落实的问题之一。
现阶段医学正在走向个体化治疗阶段,益生菌作为载体可以在该领域起到举足轻重的作用。在未来,每种益生菌可根据患者特定的临床情况作为量身定制的生物疗法。随着合成生物学等技术的不断完善和发展,对于益生菌的探索在食品领域以及生物医学领域将会有更大的突破。
