CRISPR介导功能性核酸/蛋白的食品检测研究进展
2022-12-02朱丽英
孙 杨,李 佳,朱丽英,江 凌
(1.南京工业大学 食品与轻工学院,江苏 南京 211800;2.南京工业大学 化学与分子工程学院,江苏 南京 211800)
食品供应的全球化加剧了食品安全控制和可追溯性等研究的难度,每年约6亿人因为食品污染问题而患病,并导致其中约42万人死亡,从而引起人们的关注,并成为世界性问题[1]。美国营养标签和教育法案、欧盟国家的新欧洲法规以及“蒙特利尔议定书”对食品实验室提出了一定要求[2]。现行的《中华人民共和国食品安全法》对于食品中的添加剂、食源性致病菌、农兽药残留、重金属和生物毒素等有明确和严格的规定。为了应对这些挑战,这就要求科研人员开发出高效的检测手段来检测食源性致病菌,才能保障食品安全。
2020年诺贝尔化学奖颁给了对成簇间隔的短回文重复序列(CRISPR)做出创新性研究的Emmanuelle Charpentier和Jennifer Doudna,从而使人们再次对她们所发现的CRISPR/Cas系统产生了浓厚兴趣并引起更多的关注。CRISPR及其相关Cas蛋白构成了古细菌和细菌中抵御外源核酸物质入侵的适应性免疫系统,该系统可以降解外源入侵的核酸[3-4],随后被开发为基因编辑工具。然而,随着Cas12a和Cas13a的反式切割活性被发现,基于Cas13a的SHERLOCK(specific high sensitivity enzymatic reporter unlocking)和基于Cas12a的DETECTR(DNA endonuclease-targeted CRISPRtransreporter)相继被开发为核酸检测平台,并成为分子诊断领域的热点[5-6]。但是上述平台在检测非核酸物质方面的缺陷限制了其更广阔的应用。
作为一门新兴学科,合成生物学在应对这种缺陷时表现出具有巨大的潜力。合成生物学家通过“设计—搭建—测试—学习”,开发了种类繁多的生物元件,构建了更加精密且智能的基因电路。核糖开关、转录因子、适配体等功能性核酸/蛋白作为元器件,结合CRISPR核酸检测技术,在离子、氨基酸、辅酶、食源性致病菌、毒素和农兽药残留等方面的检测应用,为分子诊断学带来了新的机遇。
笔者概述了CRISPR系统的分类及其代表蛋白的作用机制,如何利用不同的Cas蛋白的特性进行检测分析,列举了不同的元器件及其应用。笔者也分析了不同元器件和CRISPR系统的组合,并概述了该技术在食品检测中的应用,同时展望了合成生物学和CRISPR检测技术在食品检测中的应用前景和未来研究方向。
1 CRISPR的概述
1987年,日本科学家首先在大肠杆菌中发现CRISPR,经过多年的研究发现,CRISPR系统是多数细菌和古细菌的一种适应性免疫防御系统,通过适应、表达和干扰3个阶段介导的免疫机制,用于抵制外源核酸及噬菌体的入侵[3-4]。该系统主要由DNA靶向间隔序列、非重复间隔序列和Cas效应蛋白组成。
1.1 CRISPR系统的分类
根据Cas效应蛋白可将CRISPR系统分为2大类,包含6小类、33个亚型(图1)。
第一类CRISPR-Cas系统中的Cas蛋白具有多亚基效应器复合物,介导CRISPR RNA前体(pre-crRNA)加工和结合以及通过裂解进行干扰,主要有Ⅰ型、Ⅲ型和Ⅳ型蛋白,分别包括Cas3、Cas10和Csf1[7-9]。研究表明,大约90%的CRISPR-Cas系统属于第一类,广泛存在于真菌中,少数存在于细菌中[10]。Ⅰ型系统由多个效应蛋白协同作用:Cas6或Cas5介导CRISPR RNA(crRNA)解旋并与靶DNA结合,Cas7稳定R环,然后Cas3切割靶DNA[8,11]。Ⅲ型系统由Csm复合物(Ⅲ-A系统)、Cmr复合物(Ⅲ-B系统)和crRNA组成。该系统的Cas10可以产生环状寡核苷酸-(A)核苷酸,激活Csm6的RNA酶活性,切割靶RNA[12-13]。Ⅳ型系统由于存在于质粒中,暂时还不了解其作用机制[14],但是有研究表明Ⅳ型系统可能促进细胞内和质粒间的竞争,在调节质粒之间的冲突方面发挥了作用,并且与Ⅰ型CRISPR-Cas系统之间存在串扰[15-16]。此外,有报道显示Ⅳ-B型CRISPR核糖体核蛋白复合物由1个类Cas7丝和1个小亚单位(Cas11)丝缠绕而成,但该复合体缺乏RNA加工和靶DNA切割的亚基[17]。

图1 CRISPR系统的分类Fig.1 Classification of the CRISPR system
第二类CRISPR-Cas系统中的Cas蛋白具有单个蛋白的效应器复合物,主要有Ⅱ型、Ⅴ型和Ⅵ型蛋白,主要存在于细菌中,由于其简单高效的特点,已经被研究人员开发应用于基因编辑和核酸检测,其中典型的代表是CRISPR-Cas9、CRISPR-Cas12a、CRISPR-Cas13a和CRISPR-Cas14a[18]。与第一类蛋白不同的是,第二类蛋白只需要一个多域,就能与crRNA形成复合物,从而切割靶标。这些蛋白的概述、相应特征效应蛋白和特性列于表1中。

表1 应用于基因编辑和核酸检测领域的效应蛋白Table 1 Effector proteins used in gene editing and nucleic acid detection
1.2 基于CRISPR/Cas的检测技术的原理
目前基于CRISPR/Cas的检测技术根据不同Cas蛋白(表1)的不同作用机制主要分两类(图2):一类是在向导RNA(sgRNA)的引导下,利用酶促失活的Cas9 效应蛋白(dCas9),具有识别靶标核酸的能力而开发的检测方法。例如,通过使用一对dCas9蛋白各连接一半荧光素酶来进行检测[19];另一类是Cas蛋白(Cas12a、Cas13a和Cas14a)与靶DNA或RNA结合,在crRNA的引导下,进入激活状态,不仅能切割特定的DNA或RNA,还能切割环境中的任何DNA或RNA。将其与荧光-猝灭基团偶联,进而开发为检测方法,其中代表性的SHERLOCK和DETECTR检测平台已广泛应用病毒、食源性致病细菌和食源性致病真菌的检测当中[20]。
1.3 CRISPR-Cas9/dCas9
Cas9/dCas9是Ⅱ型蛋白家族中的特征蛋白,其核酸检测主要依赖于特异性识别靶序列的能力,针对靶序列设计特异性的sgRNA,可实现对不同基因型的检测[21]。dCas9由于缺乏执行平末端链断裂的能力,但可以识别双链DNA(dsDNA),被开发为检测工具(图2)。此外,基于Cas9的检测方法NASBACC已经被开发用于检测Zika病毒[22]。诸多基于Cas9/dCas9的DNA传感方法的研究的主要原理包括:由dCas9伴侣来引导重组分裂蛋白[19]、基于Cas9破坏含有PAM的位点[22]以及Cas9诱导的非靶向DNA链解离作为等温扩增的靶点[23]。
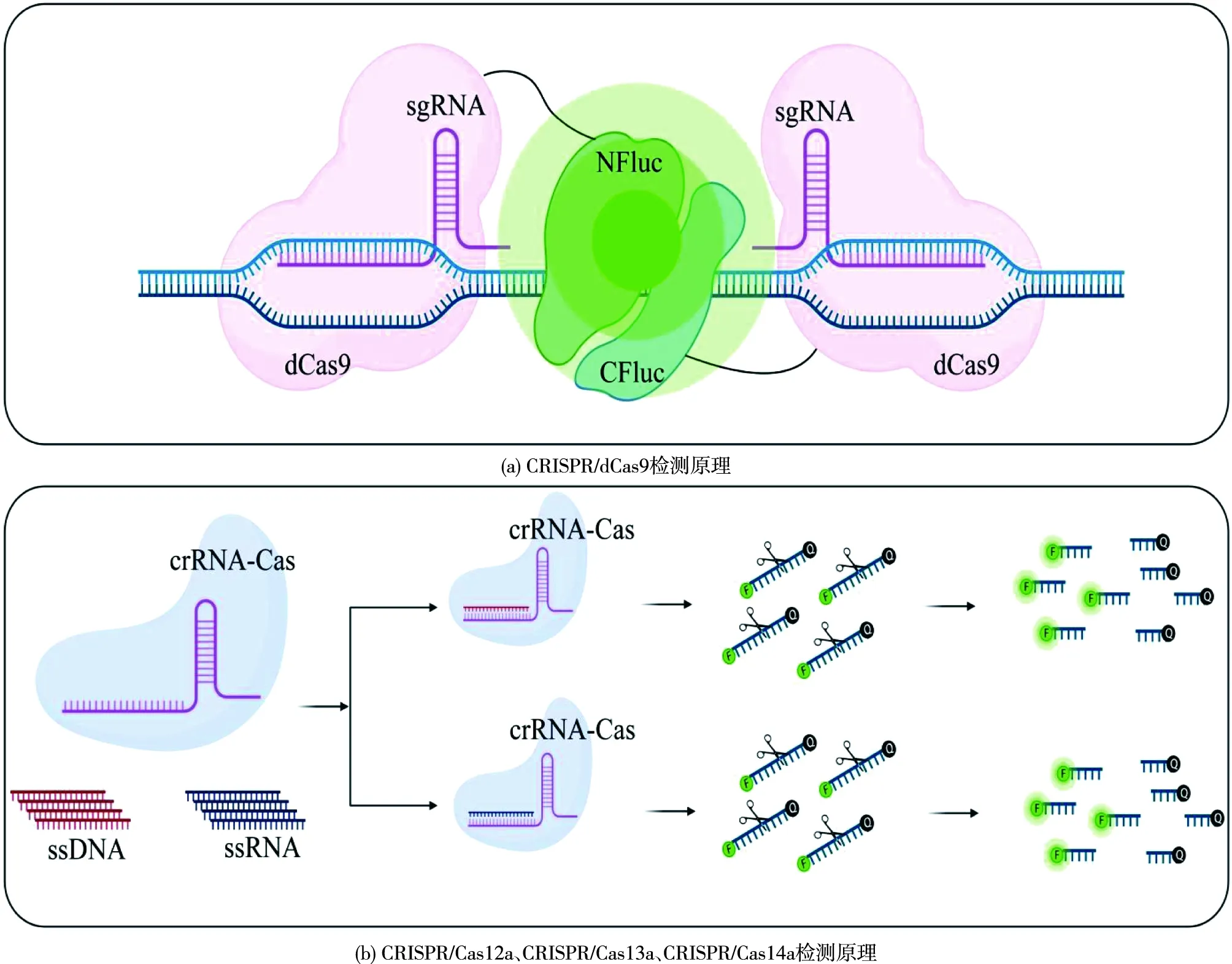
NFluc—N端部分的荧光素酶;CFluc—C端部分的荧光素酶;crRNA-Cas—crRNA和Cas组成的复合物;sgRNA—向导RNA图2 CRISPR/Cas系统检测原理Fig.2 Principle of the CRISPR/Cas system for detection
1.4 CRISPR-Cas12a
Cas12a(也被称为Cpf1)是第二大类Ⅴ型系统的代表蛋白,由RNA引导,靶向 DNA的Cas蛋白,其RuvC核酸内切酶域介导单链DNA(ssDNA)或dsDNA的切割,但基于dsDNA切割需要5'-(T)TTN PAM[24]。Cas12a-crRNA复合物结合并切割靶序列后,会激活Cas12a非特异性的ssDNA反式切割活性,根据Cas12a的这个特性,引入重组酶聚合酶等温扩增技术(RPA)和可进行荧光猝灭的ssDNA探针,开发了DETECTR核酸检测平台,该平台省去了DNA转录到RNA的过程,可以检测≤6个碱基[6]。
1.5 CRISPR-Cas13a
CRISPR-Cas Ⅵ型(Cas13)家族的大小为900~1 300个氨基酸,由于存在2个高等真核生物和原核生物核苷酸(HEPN)结合域,Cas13-RNA切割不需要PAM[25]。Cas13检测顺式构象中的ssRNA,并在体外显示出对ssRNA的侧向反式切割活性[25-26]。在基于Cas13的分析平台SHERLOCK中,分别用RPA或逆转录RPA(RT-RPA)等温扩增DNA或RNA。在RNA的扩增过程中要添加带有T7启动子的正向引物,该启动子允许靶标DNA转录RNA。当LwaCas13a蛋白与sgRNA、靶序列形成效应复合物时,通过顺式切割靶标RNA,并通过侧向反式切割以靶标依赖的方式切割ssRNA报告分子。一旦由荧光团和猝灭剂组成ssRNA报告分子被切割,荧光团从猝灭剂中分离出来,从而释放出信号,达到检测效果[5]。迭代升级后的SHERLOCKv2可以进行多路检测,并且信号灵敏度提高了3.5倍。在此基础上,引入免疫层析分析,使得检测真正做到“仪器自由”[27]。
1.6 CRISPR-Cas14a
Cas14是报道的最小的Cas蛋白,能够靶向和切割任何具有随机序列的ssDNA,且无需PAM序列。Cas14a与其他Cas蛋白相比具有诸多优势[28]:1) 质量紧凑,大小仅为Cas9的一半。2)Cas14a无需PAM序列即可进行切割,Cas12a的PAM序列是富含T的PAM,而Cas9更喜欢富含G的PAM 进行基因组切割,这一发现拓宽了其在检测分析方面的应用。3)对ssDNA序列的识别和辨别能力更高,Cas14a的所有这些优势提高了从病原体检测ssDNA的可能性,有助于建立高保真分子检测平台。4)此外,Cas14在检测单核苷酸多态性方面表现出更好的特异性和活性。
2 CRISPR检测系统的元器件挖掘
合成生物学工具箱需要不同的元器件及其文库,如,核糖开关、转录因子、适配体来建立人工生物系统,构建智能的基因电路。
2.1 核糖开关
在细菌中,核糖开关作为非编码元件,通常存在于信使RNA(mRNA)的前导区,通过控制转录终止位点的形成或影响翻译起始的效率来调节基因表达[29]。核糖开关的适配子结构域与其同源配体(如,RNA聚合酶)特异性结合,形成特定的二级RNA结构,停止并释放RNA聚合酶,从而中止RNA合成[30]。基于此,将核糖开关作为生物传感系统进行快速和现场诊断,串联CRISPR检测系统,对于构建新型食品检测装备具有启示作用(图3(a))。到目前为止,基于遗传和基于计算的方法已经被用来表征大约40种可以响应不同的代谢物或离子的天然核糖开关,用来调节代谢途径[31](表2)。Weinberg等[32]通过开发一种计算算法来分析已知的核糖开关,以发现改变其配体特异性的其他变体。因此,可以发现某类已知核糖开关的其他成员以及可能的变体,来丰富信号分子库。Thavarajah等[33]在2020年发表的一篇论文描述了一种调节蜡样芽孢杆菌CrcB(氟外排泵表达)的氟化物响应型核糖开关,该传感器由1个包含DNA模板的无细胞系统组成,该模板编码一种氟化物响应的核糖开关,调节产生荧光或比色输出的基因,并在实验室和现场条件下检测到超过2×10-6的氟化物水平。Weiss等[34]以yfp为报告基因,开发了感应环二腺苷酸(c-di-GMP)的核糖开关,该系统将YFP(yellow fluorescent protein)融合到核糖开关上,可以对活细胞进行快速成像,允许对枯草芽孢杆菌细胞亚群之间的c-di-GMP水平进行相对分析。
2.2 转录因子
转录因子参与转录过程的复杂机制,从上游途径收集信息,例如,感知和响应各种小分子和其他刺激,然后与特定的DNA序列结合以触发转录促进或者转录抑制[35]。细菌已经进化出几个变构转录因子(allosteric transcription factor,aTF)家族,它们通常包括一个DNA结合结构域和效应结合结构域。当小分子效应配体与aTF结合后,导致其构象的改变,以此来增强或者减弱DNA位点结合的亲和力[35-36]。因此,大量研究报道重新设计aTF来改变它们的配体特异性,并作为合成生物学工具用来实时检测、选择和调节细胞代谢[37-38]。然而,受aTF响应大量效应物导致构象改变的启发,也有研究表明aTF可以被开发用于体外检测各种小分子的生物传感器,尤其是那些无法被传统识别元件(如,酶、抗体和适配体)。Voyvodic等[39]利用转录因子BenR及其效应物创建了一个通用的、模块化的无细胞生物传感器检测器,该检测器可以检测商业饮料中的苯甲酸以及人尿中的马尿酸和可卡因。华东理工大学张立新课题组Cao等[40]开发了一种基于aTF 的带切口DNA模板辅助信号转导的体外生物传感平台(aTF-based nicked DNA template-assisted signal transduction system,aTF-NAST),通过利用T4 DNA连接酶和aTF之间的竞争性结合带切口的DNA,该系统可以稳定并灵敏地检测4-羟基苯甲酸。这种设计可能为将aTF和CRISPR系统的组合应用于食品检测提供了一种新方法(图3(b))。

表2 核糖开关多样性Table 2 Riboswitch diversities
2.3 适配体
适配体是指通过指数富集系统进化配体的新技术(systematic evolution of ligands by exponential enrichment,SELEX),从随机生成的DNA或RNA文库中多次循环筛选出的一定序列的寡核苷酸,通常含有20~80个核苷酸,与其靶标具有高亲和力,也被称为“化学抗体”[41-42]。但是与抗体相比,适配体具有易操作、高稳定性、高重复性、通用性等诸多优势。更重要的是,适配体在其结构设计中提供了显著的灵活性和便利性,加上它可以与细胞、病毒、毒素等靶标结合,可以用来开发具有高灵敏度和选择性的新型生物传感器,在食品检测领域发挥作用[43-44]。而将其与启动子和引物设计在一起,在未识别靶标(细菌)的时候,“适配体-启动子-引物”复合物形成一个“包裹”状态,而当识别到靶标时,该复合物“舒展”开来,露出启动子-引物模块,扩增Cas蛋白识别的靶序列,触发Cas蛋白的反式切割活性,激发荧光[45](图3(c))。近年来,许多研究报道了适配体在食品检测中的应用。Kim等[46]利用非SELEX技术分离出了大肠杆菌O157:H7的适配体,该方法省去了SELEX所必需的反复的结合孵化、分离和扩增。Nosrati等[47]将机器学习和PseKNC(pseudo k-tuple nucleotide composition)相结合,对大肠杆菌O157:H7的ssDNA适配子进行电子筛选,结果表明,筛选出的核酸适配体具有合适的结构性质,且核酸适配体折叠没有热力学限制。此外,Sun等[48]针对副溶血性弧菌的原适配体序列进行截短和定点突变,获得检测性能更优的适配体。总之,适配体作为一种新型仿生识别元件,受到广泛关注。将其与CRISPR检测系统进行整合,并开发为食品检测设备,可以实现信号转换,具备快速、高效、廉价、易携带等优势。

图3 不同元器件偶联CRISPR/Cas技术的检测原理Fig.3 Schematic mechanism of CRISPR/Cas technology combined with different components
2.4 内源性CRISPR
CRISPR-Cas系统由于其可编程性和通用性已成为一种精确基因组编辑工具,通过crRNA引导Cas蛋白识别靶标核酸序列,裂解侵入核酸。虽然有诸多研究报道了CRISPR-Cas系统在工程细菌基因组编辑方面的应用,但Cas蛋白作为一种异源蛋白由于其固有的毒性,容易导致宿主死亡,使得基因组编辑仍然具有挑战性。然而,最近的一些突破性研究成果展示了如何在细菌中利用内源性CRISPR-Cas系统,例如,Hidalgo-cantabrana等[49]利用卷曲乳杆菌的内源性I-E系统进行包括插入、缺失和单核苷酸替换等一系列遗传操作,并将其开发为基因编辑平台。类似的,Xu等[50]基于Ⅰ型CRISPR-Cas,开发了一个可转移和整合的基因编辑技术,该系统可以从宿主基因组中轻松去除靶基因,从而在宿主细胞中进行无疤痕、高效(>80%)和简便的基因组编辑。Sui等[51]利用内源性CRISPR-Cas系统,开发了一种适用于运动发酵单胞菌进行快速基因组编辑和必需基因鉴定的工具。该工具只需要构建一个带有mini-CRISPR的自靶向质粒,即可实现靶基因和长片段的敲除,上述案例说明了内源性CRISPR-Cas系统如何易于实现和可编程地利用宿主进行基因组编辑。由于大部分原核生物都有内源性CRISPR-Cas系统,将其利用起来为食源性致病菌进行基因编辑提供了另一条灵活方便的途径。值得注意的是,Jia等[52]设计了针对大肠杆菌O157∶H7志贺毒素的引导RNA,并利用双质粒平台将对志贺毒素编码基因具有特异性的CRISPR-Cas9系统导入细菌细胞,以特异性杀灭产志贺毒素大肠杆菌。总之,这些研究说明了基于CRISPR的基因组编辑如何广泛应用于食源性致病菌的工程设计的一种可行性思路。
3 CRISPR介导功能性核酸/蛋白在食品检测中的应用
利用合成生物学工具耦合CRISPR检测技术,开发新型食品检测平台,可以广泛应用于食源性致病菌、食品掺假、离子、食品防腐剂、农兽药/抗生素残留等方面的检测。
3.1 食源性致病菌
食源性致病菌(表3),如,沙门氏菌、结核分枝杆菌、蜡状芽孢杆菌等会污染食物,引起食源性疾病,导致通过摄食引起呕吐、腹泻以及腹痛等症状。因此,对于食源性致病菌的防治显得尤为重要。Shen等[45]提出了一种基于核酸的变构探针和CRISPR-Cas13a组分的组合检测系统(APC-Cas),该方法有能选择性地、灵敏地定量检测牛奶等各类试样中的肠炎沙门氏菌细胞(1~105CFU)。Zhang等[19]使用一对dCas9蛋白各连接一半荧光素酶,当一对dCas9定位到由一对sgRNA确定的大约44 bp的靶序列时,便会诱导发光,开发了一种体外DNA检测系统。用该体系检测结核分枝杆菌DNA具有较高的特异性和敏感性。Zhang等[53]构建了一种发光RNA适配子-CRISPR-Cas13a组合,能够监测病原体RNA的存在,该方法允许对RNA靶标和活的病原菌进行无反转录、无核酸扩增和无标记的定量,同时检测出低至10 CFU的蜡状芽孢杆菌。最近,Song等[54]开发了一种通用的核酸磁-DNA纳米颗粒系统,可以用于病原细菌的检测。在该系统中,目标核酸被扩增,并通过链霉亲和素包被的磁珠从混合物中分离,激活CRISPR-Cas14a的反式切割活性。
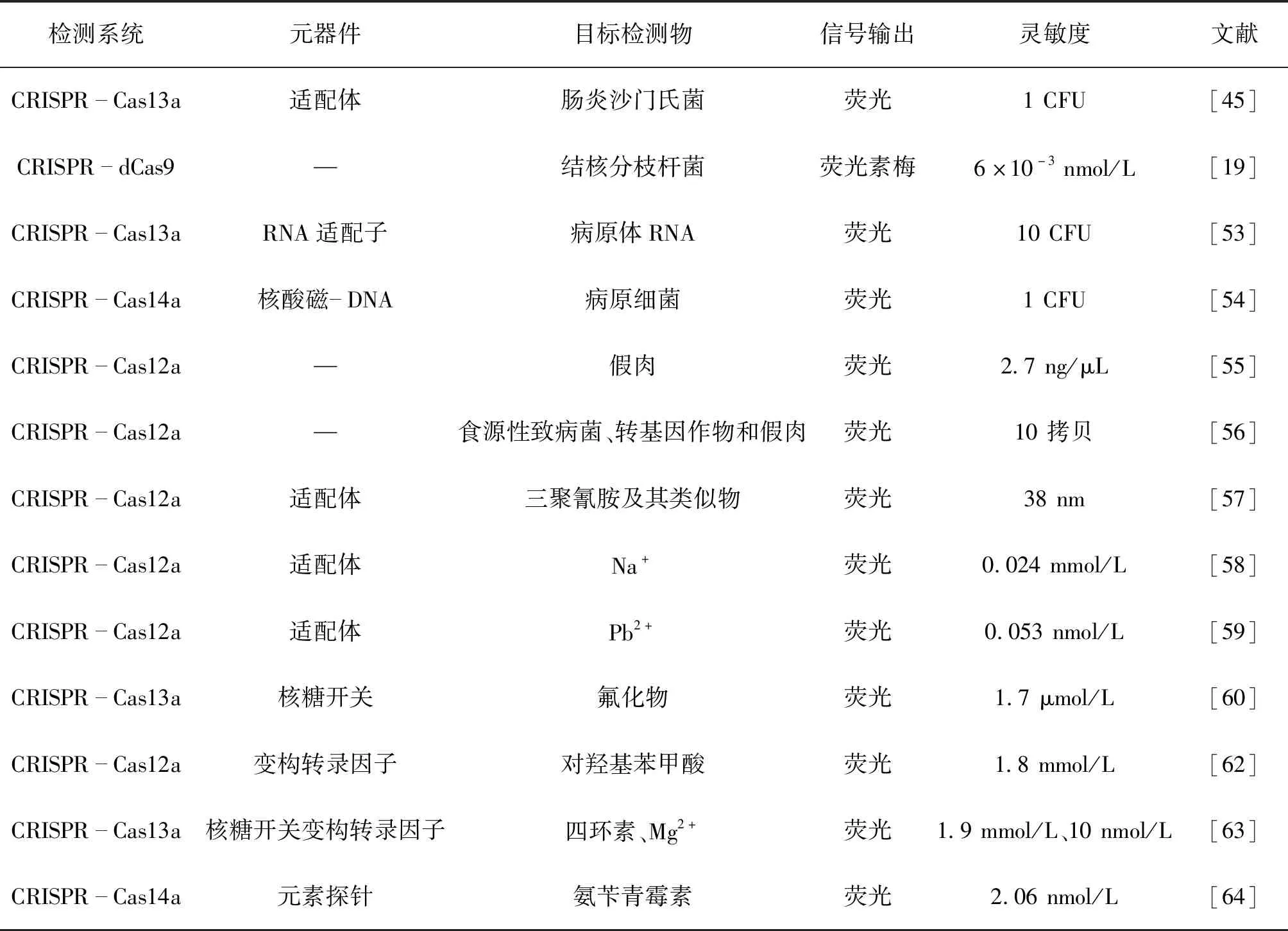
表3 基于CRISPR/Cas技术的食品检测应用Table 3 Applications of food detection based on CRISPR/Cas technology
3.2 食品掺假
随着食品产业快速发展、产业链不断延长和复杂化,食品掺假等问题严重损害消费者权益,危害消费者健康,已经成为一个不可忽视的问题。Wu等[55]针对清真食品掺假的风险问题,以猪肉细胞色素b基因为靶标,设计并优化了gRNA,允许从猪肉成分中特异性鉴定目标细胞色素b基因,然后激活Cas12蛋白的反式切割活性来检测食品掺假问题。Liu等[56]建立一种结合重组酶聚合酶扩增和CRISPR-Cas12a的食品安全检测技术(RPA-Cas12a-FS),可用于食源性致病菌、转基因作物和肉类掺假的分子鉴定。该系统可以在37 ℃下、在45 min内特异性地检测到低至10个拷贝的目的基因水平。Qiao等[57]基于CRISPR/Cas12a生物传感技术,开发了一种将适配体与之相结合的三聚氰胺灵敏快速检测方法。该方法在20 min内可检测出全脂牛奶试样中的三聚氰胺,检测限低至38 nm,同时对三聚氰胺等4种类似物显示出较高的选择性。
3.3 离子
随着食品工业技术的发展,导致一些金属离子进入食品当中,形成高毒性化合物,长期食用这类产品会导致慢性中毒现象。因此,食品当中的一些过量离子的检测也变得日趋重要。Xiong等[58]报道了一种受功能性DNA分子调控的基于CRISPR-Cas12a的检测系统,对有机小分子和金属离子的检测具有选择性。使用该方法,可以在环境温度(25 ℃)下简单快速(两步和15 min)地定量检测ATP和Na+。可以将这种CRISPR-Cas传感器系统显著地扩展到许多其他目标,从而提供了一个新的工具箱来显著地将CRISPR-Cas系统扩展到食品检测应用领域。Li等[59]利用LbaCas12a作为信号放大器,在功能核苷酸(脱氧核酶和适配体)的辅助下,开发了一个通用的CRISPR-Cas12a平台来检测范围广泛的超低浓度分析物,该平台能够实现对Pb2+的超灵敏生物检测,检测下限约为0.053 nmol/L。Ma等[60]通过串联传感器利用氟化物核糖开关来调节体外转录,并生成可被CRISPR-Cas13a识别的全长转录RNA,触发荧光团-淬灭剂标记的RNA探针的侧链裂解,并产生荧光信号输出。该系统可以在室温下定量检测水溶液中的氟化物,灵敏度高(检测下限≈1.7 μmol/L)、动态范围宽(0~800 μmol/L)、检出时间短(30 min),对其他常见阴离子有较高的选择性。
3.4 食品防腐剂、农兽药/抗生素残留
食品防腐剂是一类能抑制微生物繁殖、防治食品腐败变质的食品添加剂,农兽药/抗生素则在预防动物疾病及植物病虫害方面应用广泛。近年来,随着食品防腐剂、农兽药/抗生素的广泛使用,使得上述物质在食品中残留超标,严重危害人类身体健康[61]。因此,建立一套快速、灵敏的检测方法是保障食品安全的重要环节。Liang等[62]将aTF和CRISPR-Cas12a串联,开发了简单、超灵敏、快速和高通量小分子检测平台CaT-SMelor(CRISPR-Cas12a-and aTF-mediated small molecule detector),该平台可以检测不同类型的小分子,例如,涉及代谢性疾病诊断、抗生素残留和食品防腐剂的小分子。Iwasaki等[63]基于Cas13a开发了SPRINT(SHERLOCK-based profiling of in vitrotranscription)方法以在单批分析中检测小分子。该方法利用核糖开关或蛋白质通过特定的效应器分子来体外调节转录,将效应器浓度转换为荧光强度的耦合分析。作者定量了试样中的8种不同的化合物,包括辅因子、核苷酸、氨基酸代谢物、四环素和单原子离子,并且在几个小时得到结果。Hu等[64]开发了一种基于元素探针的CRISPR/Cas14检测平台,在室温(25 ℃)下,可在45 min内实现微量氨苄青霉素水溶液的定量检测,检测下限为2.06 nmol/L。
4 总结和展望
CRISPR系统不仅因为其强大的基因编辑能力而受到研究者的关注,最近它还被设计被生物传感器,感知食品当中的有毒有害物质:dCas9由于缺失核酸酶活性,但是保留了识别靶标的能力而被开发为检测器[19],Cas12a、Cas13a、Cas14a在识别靶标后,触发了其反式切割活性,切割带荧光基团的ssDNA/ssRNA,通过荧光信号就能使得检测出靶标的存在[5,25-26,28]。因此,基于CRISPR的检测技术具有靶标灵活性、简单性以及可编程性。然而,基于CRISPR的检测方法目前研究领域主要集中于核酸检测,对于非核酸分子的检测应用有限,而且,非核酸分子总是以复杂的基质存在食品中。功能性核酸/蛋白,例如,核糖开关[33-34]、转录因子[39-40]、适配体[47-48]等已经成为研究热点,并逐渐在现场、实时检测和诊断当中作为首要选择。尽管取得了进展,但是这些核酸/蛋白传感器缺乏通用的信号放大方法是限制灵敏生物测定的瓶颈,这也对准确定量提出了挑战。二者优势互补,CRISPR系统的信号放大能力和可编程性以及功能性核酸/蛋白在非核酸物质检测方面的突出表现为构建新型信号传感器提供了一个有用的工具箱。
由于元器件和配体之间的亲和力的不同,元器件和CRISPR串联后,对目标检测物的灵敏度也不尽相同,这就需要筛选突变文库获得亲和力更好的元器件,例如,利用噬菌体辅助进化[65]、点突变[66]和饱和突变[66]等技术对现有变构转录因子连续进化。此外,已有的元器件还远远不能满足食品中各类有害物质的检测,需要使用新兴方法,进一步大规模筛选与不同有毒有害物质结合的元器件,并建立详细的数据库,例如,利用机器学习方法[67]筛选更多新的蛋白和核糖开关。最后,可以通过多学科交叉融合的方式,迭代升级生物传感器的性能,实现检测信号的放大和仪器设备的便携性。未来食品检测,不仅仅局限于检测,应该构建“检测-清除”体系,对于一些食源性致病菌,可以尝试构建内源性CRISPR进行杀灭,彻底保障食品安全。
