炒莱菔子中萝卜苷、芥子碱硫氰酸盐在肠道菌群体外代谢的研究
2022-12-02盛华刚于绍华周洪雷朱立俏
高 磊, 张 茜,2, 盛华刚, 于绍华, 周洪雷, 朱立俏*
(1.山东中医药大学,山东 济南 250355;2.临沂高新技术产业开发区管理委员会,山东 临沂 276000)
莱菔子为十字花科植物萝卜RaphanussativusL.的干燥成熟种子,其味辛、甘,性平,归脾、胃、肺经,临床大多以炒制品入药,具有消食除胀、降气化痰的作用,可用于治疗饮食停滞、脘腹胀痛、大便秘结[1],有着降血压[2-3]、降血脂[4-5]、祛痰镇咳[6]、抗炎[7-8]、防癌[9]、消食[10]等活性,主要含硫苷[11-12]、生物碱[13]、脂肪酸[14]、黄酮[15-16]、多糖、蛋白质[17-18]等成分,以硫苷类成分萝卜苷和生物碱类成分芥子碱为代表。
中药大多以口服形式进入人体,首先会在消化道内进行生物转化,肠道菌群代谢是消化道内生物转化最重要的环节[19]。萝卜苷、芥子碱硫氰酸盐均为离子型化合物,属于强极性,故在肠道中较难吸收,生物利用度低,而肠道菌群会使两者发生代谢,生成疏水性更强的代谢产物,从而被机体吸收进入血液。目前,给予化学成分对肠道菌群的调节作用,以及肠道菌群代谢产物鉴定的研究较多[20-21],但鲜有涉及它们在肠道菌群作用下的规律。因此,本实验考察炒莱菔子中萝卜苷、芥子碱硫氰酸盐在大鼠肠道菌群作用下的体外代谢,以期为该药材开发提供依据。
1 材料
1.1 试剂与药物 炒莱菔子购于山东百味堂中药饮片有限公司(批号160101),经山东中医药大学药学院张芳教授鉴定为十字花科植物萝卜RaphanussativusL.的干燥成熟种子。芥子碱硫氰酸盐对照品(成都德斯特生物技术有限公司,批号DST160910-21);萝卜苷对照品(美国Cayman公司,批号0453522-24,纯度≥98%)。营养琼脂(批号20170838)、牛肉膏(批号20170502)购自北京奥博星生物技术有限责任公司;L-半胱氨酸(批号313E026)、胰蛋白胨(批号1939536)购自北京索莱宝生物科技有限公司;L-抗坏血酸(批号20150831)购自国药集团化学试剂有限公司;乙腈、甲醇为色谱纯(美国 Fisher公司);其他试剂均为分析纯;水为娃哈哈纯净水。
1.2 仪器 Agilent Techologies 1260 Infinity高效液相色谱仪(配置DAD检测器,美国Agilent Techologies公司);THZ-82A气浴恒温振荡器(江苏省金坛市医疗仪器厂);HFszfe-1200TE生物安全柜(上海力申科学仪器有限公司);LDZX-50FBS立式压力蒸汽灭菌器;厌氧产气袋(AnaeroPack-Anaero)、厌氧培养盒(Pack-Rectangular Jars)(日本三菱瓦斯化学株式会社);3K15型离心机(北京索莱宝科技有限公司);SZ-1快速混匀器(江苏金坛市金城国胜仪器厂);SCIENTZ-48高通量组织研磨器(宁波新芝生物科技股份有限公司);FA2004电子分析天平(上海精学科学仪器有限公司)。
1.3 动物 雄性健康SD大鼠,体质量200~220 g,购于济南朋悦实验动物繁育有限公司,动物生产合格证号SCXK(鲁)20140007。
2 方法
2.1 提取液制备 称取饮片约100 g,粉碎,加入12倍量水煎煮30 min,滤过,药渣再加10倍量水煎煮30 min,合并提取液,浓缩至每1 mL药液相当于0.4 g药材。量取适量,蒸馏水稀释至质量浓度为0.04 g/mL,过0.22 μm无菌微孔滤膜,即得。
2.2 肠道菌群代谢转化
2.2.1 厌氧培养液制备 参考文献[22]报道。A液为0.78%K2HPO437.5 mL,B液为0.47%KH2PO4、1.18%NaCl、1.2%(NH4)2SO4、0.12%CaCl2、0.25%MgSO4·H2O 37.5 mL,C液为8%Na2CO350 mL,将三者与0.5 gL-半胱氨酸、2 mL 25%L-抗坏血酸溶液、1 g牛肉膏、1 g蛋白胨、1 g营养琼脂混匀,加蒸馏水至1 L,盐酸调pH至7.5~8.0,即得。
2.2.2 大鼠肠道菌液制备 取大鼠2只,禁食不禁水12 h,取新鲜粪便0.4 g,加入4倍量生理盐水,组织匀浆机中充分混匀后5 000 r/min离心10 min,取上清液,即得,置于4 ℃冰箱中保存。
2.2.3 肠菌培养液制备 参考文献[23]报道。取大鼠肠道菌液2 mL,置于无菌培养皿中,加入厌氧培养液18 mL,混合均匀,置于厌氧培养盒中,加入厌氧产气袋后迅速盖上盒盖以保证厌氧环境,置于37 ℃气浴恒温振荡箱中培养24 h,即得。
2.2.4 实验操作 将肠菌培养液平均分为2份,每份10 mL,一份(有肠菌)中加入“2.1”项下提取液5 mL,作为给药组,而另一份(有肠菌)作为空白组;另取“2.1”项下提取液5 mL,加到10 mL厌氧培养液(无肠菌)中,作为对照组,将上述样品置于厌氧培养盒中,加入厌氧产气袋后迅速盖上盒盖以保证厌氧环境,置于37 ℃气浴恒温振荡箱中培养,于0、0.25、0.5、1、2、3、4、6、8、10、12、24 h时取出,加入10 mL甲醇涡混振摇3 min终止反应,8 000 r/min离心10 min,取上清液过0.22 μm微孔滤膜,作为供试品溶液。
2.3 色谱条件 InertSuatain AQ-C18色谱柱(4.6 mm×250 mm,5 μm);流动相乙腈(A)-0.1%磷酸(B),梯度洗脱(0~5 min,2%A;5~8 min,2%~5%A;8~10 min,5%~12.5%A;10~12 min,12.5%~14%A;12~25 min,14%~25%A;25~40 min,25%~50%A;40~50 min,50%~70%A;50~60 min,70%~100%A);体积流量1 mL/min;柱温27 ℃;检测波长225、326 nm;进样量20 μL。
2.4 对照品溶液制备 精密称取萝卜苷、芥子碱硫氰酸盐对照品适量,少量纯净水溶解后加预先灭菌的肠菌培养液,制成两者质量浓度分别为76、13.4 μg/mL的溶液,即得。
2.5 方法学考察
2.5.1 线性关系考察,吸取对照品溶液适量,8 000 r/min离心10 min,取上清液,过0.45 μm微孔滤膜,分别取1、5、10、20、40、60 μL,在“2.3”项色谱条件下进样测定,以峰面积为纵坐标(Y),进样量为横坐标(X)进行回归,得萝卜苷方程为Y=1 186.6X-154.8(R2=0.999 4),线性范围0.076~7.6 μg;芥子碱硫氰酸盐方程为Y=1 320.6X+20.612(R2=0.999 3),线性范围0.013 4~1.34 μg。
2.5.2 稳定性试验 取供试品溶液适量,于0、4、8、12、16、20、24 h在“2.3”项色谱条件下进样测定,测得萝卜苷、萝卜苷代谢产物、芥子碱硫氰酸盐、芥子碱硫氰酸盐代谢产物峰面积RSD分别为2.40%、2.39%、4.41%、4.65%,表明溶液在24 h内稳定性良好。
2.5.3 精密度试验 取供试品溶液适量,在“2.3”项色谱条件下进样测定6次,测得萝卜苷、萝卜苷代谢产物、芥子碱硫氰酸盐、芥子碱硫氰酸盐代谢产物峰面积RSD分别为1.99%、1.15%、3.76%、0.47%,表明仪器精密度良好。
2.5.4 重复性试验 按“2.2.4”项下方法平行制备供试品溶液6份,在“2.3”项色谱条件下进样测定,测得萝卜苷、萝卜苷代谢产物、芥子碱硫氰酸盐、芥子碱硫氰酸盐代谢产物峰面积RSD分别为2.10%、4.67%、4.79%、3.59%,表明该方法重复性良好。
2.5.5 专属性试验 取“2.2”项下各培养液,在“2.3”项色谱条件下进样测定,结果见图1。由此可知,萝卜苷、芥子碱硫氰酸盐保留时间分别为4.57、21.34 min,而两者代谢产物分别为16.33、28.77 min,并且大鼠肠菌液和厌氧培养液不干扰测定,表明该方法专属性良好。
2.5.6 加样回收率试验 取孵育某一时间点、各成分含量已知的肠道菌群培养液6份,精密加入适量对照品溶液,按“2.2”项下方法制备供试品溶液,在“2.3”项色谱条件下进样测定,计算回收率。结果,萝卜苷、芥子碱硫氰酸盐平均加样回收率分别为92.35%、97.12%,RSD分别为6.26%、6.93%。
2.6 降解率、生成率测定 取“2.2”项下供试品溶液,在“2.3”项色谱条件下进样测定,标记在肠道菌群孵育过程中发生变化的特征峰,记录峰面积,分别按Qi=(1-Ai/A0)×100%、Qd=(Ed/A0)×100%计算萝卜苷、芥子碱硫氰酸盐、芥子酸苷降解率及其代谢产物生成率,并绘制转化曲线[24]。其中,Qi为某一时间点的降解率,A0为0 h时1、2号峰的峰面积之和或4、5、7、9号峰的峰面积之和,Ai为某一时间点1、2号峰的峰面积之和或4、5、7、9号峰的峰面积之和,Qd为某一时间点代谢产物的生成率,Ed为某一时间点代谢产物的峰面积。
2.7 降解动力学参数测定 以萝卜苷、芥子碱硫氰酸盐质量浓度为纵坐标,时间为横坐标,分别采用零级方程、一级方程、非线性动力学方程进行线性拟合,通过相关系数(R2)来判断拟合程度。
3 结果
3.1 样品测定 将提取液不同肠道菌群孵育时间的225 nm波长处HPLC色谱图导入“中药色谱指纹图谱相似度评价系统(2012版)”软件,得到HPLC叠加图,标记9个孵育时间发生变化的特征峰,见图2。通过Agilent色谱工作站导出1~3号特征峰(225 nm)和4~9号特征峰(326 nm)在不同肠道菌群孵育时间的峰面积,见表1。
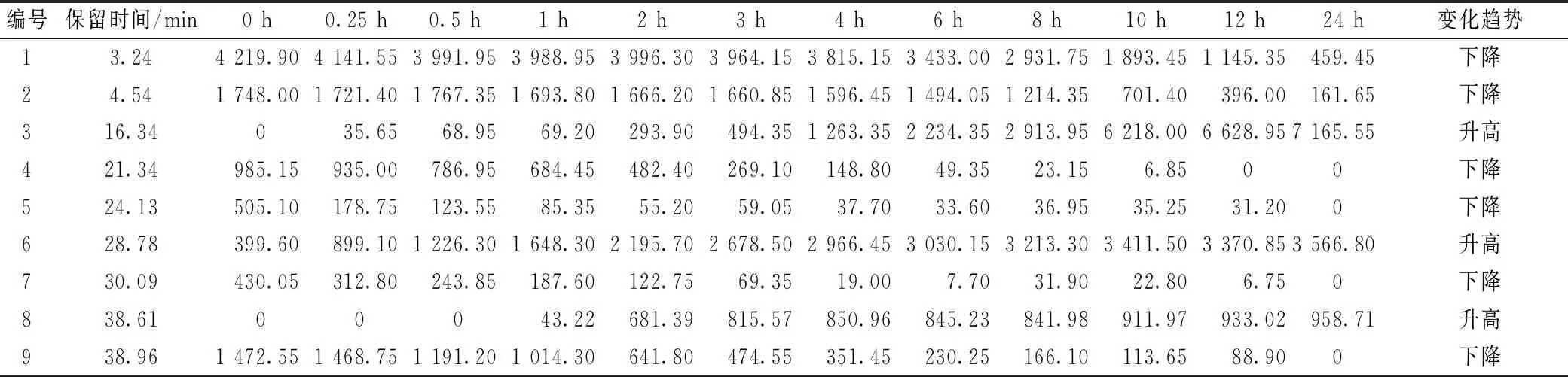
表1 不同肠道菌群孵育时间特征色谱峰的峰面积
1、2号峰(萝卜苷)在大鼠肠道菌群作用下随着共孵育时间延长,两者峰面积均减小,前8 h程度缓慢,在8 h时分别为0 h的69.97%、68.47%,10 h时分别为0 h的32.39%、28.81%;随着1、2号峰峰面积的降低,3号峰峰面积逐渐升高,24 h时达到最大值。由此推测,1、2号峰在大鼠肠道菌群作用下发生降解,代谢产物峰为3号峰。
在326 nm波长处,芥子碱硫氰酸盐(4号峰)随着共孵育时间延长,其峰面积降低,在8 h时仅为0 h的3.14%;保留时间为28 min的6号峰(芥子酸)峰面积逐渐升高。由此推测,芥子碱硫氰酸盐在大鼠肠道菌群作用下的代谢产物为6号峰,并通过对照品比对确定为芥子酸。
炒莱菔子中本身含有芥子酸,故在0 h时就检测到6号峰;10 h后4号峰(芥子碱硫氰酸盐)被代谢完全,峰面积为0,但6号峰峰面积仍在增加,提示除芥子碱硫氰酸盐外,还有其他成分在大鼠肠道菌群下也会被代谢为6号峰;随着孵育时间延长,5、7、9号峰峰面积也在逐渐减小。查阅文献[25]发现,炒莱菔子除了含芥子碱硫氰酸盐外,还含芥子酸葡萄糖苷、(Z)-β-D-(3-芥子酰基)呋喃果糖基-α-D-葡萄糖苷、(E)-β-D-(3-芥子酰基)呋喃果糖基-α-D-葡萄糖苷,它们会断裂其葡萄糖苷键得到芥子酸。
3.2 转化曲线 萝卜苷及其代谢产物的生成曲线见图3,芥子碱硫氰酸盐及芥子酸衍生物、芥子酸生成曲线见图4。
在0、0.25、0.5、1、2 h时,萝卜苷降解率分别为0、1.5%、2.5%、4.0%、4.5%,降解速率较慢;在3、4、6、8、10 h时,其降解率分别为5.2%、8.1%、18.3%、30.0%、68.8%,即在肠菌作用下被大量降解,8~10 h降解速率最快;在10 h后,其降解曲线趋于平缓。
在0、0.25、0.5、1、2、3、4、6 h时,萝卜苷代谢物生成率分别为0、0.90%、1.13%、1.23%、5.10%、8.79%、18.76%、26.49%,上升速率较慢;在8、10 h时,其生成率分别为50.00%、111.50%,即大量产生;在10 h后,其生成率趋于平缓。
在0、0.25、0.5、1、2、3、4、6 h时,芥子碱硫氰酸盐及其他成分降解率分别为0、15.8%、32.5%、43.52%、62.87%、75.27%、84.31%、90.98%;在12 h时,其降解率为96.31%,几乎被代谢完全。
在0、0.25、0.5、1、2、3、4 h时,芥子酸生成率分别为0、14.12%、23.36%、35.28%、50.66%、67.34%、70.76%;在12 h时,其生成率为86.21%;12 h后,其生成率仍在升高,但程度缓慢。
3.3 肠道菌群转化动力学研究 萝卜苷零级方程、一级方程、非线性动力学方程分别为Y=-0.011 2X+0.258 (R2=0.852 1)、lnY=-0.096 7X-1.274 2 (R2=0.967 7)、Y=0.243 6+0.013 6X-0.004 0X2+0.000 1X3(R2=0.986 0),即其体外代谢过程更符合非线性动力学方程;芥子碱硫氰酸盐三者分别为Y=-0.004 8X+0.030 8 (R2=0.860 9)、lnY=-0.643 0X-3.042 2 (R2=0.979 6)、Y=0.036 72-0.012 86X+0.001 47X2-0.000 05X3(R2=0.997 0),即其体外代谢过程也符合非线性动力学方程。
4 讨论
本实验通过文献查阅及对照品比对,确定芥子碱硫氰酸盐的代谢产物为芥子酸,对萝卜苷的代谢产物没有进行定性鉴别及纯化制备。由表1可知,除峰3(16.34 min)和峰6(28.78 min)外,峰8(38.61 min)峰面积在逐渐增加,紫外吸收在326 nm波长处,推测为芥子碱硫氰酸盐除芥子酸外的其他转化。
萝卜苷在甲醇溶液中时,会发生转化,由原来的1个峰(4.54 min)转化为2个峰,保留时间分别为3.24、4.54 min,而在乙腈中并未有此转化发生。肉苁蓉中松果菊苷也有类似现象发生,松果菊苷在甲醇中的转化途径主要包括糖苷键水解、甲基化和顺式/反式异构化[26]。
今后,本实验将采用离体代谢方法证明炒莱菔子中的萝卜苷、芥子碱硫氰酸盐及其他葡萄糖苷类化合物会在肠菌作用下发生生物转化生成相应的代谢产物,并且分析其代谢转化规律。
