合成MRI定量评估妊娠高血压孕妇子代脑发育异常
2022-12-01邢庆娜张小安
张 丁,赵 鑫,邢庆娜,张小安
(郑州大学第三附属医院影像科,河南 郑州 450051)
妊娠高血压(gestational hypertension, GH)是孕妇最常见死亡原因之一,可在不同程度上影响其子代神经发育。孕妇罹患GH与其子代注意力缺陷/多动障碍(attention deficit/hyperactivity disorder, ADHD)及其他神经发育障碍有关[1-3];早期判断GH孕妇子代脑发育状况对早期诊断并治疗相关疾病和改善预后具有重要价值。合成MRI(synthetic MRI, SyMRI)可定量评估T1、T2值,提供更多弛豫值和颅脑容积分割[4]等相关信息。本研究观察SyMRI定量分析GH孕妇子代脑发育异常的价值。
1 资料与方法
1.1 一般资料 选择2020年7月—2021年7月郑州大学第三附属医院25例早产儿(观察组),产妇均符合第9版《妇产科学》[5]诊断GH标准;以同期无高危围产因素的33例早产儿为对照组;于纠正胎龄(postmenstrual age, PMA,即出生胎龄+接受颅脑MR检查时周龄)为37~45周时行颅脑MR检查。排除标准:①合并其他高危围产因素,如产妇妊娠期糖尿病、新生儿胆汁淤积综合征等;②罹患脑膜炎等感染性疾病或存在染色体或遗传代谢等疾病。本研究通过院伦理委员会批准[(2020)医伦审查第108号]。
1.2 仪器与方法 采用GE Signa Pioneer 3.0T MR扫描仪。经静注苯巴比妥(5~10 mg/kg体质量)镇静患儿,待熟睡后使其仰卧于检查床,外耳道塞入棉球,以海绵固定头部,采集轴位、矢状位T1WI(TR 2 198 ms,TE 4.62 ms)、轴位T2WI(TR 8 000 ms,TE 6.22 ms),并行弥散加权成像及SyMRI(TR 4 266 ms,TE 19.4 ms);FOV 20 cm×20 cm,激励次数1,矩阵288×224,层数22,层厚4 mm,层间距1 mm,总扫描时间4 min 15 s。
1.3 图像处理及分析 由2名有10年以上工作经验的影像科副主任医师于SyMRI 8.0后处理工作站共同分析图像,分别于胼胝体压部、内囊后肢、额叶白质、枕叶白质、顶叶白质、半卵圆中心白质、丘脑腹外侧核、尾状核、豆状核及小脑处勾画面积为(10±2)mm2的ROI,除胼胝体压部外均使ROI位于双侧对称结构的中心,软件自动测算T1、T2值(图1、2)。
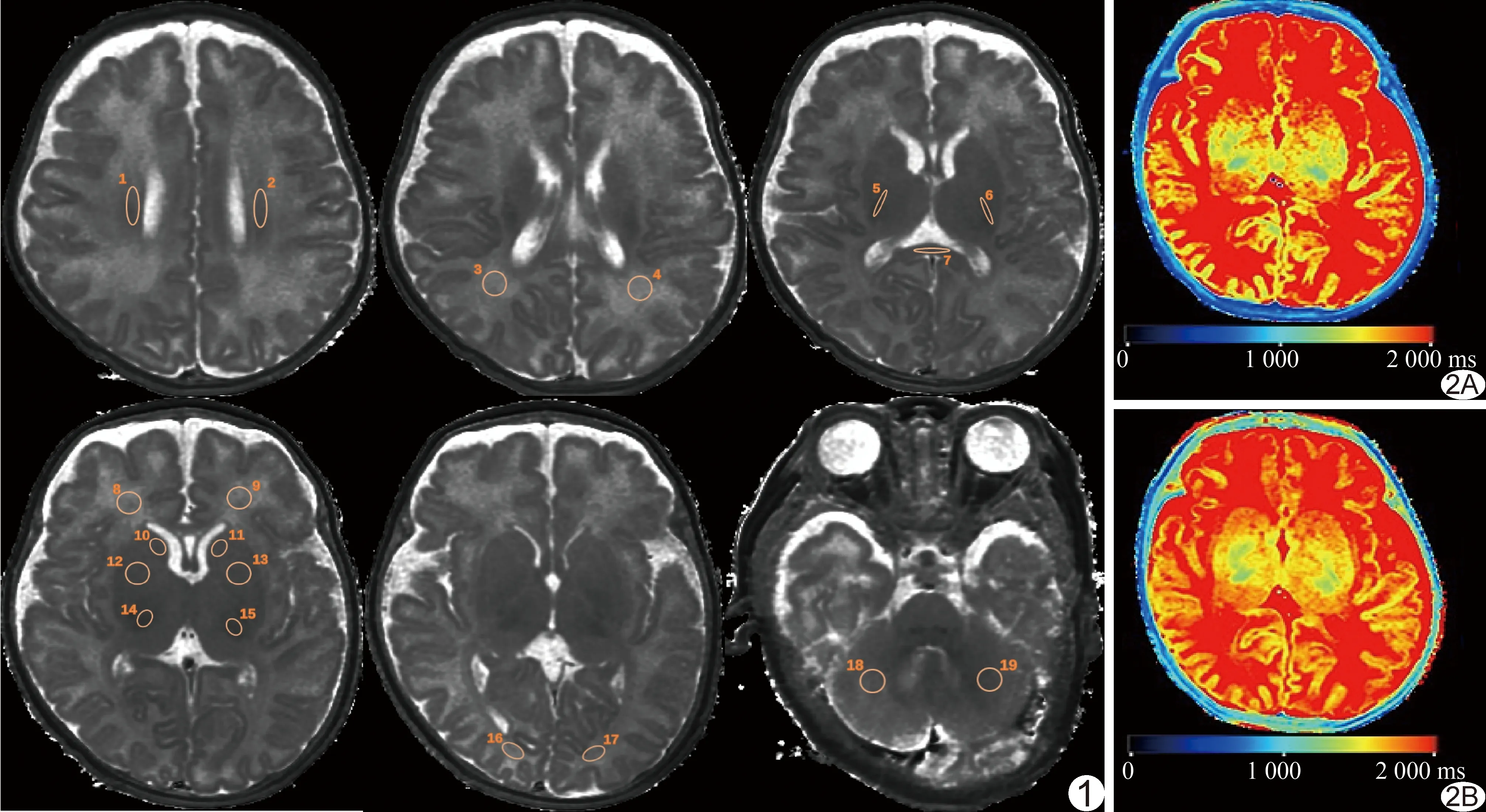
图1 各脑区ROI示意图 (圈1、2:半卵圆中心白质;圈3、4:顶叶白质;圈5、6:内囊后肢;圈7:胼胝体压部;圈8、9:额叶白质;圈10、11:尾状核;圈12、13:豆状核;圈14、15:丘脑腹外侧核; 圈16、17:枕叶白质;圈18、19:小脑) 图2 胎龄34+3周、PMA 38周女性GH早产儿,颅脑SyMRI A、B.分别示各脑区T1及T2值
1.4 统计学分析 采用SPSS 24.0统计分析软件。以Shapiro-Wilk进行正态性检验,以±s表示符合正态分布者,组间比较用独立样本t检验;以中位数(上下四分位数)表示不符合者,行Mann-WhitneyU检验。采用χ2检验比较计数资料。以Pearson相关性分析观察各脑区T1、T2值与PMA的相关性。采用受试者工作特征(receiver operating characteristic, ROC)曲线评估各脑区差异有统计学意义的T1、T2值诊断GH早产儿脑发育异常的效能。P<0.05为差异有统计学意义。
2 结果
2.1 基线资料 2组患儿性别、胎龄、PMA、出生体质量、是否为双胎之一,以及孕妇分娩方式和年龄均无统计学意义(P均>0.05),见表1。
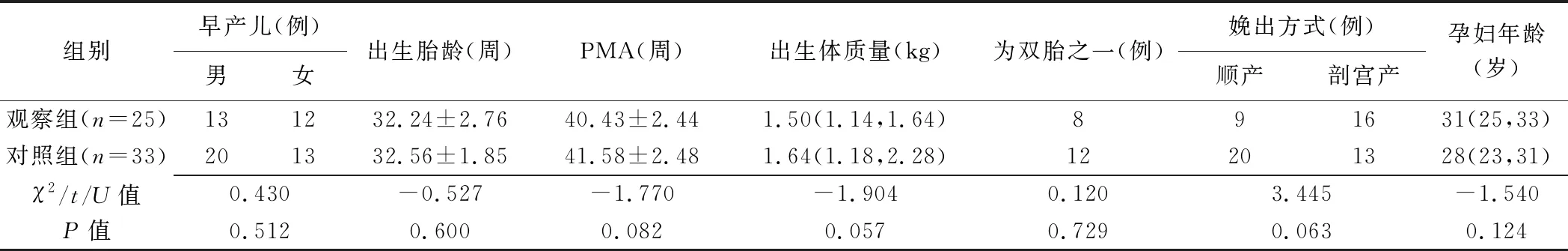
表1 58例早产儿及产妇基线资料比较
2.2 各脑区T1、T2值 观察组内囊后肢、顶叶白质、枕叶白质、半卵圆中心白质、丘脑腹外侧核、尾状核、豆状核及小脑T1值均大于对照组(P均<0.05),见图3;胼胝体压部、内囊后肢、顶叶白质、半卵圆中心白质、丘脑腹外侧核、尾状核及小脑的T2值均大于对照组(P均<0.05),见图4。
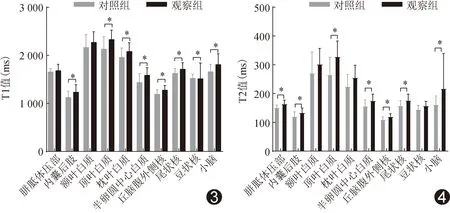
图3 GH早产儿与无高危围产因素早产儿各脑区ROI内T1值比较 (*:组间比较P<0.05) 图4 GH早产儿与无高危围产因素早产儿各脑区T2值比较 (*:组间比较P<0.05)
2.3 T1、T2值与PMA的相关性 观察组:除胼胝体压部、豆状核及小脑外,各脑区T1值均与PMA呈负相关;除额叶白质及小脑外,各脑区T2值均与PMA呈负相关(P均<0.05)。对照组:除胼胝体压部外,各脑区T1值均与PMA呈负相关;各脑区T2值均与PMA呈负相关(P均<0.05)。见表2。
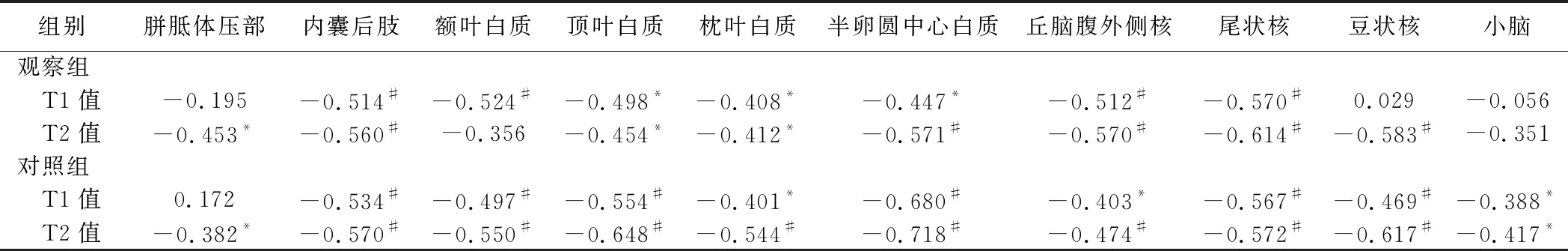
表2 58例早产儿各脑区ROI内T1、T2值与PMA的相关性
2.4 诊断效能 ROC曲线结果显示,顶叶白质及丘脑腹外侧核T1、T2值及胼胝体压部T2值诊断GH早产儿脑发育异常的曲线下面积(area under the curve,AUC)均>0.70(P均<0.05)。见表3、图5。
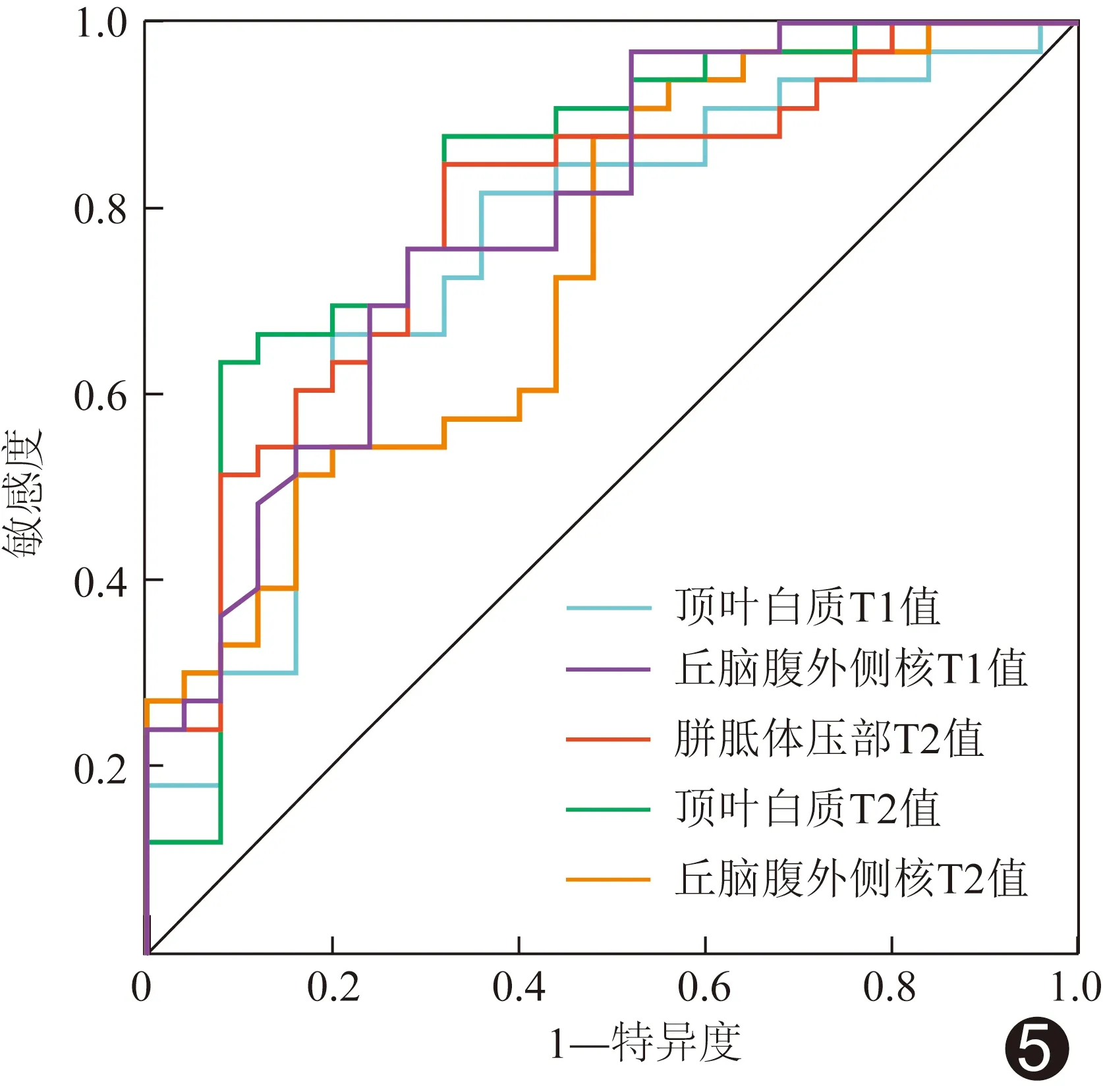
图5 各脑区T1、T2值诊断GH早产儿脑发育异常的ROC曲线
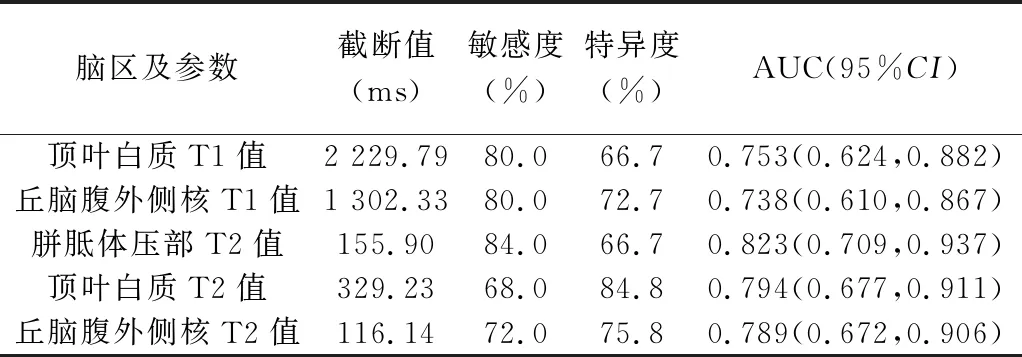
表3 各脑区T1、T2值诊断GH早产儿脑发育异常的效能
3 讨论
GH致胎盘血流灌注不足,促进炎症因子释放,炎症因子通过血液循环进入胎儿脑部,使少突胶质细胞发育障碍,表现为子代脑发育迟缓或异常[6-8]。本研究发现,观察组内囊后肢、顶叶白质、枕叶白质、半卵圆中心白质、丘脑腹外侧核、尾状核、豆状核及小脑T1值均大于对照组,胼胝体压部、内囊后肢、顶叶白质、半卵圆中心白质、丘脑腹外侧核、尾状核及小脑T2值均大于对照组。既往研究[8]报道,胎儿足月时,内囊后肢、丘脑、基底核和小脑已有部分髓鞘形成;由此推测,GH最先损害子代快速发育的脑组织。MUNOZ-MORENO等[9]发现,宫内生长受限早产儿的大脑皮质-基底核-丘脑-大脑皮质环路的各向异性分数值降低,且与其神经发育不良相关。本研究观察组顶叶白质、枕叶白质、尾状核及丘脑的弛豫时间均较对照组延长,推测孕妇GH使子代顶、枕叶白质释放炎症因子并产生氧化应激,致脑白质髓鞘化障碍,表现为弛豫时间延长,提示GH子代宫内生长受限、脑发育相对落后;组间顶、枕叶白质T1值差异显著而额叶白质差异无统计学意义,符合脑成熟从后向前、从下向上、从中心向四周延展的规律[10-12]。
本研究对照组多数脑区T1、T2值与PMA呈负相关,与既往研究[9]结果相符,2组早产儿发育趋势相似,但仅内囊后肢、丘脑腹外侧核及尾状核的T1和T2值与PMA呈显著负相关(P均<0.001);分析原因,推测胎儿足月时内囊后肢处于快速发育阶段,故其T1、T2值与PMA的相关性较高,丘脑腹外侧核和尾状核T1和T2值可能与其内神经细胞密度、铁浓度、髓磷脂及蛋白质含量等有关[13],而其他脑区T1、T2值与PMA相关性相对较弱或无明显相关可能为GH造成子代部分脑区髓鞘化进程延迟或停滞所致。
ROC曲线结果显示,本研究根据顶叶白质及丘脑腹外侧核T1、T2值及胼胝体压部T2值诊断GH早产儿脑发育异常的AUC均>0.70,其中胼胝体压部T2值的AUC最高,为0.823,提示SyMRI可用于诊断GH子代神经发育障碍,而胼胝体压部T2值对GH子代大脑相对缺氧较为敏感;组间胼胝体压部T1值差异无统计学意义,原因可能在于胼胝体生长发育与宫内环境及其他中枢神经系统发育相互制衡[14],抑或与样本量过小有关。
综上所述,SyMRI有助于早期发现GH子代脑发育异常,为早期评估及干预GH孕妇子代脑发育提供临床依据。本研究的主要局限性在于样本量小,而影响弛豫时间的因素较多,且未随访观察GH早产儿远期神经发育状况,有待后续进一步完善。
