采前氨基寡糖素喷施通过激活苯丙烷途径促进采后厚皮甜瓜愈伤
2022-11-30李宝军刘志恬薛素琳柴秀伟李志程DovPRUSKY张锋岗
李宝军,刘志恬,薛素琳,柴秀伟,李志程,毕 阳,*,Dov PRUSKY,张锋岗
(1.甘肃农业大学食品科学与工程学院,甘肃 兰州 730070;2.以色列农业研究组织农产品采后科学部,以色列 里雄莱锡安 7505101;3.海南正业中农高科股份有限公司,海南 海口 570216)
厚皮甜瓜果实具有愈伤能力,在受到机械损伤后,可在伤口表面形成愈伤封闭层。封闭层主要由软木脂和木质素构成,而软木脂主要包括聚酚软木脂(suberin polyphenolic,SPP)和聚酯软木脂[1],前者由阿魏酸、肉桂酸等酚酸以酯键和醚键相互连接而成[2],后者由ω-羟基脂肪酸、α,ω-二元酸、C16~C28中长链脂肪酸和脂肪醇等以酯键相互连接而成[3],封闭层的形成能有效抑制水分蒸腾,抵御病原物的侵染[4]。但果实自然愈伤需要较长的时间,期间易发生失水和腐烂,因此,需要采取措施加速果实的愈伤过程。氨基寡糖素(amino oligosaccharide,AOS)是一种安全且环境友好的水溶性低聚糖,由壳聚糖通过生物降解获得[5]。AOS具有调节植物生长发育[6]、诱导植物抗病性的作用[7-8]。有研究表明,AOS处理可有效诱导多种果实的采后抗病性,包括由Alternaria alternata引起的冬枣和杏黑斑病[9-10]、由Colletotrichum musae引起的香蕉炭疽病[11]、由Monilinia fructicola引起的桃褐腐病[12]以及由Penicillium italicum和P. digitatum引起的柑橘青霉病和绿霉病[13]。AOS诱导果实的抗病机制涉及苯丙烷代谢关键酶的活化以及阿魏酸、p-香豆酸和咖啡酸等酚类物质的积累[13]。此外,AOS还可提高柑橘果实中过氧化氢的水平[14],上调果实中病程相关蛋白基因的表达水平,提高防御酶活力[15]。尽管已有AOS诱导果实采后病害及相关机制的报道,但AOS采前喷施是否影响采后果实愈伤尚鲜见报道。本研究用2 mL/L AOS在‘玛瑙’厚皮甜瓜果实发育的幼果期、膨大前期、膨大后期及成熟期进行4 次喷施,评价采前喷施对采后果实愈伤期间质量损失率及病情指数的影响,观察伤口处SPP和木质素的沉积情况,分析苯丙烷代谢关键酶活力和过氧化物酶活力,以及代谢产物和H2O2含量变化,以期为厚皮甜瓜的快速愈伤提供方法及理论依据。
1 材料与方法
1.1 材料与试剂
‘玛瑙’厚皮甜瓜种子购于张掖市金种源种业有限公司,种植于甘肃省民勤县收成乡,果实在花后45 d采收。选择大小均匀、未受机械和病虫害影响的果实,并将单个果实套网后装箱,第2天运至本实验室,在常温(22±2)℃、相对湿度55%~65%下贮藏待用。
粉红单端孢(Trichothecium roseum)由本实验室提供,于马铃薯葡萄糖琼脂培养基上保存待用。
AOS由海南正业中农高科股份有限公司提供,有效质量分数5%,聚合度在2~8之间,相对分子质量在324~1 296之间。
正己烷、亚硝酸钠、乙酸、硝酸铝、丙酮、硼酸、氯化羟胺、溴化乙酰 国药集团化学试剂有限公司;愈创木酚、中性红 天津市光复精细化工研究所;甲苯胺蓝 上海中秦化学试剂有限公司;β-巯基乙醇、盐酸、小檗碱、聚乙烯吡咯烷酮(polyvinylpyrrolidone,PVP) 北京索莱宝科技有限公司;L-苯丙氨酸上海凛恩科技发展有限公司;福林-酚、Triton X-100北京酷来搏科技有限公司。
1.2 仪器与设备
CX21FSIC型光学显微镜、BX51型荧光显微镜日本奥林巴斯工业有限公司;UV-2450型紫外-可见光分光光度计 日本岛津仪器有限公司;SW-CJ-2FD型超净工作台 苏净集团苏州安泰空气技术有限公司;H-1850R型高速冷冻离心机 长沙湘仪离心机仪器有限公司;LDZX-30KBS型紫立式压力蒸汽灭菌锅 上海申安医疗器械厂;1510-04087型酶标仪 赛默飞世尔(上海)仪器有限公司;DHP-9082型恒温培养箱 上海一恒科学仪器有限公司;DW-HL218型超低温冰箱 中科美菱低温科技有限公司;A11 basic S025型研磨机艾卡(广州)仪器设备有限公司;MT201型电子秤深圳市美孚电子有限公司。
1.3 方法
1.3.1 AOS溶液的配制及田间喷施
参照Wang Bin[4]和谢东锋[16]等的方法,将AOS直接溶于自来水配制成剂量为2 mL/L(每1 mL稀释500 倍)的水溶液。在果实发育的4 个时期(幼果期、膨大前期、膨大后期及成熟期)用2 mL/L AOS对植株和果实进行喷施。在晴天下午16—17时采用农用喷雾器喷施,每1 L药液喷施20~25 株。以含体积分数0.1%烷基糖苷的自来水(参照海南正业公司药剂配方)喷施作对照组。每次处理150 株,重复3 次。
1.3.2 孢子悬浮液的制备
孢子悬浮液的制备参照Ge Yonghong等[17]的方法。在培养T.roseum1 周的培养皿中加入一定量的无菌水,用涂布器均匀的刮下孢子后通过4 层厚棉布过滤并振荡15 s,然后用血球计数板计数并将孢子浓度调至1.0×106个/mL。
1.3.3 果实的人工损伤及愈伤
参照Wang Bin等[4]的方法,甜瓜果实清洗后用体积分数1%次氯酸钠浸泡3 min,置于室温下晾干。随后,使用不锈钢剥皮器在赤道周围刮出4 个人工伤口(10 cm×2 cm×1.2 mm)。损伤果实在常温(22±2)℃、相对湿度55%~65%的黑暗条件下愈伤。每次处理200 个果实,重复3 次。
1.3.4 质量损失率和病情指数的测定
质量损失率的测定采用称质量法,分别在愈伤过程中的第0、1、3、5、7天称果实质量,每次处理9 个果实,重复3 次,质量损失率计算如公式(1)所示。

病情指数的测定参照Wang Bin等[4]的方法,甜瓜果实接种T. roseum,在果实损伤后的第0、1、3、5、7天,将20 μL上述孢子悬浮液涂布于伤口表面,黑暗常温培养7 d后统计发病级别。每次处理8 个果实,重复3 次。病情指数计算如公式(2)所示。

式中:发病级别标准分别为:5级,表面100%发病;4级,表面75%~100%发病;3级,表面50%~75%发病;2级,表面25%~50%发病;1级,表面0%~25%发病;0级,表面不发病。
1.3.5 果实愈伤过程中SPP及木质素沉积情况观察
SPP的沉积观察参照Fugate等[18]的方法。用不锈钢双面刀片垂直伤口表面切出0.2~0.3 mm厚的薄片。先用质量分数0.1%小檗碱染色45 min后,吸去染料,用蒸馏水和75%(体积分数,下同)乙醇溶液各冲洗3 遍,再用95%乙醇溶液冲洗2 遍,脱去染料,然后在质量分数0.25%甲苯胺蓝中放置1~2 min进行复染,最后用蒸馏水和75%乙醇溶液洗去染料。采用荧光显微镜观察切片中紫蓝色SPP沉积情况。
木质素沉积情况参照Alba等[19]的方法观察。用不锈钢双面刀片垂直于伤口表面切出0.2~0.3 mm厚的薄片。先用蒸馏水浸泡冲洗数遍,以除去切片组织中的淀粉颗粒,随后置于载玻片上,滴加质量分数1%间苯三酚染色1.5 min后,再加1~2 滴浓盐酸。采用荧光显微镜观察切片中红色木质素沉积情况。
果实愈伤组织中的SPP和木质素细胞层厚度测定参照Oirschot等[20]的方法,通过IS Capture软件进行计算。
1.3.6 生化指标的测定
参照Wang Bin等[4]的方法,在果实愈伤的第0、1、3、5、7天,用手术刀垂直伤口表面切取下部2~3 mm处的组织,液氮冷冻后,用研磨机磨成粉末,于-80 ℃下保存,用于生化指标测定。
1.3.6.1 酶活力的测定
苯丙氨酸解氨酶(phenylalanine ammonia lyase,PAL)活力的测定参照Koukol等[21]的L-苯丙氨酸法。取冷冻粉末3.0 g,于5 mL硼酸-硼砂缓冲液(pH 8.8,含质量浓度40 g/L PVP、2 mmol/L EDTA和5 mmol/Lβ-巯基乙醇)中,冰浴下研磨成浆状,在4 ℃、12 000×g下离心30 min,上清液即为粗酶液。反应体系为3 mL 50 mmol/L pH 8.8硼酸-硼砂缓冲溶液和0.5 mL 20 mmol/L的L-苯丙氨酸,在37 ℃水浴锅中放置10 min后加入0.5 mL粗酶液混匀后倒入比色皿中,在290 nm波长处测定吸光度作为初始值随后将混合液在37 ℃水浴锅中保温1 h,结束后立即测定混合液在290 nm波长处的吸光度作为终止值。以每小时290 nm波长处吸光度变化0.01为一个酶活力单位(U),PAL活力以U/gmf表示。
过氧化物酶(peroxidase,POD)活力的测定参照姜爱丽等[22]的愈创木酚法。取冷冻粉末2.0 g,加入5 mL乙酸-乙酸钠提取缓冲液(pH 5.5,含1 mmol/L PEG、质量分数4%交联聚乙烯吡咯烷酮和体积分数1% Triton X-100溶液),于4 ℃、8 000 r/min条件下离心30 min,收集上清液即为粗酶液。反应体系为3.0 mL 25 mmol/L愈创木酚溶液、0.3 mL酶提取液和0.1 mL 0.5 mol/L H2O2溶液。反应15 s后测定混合液在470 nm波长处的吸光度,测定持续2 min,以蒸馏水作为参比。以每分钟470 nm波长处吸光度变化1为一个活力单位(U),POD活力以U/gmf表示。
1.3.6.2 总酚和类黄酮含量的测定
总酚和类黄酮含量的测定参照Scalbert等[23]的方法。取冷冻粉末1.0 g,加入5 mL含体积分数0.5%乙酸与体积分数70%丙酮的水溶液提取愈伤组织中的总酚和类黄酮,在4 ℃、8 000 r/min条件下离心30 min,收集上清液后测定其含量。于760 nm波长处测定OD值,并以没食子酸(gallic acid,GAE)为标准物质,通过绘制该物质的标准曲线得到标准曲方程,并计算总酚含量,结果以mg/100 gmf表示。于510 nm波长处测定OD值,并以儿茶素(catechin,CE)为标准物质,通过绘制该物质的标准曲线来计算类黄酮含量,结果以mg/100 gmf表示。
1.3.6.3 木质素含量的测定
木质素含量测定参照Hammerschmidt等[24]的方法。取冷冻粉末1.0 g,加入3 mL预冷的95%乙醇溶液,于4 ℃、8 000 r/min离心30 min,弃去上清液,将沉淀物用95%乙醇溶液洗涤3 次,用乙醇与正己烷混合溶液(V(乙醇)∶V(正己烷)=1∶2)冲洗3 次,将清洗后的沉淀物在烘箱中干燥24 h,然后溶于1 mL体积分数25%溴化乙酰-冰醋酸溶液,在70 ℃下水浴30 min,随后加入1 mL 2 mol/L NaOH溶液终止反应,再加入2 mL冰醋酸和0.1 mL 7.5 mol/L盐酸羟胺,于4 ℃、8 000 r/min条件下离心30 min,取上清液0.5 mL并用冰醋酸定容至5 mL,于280 nm波长处测定OD值,木质素含量以OD280nm/gmf表示。
1.3.6.4 H2O2含量的测定
H2O2含量的测定参照Prochazkova等[25]的方法。取冷冻粉末1.0 g,加入3 mL冷丙酮,冰浴研磨成匀浆后于4 ℃、12 000 r/min离心20 min。取1 mL上清液,加入100 µL体积分数20%四氯化钛溶液(V(盐酸)∶V(四氯化钛)=4∶1)和200 µL浓氨水,混匀反应5 min后离心15 min。沉淀部分用冷丙酮洗涤4 次以减少色素的干扰,最后将沉淀溶于1.5 mL 1 mmol/L H2SO4溶液中,于415 nm波长处测定OD值,H2O2含量单位以μmol/gmf表示。
1.4 数据统计与分析
实验至少重复3 次,数据用Microsoft Excel 2019软件计算平均值和标准误差,采用SPSS 21.0软件进行Duncan’s差异显著性(P<0.05)和Pearson’s相关性分析,用Origin 2017软件作图。
2 结果与分析
2.1 AOS采前喷施对采后果实愈伤期间质量损失率和病情指数的影响
随着愈伤时间的延长,AOS喷施处理组和对照组果实的质量损失率逐渐升高,在愈伤的第5、7天,AOS组显著低于对照组(P<0.05),第7天时AOS喷施处理的质量损失率低于对照组28.64%(P<0.05)(图1A)。AOS组和对照组果实的病情指数随着愈伤时间的延长逐渐降低,AOS组显著低于对照组(P<0.05),第7天时AOS喷施处理的病情指数低于对照组32.00%(P<0.05)(图1B)。上述结果表明,AOS采前喷施可有效促进采后厚皮甜瓜的愈伤。
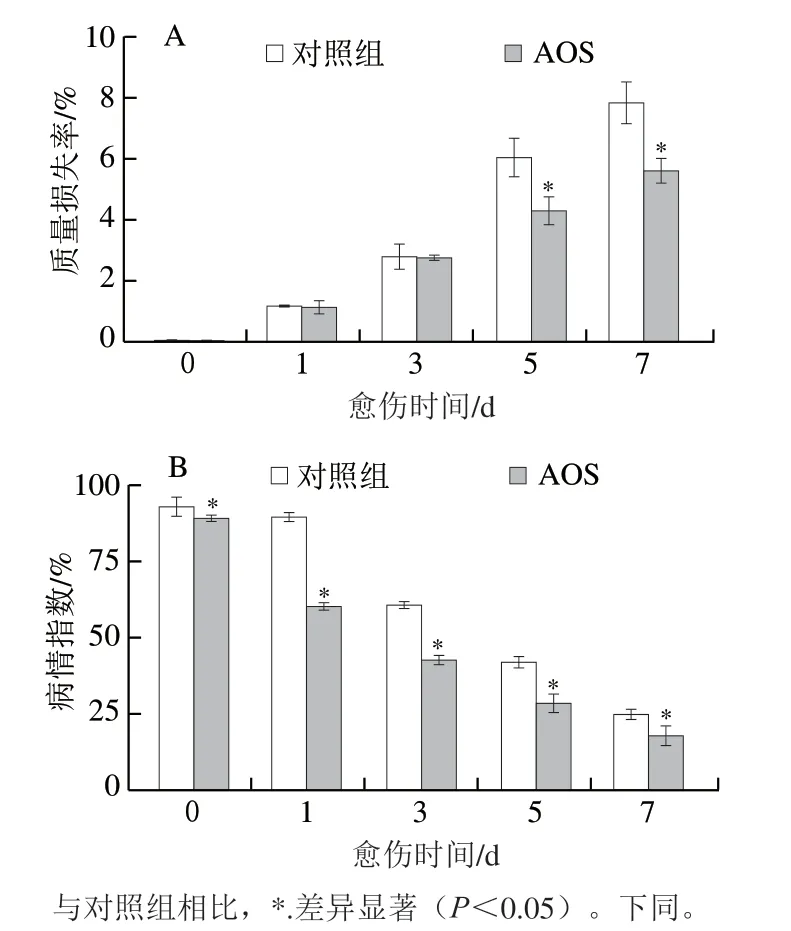
图1 AOS采前喷施对采后果实愈伤期间质量损失率(A)和病情指数(B)的影响Fig. 1 Effect of preharvest AOS sprays on mass loss (A) and disease index (B) of harvested muskmelons during wound healing
2.2 AOS采前喷施对采后果实愈伤期间伤口处SPP和木质素沉积的影响
随着愈伤时间的延长,AOS喷施处理和对照组果实伤口处的SPP和木质素的沉积量逐渐增加,在愈伤的中后期,AOS组明显高于对照组(图2A、B)。同样,AOS组和对照组果实的SPP和木质素沉积的细胞层厚度也随愈伤时间的延长逐渐增加,第3天后AOS组显著高于对照组(P<0.05),愈伤第5天时AOS喷施处理的SPP和木质素细胞层厚度分别高出对照组22.70%和25.07%,第7天时AOS喷施处理的SPP和木质素细胞层厚度分别高出对照组59.43%和43.36%(P<0.05)(图2C、D)。上述结果表明,AOS采前喷施加速了SPP和木质素在果实伤口处的沉积。
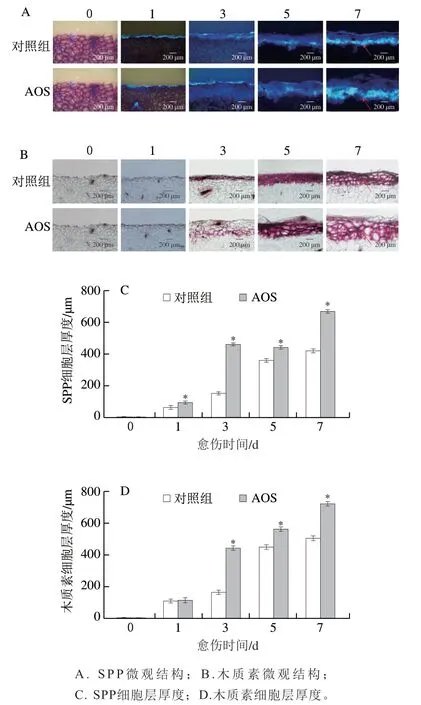
图2 AOS采前喷施对采后果实愈伤期间SPP和木质素沉积及相应细胞厚度的影响Fig. 2 Effect of preharvest AOS sprays on SPP and lignin deposition and resulting cell layer thickness in harvested muskmelons during wound healing
2.3 AOS采前喷施对采后果实愈伤期间伤口处苯丙烷代谢的影响
随着愈伤时间的延长,AOS喷施处理和对照组果实伤口处的PAL活力不断增加,AOS组同期PAL活力显著高于对照组(P<0.05),第3天时AOS喷施处理的PAL活力高出对照组43.15%(P<0.05)(图3A)。AOS组和对照组果实伤口处的总酚、类黄酮含量和木质素含量随着愈伤时间的延长逐渐增加,AOS组显著高于对照组(P<0.05),第5天时AOS喷施处理的总酚、类黄酮含量和木质素含量分别高出对照组12.15%、16.55%和20.91%(P<0.05)(图3B~D)。上述结果表明,AOS采前喷施增强了采后果实的苯丙烷代谢。
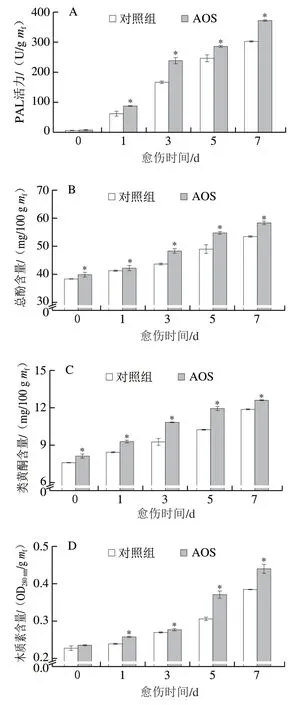
图3 AOS采前喷施对采后果实愈伤期间伤口处PAL活力(A)以及总酚(B)、类黄酮(C)和木质素(D)含量的影响Fig. 3 Effect of preharvest AOS sprays on PAL activity (A), and the contents of total phenols (B), flavonoids (C) and lignin (D) in harvested muskmelons during wound healing
2.4 AOS采前喷施对采后果实愈伤期间伤口处H2O2含量和POD活力的影响
随着愈伤时间的延长,AOS喷施处理和对照组果实伤口处的H2O2含量先上升后下降,第5天达到峰值,AOS组显著高于对照组(P<0.05),第3天时AOS喷施处理的H2O2含量是对照组的1.37 倍(P<0.05)(图4A)。AOS组和对照组果实伤口处的POD活力随着愈伤时间的延长先上升后下降,第5天达到峰值,AOS组显著高于对照组(P<0.05),第7天时AOS喷施处理的POD活力高出对照组34.34%(P<0.05)(图4B)。上述结果表明,AOS采前喷施提高了采后果实伤口处的H2O2含量和POD活力。
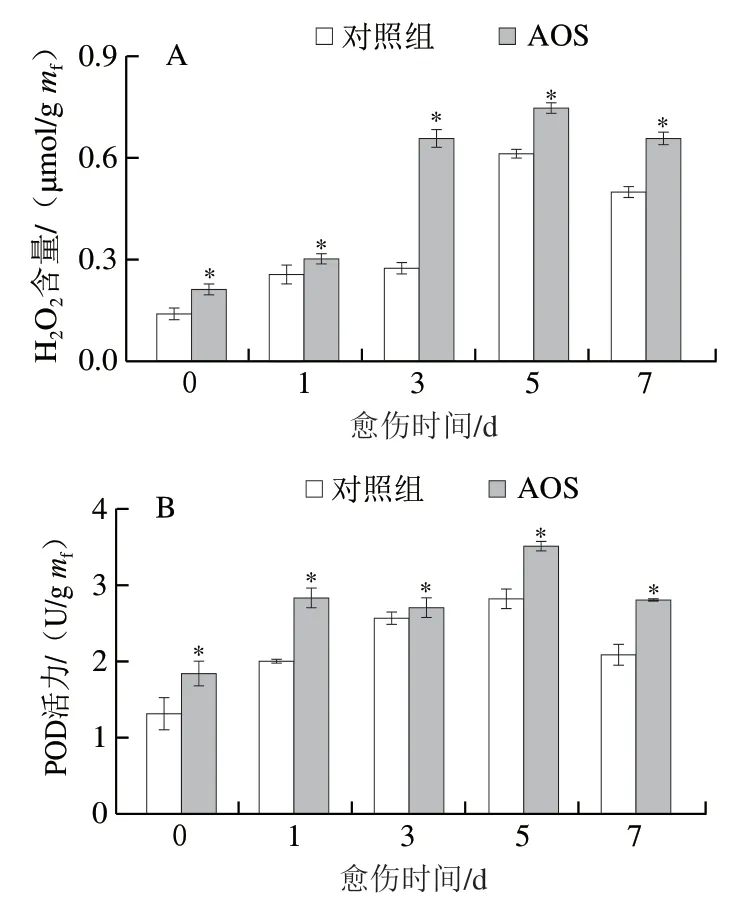
图4 AOS采前喷施对采后果实愈伤期间伤口处H2O2含量(A)和POD活力(B)的影响Fig. 4 Effect of preharvest AOS sprays on H2O2 content (A) and POD activity (B) of harvested muskmelons during wound healing
2.5 质量损失率和病情指数与其他指标间的相关性
质量损失率和病情指数与其他指标的相关性分析结果如表1所示,质量损失率与SPP细胞层厚度、木质素细胞层厚度、PAL活力、总酚及类黄酮含量之间具有极显著正相关性(P<0.01),相关系数依次为0.960、0.989、0.988、0.996和0.993;与木质素含量和H2O2含量之间具有显著正相关性(P<0.05),相关系数依次为0.942和0.888。病情指数与木质素细胞层厚度、PAL活力和类黄酮含量之间具有极显著的负相关性(P<0.01),相关系数依次为-0.971、-0.981和-0.989;与SPP细胞层厚度、总酚含量和H2O2含量之间具有显著负相关性(P<0.05),相关系数依次为-0.946、-0.956和-0.911。上述结果表明,伤口处SPP和木质素的积累降低了果实愈伤期间的质量损失率和病情指数。

表1 质量损失率和病情指数与其他指标间的相关性Table 1 Correlation between mass loss and disease index and other indicators
3 讨 论
苯丙烷代谢在果实愈伤过程中发挥着重要作用,既可为SPP和木质素的形成提供所需的单体,又可形成具有抗氧化和抗菌活性的酚类物质[26]。PAL是苯丙烷代谢的关键酶,参与苯丙烷代谢第一步反应,其可将L-苯丙氨酸脱氨转化为反式肉桂酸[27],后者在肉桂酸羟化酶的作用下生成p-香豆酸[28],p-香豆酸在香豆酸-3-羟基化酶作用下经过羟基化和酯化生成咖啡酸,咖啡酸经儿茶酚氧位甲基转移酶生成阿魏酸,阿魏酸首先羟化生成5-羟基阿魏酸,接着在5-羟基阿魏酸-O-甲基转移酶作用下催化生成芥子酸[29],这些酚酸是SPP聚合的重要单体[30]。在4-香豆酰-辅酶A连接酶的作用下,上述酚酸转化为酚酸-CoA[31],这些化合物再在肉桂酰辅酶A还原酶和肉桂醇脱氢酶的作用下生成木质素的底物芥子醇、松柏醇和肉桂醇[32]。本研究发现,AOS采前喷施提高了果实伤口处的PAL活力,提高了总酚、类黄酮含量和木质素含量(图3)。该结果与AOS处理提高柑橘PAL活力以及促进木质素合成的结果[13]类似。有研究表明,AOS可促进柑橘果实H2O2的形成,H2O2作为信号分子可激活PAL[14]。AOS还可诱导拟南芥水杨酸和茉莉酸的合成[33],而水杨酸和茉莉酸作为植物激素可激活苹果叶片的苯丙烷代谢[34]。因此,AOS可能通过调控H2O2以及水杨酸和茉莉酸的产生来激活苯丙烷代谢,至于AOS如何调控H2O2以及植物激素的合成尚有待进一步研究。
SPP和木质素是甜瓜果实愈伤封闭层的重要组成部分。SPP主要由阿魏酸、肉桂酸等酚酸以酯键和醚键相互连接而成[2],木质素由肉桂醇、松柏醇和芥子醇通过醚键聚合而成[35]。SPP和木质素单体的聚合过程均需要H2O2和POD共同参与[36]。本研究观察到,AOS喷施提高了采后甜瓜果实伤口处的H2O2含量和POD活力(图4),该结果与AOS处理提高柑橘和冬枣的H2O2含量和POD活力结果[14,37]类似。愈伤中的H2O2主要通过NADPH氧化酶(NADPH oxidase,NOX)反应生成,NOX可通过给O2转移电子产生,由于不稳定,很快被超氧化物歧化酶(superoxide dismutase,SOD)歧化为H2O2[38]。有报道表明,AOS可上调黄瓜果实中SOD基因表达,促进H2O2积累[39]。AOS还可上调柑橘果实POD12和POD16基因表达,提高POD活力[13]。
AOS采前喷施加速了采后甜瓜果实伤口处SPP和木质素的沉积(图2),沉积产生的物理屏障抑制了水分蒸腾和病原菌侵染,导致果实愈伤期间的质量损失率和病情指数相比对照组明显降低(图1)。此外,AOS还可提高病程相关蛋白基因的表达水平,从而增强果实抗病性[12]。因此,AOS采前喷施对采后果实愈伤期间质量损失率和病情指数的抑制,与加速果实伤口处SPP和木质素的沉积有关。
4 结 论
果实发育期AOS连续4 次喷施提高了采后甜瓜果实伤口处的PAL活力,促进了总酚、类黄酮、木质素的积累;喷施处理还提高了果实伤口处的H2O2含量和POD活力。苯丙烷代谢产物在H2O2和POD共同作用下氧化聚合形成SPP和木质素,并在伤口表面沉积,从而有效降低了损伤果实在愈伤期间质量损失率和病情指数,促进了采后甜瓜果实的愈伤。鉴于AOS廉价、安全、高效的特性,可作为果实促愈剂进行开发。
