采后不同温度预贮对雾化栽培微型马铃薯的愈伤效果及其机理
2022-11-30张志鹏谭芸秀李宝军李永才李守强王小晶
张志鹏,谭芸秀,李宝军,李永才,*,毕 阳,李守强,王小晶,张 宇,胡 丹
(1.甘肃农业大学食品科学与工程学院,甘肃 兰州 730070;2.甘肃省农业科学院农产品贮藏加工研究所,甘肃 兰州 730070;3.甘肃省种子总站,甘肃 兰州 730070)
马铃薯(Solanum tuberosumL.)属茄科一年生草本植物。我国马铃薯种植面积和产量皆位列世界第一[1-2]。马铃薯是重要的粮菜兼用作物,其加工用途多、产业链条长、增产增收潜力大,在保障国家经济发展及国民营养健康方面具有重要的作用[3],已成为我国种植业结构调整和农业增效、农民增收的主要经济作物之一。
优质脱毒种薯的生产是保障马铃薯产业向现代化、规模化可持续发展的重要基础。马铃薯种薯目前主要采用以蛭石为基质的传统基质生产,但传统基质生产效率低、前期投入大、质量参差不齐,且基质蛭石烧制易造成环境污染,不符合绿色、优质、高效农业的发展要求,严重制约了马铃薯种薯产业健康发展[4]。雾化栽培(以下简称雾培)法作为一种新的无基质种薯生产方式,通过将作物的根系悬挂生长在封闭保水的空间内,经喷雾设备将营养液定时喷到作物根系上,为其生长提供所需的水分、养分[5]。与传统基质栽培相比,雾培法生产自动化程度高、成本低、效率高、效果好、生产周期短,且不受季节和外界环境限制,可人工控制生产条件,近年来被广泛应用于雾培微型马铃薯的生产[6]。但是由于雾培微型马铃薯种植环境湿度较大、块茎含水量高、表面皮孔较大,块茎在采后贮藏期间极易失水和感染病虫害,严重影响种薯的品质和活力。
周皮作为保护屏障具有防止水分流失和抵抗病原菌侵染的功能[7]。地下根茎类蔬菜采后周皮组织处的细胞壁发生栓质化或木质化,形成保护组织。马铃薯块茎在采收后需先在一定的环境条件下进行预贮,预贮期间块茎进行自然愈伤,栓化物质在细胞壁中沉积,逐渐木栓化形成周皮[8]。栓化后的细胞不透水、不透气,可以防止块茎内水分、养分流失,抵抗病原菌侵染,使块茎保持较好的品质和活力[9-10]。马铃薯块茎预贮期间的愈伤效果受温度、湿度、光照等众多环境因素的影响,其中温度对马铃薯块茎愈伤效果具有非常重要的作用[11]。适宜的温度可以促进马铃薯块茎周皮处的苯丙烷代谢和活性氧(reactive oxygen species,ROS)代谢,促进栓化物质的积累,加速块茎的愈伤[12]。植物在适宜的温度下预贮,愈伤速率快、效果好,能有效加速愈伤进程;在低温下预贮,愈伤速率慢、效果差,而温度过高又会导致植物愈伤组织加速失水、表皮皱裂[13]。一般认为,马铃薯块茎的最佳愈伤温度为20 ℃,当温度低于12 ℃或高于25 ℃,块茎的愈伤速率会明显降低[14]。也有研究表明,最有利于马铃薯块茎软木脂(包括聚酚软木脂(suberin polyphenolics,SPP)和聚酯软木脂(suberin polyaliphatics,SPA))形成的温度是25 ℃[15]。研究发现,甜菜根在12 ℃预贮时木质化和栓质化更快[16];甘薯采后在32 ℃下愈伤4 d后,腐烂率降低了50%[17];山药块茎在25 ℃和35 ℃下预贮提高了抗病性和质量损失率,加速了SPP和木质素的积累,使酚类物质代谢和ROS代谢处于高水平,加速了栓质化的进程[18]。
虽然温度对地下根茎类蔬菜愈伤的促进作用已有报道,但不同地下根茎类蔬菜的最佳愈伤温度差异较大,而对于雾培微型马铃薯采后最佳愈伤温度和愈伤机理鲜见报道。本实验以无病虫害和机械伤‘通薯1号’雾培微型马铃薯为试材,研究在不同温度(4、15、25 ℃)、相对湿度86%~88%的黑暗环境预贮对雾培微型马铃薯质量损失率及周皮组织中软木脂和栓化物质积累的影响,初步分析块茎周皮组织中苯丙烷和ROS代谢的机理,以期为雾培微型马铃薯快速愈伤研究提供参考。
1 材料与方法
1.1 材料与试剂
‘通薯1号’雾培微型马铃薯于2021年5月2日采自甘肃省定西市薯类作物研究所雾培马铃薯种植基地。
正己烷、亚硝酸钠、乙酸、硝酸铝、丙酮、硼酸、氯化羟胺、溴化乙酰 国药集团化学试剂有限公司;愈创木酚、中性红 天津市光复精细化工研究所;甲苯胺蓝 上海中秦化学试剂有限公司;β-巯基乙醇、盐酸小檗碱、聚乙烯吡咯烷酮 北京索莱宝科技有限公司;L-苯丙氨酸 上海凛恩科技发展有限公司;福林-酚、Triton X-100 北京酷来搏科技有限公司;H2O2、超氧阴离子含量测定试剂盒 苏州科铭生物技术有限公司。
1.2 仪器与设备
LRH-105F型恒温培养箱 上海一恒科学仪器有限公司;DW-86L416G型低温保存箱 青岛海尔生物医疗股份有限公司;TGL-20M型低温高速离心机 长沙平凡仪器仪表有限公司;U-LH100-3型荧光显微镜 上海永科光学仪器公司;UV-2450型紫外-可见分光光度计日本岛津公司;1510-04087型酶标仪 赛默飞世尔(上海)仪器有限公司。
1.3 方法
1.3.1 预贮处理
‘通薯1号’雾培微型马铃薯采后当日运抵实验室,在(4±2)℃冷库中贮藏24 h散去田间热,然后室温下回温24 h,选取体积和质量相近、无病虫害和机械伤的雾培微型马铃薯,用水冲洗干净,自然晾干后,分3 组装入黑色聚乙烯塑料袋中,每组约1.5 kg,分别在4、15、25 ℃恒温培养箱(相对湿度86%~88%)预贮,在预贮0、5、10、15、20 d取样,每次取样品约300 g进行分析。
1.3.2 愈伤效果评价
1.3.2.1 质量损失率的测定
称量样品初始质量和贮藏期间的质量,按下式计算贮藏期间样品的质量损失率,每个平行取3 个块茎,重复9 次。

1.3.2.2 软木脂和木栓化沉积情况的观察
用双面刀片垂直于块茎周皮表面切薄片(0.5 mm×0.5 mm×0.2 mm),将切片置于10 mL离心管中,用蒸馏水冲洗5 遍以除去淀粉颗粒,用于观察SPP、SPA沉积和木栓化情况。
SPP沉积观察参照文献[16]的方法。将切片用0.1%(质量分数)盐酸小檗碱溶液染色40 min,再分别用蒸馏水以及75%(体积分数,下同)、95%乙醇溶液冲洗,脱去染料后再用0.25%(质量分数)甲苯胺蓝复染2 min,最后用75%乙醇溶液和蒸馏水冲洗脱色,SPP被染为蓝紫色。染色完成后将切片置于荧光显微镜下拍照观察。
SPA沉积观察参照文献[19]的方法。将切片用0.05%甲苯胺蓝染液染色40 min,然后用75%乙醇溶液和蒸馏水进行洗涤,脱去染料。用1%(质量分数)中性红染液染色2 min,最后再用75%乙醇溶液和蒸馏水洗涤,SPA被染为紫蓝色。染色完成后将切片置于荧光显微镜下拍照观察。
木栓化的观察参照文献[20]的方法并稍作修改。将切片用1%(质量分数)间苯三酚溶液染色2 min后,滴加1~2 滴37%(质量分数)浓盐酸染色1 min。染色完成后将切片置于荧光显微镜下拍照观察。
1.3.2.3 软木脂和木栓化细胞层厚度测定
块茎周皮细胞中沉积的SSP、SPA和木栓化细胞层厚度参照文献[21]的方法通过IS Capture软件进行测定。
1.3.3 马铃薯块茎周皮组织的预处理
参照文献[22]的方法,分别在块茎预贮第0、5、10、15、20天用刮皮刀刮取块茎周皮表面及以下2~3 mm的组织,包裹在锡箔纸中,迅速放入液氮中冷冻干燥,然后用研样机将样品研磨成粉末并装入50 mL离心管中,保存在-80 ℃冰箱中,用于测定块茎预贮期间周皮组织中木质素含量、总酚和类黄酮含量、苯丙氨酸解氨酶(phenylalanine ammonia lyase,PAL)、过氧化物酶(peroxidase,POD)活力以及H2O2和超氧阴离子含量。
1.3.4 木质素含量的测定
木质素含量的测定参照文献[23]的方法并略作修改。称取1.0 g冻干粉末加入10 mL离心管,加入3 mL 95%乙醇溶液,于4 ℃、8 000×g离心30 min,弃去上清液,重复3 遍,然后加入95%乙醇-正己烷(体积比为1∶2)的混合溶液,于4 ℃、8 000×g离心20 min,弃去上清液,重复冲洗3 遍后,将沉淀物置于60 ℃烘箱中干燥24 h,得到粉状物质。加入1 mL 25%(体积分数)溴化乙酰与75%(体积分数)冰醋酸混合溶液,70 ℃下水浴30 min后,依次加入1 mL 2 mol/L NaOH溶液、2 mL冰醋酸溶液(纯度99.5%)、0.1 mL 7.5 mol/L氯化羟胺溶液,于4 ℃、8 000×g离心30 min,吸取0.5 mL上清液,用冰醋酸定容至5 mL,测定280 nm波长处光密度值OD280nm,木质素含量以OD280nm/g表示。
1.3.5 总酚、类黄酮含量的测定
总酚、类黄酮的提取:称取1.0 g冻干粉末加入10 mL离心管,加入3 mL含70%(体积分数)丙酮与0.5%(体积分数)乙酸的水溶液,振荡匀浆后,在4 ℃黑暗环境中静置提取24 h,在4 ℃、8 000×g离心30 min,收集上清液进行总酚、类黄酮含量测定。
总酚含量的测定参照文献[24]的方法并稍作修改。取1 mL上清液,加入2 mL 10%(体积分数)福林-酚试剂、2 mL 7.5 g/100 mL碳酸钠溶液,在50 ℃ 恒温水浴5 min,以甲醇作对照,测定760 nm波长处的吸光度,以没食子酸为标准品绘制标准曲线,总酚含量以没食子酸当量表示,单位为mg/100 g。
类黄酮含量的测定参照文献[25]。取0.5 mL上清液,加入0.15 mL 10%(质量分数)Al(NO3)3溶液、0.15 mL 0.5%(质量分数)NaNO2溶液,常温静置5 min,加入1 mL 1 mol/L NaOH溶液,常温下反应15 min,然后用蒸馏水定容至5 mL,以等体积无水乙醇作对照,测定510 nm波长处的吸光度,以儿茶素为标准品绘制标准曲线,类黄酮含量以儿茶素当量表示,单位为mg/100 g。
1.3.6 苯丙氨酸解氨酶、过氧化物酶活力的测定
PAL活力的测定参照文献[26],以1 h吸光度变化0.01为1 个酶活力单位(U)。
POD活力的测定参照文献[27]的方法并作修改。称取1.0 g冻干粉末加入10 mL离心管,加入5 mL乙酸-乙酸钠缓冲液(pH 5.5、0.1 mol/L,后同),于4 ℃、8 000×g离心30 min,取上清液,置于冰上备用。反应体系:1.5 mL乙酸-乙酸钠缓冲液;0.5 mL 25 mmol/L 愈创木酚;50 μL上清液;0.1 mL 0.5 mol/L H2O2溶液。以等体积蒸馏水为对照,每隔15 s测定1 次470 nm波长处吸光度,连续测定120 s。以1 min吸光度变化0.01为1 个酶活力单位(U)。
1.3.7 H2O2和超氧阴离子含量的测定
H2O2和超氧阴离子含量分别参考对应试剂盒说明书进行测定。H2O2含量的单位为μmol/g;超氧阴离子含量的单位为nmol/(g·min)。
1.4 数据处理与分析
实验至少重复3 次,采用Excel 2010软件处理数据,结果以平均值±标准差表示,采用Origin 2018软件作图。采用SPSS Statistics 25软件进行单因素方差分析,采用Duncan检验进行显著性分析,P<0.05表示差异显著。
2 结果与分析
2.1 不同温度预贮对雾培微型马铃薯块茎预贮期间质量损失率的影响
预贮期间,随着预贮时间的延长,马铃薯块茎的质量损失率均逐渐上升(图1)。相同预贮时间,4 ℃预贮马铃薯块茎质量损失率显著低于在25 ℃预贮的马铃薯块茎,第20天时,与25 ℃和15 ℃预贮块茎相比,4 ℃预贮马铃薯块茎的质量损失率分别显著降低58.18%、27.67%(P<0.05);第20天时,与25 ℃预贮马铃薯块茎相比,15 ℃预贮马铃薯块茎的质量损失率显著降低42.19%(P<0.05)。由此可知,在本实验所选温度范围内,预贮温度越高,马铃薯块茎的质量损失率越大。

图1 不同温度预贮对马铃薯块茎质量损失率的影响Fig. 1 Effects of pre-storage temperature on weight loss percentage of potato tubers during wound healing
2.2 不同温度预贮对雾培微型马铃薯块茎预贮期间周皮处软木脂沉积和木栓化的影响
预贮期间,随着预贮时间的延长,马铃薯块茎的周皮细胞中SPP、SPA和木栓化物质逐渐积累(图2)。如图2A、B和图3A、B所示,相同预贮时间下15 ℃预贮马铃薯块茎SPP和SPA积累速率和积累量均明显高于在4 ℃和25 ℃预贮的马铃薯块茎。预贮5 d时,与4 ℃和25 ℃预贮的马铃薯块茎相比,15 ℃预贮处理马铃薯块茎SPP细胞层厚度分别显著增加了50.90%和26.94%(P<0.05),SPA细胞层厚度分别显著增加了44.89%和30.23%(P<0.05)。如图2C和图3C所示,随着预贮时间的延长,木栓化物质的积累速率和积累量也逐渐增加,预贮5 d时,与4 ℃和25 ℃预贮的马铃薯块茎相比,15 ℃预贮处理马铃薯块茎木栓化细胞层厚度分别显著增加27.66%和8.18%(P<0.05)。上述结果表明15 ℃预贮能显著加快马铃薯块茎木栓层的形成。
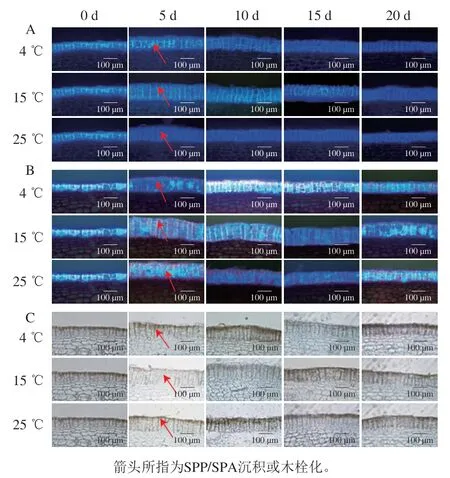
图2 不同温度预贮对马铃薯块茎周皮处SPP(A)、SPA(B)积累和木栓化(C)的影响Fig. 2 Effects of pre-storage temperature on the accumulation of SPP (A)and SPA (B) and suberization (C) in periderm tissue during wound healing
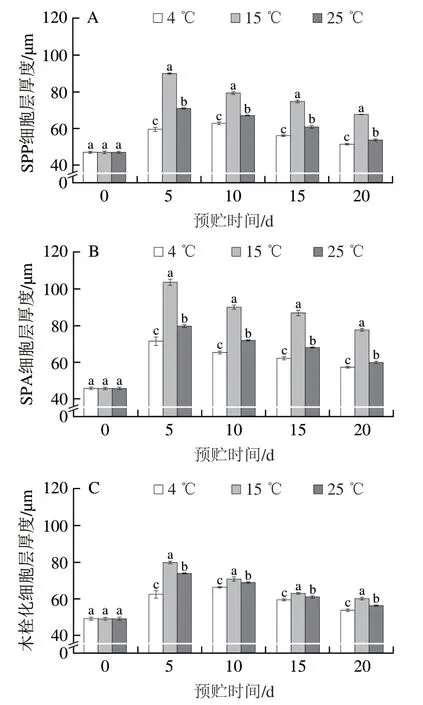
图3 不同温度预贮对马铃薯块茎周皮处SPP(A)、SPA(B)和木栓化(C)细胞层厚度的影响Fig. 3 Effects of pre-storage temperature on cell layer thickness of SPP (A),SPA (B) and phellem (C) in periderm tissue during wound healing
2.3 不同温度预贮对雾培微型马铃薯块茎周皮细胞中木质素含量的影响
如图4所示,预贮期间,块茎周皮组织中木质素含量随预贮时间的延长而持续增加。相同预贮时间下,15 ℃预贮马铃薯块茎周皮组织中木质素含量显著高于4 ℃和25 ℃(P<0.05),第20天时,分别高出24.50%和8.24%(P<0.05)。
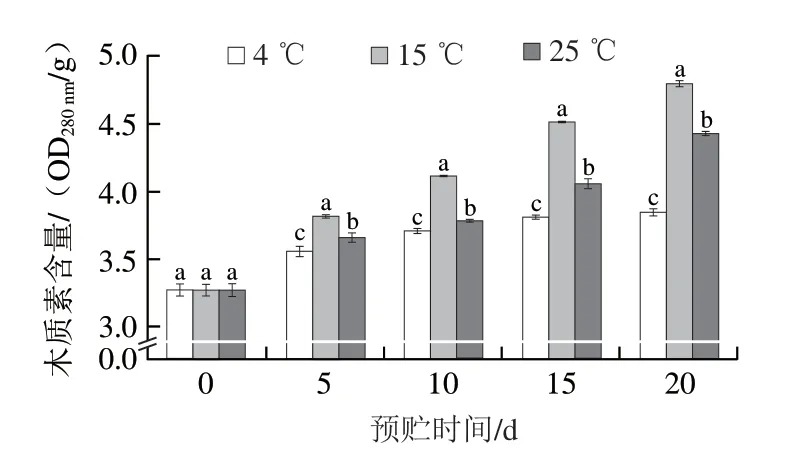
图4 不同温度预贮对马铃薯块茎周皮处木质素含量的影响Fig. 4 Effects of pre-storage temperature on lignin contents in potato tuber periderm during wound healing
2.4 不同温度预贮对雾培微型马铃薯块茎周皮愈伤组织中总酚和类黄酮含量的影响
如图5所示,随预贮时间延长,马铃薯块茎周皮组织中总酚和类黄酮含量持续增加。其中相同预贮时间下15 ℃预贮马铃薯块茎周皮组织中总酚和类黄酮含量高于4 ℃和25 ℃预贮马铃薯。预贮第5天时,与4 ℃和25 ℃相比,15 ℃预贮马铃薯块茎周皮组织的总酚含量分别显著增加了11.93%和2.72%(P<0.05),类黄酮含量分别显著增加了40.05%和15.50%(P<0.05)。
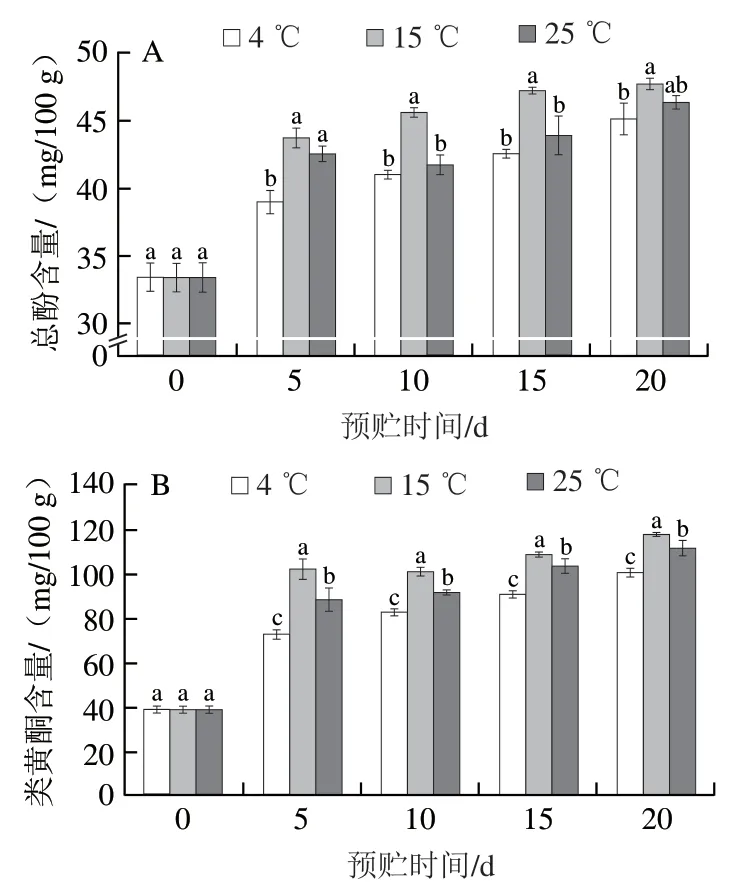
图5 不同温度预贮对马铃薯块茎周皮处总酚(A)和类黄酮(B)含量的影响Fig. 5 Effects of pre-storage temperature on the contents of total phenols (A)and flavonoids (B) in potato tuber periderm during wound healing
2.5 不同温度预贮对雾培微型马铃薯块茎周皮愈伤组织中PAL活力的影响
如图6所示,预贮期间,马铃薯块茎周皮组织细胞中PAL活力呈先上升后下降的趋势,且均在第5天达到峰值。相同预贮时间下,15 ℃预贮马铃薯块茎周皮组织的PAL活力始终高于4 ℃和25 ℃。贮藏第5天时,与4 ℃和25 ℃相比,15 ℃预贮马铃薯块茎周皮组织PAL活力分别显著增加了52.08%和27.41%(P<0.05)。

图6 不同温度预贮对马铃薯块茎周皮处PAL活力的影响Fig. 6 Effects of pre-storage temperature on PAL activity in potato tuber periderm during wound healing
2.6 不同温度预贮对雾培微型马铃薯块茎周皮愈伤组织中POD活力的影响
如图7所示,预贮期间,不同温度下预贮处理的马铃薯块茎周皮组织处的POD活力随预贮时间的延长而不断增加。相同预贮时间下15 ℃预贮马铃薯块茎周皮组织的POD活力明显高于4 ℃和25 ℃,且预贮第20天时15 ℃预贮马铃薯块茎周皮组织的POD活力分别提高了6.89%和4.18%。

图7 不同温度预贮对马铃薯块茎周皮处POD活力的影响Fig. 7 Effects of pre-storage temperature on POD activity in potato tuber periderm during wound healing
2.7 不同温度预贮对雾培微型马铃薯块茎周皮愈伤组织中H2O2和超氧阴离子含量的影响
如图8A所示,预贮期间,马铃薯块茎周皮组织中H2O2含量随预贮时间的延长呈先上升后下降的趋势,15 ℃下预贮块茎的H2O2含量在在第15天时达到峰值。相同预贮时间下15 ℃预贮马铃薯块茎周皮组织的H2O2含量显著高于4 ℃和25 ℃(P<0.05),预贮第15天时H2O2含量分别显著增加了32.30%和22.78%(P<0.05)。如图8B所示,马铃薯块茎周皮组织中超氧阴离子含量随预贮时间的延长逐渐升高,相同预贮时间下15 ℃预贮的马铃薯块茎超氧阴离子含量显著高于4 ℃和25 ℃(P<0.05),第20天时超氧阴离子含量分别显著增加7.55%和5.56%(P<0.05)。

图8 不同温度预贮对马铃薯块茎周皮处H2O2(A)和超氧阴离子(B)含量的影响Fig. 8 Effects of pre-storage temperature on the contents of H2O2 (A)and superoxide anion (B) in potato tuber periderm during wound healing
3 讨 论
温度是影响果蔬愈伤进程的重要因素,对地下根茎类蔬菜发挥着重要的作用,直接影响其采后的愈伤效果。不适宜的愈伤温度会导致愈伤组织由于蒸腾作用发生脱水和呼吸速率加快,造成果蔬生理代谢的紊乱,导致产量损失[18]。本研究发现,15 ℃预贮可以促进周皮组织处软木脂和栓化物质的积累,加速雾培微型马铃薯块茎采后自然愈伤进程。吴朝霞等[17]研究表明,甘薯在采后32 ℃预贮4 d后腐烂率降低50%;Fugate等[16]研究低温(12 ℃和6 ℃)贮藏对甜菜根愈伤进程的影响,发现12 ℃贮藏甜菜根的木质化和栓质化更快,且在12 ℃下,木栓化细胞层连续发育,而在6 ℃下没有出现在此现象;Shao Xingfeng等[28]将红富士苹果在38 ℃下放置4 d,结果表明损伤组织周围的酚类物质和木质素含量明显增加,木栓化物质得到积累;Arancibia等[29]研究发现,甘薯在采后29 ℃、相对湿度85%~90%的条件下预贮3~5 d能够延长甘薯贮藏时间并增加其抗病性。本研究表明在适宜温度范围内,预贮处理能够增强雾培微型马铃薯采后块茎周皮处的栓化程度,有效降低块茎的质量损失率。
苯丙烷代谢在马铃薯块茎采后愈伤进程中具有非常重要的作用,为块茎周皮细胞中软木质和木质素的积累提供了聚合所需的底物[30]。Bajji等[31]研究表明植物组织愈伤过程中,木栓质与SPP通过共价键进行连接,沉积在细胞壁表面,组成一个甘油桥联聚酯网,加强细胞壁的结构以抵御各种病虫害的侵害和水分散失。在植物组织中,苯丙烷代谢是酚类物质产生次生代谢产物的重要途径之一[32],而总酚、类黄酮和木质素是苯丙烷代谢的终产物。酚类化合物不仅为愈伤组织木质素的合成提供了所需的前体物质,而且参与了周皮愈伤组织的形成;此外,酚类化合物本身具有抗菌特性,能有效抵抗病原菌侵染[33]。类黄酮作为一种抗氧化物质,具有较强的抗氧化能力,能有效抑制多种真菌生长[34]。木质素作为愈伤组织的重要组成部分,是植物体内的结构性屏障,可以使真菌菌丝尖端木质化从而抵抗病原物侵染[35]。本研究结果表明,15 ℃预贮处理激活了雾培微型马铃薯块茎周皮处的苯丙烷代谢,参与木栓化进程的PAL活力均高于其他温度预贮的样品,并提高了总酚、黄酮和木质素的含量,促进了周皮处软木脂的积累,加速了木栓化,维持了贮藏品质。相似的,刘灿[18]研究表明,山药在5 ℃和15 ℃低温预贮期间切面色泽没有明显变化,而在25 ℃和35 ℃下预贮提高了山药抗病性和质量损失率,加速了SPP和木质素的积累,提高了PAL活力,使酚类物质代谢处于高水平,加速了栓化进程。PAL是苯丙烷代谢途径的关键酶和限速酶,不仅诱导激活植物组织的防御机制,而且在栓化过程中也发挥着重要作用。Razem等[36]研究表明,马铃薯栓化形成的SPP中包含大量的共价键交联的羟基肉桂酸,阿魏酸衍生物以及非木质素前体物质羟基肉桂酸及其衍生物。Vishwanath等[37]研究发现拟南芥根木栓质主要由羟基肉桂酸、阿魏酸、香豆酸、单体木质素组成。而PAL是催化生物合成这些酚类前体物质的关键酶,因此,诱导提高PAL活力有利于加速愈伤进程。而适宜的温度可以有效诱导PAL活力提升,促进酚类物质和木质素含量的增加和栓化过程,活化组织抗病防御系统,增强抗病性。
ROS是植物体应对病原菌的侵染产生的早期抗性反应之一,在植物体抗病过程中具有重要作用。Bajji[31]报道H2O2与POD共同参与了SPP的形成和马铃薯的栓化进程。在马铃薯块茎周皮组织中形成的H2O2不仅能作为信号分子,而且还具有氧化交联的作用[26]。H2O2作为信号分子能够激活植物愈伤组织早期的防卫反应[38],参与酚单体与芳香结构域的氧化交联[39]。POD作为植物愈伤组织中软木脂和木质素合成的关键酶,与H2O2通过氧化交联参与了软木脂和木质素的聚合[40]。本研究发现,15 ℃预贮显著提高了雾培微型马铃薯块茎H2O2、超氧阴离子的含量和POD活力。同样地,Jacobo-Velázquez等[41]研究发现,ROS可以作为信号分子,促进采后胡萝卜愈伤过程中酚类化合物的积累。Han Cong等[42]发现,适宜的愈伤温度可通过诱导ROS的产生介导胡萝卜中酚类物质的积累。Razem等[36]发现在马铃薯的栓化进程中使用二苯基碘(ROS抑制剂)抑制H2O2和超氧阴离子产生后,POD对酚类氧化的催化作用也受到抑制,而未聚合的羟基肉桂酸衍生物等可溶性酚类得到积累,木质素含量减少。可见激活组织ROS代谢水平,可促进栓化进程中所需酚类物质的合成,增强块茎的抗病性。但H2O2与POD如何通过氧化交联使软木脂和木质素聚合的过程仍有待分析。
本研究结果表明,采后15 ℃预贮可以显著激活雾培微型马铃薯块茎周皮组织处苯丙烷代谢,增加总酚、类黄酮和木质素的含量,提高PAL和POD活力以及H2O2和超氧阴离子的含量,促进块茎周皮组织处软木脂和栓化物质的积累,进而加速雾培微型马铃薯块茎采后的愈伤进程。
