荔枝果壳原花青素对中波紫外线诱导HaCaT细胞氧化损伤的保护作用
2022-11-30董丽红罗牡康张名位张瑞芬陈燕霞贾栩超
董丽红,罗牡康,张名位,张瑞芬,邓 梅,陈燕霞,贾栩超
(广东省农业科学院蚕业与农产品加工研究所,农业农村部功能食品重点实验室,广东省农产品加工重点实验室,广东 广州 510610)
皮肤老化包括自然老化和光老化,研究表明,光老化占面部老化的80%以上,太阳紫外线辐射是造成皮肤光老化的主要原因[1]。紫外线分为长波紫外线(ultraviolet A,UVA)(波长320~400 nm),中波紫外线(ultraviolet B,UVB)(波长280~320 nm)和短波紫外线(波长100~280 nm)。UVB主要作用于皮肤最外层的表皮,是引起皮肤损伤的主要波段[2]。氧化损伤是UVB所致皮肤损伤的重要机制,其中活性氧自由基(reactive oxygen species,ROS)起着关键性的作用。UVB可以导致皮肤中的ROS过量产生,大量的ROS可直接或间接地氧化细胞膜上的脂质产生过氧化物,进一步形成脂褐素,破坏表皮细胞内酶性和非酶性抗氧化防御系统,造成细胞损伤,容易诱发皮肤出现局部红斑、色素沉着异常、皱纹甚至皮肤癌等病理状态[3]。因此,抗氧化是预防皮肤紫外损伤或延缓皮肤光老化的一个重要途径。研究表明,一些天然的植物化学组分表现出较好的抑制紫外线致皮肤氧化损伤潜力[4-7],鉴于其安全性更高、功能活性更突出等优点受到学者们的极大关注,从天然植物化合物中开发皮肤光保护剂已成为该领域的研究热点。细胞模型因其实验条件可控、影响因素少且可模拟机体生理环境而被广泛用于皮肤氧化损伤的体外研究,最常用的是人永生化角质形成细胞(HaCaT)或人表皮成纤维细胞[8-9]。其中,角质形成细胞是构成人表皮的主要细胞,而UVB作用于皮肤表皮会引起角质形成细胞氧化损伤和细胞凋亡[10],因此UVB诱导角质形成细胞损伤更适合于构建皮肤氧化损伤细胞模型,且近年来,已有部分研究报道了天然多酚类物质对UVB辐射HaCaT细胞氧化损伤的保护作用[9-11]。
原花青素是广泛存在于自然界中的一大类多酚化合物,由表儿茶素和/或儿茶素为单元聚合而成,根据其单体聚合度(degree of polymerization,DP)分为单体(DP=1)、寡聚体(DP=2~5)和多聚体(DP>5);根据单体连接方式的不同,可分为A型(C2-O-C7或C2-O-C5连接)和B型(C4-C8或C4-C6连接)两种[12]。大量研究已证实,原花青素因含有多个酚羟基而显示出较强的抗氧化活性和自由基清除能力,同时还具有一些生理活性,如抗炎症、抗衰老、抗肿瘤、抗心血管疾病等[13-15]。近年来研究表明,原花青素对紫外线有很强的吸收,可以有效抑制紫外线照射引起的皮肤损伤。李桂双等[16]发现葡萄籽原花青素可通过增加细胞内超氧化物歧化酶(superoxide dismutase,SOD)和谷胱甘肽过氧化物酶(glutathion peroxidase,GSH-Px)活力,减少丙二醛(malondialdehyde,MDA)生成量,从而对UVB诱导HaCaT细胞氧化损伤发挥防护作用。史云容等[17]研究发现,葡萄籽原花青素具有抗紫外线所致光老化早期血管生成的作用,能够修复紫外线照射诱导的皮肤屏障功能损伤。王刚等[18]发现黑果枸杞原花青素能减轻D-半乳糖皮下注射联合紫外线(UVA+UVB)辐射后小鼠颈背部皮肤氧化损伤及炎症反应,延缓皮肤衰老。以上研究中原花青素提取物均以B型原花青素为主,而对于A型原花青素的抗紫外线损伤鲜有报道。
荔枝果壳作为荔枝加工的主要副产物,富含原花青素类化合物等多种活性成分,其中以自然界少见的A型原花青素为主,具有很高的药用价值。Sui Yong等[19]利用高效液相色谱-质谱联用技术分析荔枝果壳原花青素组成,发现其含有儿茶素、表儿茶素、12 种原花青素二聚体和6 种原花青素三聚体,并指出其中A型原花青素的含量远高于B型原花青素,且最主要的单体和低聚原花青素是表儿茶素、A型原花青素二聚体(A1和A2)。目前,荔枝果壳原花青素的生物活性研究已被广泛报道,具有良好的抗氧化[20]、抗动脉粥样硬化[21]、改善高血糖症[15]、抑制血管紧张素I转化酶[22]等多种有益的生物活性,在食品、药品以及化妆品领域具有潜在的应用价值。也有研究表明荔枝果壳提取物具有良好的亮肤增白和抗光老化效果[23],但其对UVB诱导皮肤细胞氧化损伤是否具有保护作用尚不清楚。此外,先前研究均以原花青素粗提物为试材,其中发挥活性作用的主要活性物质是否为A型原花青素仍不明确。因此,本实验通过构建UVB辐射诱导HaCaT细胞氧化损伤模型,评价荔枝果壳低聚原花青素(litchi pericarp oligomolymeric procyanidins,LPOPC)及其单体组分对UVB辐射诱导HaCaT细胞氧化损伤的保护作用,考察A型原花青素用于防护皮肤紫外损伤领域的可行性。
1 材料与方法
1.1 材料与试剂
‘妃子笑’荔枝 广州水果批发市场;对氨基苯甲酸(para-aminobenzoic acid,PABA)(纯度≥99.9%) 美国Sigma公司;HaCaT细胞 美国模式培养物集存库。
Dulbecco’s改良Eagle培养基(Dulbecco’s modified Eagle medium,DMEM)培养基、胎牛血清(fetal bovine serum,FBS)、双抗(青霉素-链霉素)溶液、0.25%(质量分数)胰酶、磷酸盐缓冲液(phosphate buffered saline,PBS)(0.01 mol/L、pH 7.2,下同) 美国Gibco公司;牛血清白蛋白(bovine serum albumin,BSA) 美国Sigma公司;细胞计数试剂盒(cell counting kit-8,CCK-8) 上海碧云天生物技术有限公司;ROS、SOD、过氧化氢酶(catalase,CAT)、GSH-Px、还原型谷胱甘肽(glutathion,GSH)、MDA、二喹啉甲酸(bicinchoninic acid,BCA)蛋白质量浓度测定试剂盒南京建成生物工程研究所。
1.2 仪器与设备
SW-CJ-2G超净实验台 苏州净化设备有限公司;HeraCell 240i二氧化碳培养箱 美国Thermo Fisher Scientific公司;DMI 4000B荧光倒置显微镜 德国Leica公司;Infinite M200pro荧光酶标仪 瑞士Tecan公司;5702RH低速冷冻离心机 德国Eppendorf公司;HOPE-MED 8140紫外辐照灯 天津开发区合浦工贸有限公司;WB20恒温水浴锅 瑞士Salvis公司。
1.3 方法
1.3.1 LPOPC及其单体化合物的制备及分离纯化
取荔枝去壳后参考文献[24]的方法由新鲜荔枝果壳制备LPOPC。采用香草醛法测定LPOPC原花青素含量为96.38 g/100 g(以儿茶素计),纯度为96.38%。
2 g LPOPC经反相中压柱层析分离,依次以1.5 L不同体积分数(10%、20%、30%、40%、50%、60%、70%、80%、90%)甲醇溶液以及无水甲醇进行洗脱,流速为10 mL/min,分别得到组分1~10。组分5(203.2 mg)经过葡聚糖凝胶LH-20柱分离,流动相为无水甲醇,流速5 mL/min,收集洗脱液得到化合物1(7.0 mg)和化合物2(155.2 mg)。组分6(316.4 mg)经过葡聚糖凝胶LH-20柱分离,流动相为无水甲醇,流速5 mL/min,收集洗脱液得到化合物3(87.8 mg)和化合物4(13.4 mg)。组分7(53.6 mg)经过葡聚糖凝胶LH-20柱分离,流动相为无水甲醇,流速5 mL/min,收集洗脱液得到化合物5(16.7 mg)。组分8(18.8 mg)经高效液相色谱分析,流动相为65%(体积分数)甲醇水溶液,流速5 mL/min,收集洗脱液得到化合物6(5.5 mg)。综上,由LPOPC制备得到6 种单体化合物1~6,经鉴定(相关研究尚未发表)这6 种单体化合物分别为木脂素(meliasendanin B)、表儿茶素、原花青素A2、原花青素A1、槲皮素-3-O-芸香糖苷和山柰酚-3-O-芸香糖苷,纯度均在99.0%以上。
1.3.2 HaCaT细胞培养
将1 mL冻存的HaCaT细胞接种于25 cm2培养瓶中,加入6 mL完全培养基(含10%(体积分数,下同)FBS和1%双抗溶液的DMEM)后放入培养箱(37 ℃、5%(体积分数)CO2,下同)内培养。待细胞融合度达到80%~90%时,用1 mL 0.25%胰酶消化细胞,离心(4 000 r/min、5 min)后用完全培养基重悬细胞,进行传代培养。取对数生长期的细胞进行后续实验。
1.3.3 药物安全剂量和UVB辐照剂量的确定
取对数生长期HaCaT细胞以5 000 个/孔接种于96 孔培养板,培养12 h后,弃去培养液后用100 μL PBS洗涤2 次,分别加入100 μL含不同质量浓度(0(即对照组)、50、100、150、200 μg/mL)LPOPC或含不同浓度(0、12.5、25、50、100 μmol/L)PABA、6 种单体化合物的1%(质量分数,下同)BSA DMEM,继续培养12 h。采用CCK-8分析细胞活力,以确定PABA、LPOPC及6 种单体化合物对正常细胞不产生毒性作用的安全剂量范围。
取对数生长期HaCaT细胞以5 000 个/孔接种于96 孔培养板,培养24 h后,弃去培养液后用100 μL PBS洗涤2 次,然后加入100 μL PBS覆盖细胞,用紫外辐照装置对细胞进行UVB照射,照射剂量分别为0、50、100、150、200、250 mJ/cm2。照射后用PBS洗涤细胞,采用CCK-8分析细胞活力以确定合适的辐射剂量。
1.3.4 抑制UVB辐照损伤实验分组
参考文献[25]的方法并略有改动,实验分为对照(Con)组、UVB照射组、8 个药物组(LPOPC、PABA及6 种单体化合物)。HaCaT细胞(106个/mL)以2 mL/孔接种于6 孔培养板,培养12 h后,弃去培养液后加入1 mL PBS洗涤2 次,然后对照组和UVB照射组分别加入2 mL 1% BSA DMEM;LPOPC、PABA、单体化合物组加入2 mL含相应药物的1% BSA DMEM,其中LPOPC质量浓度分别为12.5、25、50、100 μg/mL,PABA和6 种单体化合物浓度分别为6.25、12.5、25、50 μmol/L。继续培养12 h后,用PBS洗涤细胞2 次,然后加入1 mL PBS覆盖细胞,除对照组外,其余各组经142 mJ/cm2UVB照射,用PBS洗涤细胞。收集各组细胞进行相关指标测定,考察药物对UVB诱导HaCaT细胞损伤的抑制作用。
1.3.5 细胞活力的测定
参照CCK-8说明书测定1.3.4节中各组细胞活力(以细胞存活率表征)。
1.3.6 细胞内ROS相对含量的测定
HaCaT细胞(106个/mL)以2 mL/孔接种于6 孔培养板,细胞分组及处理方法参考1.3.4节。用2’,7’-二氯荧光素二乙酸酯(2’,7’-dichlorofuorescin diacetate,DCFH-DA)荧光探针检测细胞内的ROS相对含量,参照试剂盒说明书原位装载探针,用DMEM将DCFH-DA稀释至10 μmol/L,每孔加入1 mL DCFH-DA溶液,将6 孔板置于培养箱内继续孵育30 min。PBS洗涤细胞3 次,用荧光酶标仪在500 nm激发波长和525 nm发射波长下测定DCFH-DA荧光强度,按下式计算各组细胞内ROS相对含量。

1.3.7 细胞内SOD、CAT、GSH-Px活力和GSH、MDA含量的测定
HaCaT细胞(106个/mL)以2 mL/孔接种于6 孔培养板,细胞分组及处理方法同1.3.4节,待细胞贴壁后进行加药处理,对照组和UVB照射组更换为1% BSA DMEM;LPOPC组和PABA组及6 种单体化合物组分别更换为含100 μg/mL LPOPC和50 μmol/L PABA及6 种单体化合物的1% BSA DMEM。参考相应试剂盒说明书测定SOD、CAT和GSH-Px活力以及GSH、MDA含量。
1.4 数据处理与分析
实验数据至少3 次重复,结果以平均值±标准差表示。采用Excel 2007软件处理数据和作图。采用SPSS 24.0软件进行单因素方差分析,采用Duncan检验进行显著性分析,P<0.05表示差异显著。
2 结果与分析
2.1 LPOPC及其单体化合物对HaCaT细胞活力的影响
由图1可知,随着药物剂量的增大,HaCaT细胞活力逐渐降低。与对照组相比,50 μg/mL LPOPC对细胞活力无显著影响(P>0.05),当LPOPC质量浓度增加至100 μg/mL时,细胞活力为(84.12±7.03)%,而当质量浓度继续增加至150 μg/mL时,细胞活力显著下降至(53.47±4.40)%(P<0.05)。0~50 μmol/L PABA和6 种单体化合物处理细胞活力均大于80%,而当处理浓度增加至100 μmol/L时,仅表儿茶素处理细胞活力仍大于80%,其余化合物处理细胞活力均小于80%。一般细胞活力大于80%可视为药物对细胞无毒性,因此,选择12.5、25、50、100 μg/mL LPOPC和6.25、12.5、25、50 μmol/L PABA及6 种单体化合物进行后续实验。
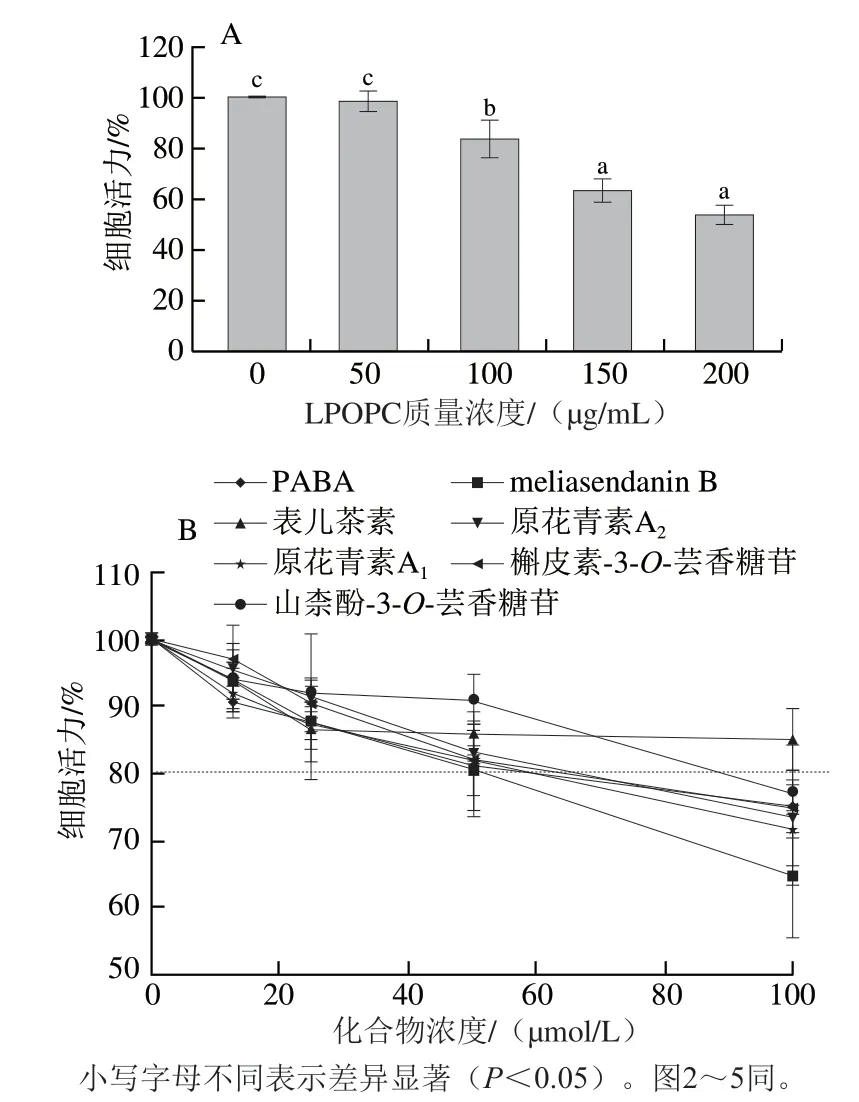
图1 不同剂量的LPOPC(A)、PABA和6 种单体化合物(B)对HaCaT细胞活力的影响Fig. 1 Effect of LPOPC (A), PABA and six monomeric compounds (B)at different concentrations on HaCaT cell viability
2.2 UVB辐照对HaCaT细胞活力的影响
由图2可知,本实验所选UVB照射剂量对HaCaT细胞活力有显著影响,细胞活力随着UVB照射剂量的增大而显著降低(P<0.05),当照射剂量达到250 mJ/cm2时,细胞活力仅为(20.95±9.88)%。通过SPSS 24.0软件对细胞活力和照射剂量进行拟合分析,结果表明细胞活力为50%时的照射剂量为142 mJ/cm2,后续研究采用该剂量建立UVB辐照损伤细胞模型。
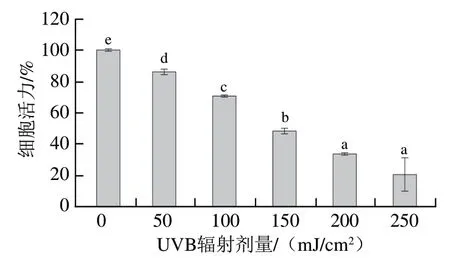
图2 UVB辐射强度对HaCaT细胞活力的影响Fig. 2 Effect of UVB intensity on HaCaT cell viability
2.3 LPOPC及其单体化合物对UVB诱导HaCaT细胞氧化损伤的影响
由图3可知,LPOPC及6 种单体化合物对UVB诱导HaCaT细胞氧化损伤均有一定的保护作用。与对照组相比,UVB照射组细胞活力显著降低至(48.74±1.26)%(P<0.05);与UVB照射组相比,12.5 μg/mL LPOPC处理细胞活力无显著变化(P>0.05),25、50、100 μg/mL LPOPC处理可显著提高细胞活力(P<0.05),100 μg/mL时细胞活力达到(84.26±10.32)%。经6.25~50 μmol/L的6 种单体化合物处理后,HaCaT细胞活力均显著高于UVB照射组(P<0.05);50 μmol/L时,meliasendanin B、表儿茶素、原花青素A2、原花青素A1、槲皮素-3-O-芸香糖苷、山柰酚-3-O-芸香糖苷处理组细胞活力分别达到(75.22±14.94)%、(96.96±1.61)%、(96.19±10.14)%、(93.10±10.02)%、(82.28±5.15)%和(69.31±1.84)%;经相同浓度的3 种原花青素单体(表儿茶素、原花青素A2和原花青素A1)处理后,细胞活力均高于其他类单体组分(meliasendanin B、槲皮素-3-O-芸香糖苷和山柰酚-3-O-芸香糖苷),且相同浓度的原花青素A2和阳性药物PABA处理后细胞活力相当,提示荔枝果壳A型原花青素对UVB诱导HaCaT细胞氧化损伤具有良好的保护作用。此外,随着各化合物剂量的增加,细胞活力逐渐升高,呈现剂量-效应关系。因此选取最高作用剂量,即100 μg/mL LPOPC和50 μmol/L PABA及6 种单体化合物进行后续实验。
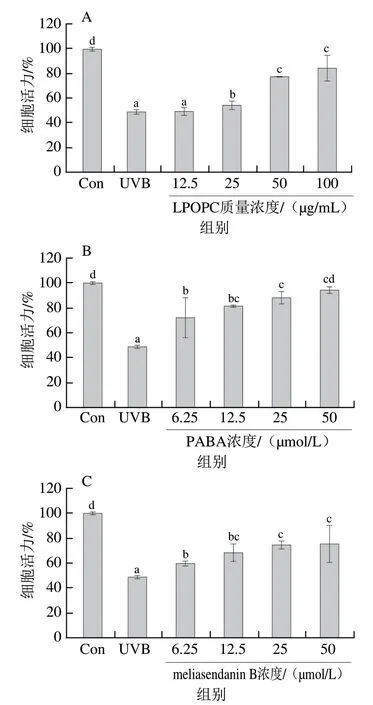
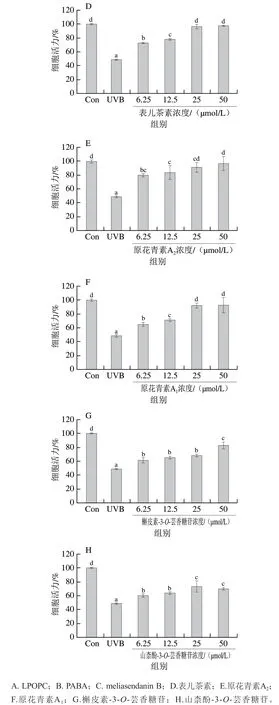
图3 不同浓度的LPOPC、PABA和6 种单体化合物对UVB诱导HaCaT细胞活力的影响Fig. 3 Effects of LPOPC, PABA and six monomeric compounds at different concentrations on cell viability of HaCaT cells induced by UVB
2.4 LPOPC及其单体化合物对UVB诱导氧化损伤的HaCaT细胞内ROS相对含量的影响
ROS是细胞氧化损伤的重要标志因子,通过检测DCFH-DA被细胞内ROS氧化的DCF荧光强度来分析细胞内ROS相对含量变化,从而反映出细胞氧化损伤的程度[26]。如图4所示,UVB照射诱导HaCaT细胞内ROS相对含量显著升高至对照组的2.94 倍(P<0.05)。而LPOPC及6 种单体化合物的干预处理对UVB诱导细胞内ROS相对含量的升高均有显著抑制作用(P<0.05),其中表儿茶素、原花青素A2和原花青素A1的干预作用较强,且原花青素A2对UVB诱导ROS生成的抑制作用优于阳性药物PABA组,其干预后细胞内ROS相对含量趋于对照组。以上结果表明,荔枝果壳原花青素类化合物,尤其是原花青素A2,能显著降低UVB诱导氧化损伤的HaCaT细胞内ROS相对含量(P<0.05),有效减轻细胞氧化应激,从而保护细胞。
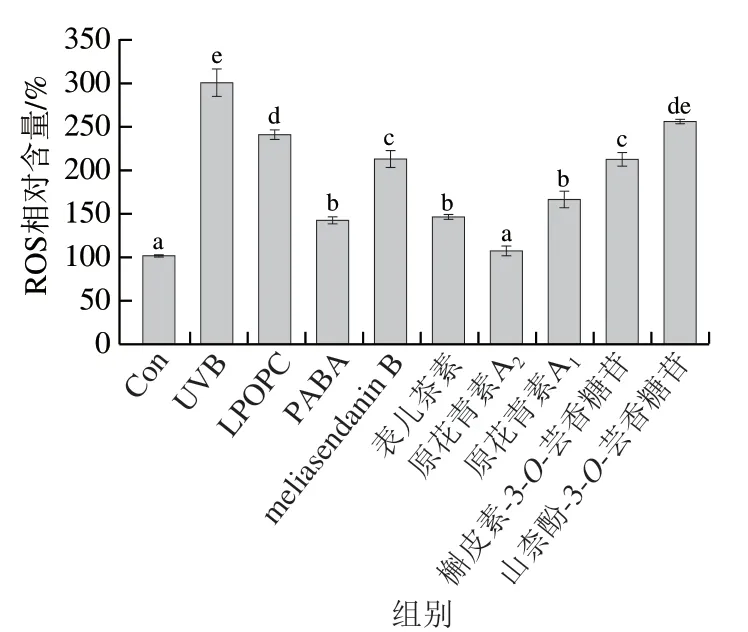
图4 LPOPC、PABA和6 种单体化合物处理对UVB诱导HaCaT细胞内ROS相对含量的影响Fig. 4 Effects of LPOPC, PABA and six monomeric compounds on intracellular ROS relative content of HaCaT induced by UVB
2.5 LPOPC及其单体化合物对HaCaT细胞内抗氧化酶活力、GSH含量和MDA含量的影响
细胞内SOD、CAT、GSH-Px等抗氧化酶和非酶类抗氧化物GSH是细胞氧化应激防御系统的重要组成部分,能有效清除自由基,阻止脂质过氧化产物MDA产生,这些物质水平均可以间接反映细胞氧化应激损伤的程度[27]。由图5可知,与对照组相比,经UVB照射后HaCaT细胞内的SOD、CAT、GSH-Px活力和GSH含量均显著降低(P<0.05),MDA含量显著增加(P<0.05),表明UVB照射会打破HaCaT细胞内的抗氧化系统平衡,对细胞造成氧化损伤。LPOPC及6 种单体化合物的干预处理对受损细胞内SOD、CAT、GSH-Px、GSH、MDA水平的变化均有不同程度的改善作用。总体来看,表儿茶素、原花青素A2和原花青素A1的作用强于meliasendanin B、槲皮素-3-O-芸香糖苷和山柰酚-3-O-芸香糖苷,且与对照组相比,原花青素A2干预后细胞内SOD、CAT和GSH-Px活力和GSH含量无显著差异(P>0.05),与阳性药物PABA作用效果相当。上述结果表明,荔枝果壳原花青素能显著增强UVB诱导HaCaT细胞的抗氧化能力,保护细胞免受氧化应激损伤,且6 种单体化合物中原花青素A2的保护作用最强。
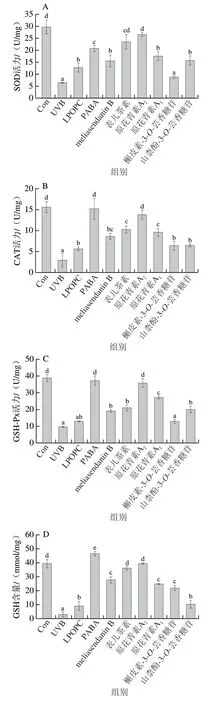
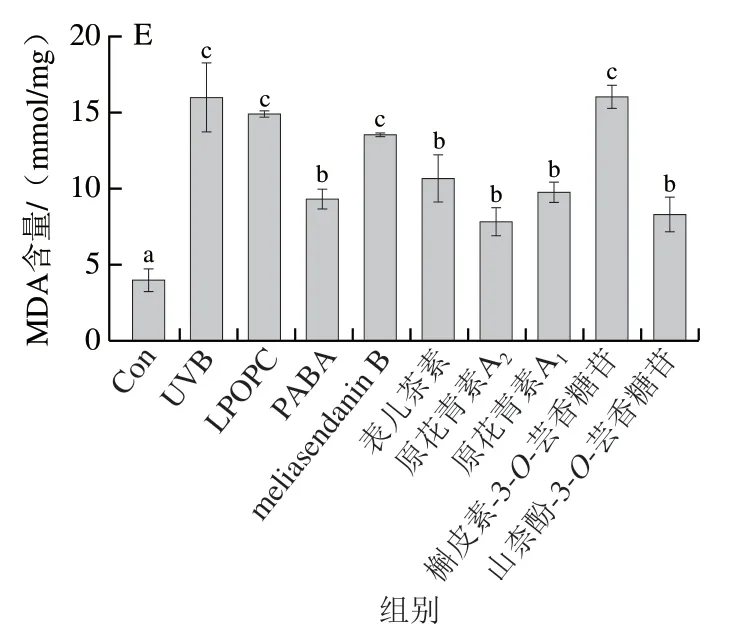
图5 LPOPC、PABA和6 种单体化合物处理对UVB诱导HaCaT细胞内SOD活力(A)、CAT活力(B)、GSH-Px活力(C)、GSH含量(D)和MDA含量(E)的影响Fig. 5 Effects of LPOPC, PABA and six monomeric compounds on the activity of SOD (A), CAT (B), and GSH-Px (C), and the contents of GSH (D) and MDA (E) in HaCaT cells induced by UVB
3 讨 论
皮肤是人体抵御不良环境或有害物质的第一道物理屏障,UVB是造成皮肤光老化的主要波段,UVB辐射会引起角质形成细胞氧化应激,造成细胞损伤甚至死亡[28]。目前,关于UVB辐射诱导HaCaT细胞氧化损伤已有较多研究报道[9-11,16,26],但很少有研究涉及不同辐射剂量与细胞活力的关系。本研究首先探究了不同辐照剂量UVB对HaCaT细胞活力的影响,发现随着辐照剂量的增加,HaCaT细胞活力逐渐降低,这与李辰等[29]研究得到的趋势一致,然而,李辰等研究发现当照射剂量达到80 mJ/cm2时,细胞活力已降至30%左右,而本研究中照射剂量达到200 mJ/cm2时,细胞活力降至34.06%;He Yong等[30]测定了经100~400 mJ/cm2UVB照射的HaCaT细胞活力,发现100 mJ/cm2UVB照射对HaCaT细胞活力无显著影响,当照射剂量达到400 mJ/cm2时,细胞活力仍然可达到77.59%,这些差异可能与辐照设备和处理方式不同有关。为方便后续研究,本研究选择UVB照射后细胞活力为50%时的照射剂量(142 mJ/cm2)建立紫外线损伤HaCaT细胞模型,评价荔枝果壳原花青素对UVB诱导的皮肤细胞损伤的保护作用。结果表明,25、50、100 μg/mL LPOPC处理后HaCaT细胞活力相比UVB组均显著升高(P<0.05),且呈剂量-效应关系,与阳性对照天然防晒药物PABA的作用趋势相近。由此推测荔枝果壳原花青素对UVB诱导的皮肤损伤具有良好的保护作用。
紫外线辐射引起皮肤损伤的主要原因是产生过多的ROS和自由基。经UVB照射后,HaCaT细胞会产生大量ROS,破坏抗氧化防御系统,使抗氧化酶活力下降,产生大量的自由基并攻击细胞,导致脂质过氧化产物MDA含量增加,引起细胞氧化损伤[31]。SOD、CAT和GSH-Px是机体中重要的抗氧化酶,这些酶能够通过多种内源性细胞防御系统消除ROS,并对细胞氧化损伤有一定的保护作用[8]。多项研究证实,多羟基化合物具有清除ROS和抗脂质过氧化的作用,可以有效延缓皮肤光老化[4-11]。本研究发现,LPOPC能有效降低经UVB辐射后的HaCaT细胞内的ROS相对含量,显著增加受损细胞的SOD、CAT、GSH-Px活力和GSH含量,减少氧化应激产物MDA的产生,从而提升角质细胞抵抗氧化应激的能力,抑制UVB辐射所致的皮肤损伤。有研究表明,柿子低聚原花青素能增强UVB辐射诱导的HaCaT细胞抗氧化酶系统的活性,抑制ROS的产生[32],与本研究结果一致。
目前关于原花青素的抗紫外线致皮肤氧化损伤及光老化的研究已有不少报道,但以针对葡萄籽、黑果枸杞等来源的B型原花青素的研究居多[33-36],而对于A型原花青素的抗光老化效果鲜有报道。荔枝果壳中富含以A型结构为主的原花青素类化合物,LPOPC缓解皮肤氧化损伤的主要活性组分尚不清楚。因此本实验测定并比较LPOPC及各单体化合物(meliasendanin B、表儿茶素、原花青素A2、原花青素A1、槲皮素-3-O-芸香糖苷和山柰酚-3-O-芸香糖苷)对UVB诱导HaCaT细胞内脂质过氧化相关酶SOD、CAT、GSH-Px的活力和非酶类抗氧化物GSH以及过氧化产物ROS、MDA的水平,研究发现表儿茶素、原花青素A2和原花青素A1的抗氧化损伤能力明显强于meliasendanin B、槲皮素-3-O-芸香糖苷和山柰酚-3-O-芸香糖苷,这可能与原花青素类化合物相比于黄酮苷类化合物因含有更多的活性羟基而具有更强的自由基清除能力有关[37-38]。且有研究报道,表儿茶素和原花青素A2是荔枝果壳中最主要的原花青素类化合物[19-20],提示表儿茶素和原花青素A2是荔枝果壳原花青素中对UVB诱导HaCaT细胞氧化损伤具有防护作用的主要活性组分。此外,原花青素A2对UVB诱导HaCaT细胞氧化损伤的保护作用最强,与阳性药物PABA相当,提示原花青素A2具有作为天然防晒物质代替PABA的可能性。
综上所述,荔枝果壳原花青素对UVB诱导氧化应激损伤的HaCaT细胞具有保护作用,其中原花青素A2是保护作用最强的活性组分。本实验结果可为荔枝果壳A型原花青素及其主要活性组分原花青素A2在防护皮肤紫外损伤领域中的应用提供参考,但仍需进一步研究以阐明其保护途径和调控机制。
