麦胚源活性肽对H2O2诱导的成骨细胞-破骨细胞共育体系中细胞氧化损伤的保护作用
2022-11-30翁泽斌宋海昭王銮凤沈新春
罗 涛,李 宇,汪 芳,*,翁泽斌,熊 玲,宋海昭,王銮凤,沈新春,*
(1.南京财经大学食品科学与工程学院,江苏省现代粮食流通与安全协同创新中心,江苏高校粮油质量安全控制及深加工重点实验室,江苏 南京 210023;2.南京中医药大学中医学院•中西医结合学院,江苏 南京 210000)
随着全球老龄化加剧,老年性骨质疏松逐渐成为当今国际的研究热点。世界卫生组织关于骨质疏松的定义为:以骨量减少、骨组织微结构破坏、骨脆性增加和易于骨折为特征的代谢性疾病,其组织病理学特点为单位体积内骨量降低而骨矿物质与骨基质比例仍正常或基本正常。早期研究证实骨质流失与雌激素缺乏相关。但近年来大量研究表明,增龄性骨质疏松症与氧化应激密切相关[1]。随年龄增长,受环境和代谢因素影响,机体内大量产生自由基,抗氧化体系(活性氧清除酶类)能力下降,导致自由基在体内积累过多,从而产生氧化应激。这不但抑制了成骨细胞(osteoblast,OB)的骨形成作用[2-3],还会诱导OB凋亡[4],促进破骨细胞(osteoclast,OC)分化,进一步破坏骨稳态[5]。目前市场上治疗骨质疏松的药物多以雌激素类为主,对人体会产生不同程度的副作用,因此,开发高效、安全、副作用小的抗骨质疏松天然产物成分显得尤为重要。麦胚作为“人类天然的营养宝库”,不仅含有丰富的蛋白质、生育酚、硫胺素、核黄素和烟酸,营养价值很高[6],其酶解产物也具有极高的安全性和生物活性。研究表明麦胚肽可以改善氧化应激损伤模型小鼠体内的氧化应激水平[7],陈思远等[8]从麦胚清蛋白中提取的肽AREGETVVPG具有较强的自由基清除能力。但有关麦胚活性肽对氧化应激引起的老年性骨质疏松的作用研究较少。基于此,研究麦胚活性肽在骨质疏松中的作用对麦胚资源的开发具有重大意义。
在人体骨代谢环境中,OC首先侵蚀旧骨,而后OB通过分泌胶原蛋白,吸收血液中的钙镁离子,逐渐形成骨组织,填补OC引起的骨凹陷,从而形成骨代谢循环。OB和OC间的功能活动并不是孤立存在的,二者之间的相互作用是骨组织代谢的直接调节因素。在骨重建过程中,OB和OC相互耦联,然而目前相关研究大多采用单一的细胞模型,不能体现骨重建过程中的这种耦联关系,而OB和OC共育体系更接近机体内的骨稳态环境。在共育条件下,这两种细胞能够通过外泌体和旁分泌进行细胞间信号传递。OB-OC共育体系已被报道为研究骨稳态的体外细胞模型,并用于筛选骨疾病的治疗药物[9]。
前期研究对小麦胚芽蛋白进行酶解、超滤、分离和鉴定,得到活性肽ADWGGPLPH,发现其具有极强的1,1-二苯基-2-三硝基苯肼自由基清除能力,并且可以通过调节PKCζ/AMPK/NOX4通路消除高糖诱导的平滑肌细胞氧化应激[10-11]。但麦胚源活性肽ADWGGPLPH在氧化应激条件下在骨环境中的作用尚未明确。本研究在OB-OC细胞共育体系中构建氧化应激模型,研究麦胚源活性肽对OB增殖、分化活性和凋亡以及OC分化的影响,以期为从麦胚蛋白中开发维持骨稳态功能因子提供科学依据。
1 材料与方法
1.1 材料与试剂
麦胚源活性肽ADWGGPLPH(纯度大于95%,分子质量949.03 Da) 南京金斯瑞生物科技有限公司;MC3T3-E1细胞株、小鼠巨噬细胞RAW264.7细胞株上海中科院细胞库。
胎牛血清(fetal bovine serum,FBS)、α-MEM培养基、0.25%胰蛋白酶溶液、青霉素-链霉素(100×)、磷酸盐缓冲液(phosphate buffered saline,PBS) 美国Gibco公司;聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜、ECL化学发光试剂盒 美国Thermo Fisher公司;二甲基亚砜(dimethyl sulfoxide,DMSO)、2,7-二氯荧光素二乙酸酯(2,7-dichlorodihydrofluorescein diacetate,DCFH-DA)(避光保存)、L-抗坏血酸、β-甘油磷酸钠 美国Sigma公司;抗坏血酸(VC) 广东西陇科学有限公司;噻唑蓝(3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyl-2H-tetrazolium bromide,MTT)、质量分数1%多聚甲醛溶液 北京索莱宝科技有限公司;异硫氰酸荧光素(fluorescein isothiocyanate,FITC)-Annexin V凋亡检测试剂盒I 美国BD公司;Hoechst 33258染料、结晶紫染料、BCA蛋白浓度测定试剂盒、细胞裂解液 碧云天生物技术(上海)有限公司;乳酸脱氢酶(lactate dehydrogenase,LDH)检测试剂盒、碱性磷酸酶(alkaline phosphatase,ALP)活力检测试剂盒、抗酒石酸酸性磷酸酶(tartrate resistant acid phosphatase,TRAP)染色试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)测定试剂盒、总超氧化物歧化酶(superoxide dismutase,SOD)测定试剂盒、丙二醛(malondialdehyde,MDA)测定试剂盒南京建成生物工程研究所;蛋白I型胶原(protein type I collagen,COL-I)酶联免疫吸附测定(enzymelinked immunosorbent assay,ELISA)试剂盒、骨钙素(osteocalcin,OCN)ELISA试剂盒 上海酶联生物科技有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
Spectra Max M2e酶标仪 美国Molecular Devices公司;HY-1漩涡混合仪 上海仪电科学仪器股份有限公司;JY92-II超声细胞粉碎仪 宁波新艺超声设备有限公司;5200Tanon数码凝胶图像分析系统 上海天能科技有限公司;Axio Vert.A1荧光倒置显微镜 卡尔蔡司光学(中国)有限公司。
1.3 方法
1.3.1 成骨细胞MC3T3-E1的培养
小鼠成骨细胞MC3T3-E1在含有10%胎牛血清、100 U/mL青霉素和100 μg/L链霉素的α-MEM培养基中培养,置于37 ℃、5% CO2细胞培养箱中,待细胞贴壁生长至80%融合后,吸弃培养液,用预冷PBS洗3 次,加入2 mL胰蛋白酶溶液,轻轻摇晃10 s,吸弃后将培养皿置于培养箱中孵育90 s,使细胞变成球状,拍散后加入4 mL培养液,用枪头吹打细胞层使细胞从皿底脱落,并使之均匀分散,根据实验需要进行细胞传代或铺板。
1.3.2 巨噬细胞RAW264.7的培养及诱导分化破骨细胞
小鼠巨噬细胞RAW264.7在含有10%胎牛血清、100 U/mL青霉素和100 μg/L链霉素的α-MEM培养基中培养,并置于37 ℃、5% CO2细胞培养箱中。待细胞贴壁生长至80%融合后,吸弃培养液,预冷PBS洗3 次后用细胞培养液轻轻吹打细胞,使其脱落并使细胞分散均匀,根据实验需要进行细胞传代或铺板。
1.3.3 OB-OC共育体系的建立
采用Transwell实验建立共育体系。将小鼠巨噬细胞RAW264.7按4×104个/孔铺于6 孔板内,待其贴壁后,使用OC分化因子核因子κB受体活化因子配体(receptor activator for nuclear factor κB ligand,RANKL)和巨噬细胞集落刺激因子M-CSF诱导72 h,分化成OC。在6 孔板中放置Transwell小室,按2×105个/孔铺板培养OB,于α-MEM培养液中共育24 h和48 h[12-13]。
1.3.4 MTT法检测OB活力
在Transwell小室中OB-OC共育24 h和48 h后,取出上室,加入30 μL MTT,并于37 ℃培养箱中孵育4 h,吸弃MTT,加入400 μL DMSO,37 ℃摇晃15 min,取200 μL上清液于96 孔板中,用酶标仪于570 nm波长处测定吸光度。以无细胞培养液为空白组,以单独培养的OB为对照组,按式(1)计算OB-OC体系中OB相对活力。

OB-OC共育24 h后,加入100、200、300 μmol/L H2O2,用MTT法测定OB活力,确定H2O2实验浓度。添加相应浓度H2O2、麦胚肽,OB-OC共育24 h后,使用试剂盒测定培养上清液中LDH活力。
1.3.5 结晶紫染色观察OB生长状态
在OB分别完成单独培养以及共育培养后,吸弃6 孔板内培养液,PBS洗3 次,质量分数1%多聚甲醛溶液固定20 min,然后PBS浸洗3 次,结晶紫染料染色20 min,再次用PBS浸洗3 次,于空气中干燥后拍照记录,并使用Image J软件记录染色细胞数目。
1.3.6 TRAP染色检测OC分化活性
按1.3.3节OB-OC共育24 h后,首先吸弃细胞培养液,每孔加入1 mL固定液于6 孔板中固定细胞10 min,用超纯水洗3 次,立刻在每孔加入孵育液1 mL,避光孵育60 min。孵育结束后超纯水洗3 次,在水未完全干时,用苏木素复染5~10 min,吸弃复染液进行拍照记录。统计分化后多核细胞所占面积即为OC相对阳性面积。
1.3.7 共育体系中OB的骨代谢相关蛋白表达水平测定
提取共育后OB内骨保护素(osteoclastogenesis inhibitory factor,OPG)、RANKL、核因子κB受体活化因子(receptor activator for nuclear factor κB,RANK)、肿瘤坏死因子受体相关分子6(tumor necrosis factor receptor associated factor 6,TRAF6)蛋白并测定蛋白质量浓度,将各组蛋白样品利用细胞裂解液稀释至相同质量浓度,然后以体积比4∶1加入5×蛋白上样缓冲液,混匀后于95 ℃下水浴加热5 min,置于冰上冷却,上样;选择12%的分离胶,每孔进行加样10 μg,调整电压80 V进行电泳,当溴酚蓝指示剂进入分离胶后,电压调整至120 V,至电泳结束;电泳结束后,将蛋白转移至PVDF膜上,用5%脱脂牛奶封闭3~4 h,TBST溶液清洗4 次,每次15 min。然后加入一抗中低温封闭过夜,TBST溶液清洗4 次,每次15 min,再转移至相应二抗中室温封闭1 h,然后用TBST溶液清洗4 次,每次15 min,完成后显色拍照,以β-actin作为内参蛋白进行相对定量。
1.3.8 氧化应激水平测定
按1.3.3节OB-OC共育24 h后,加入200 μmol/L H2O2,同时加入终浓度分别为20、40 μmol/L的麦胚肽处理24 h,以10 μmol/L VC处理24 h为阳性对照组[14],每个浓度设3 个平行。
处理完成后吸弃培养液,每孔加入1 mL 10 μmol/L DCFH-DA荧光探针,置于37 ℃培养箱中孵育30 min,吸弃培养液,用PBS清洗2 次,加入500 μL 0.25%胰蛋白酶溶液,轻轻摇晃10 s,吸弃胰蛋白酶溶液,并置于37 ℃培养箱中孵育90 s,拍打并观察细胞消化情况。
待细胞消化完全后,每孔加入1 mL培养液,轻轻吹打,转移到离心管中,1 000 r/min离心3 min,吸弃上清液,每支离心管中加入1 mL PBS,将细胞吹打均匀,置于冰上,用流式细胞仪检测共育体系中OB内活性氧(reactive oxygen species,ROS)水平,结果以FITC荧光强度表示。
处理完成后按照试剂盒说明书测定细胞内GSH-Px、SOD活力及MDA含量。
1.3.9 ALP活力测定
利用ALP活力测定共育体系中OB早期分化活性。按1.3.3节诱导分化处理,OB-OC按比例5∶1于α-MEM培养液中共育24 h,待共育环境稳定后,在7.5% FBS、50 μg/mL VC和4 mmol/Lβ-甘油磷酸钠,培养7 d,每3 d换一次培养液。然后加入200 μmol/L H2O2,同时加入终浓度分别为20、40 μmol/L的麦胚肽处理24 h,每个浓度设3 个平行。处理完成后用预冷的PBS洗3 次,加入细胞裂解液120 µL置于冰上摇晃15 min,用细胞刮刀将细胞刮下,转移到1.5 mL离心管中,冰浴下超声破碎(300 W、5 s/次、间隔5 s,重复5 次),并在4 ℃、12 000 r/min下离心15 min,取上清液,于-80 ℃保存待用。根据试剂盒说明书步骤测定ALP活力,单位为U/g。用BCA法检测细胞内总蛋白质量,校正ALP活力。
1.3.10 COL-I和OCN水平测定
按1.3.3节诱导分化步骤,分化培养7 d后测定早期分化指标COL-I质量浓度,单位为mg/L;分化培养21 d后测定晚期分化指标OCN质量浓度,单位为μg/L。具体操作按照相应ELISA检测试剂盒说明书进行。
1.3.11 OB矿化率测定
按1.3.3节诱导分化步骤,分化培养21 d,然后加入200 μmol/L H2O2,同时加入终浓度分别为20、40 μmol/L的麦胚肽处理24 h,每个浓度设3 个平行。处理24 h后,细胞用PBS洗涤两次,然后用10%福尔马林溶液固定10 min,加入1%茜素红(pH 4.2),再孵育10 min,双蒸水洗涤两次,晾干,用倒置显微镜拍照观察。
处理24 h后,每孔加入1 mL 100 mmol/L氯化十六烷基吡啶溶液,37 ℃恒温振荡20 min,在562 nm波长处测定吸光度。以不含细胞的氯化十六烷基吡啶溶液为空白组,OB矿化率按式(2)计算。
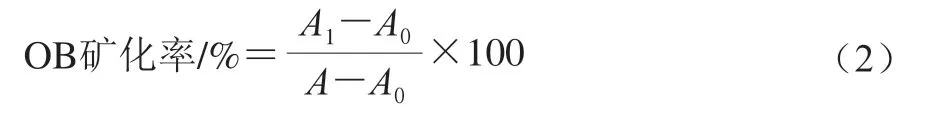
式中:A、A0和A1分别为对照组、空白组以及加样组吸光度。
1.3.12 Annexin V-FITC/PI双染实验
OB-OC共育24 h后,加入200 μmol/L H2O2,同时加入终浓度分别为20、40 μmol/L的麦胚肽处理24 h,每个浓度设3 个平行。处理完成后,用PBS清洗细胞,用不含EDTA的0.25%胰蛋白酶溶液1 mL进行消化处理,使用培养液重悬,1 000 r/min离心5 min后用预冷的PBS洗涤细胞,再次离心去除上清液,重复洗涤两次。然后用1×结合缓冲液重悬,调整细胞浓度为1×106个/mL,转移1×105个细胞至新的离心管中,加入5 µL Annexin VFITC和5 µL碘化丙啶(propidium iodide,PI)染料,混匀后于室温下避光处理15 min,然后加入400 µL 1×结合缓冲液并混匀,利用流式细胞仪检测。流式细胞仪激发光波长488 nm,用波长515 nm的通带滤器检测FITC荧光,波长大于560 nm的滤器检测PI。每组设置3 个平行,利用Flowjo软件分析细胞凋亡率。
1.3.13 Hoechst染色实验
OB-OC共育24 h后,加入200 μmol/L H2O2,同时加入终浓度分别为20、40 μmol/L的麦胚肽处理24 h,每个浓度设3 个平行。处理完成后,用质量分数4%多聚甲醛溶液固定Transwell小室内的OB,固定时间20 min,用PBS洗涤两次,然后用Hoechst 33258染料染色10 min,PBS洗涤3 次,使用荧光倒置显微镜观察并拍摄细胞核形态。根据凋亡细胞比例计算凋亡率。
1.4 数据处理与分析
实验至少重复3 次,结果以平均值±标准差表示。采用Excel和Origin 8.0软件进行t检验统计分析。P<0.05表示差异显著;P<0.01表示差异极显著。
2 结果与分析
2.1 OB-OC共育体系下氧化应激模型的构建
如图1A所示,随培养时间延长,单独培养的OB以及OB-OC共育体系中OB的生长密度均逐渐增大,但培养48 h后,OB-OC共育体系的OB生长密度稍小于单独培养的OB,这是因为OC来源的外泌体会抑制OB的持续增殖,这可以维持骨增长处于相对平衡状态[15]。用MTT法进一步测定OB增殖活性,如图1B所示,共育24 h时,共育体系中OB增殖活性与单独培养的OB无显著差异(P>0.05),但在48 h时共育体系中OB增殖活性显著低于单独培养的OB(P<0.05);与上述OB生长密度观察结果相印证。因此,选取24 h作为后续实验的OB-OC共育时间。利用TRAP染色进一步验证共育体系中OC分化活性,如图1C、D所示,与单独培养的OC相比,共育体系中OC具有更强的分化活性,说明共育条件下,OC进一步分化使整个培养体系达到稳态[9]。在人体骨代谢环境中,OC首先侵蚀旧骨,然后OB通过分泌胶原蛋白,吸收血液中的钙镁离子,逐渐形成骨组织,填补OC引起的骨凹陷,从而形成骨代谢循环。
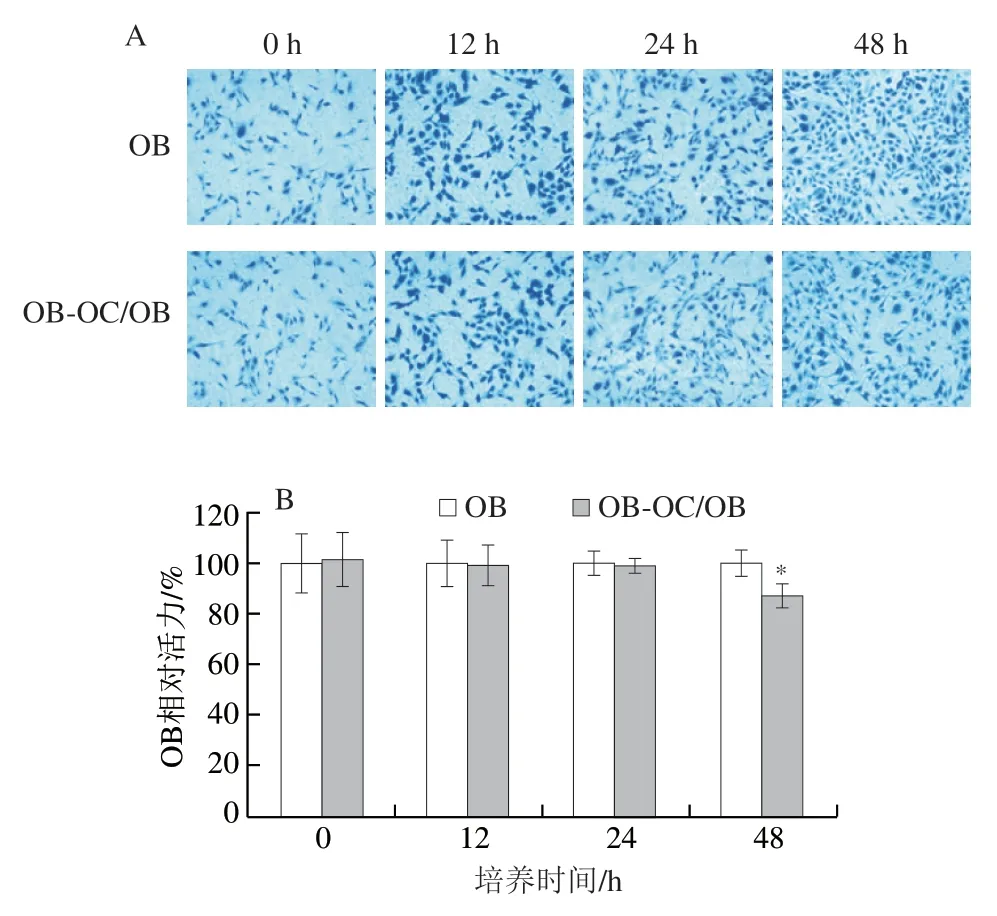
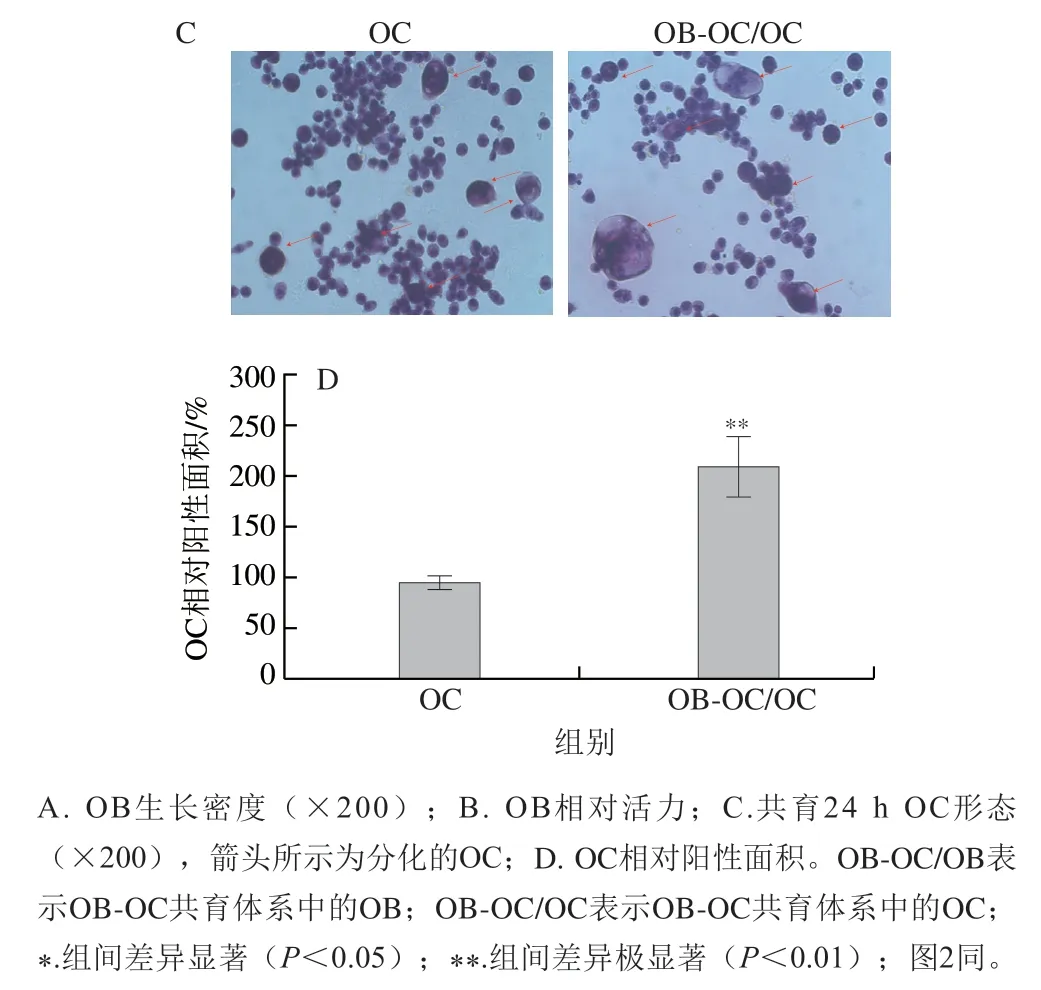
图1 OB-OC共育体系的构建Fig. 1 Establishment of an OB-OC co-culture system
如图2所示,与单独培养OB相比,共育体系中OB的OPG表达量极显著降低(P<0.01),RANKL表达量极显著上升(P<0.01),这是由于共培养中OB与OC接触,OC表面的RANK作为受体与OB中的膜蛋白RANKL结合,促使RANKL表达量上升,从而促进OC分化[16]。
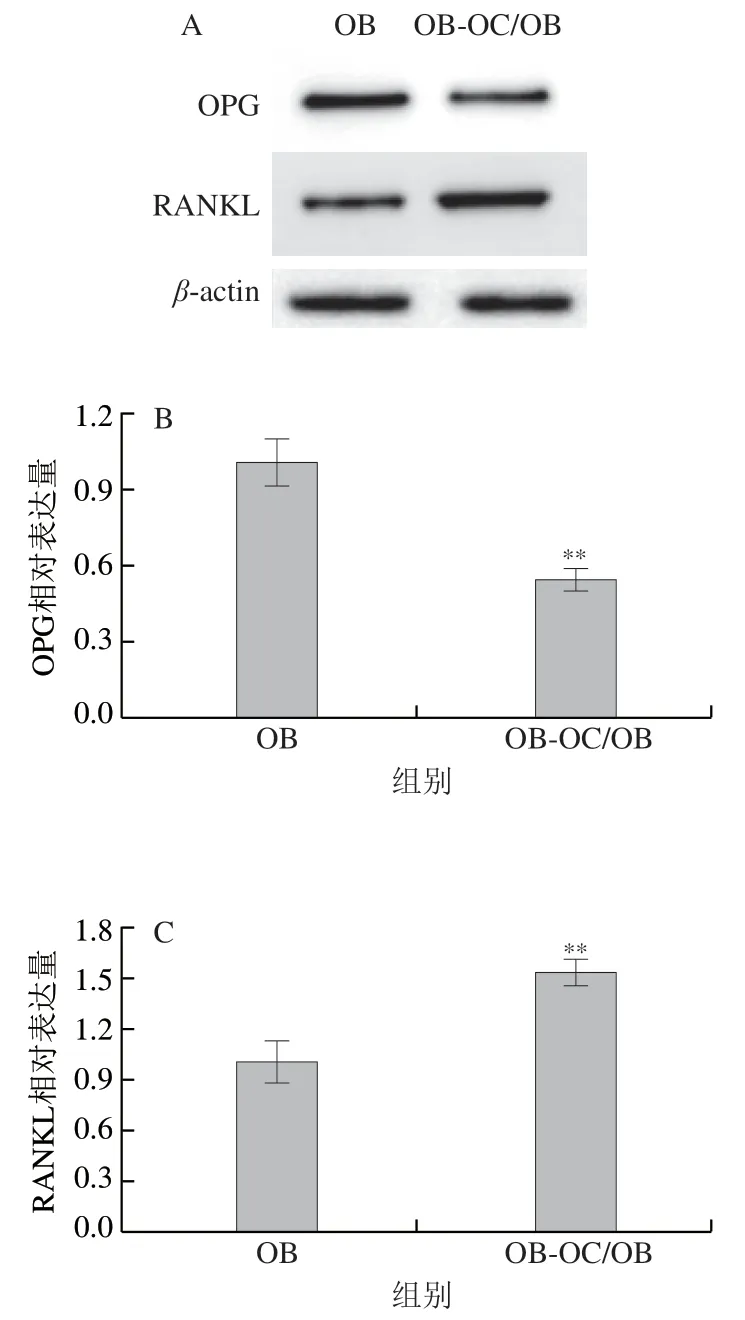
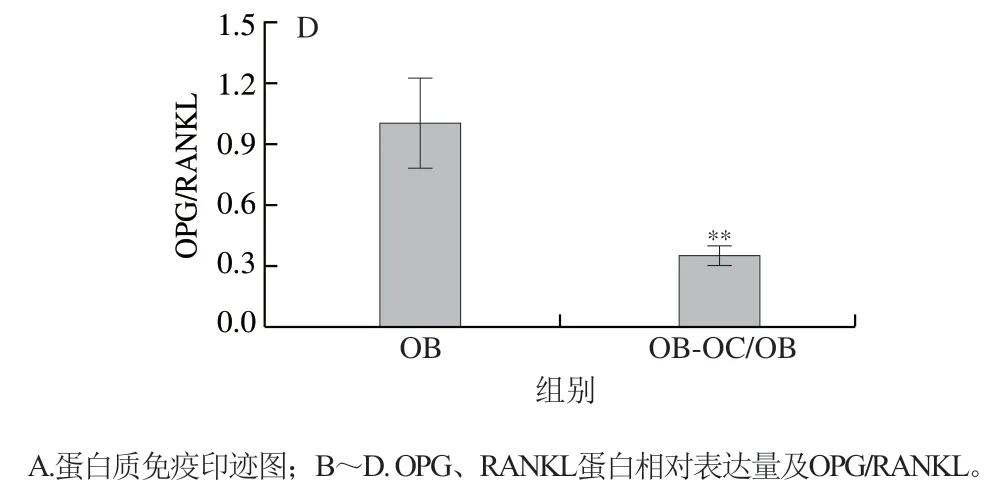
图2 OB-OC共育体系中OB的OPG、RANKL蛋白表达水平Fig. 2 Expression of OPG and RANKL proteins in OB-OC co-culture system
老年性骨质疏松的发生与自由基积累导致的骨代谢失衡密切相关,因此,在共育体系中构建氧化应激模型模拟老龄群体的骨代谢内环境。H2O2是一种常见的自由基,常被用于构造氧化应激模型。采用MTT检测不同H2O2浓度对共育体系下OB存活率的影响。如图3所示,H2O2对共育体系中OB相对活力的影响呈明显剂量依赖效应。在H2O2浓度为200 µmol/L时,OB相对活力较未添加H2O2时极显著下降(P<0.01),随着H2O2浓度继续上升,OB相对活力进一步下降。因此,选择H2O2浓度为200 µmol/L建立共育体系氧化应激模型。
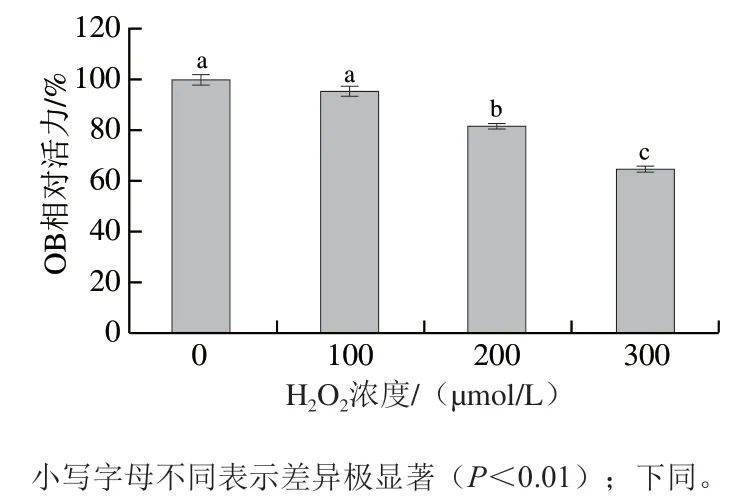
图3 H2O2浓度对共育体系中OB相对活力的影响Fig. 3 Effect of H2O2 on viability of OB in co-culture system
2.2 麦胚活性肽对共育体系中H2O2诱导的OB氧化应激水平的影响
通过流式细胞仪检测麦胚肽对OB内ROS的影响,如图4A所示,H2O2使OB内ROS水平极显著上升(P<0.01),当20 µmol/L和40 µmol/L麦胚肽干预后,OB内ROS水平极显著降低(P<0.01),且呈剂量依赖性,说明麦胚肽可以有效降低共育体系中OB的氧化应激水平,且40 µmol/L麦胚肽与阳性对照VC的作用效果未见显著差异(P>0.05)。GSH-Px可特异催化还原型GSH对H2O2的还原反应[17]。如图4B所示,与空白组相比,H2O2使OB内GSH-Px活力极显著下降(P<0.01),麦胚肽能够有效提高GSH-Px活力(P<0.01),从而催化GSH对H2O2的还原反应,降低细胞内自由基含量,且40 µmol/L麦胚肽与阳性对照VC的作用效果未见显著差异(P>0.05)。
SOD是机体内清除氧自由基的重要抗氧化酶,能清除超氧阴离子自由基,保护细胞免受损伤;SOD活力间接反映了机体清除氧自由基的能力。如图4C所示,与空白组相比,H2O2组SOD活力极显著下降(P<0.01),说明H2O2使OB清除自由基的能力变弱。20 µmol/L和40 µmol/L麦胚肽干预后,SOD活力极显著上升(P<0.01),且呈剂量依赖性,但稍弱于VC组。说明麦胚肽可以改善共育体系下OB清除自由基的能力。
MDA是氧自由基攻击生物膜中不饱和脂肪酸而形成的过氧化物,其含量可反映机体内脂质过氧化和机体细胞受自由基攻击的损伤程度[18]。如图4D所示,与空白组相比,H2O2组MDA含量极显著上升(P<0.01),说明H2O2组OB受自由基攻击的程度比较严重。20 µmol/L和40 µmol/L麦胚肽干预后,MDA含量极显著下降(P<0.01),且呈剂量依赖性,但效果稍差于VC组。说明麦胚肽可以使OB在一定程度上抵御自由基的攻击。
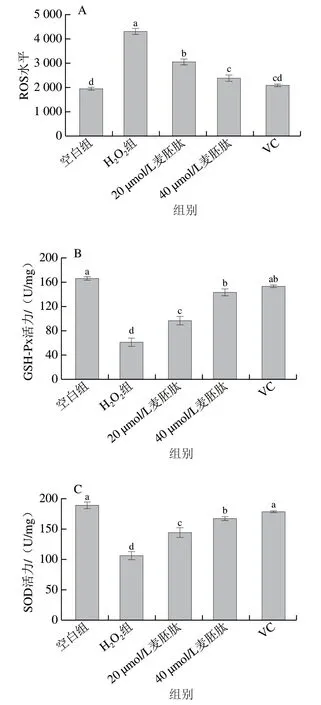
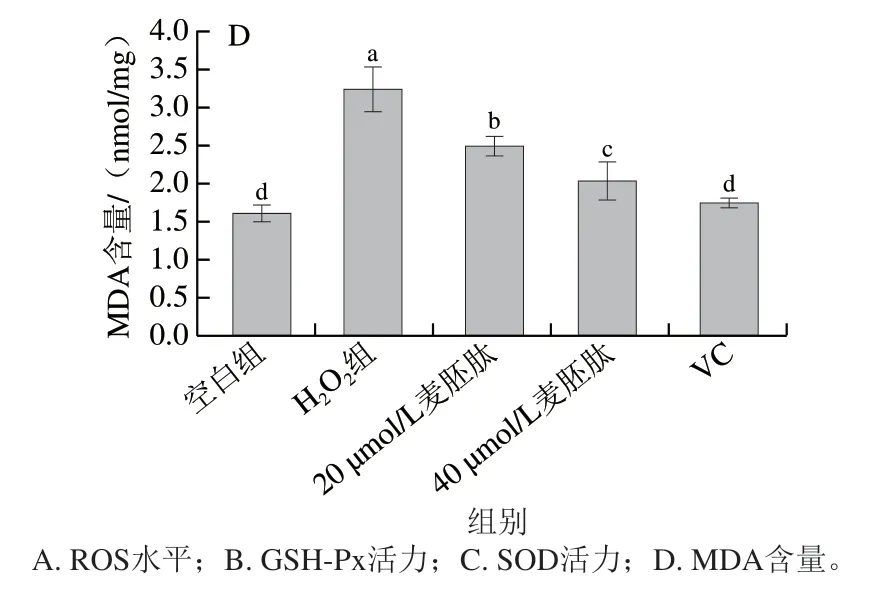
图4 麦胚活性肽对共育体系中OB氧化应激的影响Fig. 4 Effect of wheat germ-derived peptide on oxidative stress indexes of OB in co-culture system
2.3 麦胚活性肽对H2O2诱导下共育体系中OB活性的影响
采用MTT法测定麦胚肽对氧化应激共育体系中OB活力的影响。如图5A所示,共育体系下,H2O2极显著降低了OB相对活力(P<0.01),而麦胚肽能够有效改善H2O2造成的OB相对活力降低(P<0.01),并呈剂量依赖性,40 µmol/L麦胚肽干预后OB相对活力由H2O2组的60.4%提高至92.8%。LDH是稳定的胞浆酶,存在于所有细胞中,当细胞膜损伤时会快速释放到细胞培养液中,检测细胞培养上清液中LDH活力能够反映细胞膜受损程度。如图5B所示,共育体系中,与空白组相比,H2O2极显著增加了培养上清液中LDH活力(P<0.01),说明H2O2使共育体系中OB膜严重受损,麦胚肽可以有效缓解OB膜损伤(P<0.01)。
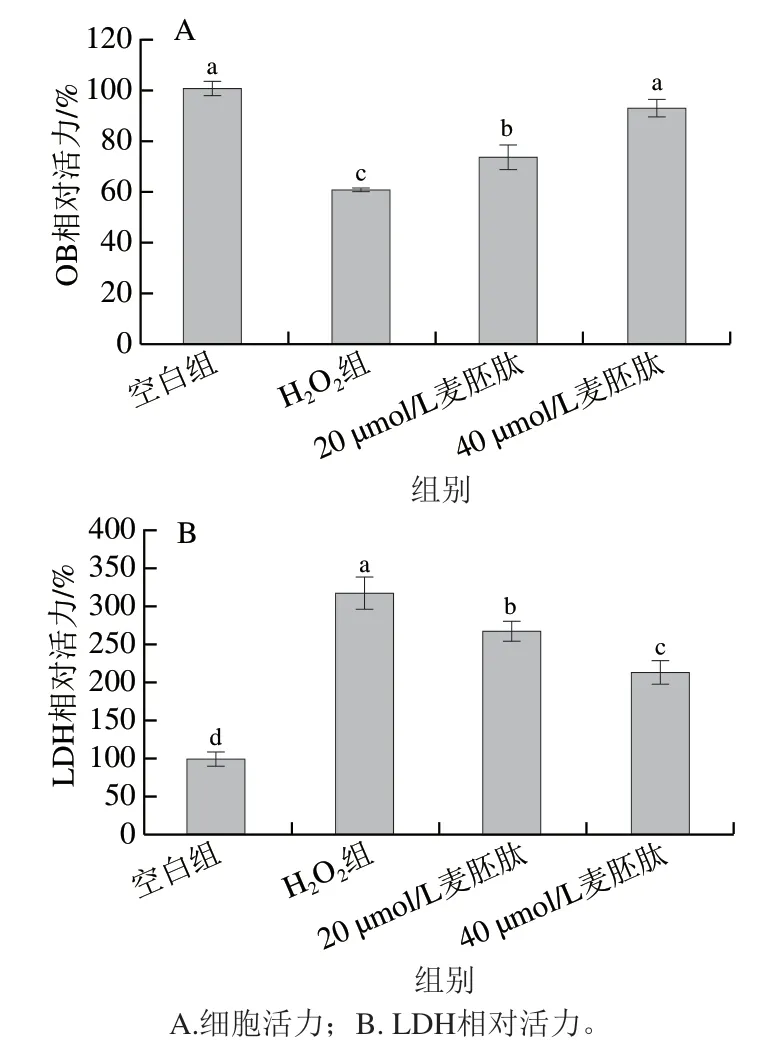
图5 麦胚活性肽对氧化应激共育体系中OB活性的影响Fig. 5 Effect of wheat germ-derived peptide on OB viability in co-culture system under oxidative stress
2.4 麦胚活性肽对氧化应激共育体系中OB凋亡的影响
氧化应激通常会引起OB凋亡,而OB凋亡是骨质疏松的特征之一。如图6A、B所示,共育体系中,与空白组相比,H2O2导致OB凋亡率极显著上升(P<0.01),40 µmol/L麦胚肽干预后,OB凋亡率由12.4%下降至5.3%(P<0.01)。此外,如图6C、D所示,通过Hoechst染色实验也发现,在共育体系中,H2O2可以诱导OB凋亡率极显著上升(P<0.01),40 µmol/L麦胚肽干预后,OB凋亡率由15.1%下降至7.1%(P<0.01),进一步佐证了FITC-PI双染结果。
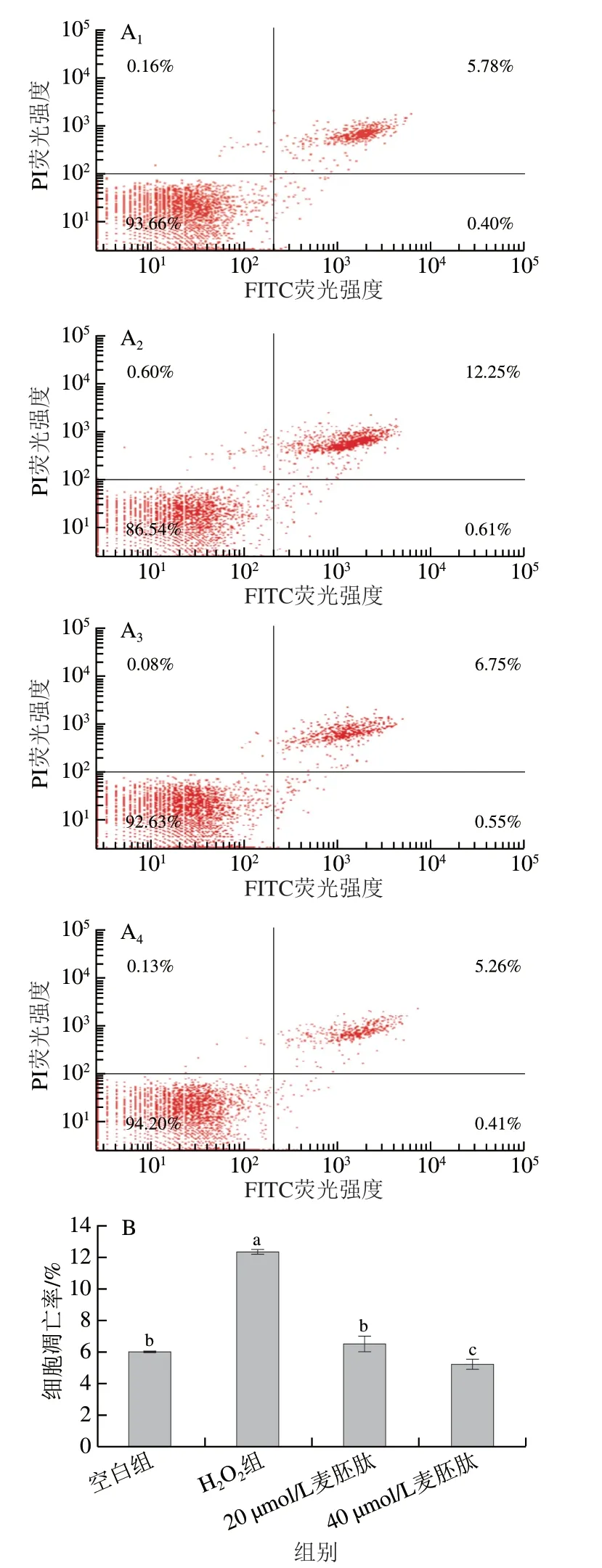
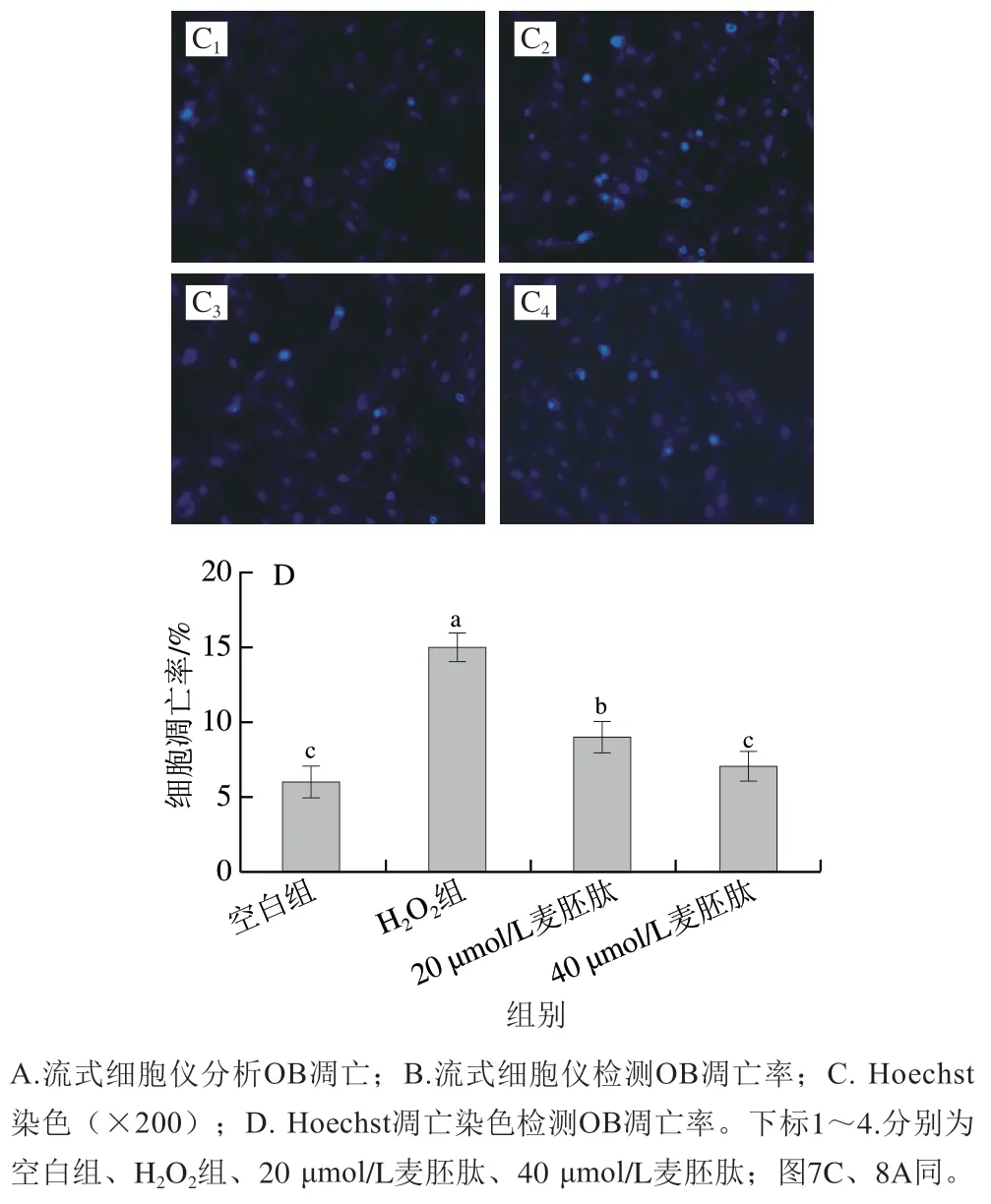
图6 麦胚活性肽肽对氧化应激共育体系中OB凋亡的影响Fig. 6 Effect of germ-derived peptide on OB apoptosis in co-culture system under oxidative stress
2.5 麦胚活性肽对H2O2诱导下共育体系中OB分化活性的影响
ALP的主要功能是在OB分化过程中水解磷酸酯,为羟基磷灰石的沉积提供必要的磷酸,同时水解焦磷酸盐,解除焦磷酸盐对骨盐形成的抑制作用,从而促进OB分化。在骨组织中,ALP在分化过程的早期阶段表达,可在基质囊泡中的细胞表面观察到。在分化过程后期,ALP表达下降[19]。如图7A所示,共育体系中,与空白组相比,H2O2极显著抑制了OB中ALP活力(P<0.01),麦胚肽能够有效改善OB内ALP活力的下降(P<0.01),且呈剂量依赖性。
COL-I常作为OB早期分化的一项检测指标[20-21]。COL-I对骨组织结构的完整及维持其生物力学特性具有重要作用。如图7B所示,共育体系下,与空白组相比,H2O2极显著降低OB早期分化过程中COL-I水平(P<0.01),麦胚肽能够有效提高OB中COL-I水平(P<0.01),并呈剂量依赖性。
矿化结节是OB分化成熟的标志,同时也是OB行使成骨功能的主要形态学表现。研究表明,H2O2能显著降低OB的矿化能力[22]。如图7C、D所示,共育体系下,诱导分化21 d的OB出现大面积矿化结节染色,H2O2导致矿化结节面积显著下降,40 µmol/L麦胚肽干预后,矿化率从H2O2组的21.3%提高至84.3%(P<0.01)。
OCN是由OB特异性分泌的小分子非胶原蛋白质,在OB分化末期出现,具有维持骨正常矿化速率的作用,矿化过程受OCN表达水平的影响[23]。OCN可以调节钙离子稳态和骨矿物沉积,促进OB分化成熟及骨细胞形成[24]。如图7E所示,与空白组相比,H2O2导致OB晚期分化标志物OCN水平极显著下降(P<0.01),麦胚肽干预后,OCN水平极显著上升(P<0.01)。
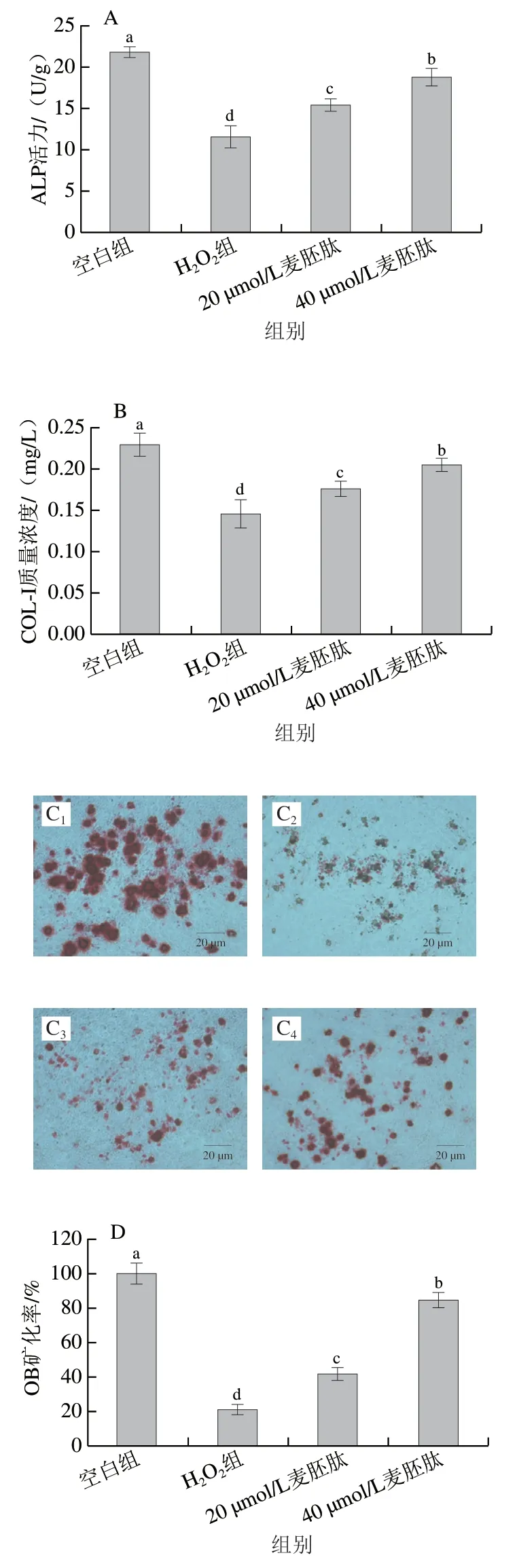
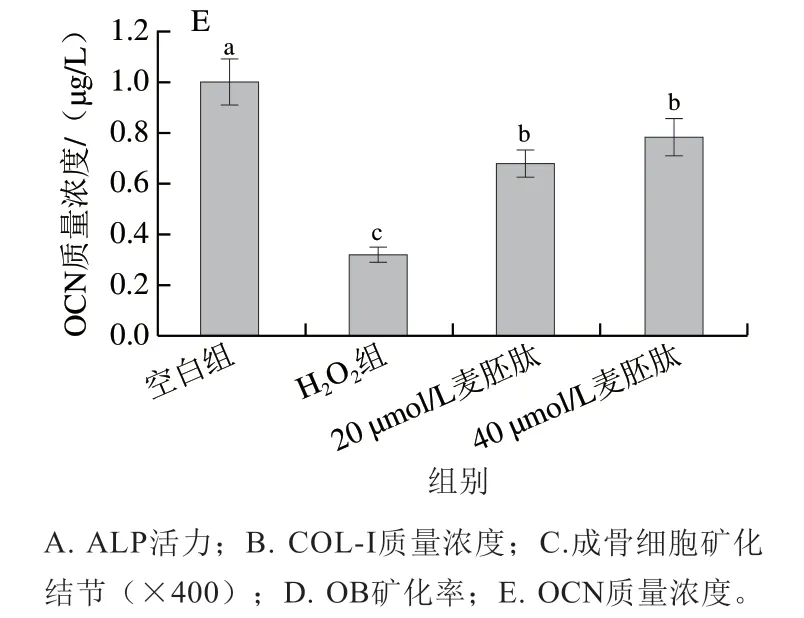
图7 麦胚活性肽对氧化应激共育体系中OB分化活性的影响Fig. 7 Effect of wheat germ-derived peptide on the differentiation of OB in co-culture system under oxidative stress
2.6 麦胚活性肽对氧化应激共育体系中OC分化的影响
通过TRAP染色检测麦胚肽对共育体系内OC分化的影响。如图8所示,和空白组相比,H2O2显著促进OC的分化活性,从而造成OC过度分化(P<0.01),40 μmol/L麦胚肽干预后,OC相对阳性面积从H2O2组的376.4%减小至128.1%(P<0.01),抑制了由H2O2引起的OC分化活性异常。
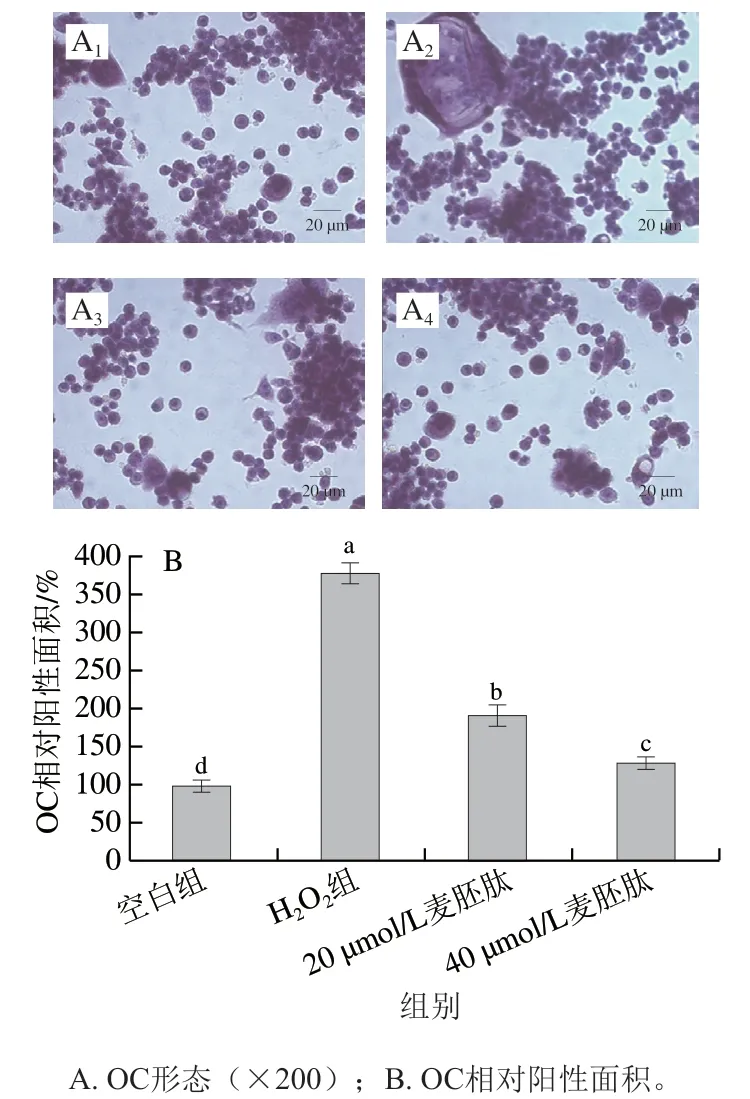
图8 麦胚活性肽对氧化应激共育体系中OC分化的影响Fig. 8 Effect of wheat germ-derived peptide on OC differentiation in co-culture system under oxidative stress
OPG、RANK和RANKL通路的三联体成分是TNF-α受体超家族成员[25-26]。当OB释放的RANKL与OC表面RANK结合后,TRAF6会与RANK快速结合,激活下游信号通路,最终达到促进OC分化、成熟的作用[27-28]。OPG可竞争性抑制并有效阻断RANKL与OC表面RANK结合,延缓前体OC的活化,抑制骨吸收,达到维持骨代谢平衡的目的[29-30]。通过Western blot检测麦胚肽对共育体系下OB内OPG、RANKL、RANK、TRAF6的表达情况。如图9A、B所示,H2O2极显著抑制了OB内OPG的表达(P<0.01),麦胚肽干预后极显著提高了OPG的表达量(P<0.01)。如图9C~E所示,H2O2极显著提高了OB内RANKL、RANK和TRAF6的表达量(P<0.01),麦胚肽可以极显著抑制OB内RANKL、RANK和TRAF6表达(P<0.01),且呈剂量依赖性。综上,共育体系中,H2O2促进RANKL表达,RANK表达量也随之增加,诱饵受体OPG结合力变弱,导致表达量下降,而RANK下游蛋白TRAF6表达量也上升,从而促进OC细胞分化,而麦胚肽可以通过调节OPG/RANKL/RANK通路,降低OC分化诱导因子TRAF6表达量,从而降低OC的分化活性。
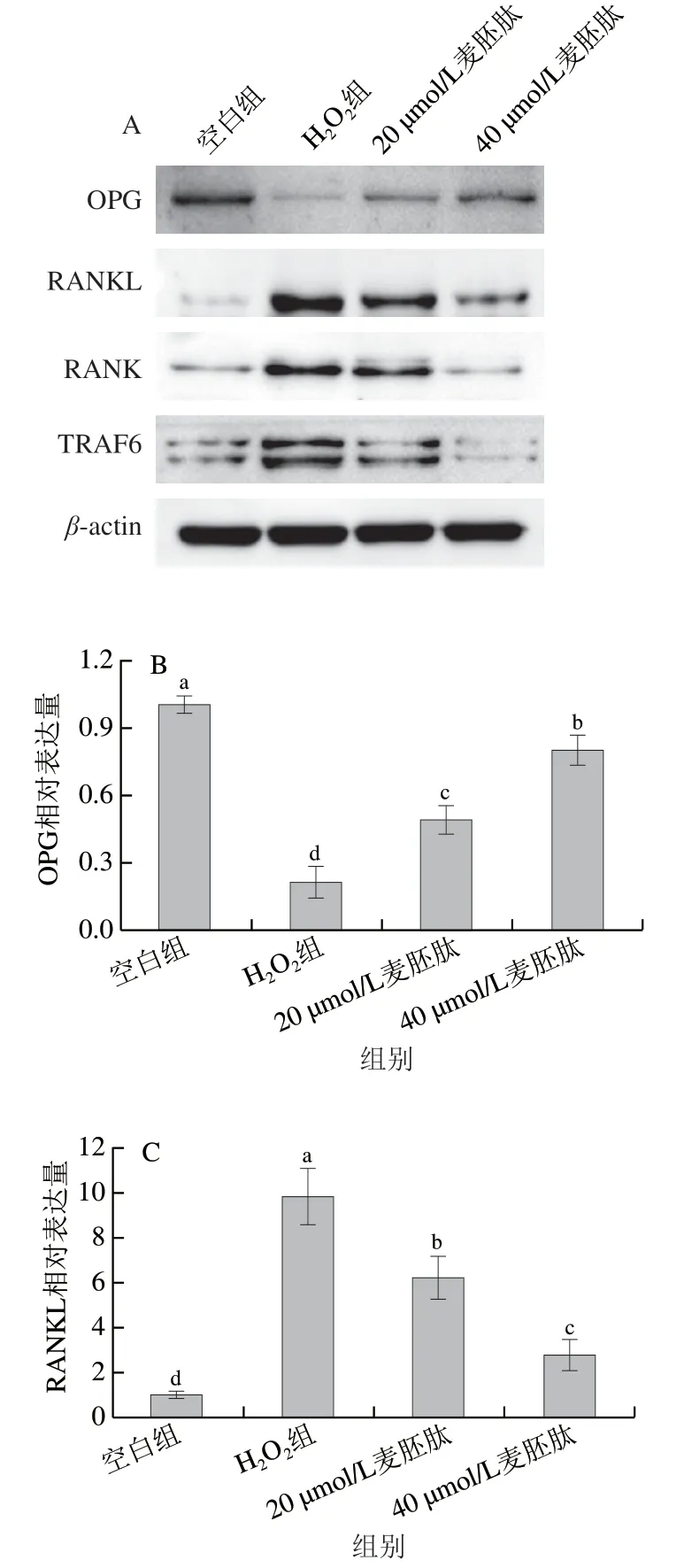
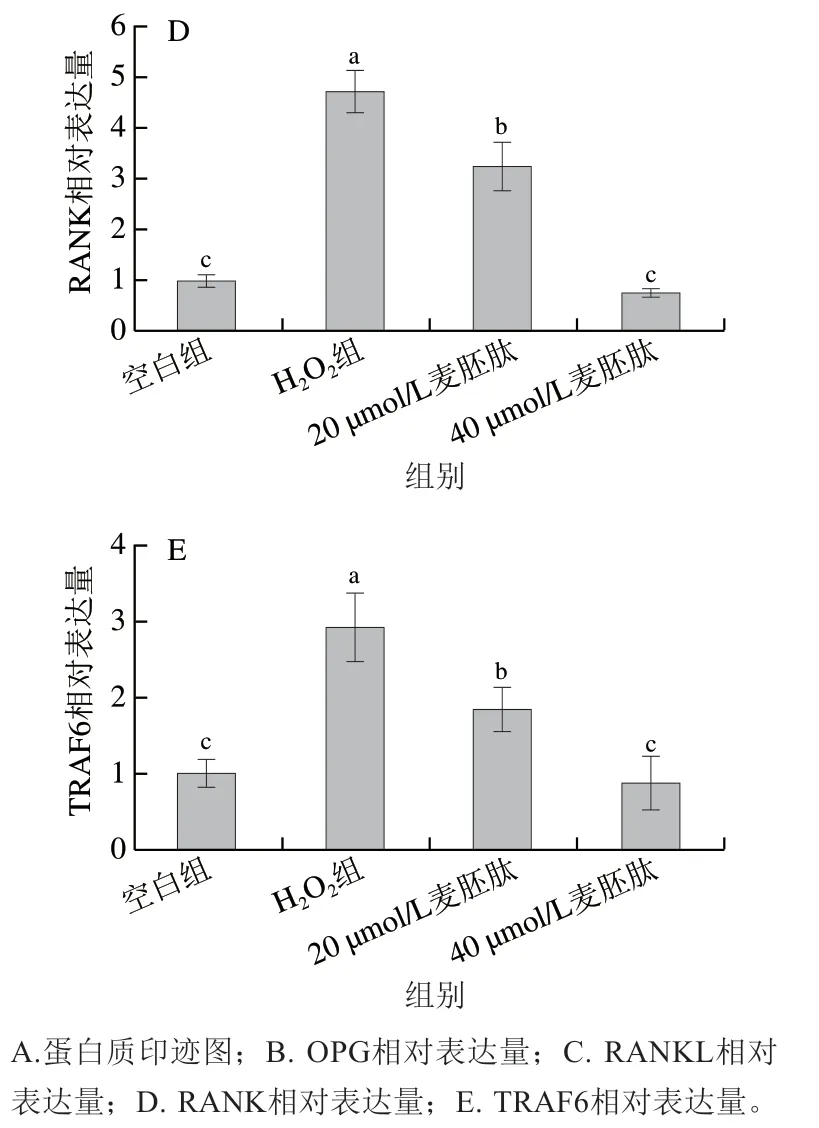
图9 麦胚活性肽对氧化应激共育体系中骨代谢相关蛋白表达的影响Fig. 9 Effect of wheat germ-derived peptide on the expression of bone metabolism-related proteins in co-culture system under oxidative stress
3 讨 论
小麦胚芽肽是以麦胚蛋白为原料,经微生物发酵或酶水解得到的小分子生物活性肽[31]。前期研究表明,麦胚源活性肽ADWGGPLPH能够有效抑制高糖诱导的平滑肌细胞氧化应激[9-10]。本研究选用麦胚源活性肽ADWGGPLPH,利用OB-OC共育模型探究其在氧化应激环境中对OB和OC间稳态的调节能力。
氧化应激被认为是诱发衰老相关疾病的重要因素。骨质疏松作为常见的老年性疾病也已被证实其发病与氧化应激有着密切关系[32]。为评价麦胚源活性肽对共育体系中OB氧化应激水平的影响,通过检测ROS、GSH-Px、SOD、MDA水平发现,麦胚源活性肽能够有效改善H2O2诱导的OB氧化。基于此,假设ADWGGPLPH可能会改善氧化应激引起的OB和OC活性异常,维持共育体系稳态。为验证麦胚源活性肽是否对OB的增殖和分化具有积极作用,本研究采用结晶紫染色和ELISA等方法检测发现,ADWGGPLPH能够有效促进氧化应激环境下共育体系中OB的增殖和分化活性,因此,可以初步得出结论:麦胚源活性肽能够通过促进OB的增殖和分化活性,缓解氧化应激对共育体系中OB活性的影响。进一步研究发现,麦胚源活性肽还可以抑制氧化应激共育体系中OB的凋亡。
OPG是位于OB内部的TNF-α受体超家族的成员蛋白,它可以与同样位于OB内部的RANKL特异性结合,继而影响位于OC表面的RANK,从而抑制OC的分化。因此,OPG又被称作OC形成抑制因子[33]。OPG/RANKL/RANK是调控骨代谢的重要通路之一,也是参与影响OC分化、发育和功能的唯一途径,而OPG/RANKL/RANK信号通路在诱导OC分化成熟、促进骨吸收的同时,OB分泌的OPG使OPG/RANKL比例保持在适当水平[32],以防止骨吸收过度,从而维持骨代谢平衡。本研究通过Western blot以及TRAP染色发现,麦胚源活性肽可以通过调节OPG/RANKL/RANK通路抑制OC的分化活性,从而改善氧化应激引起的OB和OC活性异常。
已有许多研究发现,抗氧化物质干预氧化应激造成的骨代谢异常,从而延缓骨质疏松的发展。白藜芦醇能够通过MAPK磷酸化等抑制OC的分化以及ROS的产生,进而达到促进骨形成的目的[34];褪黑素可以促进抗氧化酶的表达发挥抗氧化活性,延缓骨质疏松的发病进程[35]。此外,茶多酚、蓝莓中的多酚等多种抗氧化物质都被证实具有缓解骨质疏松能力[36-38]。基于上述研究结果,后续本课题组将使用自然衰老大鼠为模型,对麦胚源活性肽ADWGGPLPH维持与氧化应激相关的老年性骨稳态的营养干预进行研究。
4 结 论
麦胚源活性肽可以有效降低共育体系中H2O2诱导的OB氧化应激以及缓解氧化应激造成的OB损伤和凋亡,并促进OB的增殖活性。此外,麦胚源活性肽可以改善氧化应激共育体系中OB分化活性的下降,并通过调节OPG/RANKL/RANK通路抑制OC的过度分化,从而改善共育体系中氧化应激引起的OB和OC活性异常,维持良好的细胞稳态。研究结果可为从麦胚蛋白中开发维持骨稳态的功能因子提供科学依据。
