18F-氟代脱氧葡萄糖PET/CT代谢参数联合临床病理因素预测食管癌患者预后的价值▲
2022-11-30丘文明刘子雅韦红娇黄明捷庞丁华肖国有
丘文明 刘子雅 柴 华 韦红娇 黄明捷 黄 馨 庞丁华 肖国有
(广西医科大学附属肿瘤医院核医学科,广西临床重点建设专科核医学科,广西南宁市 530021)
2020年,食管癌的新发病例数在全球癌症中位居第七,死亡病例数位居第六[1]。研究表明,中国食管癌患者的5年生存率约为20.9%[2]。在治疗前准确预测食管癌患者的生存期有助于医师制订合理的治疗和随访计划,从而提高患者的生存率。有研究报告,18F-氟代脱氧葡萄糖(18F-fludeoxyglucose,18F-FDG)PET/CT代谢参数与食管癌患者的生存期或疗效有关[3],但单个指标预测食管癌患者生存期的受试者工作特征曲线下面积多为0.6~0.8,预测价值有限[4-5]。因此,本研究联合18F-FDG PET/CT代谢参数和临床病理特征预测食管癌患者确诊后的生存情况,旨在为临床上评估食管癌患者的预后提供参考。
1 资料与方法
1.1 临床资料 选取2018年1月至2022年1月在我院接受18F-FDG PET/CT检查和治疗的63例食管癌患者,纳入标准:(1)活检或术后病理确诊为食管癌;(2)抗肿瘤治疗前行18F-FDG PET/CT检查。排除标准:(1)资料不完整的患者;(2)合并其他癌症的患者;(3)非初治患者;(4)死于其他疾病的患者。其中,男性58例、女性5例,年龄23~81岁,中位年龄为59岁;鳞癌59例,神经内分泌癌3例,腺癌1例;5例接受食管癌根治性切除术,58例行化放疗或中药治疗。
1.2 临床病理指标的收集 收集患者的年龄、饮酒史(每周至少饮酒1次,累计达1年以上为有饮酒史)、合并基础疾病情况、体质指数、临床分期、TNM分期、病灶长度(在PET/CT图像中测量)、肿瘤位置、治疗情况(中药治疗/不规律治疗/规律治疗),以及治疗前的中性粒细胞/淋巴细胞比值(neutrophil-to-lymphocyte ratio,NLR)、鳞状细胞癌抗原(squamous cell carcinoma antigen,SCCA)水平、胸苷激酶1(thymidine kinase 1,TK1)水平、肿瘤浸润淋巴细胞(tumor infiltrating lymphocytes,TILs)密度。其中,合并基础病定义为影响抗肿瘤方案实施的基础病;TNM分期和肿瘤部位的判断参考《中国临床肿瘤学会(CSCO)食管癌诊疗指南2021》[6]中的相关标准;规律治疗定义为接受医师建议的首选治疗方案并按时返院复诊,不规律治疗定义为因患方意愿中断治疗或不按时返院复诊,中药治疗为确诊后拒绝西医治疗自行服用中药治疗。血生化检查选取治疗前2周内的结果,采用全自动血液细胞分析仪检测血常规,采用雅培i4000型全自动化学发光仪检测SCCA,采用酶免疫点印迹化学发光法检测TK1。TILs密度评估:组织蜡块来源于广西医科大学附属肿瘤医院病理科,按标准程序行HE染色后,由1名研究者和1名病理科专科医师分别进行TILs密度评定,在200倍镜下,避开坏死区域,评估整张切片淋巴细胞分布密度,将肿瘤侵犯边缘或瘤内淋巴细胞分布稀疏评为少量,弥漫或多灶密集分布评为大量,中等介于两者之间[7],将中等和大量定义为TILs(+),少量定义为TILs(-),评定结果不一致的病例经协商得出统一结论。
1.318F-FDG PET/CT检查方法 所有患者均在抗肿瘤治疗前接受18F-FDG PET/CT检查。18F-FDG由广西医科大学附属肿瘤医院PET/CT中心制备(放化纯度>95%),PET/CT机型为GE Discovery 710(美国通用电气公司)。检查前将患者血糖控制低于8.3 mmol/L,静脉注射3.70~5.55 MBq/kg的18F-FDG,50 min后行64排CT检查,CT管电压为120 kV,管电流为110 mAs,层厚为3 mm或5 mm。PET采用3D采集,5~7个床位,2.5 min/床位。CT数据衰减校正后,采用有序子集最大期望算法重建及融合图像。由两名受过培训的核医学科医师阅片,其中一名具有主治医师以上职称。选取矢状位或冠状位融合图像上病灶垂直距离最长的层面,测量病灶长度,在此层面用3D软件圈选摄取增高区域,尽可能将代谢增高区域包括入内,以40%的最大标准摄取值(maximal standardized uptake value,SUVmax)作为阈值,由电脑自动勾画肿瘤代谢体积(metabolic tumor volume,MTV),SUVmax、MTV、病灶糖酵解总量(total lesion glycolysis,TLG)均由电脑软件自动计算给出。全身肿瘤代谢体积(whole-body metabolic tumor volume,MTVwb)为原发灶和转移灶的MTV总和,全身病灶糖酵解总量(whole-body total lesion glycolysis,TLGwb)为原发灶和转移灶的TLG总和,以上均不包括可疑病灶及炎性病灶。
1.4 随访 通过查阅住院病历和电话随访的形式回访患者,总生存期定义为病理确诊至死亡。随访截止至2022年3月30日,随访时间为0.5~40个月,中位随访时间为8.5个月。随访末期仍存活的病例或失访病例按照截尾数据纳入分析。
1.5 统计学分析 采用GraphPad Prism 5.0、SPSS 22.0、R 4.1.3软件进行统计分析。以生存时间≤中位随访时间(8.5个月)作为阳性事件,通过受试者工作特征(receiver operating characteristic,ROC)曲线获得连续变量SUVmax、MTV、TLG、MTVwb、TLGwb、BMI、NLR、病灶长度的最佳界值[8],以此进行分组及单因素分析;采用Kaplan-Meier法计算中位生存期或生存率,采用log-rank检验法比较中位生存期的差异;采用COX比例风险模型进行多因素分析,方法选择“向前LR”。采用R软件rms程序包绘制Nomogram图并计算一致性指数,通过绘制校准曲线和ROC曲线评估模型的预测价值。以P<0.05为差异有统计学意义。
2 结 果
2.1 随访结果 至随访截止日期,共28例死亡(44.44%)。经Kaplan-Meier生存曲线法分析,63例食管癌患者确诊后的中位生存期为16.5个月,确诊后的6个月、1年总生存率分别为75.22%、60.53%。见图1。
2.2 单因素分析结果 ROC曲线结果得出SUVmax、MTV、TLG、MTVwb、TLGwb、体质指数、NLR、病灶长度的最佳界值分别为17.1、15.2 cm3、87.2 g、14.2 cm3、166.0 g、18.02 kg/m2、2.47、5.4 cm。最终评定TILs密度为少量30例、中等19例、大量14例(典型结果见图2),故TILs(+)共33例,TILs(-)共30例。单因素分析结果显示,不同体质指数、治疗情况、病灶长度、MTV、MTVwb、TLGwb的食管癌患者之间确诊后的中位生存期差异均有统计学意义(均P<0.05),见表1。
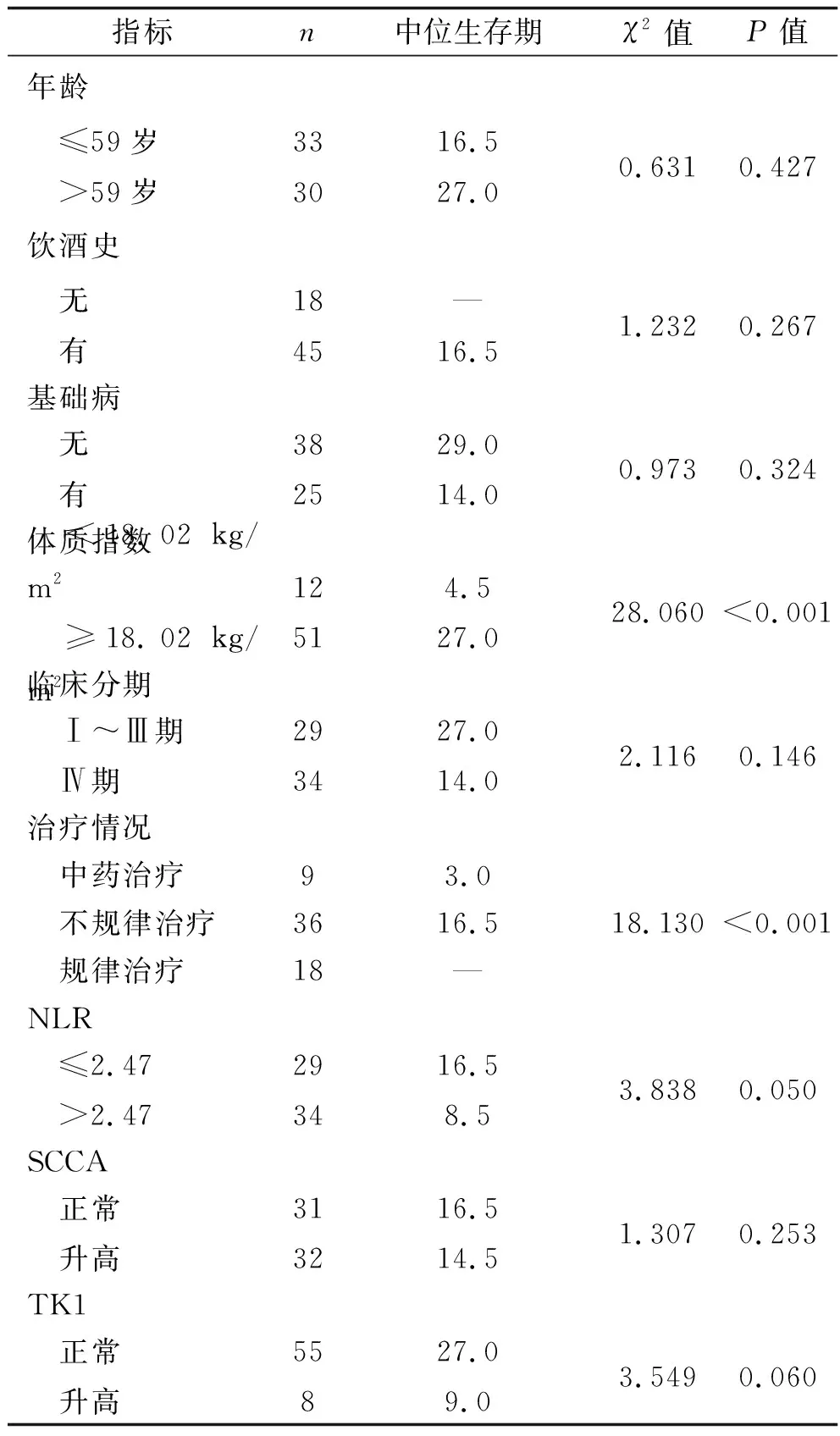
表1 单因素分析结果(个月)
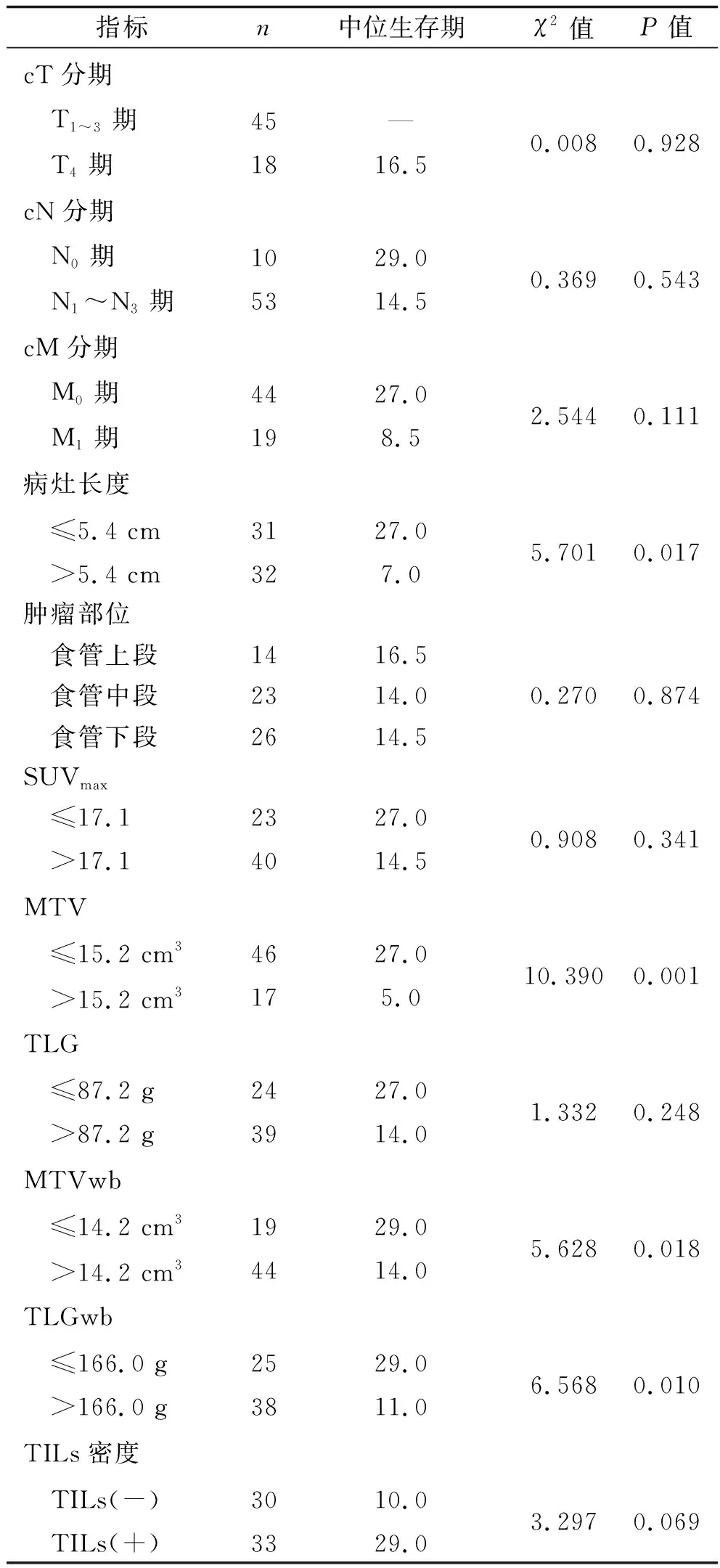
续表1
2.3 多因素生存分析结果 将单因素分析中有统计学意义的指标MTV、MTVwb、TLGwb、体质指数、治疗情况、病灶长度,以及可能对生存期有影响的指标NLR、TK1、TILs密度作为自变量,生存情况作为因变量,纳入多因素COX回归分析,变量赋值见表2。结果显示,体质指数≥18.02 kg/m2、规律治疗、TILs(+)是食管癌患者确诊后生存情况的独立保护因素,TLGwb>166.0 g是其独立危险因素(均P<0.05),见表3。

表2 变量赋值情况
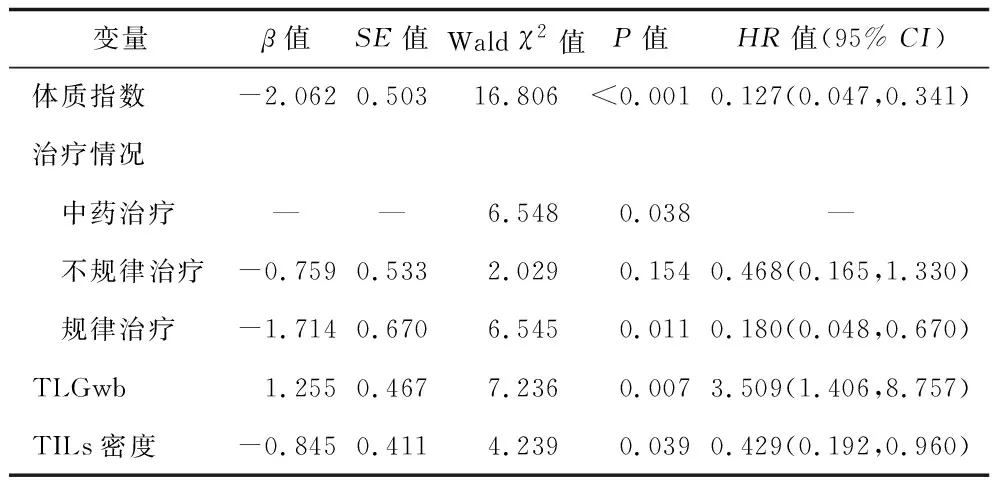
表3 多因素 COX回归分析结果
2.4 食管癌患者预后的预测模型构建及验证 根据多因素分析结果建立食管癌患者确诊后生存情况的Nomogram预测模型(见图3),预测模型的一致性指数为0.838;该模型预测食管癌患者确诊后6个月和1年生存情况的校准曲线与参考线基本拟合(见图4)。 Nomogram模型、体质指数、治疗情况、TLGwb及TILs密度预测食管癌患者6个月生存情况的曲线下面积分别为0.935、0.760、0.765、0.731及0.597,预测1年生存情况的曲线下面积分别为0.841、0.664、0.660、0.704及0.690,见图5。
3 讨 论
18F-FDG PET/CT具有集代谢和解剖显像于一体的优势,在疾病的预后评估中发挥一定的作用。有研究报告,MTV和TLG在预测食管癌患者生存情况方面优于SUVmax[9-10]。本研究中,SUVmax与食管癌患者的生存情况不相关(P>0.05),这提示SUVmax在预测食管癌患者预后中的价值可能有限。而TLGwb>166.0 g是食管癌患者确诊后生存情况的独立危险因子(P<0.05),对患者的6个月和1年的生存情况均具有一定的预测效能(曲线下面积均>0.7),与Takahashi等[11]的研究结果相似,这表明在评估食管癌患者的预后方面,TLGwb可能比其他PET/CT代谢参数更有价值,但是不排除样本量不足、选取界值的方法不同对研究结果造成干扰,导致其他PET/CT代谢参数与食管癌患者的生存情况无明显相关性。目前尚无选择指标分界值的统一方法,部分研究选择采用中位生存期分组[12],也有研究以随访末期患者死亡作为终点事件,通过ROC曲线获取最佳界值进行分组[13]。由于本研究死亡病例多发生在中位随访期8.5个月内,因此借鉴谢彦婷等[8]的研究方法,以生存时间是否少于8.5个月作为状态变量,绘制ROC曲线获得最佳界值。今后可进一步探讨最佳的分组界值并扩大样本量,以明确其他PET/CT代谢参数与食管癌患者生存情况的相关性。
本研究结果显示,TILs密度是食管癌患者确诊后生存情况的独立保护因素(P<0.05),TILs(+)的食管癌患者确诊后的生存情况优于TILs(-)者,这与Okadome等[14]的研究结果相似。TILs由CD8+细胞毒T淋巴细胞、CD4+辅助性T细胞、叉头框蛋白P3+调节性T淋巴细胞、B淋巴细胞、NK细胞等组成,各亚群可能具有不同的免疫作用[15-17]。目前临床上已广泛开展免疫治疗,其中程序性细胞死亡受体1(programmed cell death receptor-1,PD-1)抑制剂可通过阻断T淋巴细胞表面的PD-1与肿瘤细胞表面的PD-1配体结合,防止T淋巴细胞活性降低;若在治疗前病灶即存在丰富的TILs,肿瘤微环境中具有抗肿瘤作用的T淋巴细胞数量一般也较多,PD-1抑制剂进一步维持了这部分细胞对肿瘤的杀伤作用,因此患者的治疗效果较好。本研究中有26例患者使用PD-1抑制剂,这可能是本研究中TILs密度与食管癌患者预后相关的原因之一。此外,本研究结果显示,体质指数<18.02 kg/m2是食管癌患者确诊后生存情况的危险因素(P<0.05),这可能与本研究中体质指数<18.02 kg/m2的患者多为较晚期病例,就诊时身体基础状况已较差有关。由于本研究所纳入的病例治疗方案和周期数差异大,本研究中仅5例患者行食管癌根治性切除术,有9例患者服用中药治疗,其余患者接受不同周期的化疗、放疗或免疫治疗,因此本研究只根据依从性进行分组。结果显示,规律治疗是食管癌患者确诊后生存情况的独立保护因素,规律治疗的患者的生存情况更好(P<0.05);而中药治疗可能疗效不确切或者使用不规范,此类患者预后相对较差。
Nomogram图由于具有直观、实用的特点,近年被广泛应用于患者的预后和疗效评估。Chu等[18]利用MRI放射组学参数联合临床参数建立预测食管癌患者生存情况的Nomogram模型,模型的一致性指数为0.712。本研究Nomogram模型的一致性指数达到0.838,校准图提示预测生存率与实际生存率基本接近,预测6个月和1年生存情况的ROC曲线下面积分别达到0.935、0.841,均优于单一指标TLGwb、TILs密度、体质指数和治疗情况的预测价值,说明该模型的区分度和精确度均达到较高水平。根据本研究的Nomogram图可快速预测食管癌患者的生存情况,如1例体质指数为17.19 kg/m2、TLGwb为88.2、TILs(+)、不规律治疗的食管癌患者,其对应的总分为160分,确诊后6个月和1年仍存活的概率约为72%和40%,可加强随访或积极治疗,从而延长其生存期。但本研究属于单中心小样本回顾性研究,由于样本量小,未划分测试集和验证集,需结合其他中心的数据进行外部验证。
综上所述,联合TLGwb、TILs密度、体质指数、治疗情况构建的Nomogram模型预测食管癌患者确诊后生存情况的效能较高,可为临床筛选高风险患者和制订个体化治疗方案提供参考,后期可结合多中心数据进行外部验证。
