Graves病患者促甲状腺素受体抗体与肠道菌群及短链脂肪酸的相关性
2022-11-29史婷婷中华曹秋梅
王 华 史婷婷 信 中华 琳 李 聪 曹秋梅*
(1.首都医科大学附属北京同仁医院南区急诊科,北京 102600;2.首都医科大学附属北京同仁医院内分泌科,北京 102600;3.首都医科大学生物工程学院生物医学信息学系,北京 100069)
肠道菌群是指在人体胃肠道内定植的有机微生物群,被称作人体“第二大脑”,对内分泌系统、免疫系统及神经系统发挥重要的调节作用[1-2]。短链脂肪酸(short chain fatty acids,SCFAs)是肠道菌群发酵膳食纤维产生的一类重要的信号分子,是含有1~6个碳原子的有机脂肪酸的总称,主要包含乙酸、丙酸、丁酸和戊酸等[3]。研究[4-5]证实SCFAs参与肠上皮细胞的能量供应,维持肠黏膜屏障通透性以及具有抗炎和抗肿瘤等作用,在肠道疾病和免疫性疾病中扮演重要角色。近年来有研究[6]表明,肠道菌群的改变在甲状腺疾病如桥本病、Graves病及甲状腺癌中发挥着重要的调节作用,研究[7]表明,初诊Graves病患者的肠道菌群及代谢产物SCFAs发生显著性变化,但是Graves病的患者如果经过药物治疗后甲状腺激素水平恢复正常时,肠道菌群及代谢产物的水平是否与正常人存在差异?促甲状腺素受体抗体(thyrotropin receptor auto-antibodies,TRAb)在Graves病的进展及预后中发挥重要的作用,该抗体的血清滴度是否与肠道菌群及代谢产物具有相关性?关于此部分的研究较少。本研究入组了药物治疗后甲状腺功能正常的Graves病患者及健康对照者,通过16S rRNA测序了解两组人群的粪便肠道菌群结构,气相色谱-质谱法(gas chromatography-mass spectrometer,GC-MS)测定两组的SCFAs浓度,分析血清TRAb滴度与差异菌群及代谢物的相关性,为Graves病的治疗提供新思路。
1 对象与方法
1.1 研究对象
将2018年3月至2019年12月在首都医科大学附属北京同仁医院急诊科及内分泌科被诊断为Graves病的患者中选取30例治疗后甲状腺功能正常的患者作为病例组(Graves组)。Graves病患者入组标准:①结合临床症状、实验室检查及影像学检查,已确诊为Graves病,应用甲巯咪唑片(德国默克公司,国药准字J20171078,规格10 mg/片)治疗半年后甲状腺功能正常的患者。②年龄≥18岁。③神志清楚,配合随访。Graves组排除标准:①甲状腺功能异常者;②既往对抗甲状腺药物过敏,有放射性碘或甲状腺手术治疗史;③1个月前抗生素、微生物制剂、免疫抑制剂或激素类药物使用史;④合并其他自身免疫性疾病;⑤妊娠期或哺乳期妇女;⑥合并其他严重原发性疾病,包括糖尿病、高血压、高血脂等;合并恶性肿瘤;胃肠道手术史,素食主义,以及乙醇或其他药物依赖史,伴有精神障碍及认知障碍者[8]。
同期选取32名健康志愿者为对照组。对照组纳入标准:①性别、年龄匹配;②血、尿常规、生化检查及甲状腺功能均无明显异常。③甲状腺超声无异常。排除标准:①既往被确诊的糖尿病患者、急慢性感染性疾病、有严重肝肾疾病史及自身免疫疾病病史的人群;②有1个月前抗生素、微生物制剂、免疫抑制剂或激素类药物使用史者;③怀孕或哺乳期妇女;④素食主义,以及乙醇或其他药物依赖史,伴有精神障碍及认知障碍者。
1.2 资料收集
内容包括性别、年龄、体质量指数(body mass index, BMI)、吸烟史、肝肾功能、甲状腺功能检查、甲状腺自身抗体及患者用药史。研究方案符合人体试验伦理学标准,并得到首都医科大学附属北京同仁医院伦理委员会的批准(伦理审批号:20160501)。病例组及对照组受试者均签署书面知情同意书。
1.3 实验室检测
1.3.1 血清甲状腺激素测定
血清甲状腺激素[游离三碘甲腺原氨酸(free triiodothyronine, FT3)、 游离甲状腺素(free thyroxine, FT4)、三碘甲腺原氨酸(triiodothyronine, T3)、四碘甲腺原氨酸(thyroxine, T4))和促甲状腺激素 (thyroid-stimulating homone, TSH)]在 ADVIA Centaur XP Immunoassay系统平台中进行检测(德国西门子公司)。TRAb滴度的测定采用电化学发光法(德国Roche公司)。参考范围(FT3:3.50~6.50 pmol/L,FT4:11.50~22.70 pmol/L,TSH:0.55~4.78 μIU/mL,TRAb:0.00~1.75 IU/L)。
1.3.2 粪便标本的收集
Graves组患者在治疗6个月时甲状腺功能恢复正常后留取粪便标本,对照组同期留取粪便标本。标本均是空腹8 h晨起留取。每个受试者收集不少于2.5 g的新鲜粪便样本,装于含有DNA 稳定剂的粪便采集管中(PSP Spin Stool DNA Plus Kit, Stratec Molecular公司, 德国)。粪便样本均储存在-80 ℃冰箱中。
1.3.3 粪便16S rRNA测序及生物信息学分析
使用Stool DNA Kit进行粪便DNA提取,通过琼脂糖凝胶电泳检测DNA提取质量,紫外分光光度计对DNA进行定量,对粪便细菌16S rDNA的V4区进行PCR扩增,选用引物515F (5′-GTG CCA GCMGCC GCG GTAA-3′) 和 806R (5′-GGA CTACHVGGG TWT CTAAT-3′) 进行扩增。扩增的PCR产物经过Illumina Hiseq 2000测序仪进行测序(诺禾致源公司)。去除原始数据中低质量的Reads,通过97%相似度的标准聚类,得到操作分类单元(operational taxonomic units, OTU)。分别从每个聚类单元挑选1条代表性序列,以Greengene 13.8的数据库为模板注释物种名称组成OTUs。基于有效数据进行OTU聚类及物种分析。绘制韦恩图(Venn diagram)分析两组之间特有或共有的OTU,直观地表现样本在OTU水平上的组成相似性及重叠情况。
根据物种丰度表进行Alpha(α)多样性分析、Beta(β)多样性分析及物种分类与丰度分析。α多样性其水平能反映个体肠道菌群的丰富性和多样性。其中, Chao1及Ace指数A用于评价菌群丰富度,simpson与shannon指数用于评价菌群多样性和均匀性,Goods_coverage指数评估测序深度。采用 BIPES QIIME分析流程进行提取和处理测序数据,采用linear discriminant analysis(LDA)coupled with effect size measurements(LEfSe)在线工具寻找组间差异有统计学意义的菌群。
1.3.4 GC-MS法测定SCFA
检测指标包括:乙酸、丙酸、丁酸、异丁酸、异戊酸、己酸。空腹8 h晨起取血,离心取血清150 μL,加入100 μL磷酸,再加75 μg/mL的内标(异己酸)溶液20 μL和乙醚280 μL匀浆1 min,于4 ℃ 12 000 r/min离心10 min,取上清上机待测。检测平台:Thermo TRACE 1310-ISQLT气-质联用仪(Thermo公司,美国)。
1.4 统计学方法
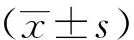
2 结果
2.1 两组基本临床特征比较
Graves组患者及对照组的年龄、性别、BMI、尿素氮、肌酐及丙氨酸氨基转移酶比较,差异均无统计学意义。两组的门冬氨酸氨基转移酶浓度差异有统计学意义,但数值均在正常范围。虽然组间T3、T4及TSH浓度之间差异有统计学意义,但是两组的FT3、FT4、T3、T4及TSH浓度均在正常范围,差异没有临床意义。Graves组的TRAb浓度明显升高,与对照组相比,差异有统计学意义(P<0.001),详见表1。
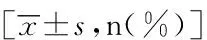
表1 Graves组与对照组的一般临床特征比较Tab.1 Baseline characteristics of patients with Graves and controls
2.2 Alpha(α)多样性分析
统计分析显示,Alpha多样性指标在两组间差异均有统计学意义(P<0.05),详见表2。

表2 Graves组与对照组肠道菌群的Alpha多样性指标比较Tab.2 Comparison of Alpha diversity in intestinal microbia between GD patients and controls
2.3 OTUs分析的韦恩图分析
如图1所示,Graves组特有OTU 940个,对照组特有OTU 196个,两组重叠OTU 1 480个,Graves组OTU丰度较对照组增加。
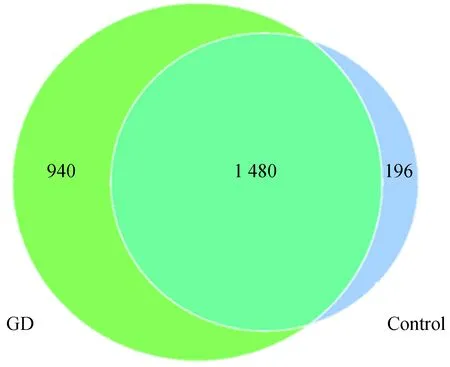
图1 Graves组及对照组肠道菌群OTUs分析的韦恩图Fig.1 Venn diagram of OTUs analysis of intestinal flora in GD patients and control
2.4 Graves组及对照组肠道菌群纲水平(Class)差异性分析
在纲水平,与对照组相比,只有柔膜菌纲(Erysipelotrichia)在Graves组丰度明显升高,差异有统计学意义(P<0.05,图2)。
2.5 Graves组及对照组肠道菌群科水平(Family)差异性分析
在科水平,与对照组相比,Graves组的拟杆菌科(Bacteroidaceae)、瘤胃球菌科(Ruminococcaceae) 及理研菌科(Rikenellaceae)丰度下降,普雷沃菌科(Prevotellaceae)、韦荣球菌科(Erysipelotrichaceae)及消化链球菌科(Peptostreptococcaceae)丰度升高,差异均有统计学意义(P<0.05,图3)。
2.6 Graves组及对照组肠道菌群种水平(Species)差异性分析
在种水平,与对照组相比,Graves组的Bacterium_LF-3、瘤胃球菌属(Ruminococcus-bromii) 、霍氏真杆菌(Eubacterium_hallii)、瘤胃球菌(Ruminococcus—SP-Marseille-P328)、反刍动物真杆菌(Eubacterium_ventriosum)、多尔菌(Dorea_longicatena及Dorea_formicigenerans)丰度升高。而瘤胃球菌(Ruminococcus-bicirculans)、普通拟杆菌(Bacteroide_vulgatus)、华德萨特菌(Sutterella_wadsworthensis)、颤杆菌(Oscilibacter_sp_ER4)及另枝菌(Alistipes_shahii)丰度下降,差异均有统计学意义(P<0.05,图4)。
2.7 Graves及对照组粪便中特异性差异肠道菌群
Graves组和对照组间的LEfSe统计的差异菌属如图5A所示,不同颜色分别代表在两组内各自富集的菌属:在Graves组普雷沃菌(f_Prevotellaceae及g_unidentified_Prevotellaceae)及厌氧菌(s_Prevotellacopri)富集,其中f_Prevotellaceae富集程度最高。在对照组中,拟杆菌(s_Bacteroides_plebeius), 罕见小球菌属(g_Subdoligranulum) 及瘤胃球菌科(f_Ruminococcacea) 富集,其中f_Ruminococcaceae富集程度最高。

图2 Graves组及对照组的纲水平差异菌相对丰度比较 Fig.2 Comparison of the bacterial abundance at the class level in patients with GD and controlsControl: n=32;GD: Graves disease, n=30.
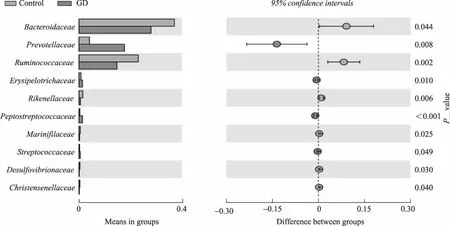
图3 Graves组及对照组的科水平差异菌相对丰度比较Fig.3 Comparison of the bacterial abundance at the Family level in patients with GD and controls Control: n=32;GD: Graves disease,n=30.
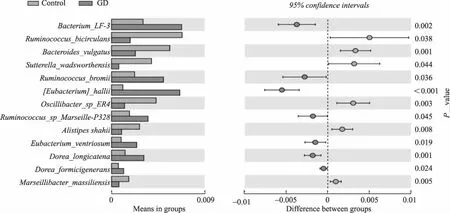
图4 Graves组及对照组的种水平差异菌相对丰度比较Fig.4 Comparison of the bacterial abundance at the Species level in patients with GD and controlsControl: n=32;GD: Graves disease, n=30.
2.8 功能预测
基于SILVA数据库的物种注释,本研究通过Tax4Fun方法对两组之间的菌群进行功能预测。与对照组相比,在Level 2水平,Graves组菌群的糖代谢、脂肪酸代谢及细胞合成和信号传导等通路水平显著下调,而转录通路、能量代谢及酶家族活性等通路水平显著上调,差异有统计学意义(P<0.05,图6)。
2.9 短链脂肪酸测定
液相色谱法测定Graves组及对照组的短链脂肪酸浓度。与对照组相比,Graves组的丙酸及丁酸的浓度明显降低,而异戊酸浓度明显升高,组间差异有统计学意义(P<0.05)。其余短链脂肪酸浓度在两组间差异无统计学意义(P>0.05,图7)。
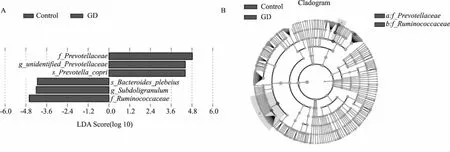
图5 Graves组及对照组差异菌群LEfSe分析Fig.5 LEfSe analysis between the intestinal microbiota in patients with GD and controls
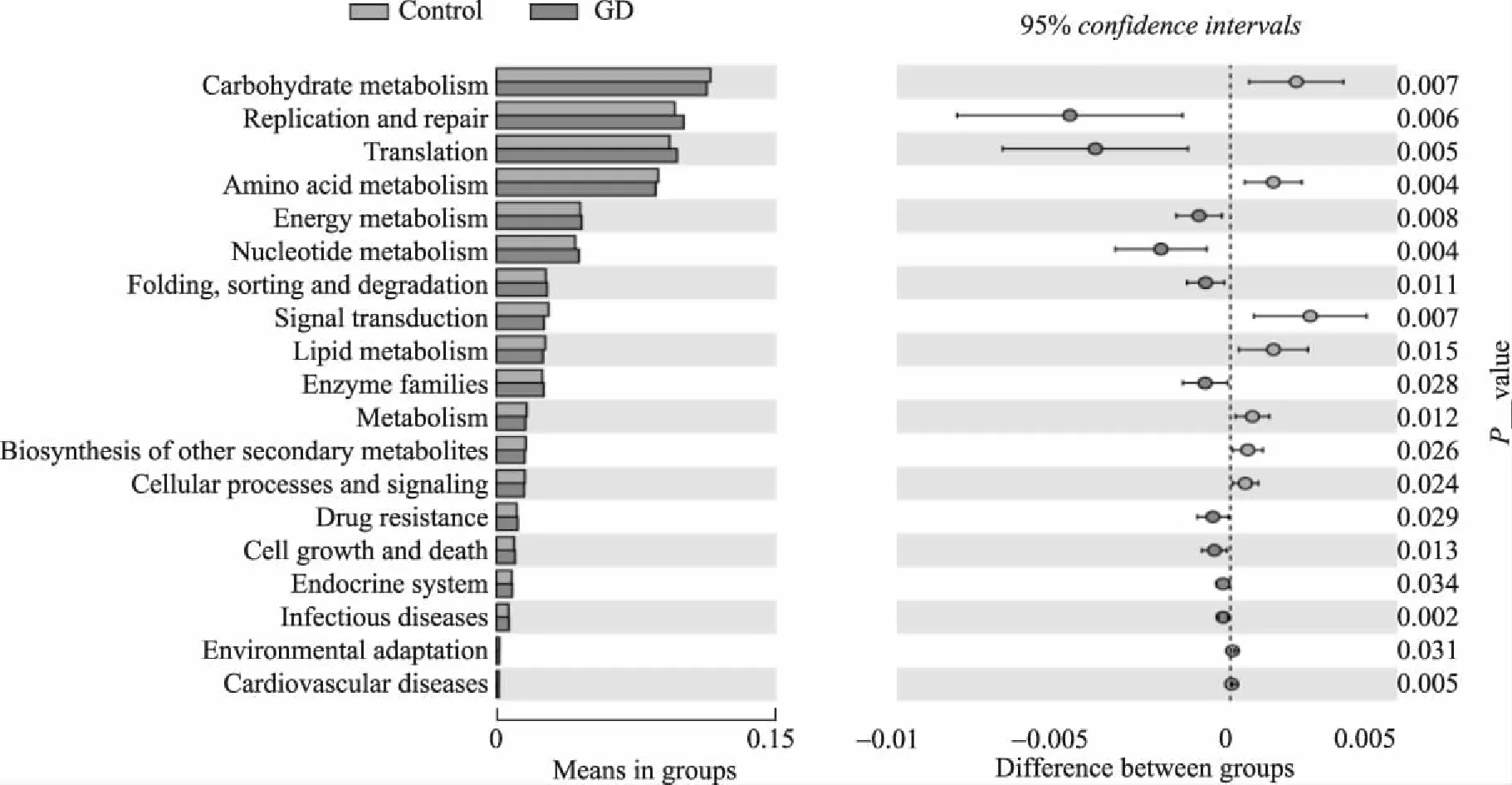
图6 Graves组及对照组差异代谢途径Fig.6 Comparisons of changes in the predicted function abundance between GD and control Control: n=32;GD: Graves disease, n=30.
2.10 肠道菌群与短链脂肪酸的相关性分析
Graves组中肠道菌群及短链脂肪酸的相关性分析结果显示,丙酸与瘤胃球菌呈正相关关系(r=0.376,P=0.041,图8)。
2.11 TRAb抗体滴度与肠道菌群的相关性分析
TRAb抗体的滴度与差异肠道菌群相关性分析结果显示,TRAb滴度与胃瘤球菌丰度呈现负相关关系(r=-0.349,P=0.022,图9)。
3 讨论
肠道菌群与人体宿主保持动态平衡,在保护肠道、抵御病原、代谢及免疫等方面发挥着重要的作用。肠道菌群紊乱与多种免疫性疾病密切相关,成为多种疾病治疗的新靶点。近年来有研究[9]表明,肠道菌群在甲状腺疾病的发生发展中发挥着调节作用。肠道菌群中耶尔森菌、乳杆菌、直肠真杆菌、双歧杆菌、分节丝状菌、普雷沃菌属等通过分子模拟等机制引起交叉免疫反应从而诱发甲状腺功能亢进(以下简称甲亢)的发生。本研究团队既往研究[10]显示,Graves病合并甲状腺性眼病患者的肠道菌群发生了显著改变。林凯等[11]报道,Graves病患者肠道耶尔森菌、分节丝状菌、直肠真杆菌数量均高于健康组,而双歧杆菌、乳杆菌、普雷沃菌属数量均低于健康组。有研究[12]显示,甲状腺功能的异常本身会对肠道菌群的构成产生影响。如果甲状腺功能恢复正常,肠道菌群是否与对照组有差异?本研究纳入了经过治疗甲状腺功能恢复正常的Graves患者与对照组。本研究显示,虽然Graves组患者的甲状腺功能恢复正常,但是与对照组相比,Graves组患者的普雷沃菌(Prevotellaceae)等丰度升高,而拟杆菌(Bacteroidaceae)及瘤胃球菌(Ruminococcaceae) 等丰度下降, LEfSe分析显示Graves组普雷沃菌(f_Prevotellaceaeg_unidentified_Prevotellaceae)富集,其中f_Prevotellaceae富集程度最高。普雷沃菌有可能是Graves病的一个特征性菌群,但肠道菌群的个体差异较大,多种因素如饮食、地域等都会影响个体的肠道菌群,这是部分研究结果不一致的原因之一,因此还需要宏基因组测序等进一步的研究。本研究结果表明,即使甲状腺功能恢复正常,Graves组患者的肠道菌群与对照组相比差异仍然有统计学意义。
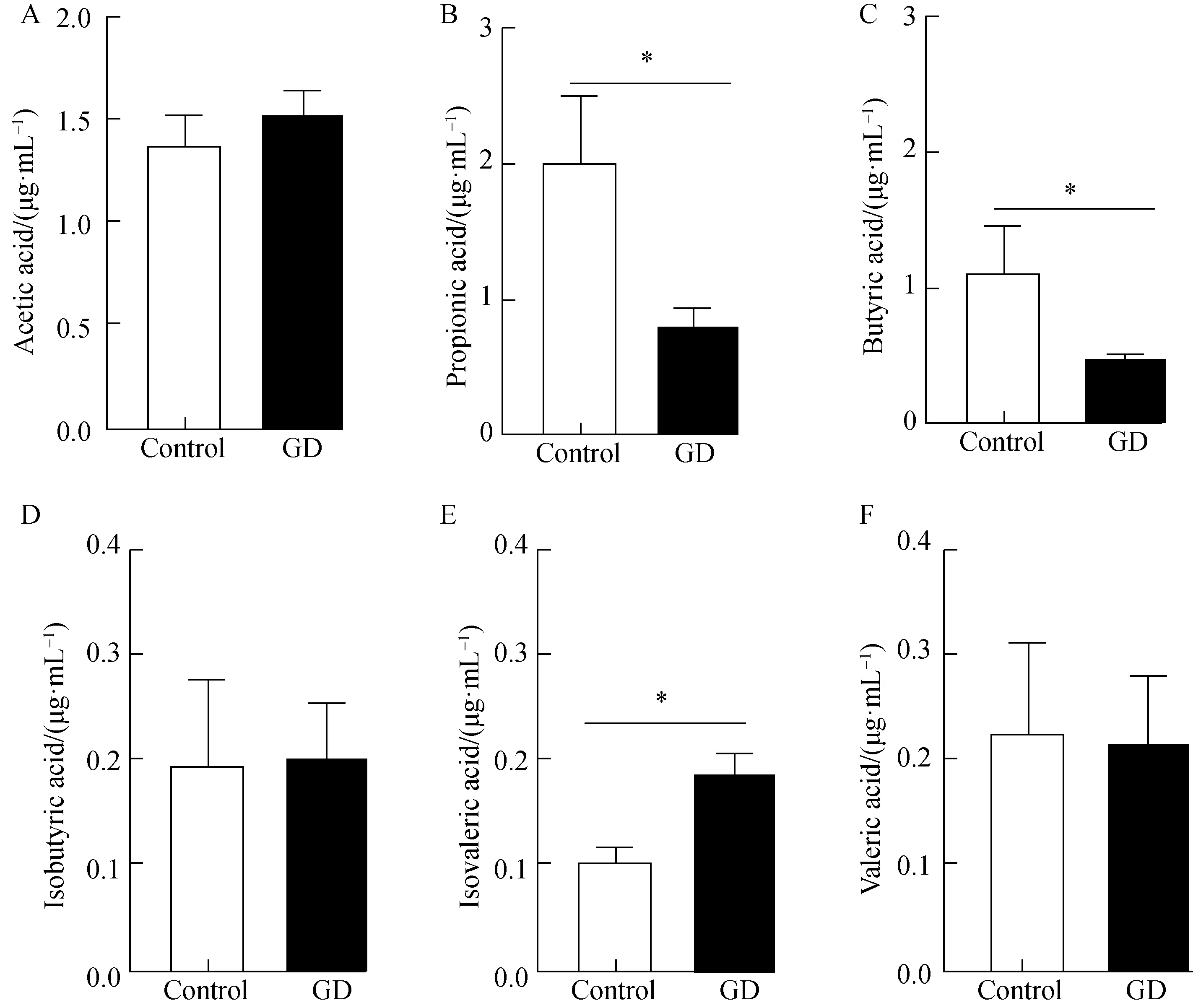
图7 GC-MS法测定Graves组及对照组SCFA浓度Fig.7 Assay of SCFA levels in GD group and control by GC-MS

图8 丙酸浓度与瘤胃球菌丰度的关联分析Fig.8 Correlation analysis of propionic acid and Ruminococcus

图9 TRAb抗体滴度与瘤胃球菌丰度的关联分析 Fig.9 Correlation Analysis of TRAb and Ruminococcus TRAb: thyrotropin receptor auto-antibodies.
SCFAs是肠道菌群发酵膳食纤维的终产物,除了为宿主提供能量,在调节免疫等方面发挥重要的作用。SCFAs的浓度主要与产生SCFAs的细菌丰度及饮食中膳食纤维的含量有关[13-14]。在人体中,乙酸、丙酸、丁酸占肠道中短链脂肪酸的95%以上。主要产乙酸菌包括拟杆菌类、双歧杆菌类、消化链球菌类及梭菌类;主要产丙酸菌有拟杆菌等;主要产丁酸菌有梭菌、毛螺菌、真杆菌和瘤胃球菌等[15]。Su等[16]报道,Graves组患者的丙酸浓度发生显著性改变,可能与产生丙酸的脆弱拟杆菌(Bacteroidesfragilis)中的YCH46分支菌群的丰度变化相关。 本研究显示,经过治疗后的Graves组患者的丙酸及丁酸浓度仍显著降低,同时异戊酸浓度显著升高,差异有统计学意义。有研究[17]报告,拟杆菌及瘤胃球菌的代谢产物是丙酸及丁酸,本研究将瘤胃球菌的丰度与血清丙酸及丁酸的浓度进行了关联分析,结果显示,丙酸与瘤胃球菌丰度呈正相关,丙酸浓度的下降有可能跟瘤胃球菌的丰度下降相关。既往研究[18-19]表明,丁酸和丙酸能增加肠上皮细胞紧密连接蛋白 ZO-1 等的表达,减少免疫反应的发生,而异戊酸浓度升高会引起结肠平滑肌松弛,对肠道健康不利[20]。因此,丙酸及丁酸作为肠道菌群的代谢产物,其变化可能参与Graves病的免疫调节过程,这一点需要进一步研究证实。
TRAb抗体在Graves病的进展及预后中发挥重要的作用。本研究表明,Graves组患者即使甲状腺功能恢复正常,患者的肠道菌群与对照组差异仍有统计学意义,这一差异是否与TRAb抗体相关?本研究进一步将血清TRAb抗体与差异肠道菌群的丰度进行了关联性分析,结果显示,TRAb抗体滴度与瘤胃球菌丰度呈现负相关。该结果提示,与甲状腺激素浓度相比,TRAb抗体可能与Graves组患者的肠道菌群更有相关性。
综上所述,经过治疗后的Graves病患者的肠道菌群及代谢物SCFAs发生了显著性改变,其中拟杆菌及瘤胃球菌等菌丰度下降,代谢物丙酸及丁酸的浓度降低,丙酸浓度的下降有可能是跟瘤胃球菌的丰度下降相关。与甲状腺激素浓度相比,TRAb抗体可能与Graves病患者的肠道菌群变化更有相关性。但在本项研究中,课题组未对Graves组患者治疗前的肠道菌群及代谢物进行研究,无法明确治疗过程中TRAb浓度的变化与肠道菌群的关联性。并且此研究样本量偏小,缺乏长期随访跟踪研究,未能排除药物对肠道菌群的影响,在后续的研究中需要扩大样本量,对Graves组患者治疗前后的肠道菌群及代谢物进行分析,并设置药物治疗后TRAb阳性及阴性对照组,进一步探讨肠道菌群及短链脂肪酸与Graves病的相关性。其次,需要深入开展肠道菌群宏基因组测序分析,进一步寻找差异菌群并进行验证。
利益冲突所有作者均声明不存在利益冲突。
作者贡献声明王华:提出研究思路,设计研究方案,收集标本及撰写论文;史婷婷、信中:收集标本、提取粪便DNA及采集数据;华琳:分析数据及审阅论文;李聪:整理数据;曹秋梅:总体把关,审定论文。
