黄芩苷在呼吸道黏膜慢性炎症性疾病中的抗炎作用及机制研究进展
2022-11-29杨婧兴王向东
杨婧兴 蔡 超 赵 妍 王向东 张 罗,4,5
(1.首都医科大学附属北京同仁医院耳鼻咽喉头颈外科,北京100730; 2.北京市耳鼻咽喉科研究所,北京100005;3.首都医科大学附属北京佑安医院耳鼻咽喉科,北京100069;4. 首都医科大学附属北京同仁医院变态反应科,北京100730; 5.中国医学科学院慢性鼻病诊疗策略研究创新单元,北京 100005)
以过敏性鼻炎(allergic rhinitis,AR)、慢性鼻窦炎(chronic rhinosinusitis,CRS)和哮喘为主的呼吸道黏膜慢性炎症性疾病严重影响人类日常生活,给社会经济造成负担。AR是个体接触变应原后引起的上呼吸道黏膜慢性非感染性炎症,主要症状表现有打喷嚏、流清水样涕、鼻痒、鼻塞,还可能伴有眼痒、流泪等,是由免疫球蛋白E(immunoglobulin E, IgE)介导的Ⅰ型超敏反应[1]。但目前AR无法根治,仅通过药物和免疫治疗来控制症状以期提高患者生活质量[2]。CRS主要症状有鼻塞、流涕、头面部疼痛、嗅觉受损或丧失等[3-4]。CRS的发病机制复杂,受多种外在和内在因素影响,如微生物组分改变、先天免疫缺陷和上皮屏障功能障碍等,其治疗仍然面临挑战,传统的鼻内镜手术以及糖皮质激素、大环内酯类抗生素、抗组胺和抗白三烯类药物治疗对大多数患者有效,但仍有局限性和不良反应。哮喘是异质性的下气道慢性炎症性疾病,临床表现为反复发作的喘息、气急,伴或不伴胸闷和咳嗽等症状,同时伴有气道高反应性和可变的气流受限,随着病程延长,可出现气道重塑[5]。目前哮喘的治疗以药物和生物治疗为主,治疗目标在于控制症状,尽量减少急性发作和肺功能的不可逆损伤,且无法根治。
因此,呼吸道黏膜慢性炎症性疾病的治疗迫切需要更多、更安全的手段和方式,传统祖国医学中的中草药在我国受众较广[6]。本文总结归纳了黄芩苷在以AR、CRS和哮喘为主的细胞和动物模型中的抗炎作用研究,为黄芩苷应用于呼吸道黏膜慢性炎症性疾病的临床治疗提供理论依据。
1 黄芩苷
黄芩最早见于《神农本草经》,可追溯至公元200年至250年,用于治疗苦、寒、肺和肝问题,黄芩苷是一种从黄芩根部提取的类黄酮单体[7],在中国已经有2 000多年的使用史,最早用于治疗感冒和细菌性肺炎[8]。黄芩苷不良反应低,研究表明[9-10]黄芩苷在一定的药用剂量下对人类正常上皮细胞、外周细胞和髓系细胞几乎没有毒性。黄芩苷因其较好的抗炎功效,已被用于治疗类风湿关节炎、骨关节炎、牙周炎等多种炎症性疾病[11]。黄芩作为中药制剂 “双辛鼻鼽散”“鼻渊舒口服液”“鼻渊通窍颗粒”和汤剂“白果黄芩汤”中有效抗炎成分,分别用于治疗AR、CRS和哮喘等呼吸道黏膜慢性炎症性疾病。笔者对黄芩苷在呼吸道黏膜慢性炎症性疾病中的抗炎作用及机制的现有研究进行归纳总结如下。
2 黄芩苷在呼吸道黏膜慢性炎症性疾病中的抗炎作用及机制
2.1 调节T辅助细胞1(T help cell 1, Th1)/Th2细胞免疫失衡
Th1/Th2细胞免疫失衡在AR、CRS伴鼻息肉和哮喘的发病机制中具有重要调节作用。Th2细胞相关的细胞因子白细胞介素-4(interleukin-4, IL-4)、IL-5和IL-13有助于嗜酸性粒细胞的募集、促进黏液分泌和气道高反应性,Th1细胞分泌的细胞因子干扰素γ(interferon-γ, IFN-γ)、IL-12等与之拮抗,从而抑制炎症反应[12]。黄丰等[13]在卵清蛋白(ovalbumin, OVA)诱导的小鼠哮喘模型研究中发现黄芩苷对Th1细胞因子IFN-γ及Th2细胞因子IL-4、IL-5有一定的抑制作用,其对Th2细胞因子的抑制作用显著强于Th1细胞因子。Bui等[14]利用OVA诱导哮喘小鼠模型发现黄芩提取物能减少嗜酸性粒细胞的数量,降低血清中总IgE水平以及Th2细胞相关的OVA特异性IgE和免疫球蛋白G1(immunoglobulin G, IgG)水平,显著增加IFN-γ和OVA特异性IgG2a的表达水平,并降低细胞因子TNF-α、IL-1β、IL-4和IL-5的表达水平。黄芩苷还可通过抑制肥大细胞脱颗粒以及组胺释放在OVA诱导的过敏性哮喘小鼠模型中达到积极的抗炎效果[15]。
2.2 调节Th17/调节性T细胞(regulatory T cell, Treg)失衡
Treg和Th17细胞是T淋巴细胞的两个亚群,Treg细胞通过分泌转化生长因子-β1(transforming growth factor beta-1, TGF-β1)和IL-10等细胞因子,促进机体免疫耐受和维持免疫平衡;而Th17细胞通过分泌IL-17发挥促炎作用。Treg细胞和Th17细胞的免疫调节作用完全相反,通过调节抑炎因子与促炎因子之间的平衡来维持机体正常的免疫功能。Treg细胞与Th17细胞的免疫失衡是呼吸道黏膜慢性炎症性疾病的重要机制之一[16-19]。已有研究[20]证实AR患者外周血中Th17/Treg比例失衡,并且AR患者上气道中自噬小体数量增加以及自噬相关蛋白表达增加与气道重塑相关蛋白的变化有关[21]。AR中自噬的激活会促进Th17细胞的增殖,抑制Treg细胞的生长,参与调节AR的发病机制。Li等[22]研究发现黄芩苷可有效抑制OVA诱导的小鼠过敏性鼻炎症状,显著抑制OVA诱导的小鼠鼻黏膜自噬的激活,从而减少鼻腔灌洗液和鼻黏膜炎症细胞的浸润,并改善鼻黏膜厚度和黏液分泌;并且体外实验证实了黄芩苷可抑制自噬相关蛋白的表达,并恢复AR引起的Th17/Treg细胞失衡[22]。
特异性转录因子叉头框蛋白P3(forkhead box P3, FOXP3)、SMAD家族成员3(SMAD family member 3, Smad3)促进Treg细胞的分化与功能,而信号转导及转录激活蛋白3(signal transducer and activator of transcription 3, STAT3)、视黄酸受体相关的孤儿核受体γ(retinoic-acid-receptor-related orphan nuclear receptor γ,RORγt)的表达则抑制Th17细胞的分化和功能。Yang等[23]在OVA诱导的小鼠鼻窦炎模型中研究发现黄芩苷可明显改善鼻窦炎小鼠的鼻部症状,降低血清IgE和组胺的水平,通过逆转FOXP3的下调和RORγt的上调,平衡Treg/Th17细胞比例,继而抑制炎症。在OVA和小剂量的脂多糖(lipopolysaccharide, LPS)联合诱导的哮喘小鼠模型中,黄芩苷通过抑制哮喘小鼠血清中特异性IgE的分泌,抑制支气管肺泡灌洗液(bronchoalveolar avage fluid, BALF)中IL-17A和IL-6的分泌, 促进IL-10的分泌,减轻肺组织炎症情况, 减少黏液分泌;抑制小鼠肺组织中STAT3蛋白的表达, 促进FOXP3蛋白的表达,调节Th17/Treg比例,从而达到抗炎作用[24]。
2.3 抑制核因子κB(nuclear factor κ-light-chain-enhancer of activated B cells, NF-κB)表达
呼吸道黏膜慢性炎症性疾病的发病机制涉及多种炎症细胞、炎症介质。炎症细胞因子表达受转录因子调控,其中 NF-κB是最重要的转录因子[25],当其被激活时,NF-κB转移到细胞核,从而促进细胞因子、趋化因子和黏附分子的转录。在慢性鼻窦炎鼻息肉(CRS with nasal polyps, CRSwNP)患者中,NF-κB信号通路被激活,并且NF-κB的激活与细胞因子IL-6和IL-8的表达正相关[26]。C-C趋化因子受体7(CC-chemokine receptor 7, CCR7)被认为参与幼稚T细胞和树突状细胞(dendritic cell, DC)的淋巴结归巢,并在调节免疫细胞迁移以平衡对病原体的免疫以及维持中枢和外周免疫耐受方面发挥关键作用,趋化因子C-C基序趋化因子配体19(C-C motif chemokine ligand 19, CCL19)和CCL21是CCR7的唯一配体,CCR7的表达受NF-κB调控[27]。研究[28]显示黄芩苷显著抑制NF-κB的激活,使用25 mg/kg的黄芩苷有效抑制OVA致敏小鼠的肺组织中CCR7 基因和蛋白质水平以及NF-κB的p65蛋白表达,且细胞因子IL-6和TNF-α表达也被显著抑制。 Hsieh等[29]发现黄芩苷可通过抑制人肥大细胞中NF-κB的活化和核因子κB的抑制剂α(nuclear factor of κ-light polypeptide gene enhancer in B-cells inhibitor α, IκBα)的磷酸化,从而抑制下游炎症细胞因子的产生。
2.4 其他机制
2型固有淋巴细胞(group 2 innate lymphoid cells, ILC2s)是一种强大的固有免疫细胞,激活时产生IL-4、IL-5和IL-13等细胞因子,促进2型炎症,并可被上皮源性细胞因子IL-25、IL-33和胸腺基质淋巴细胞生成素(thymic stromal lymphopoietin, TSLP)激活[30],IL-33诱导肥大细胞产生IL-13,TSLP强烈增强肥大细胞产生IL-5,IL-25可激活NF-κB并促进ILC2s中2型细胞因子的产生,研究[31]证实ILC2s在CRSwNP组织中升高。Yoshida等[32]研究发现黄芩苷在人支气管上皮细胞中可显著抑制IL-33的表达,从而降低IL-33对肥大细胞的刺激和降低2型细胞因子IL-13的产生。Chen等[33]研究发现黄芩苷可明显减轻OVA诱导的AR大鼠模型中模型组鼻部黏膜的病理改变,同时显著抑制了IgE、组胺、IL-1β、IL-4、IL-6和TNF-a的表达水平。对不同组别的大鼠血浆进行非靶向代谢组学检测,发现黄芩苷可以逆转OVA诱导的AR大鼠中花生四烯酸代谢、柠檬酸循环、组氨酸代谢、亚油酸代谢和其他氨基酸的代谢水平的紊乱。
综上所述,黄芩苷对呼吸道黏膜慢性炎症性疾病抗炎作用研究总结详见图1。
3 展望
以过敏性鼻炎、慢性鼻窦炎和哮喘为主的呼吸道黏膜慢性炎症性疾病严重危害人类健康,且现有的治疗手段不能达到疾病根治的效果。因其致病机制复杂,过敏性鼻炎具有较高的发病率,慢性鼻窦炎伴鼻息肉即使经过规范的手术和药物治疗后仍具有高复发率,而哮喘的治疗大多数也只是起到症状控制的效果,呼吸道黏膜慢性炎症性疾病一直是研究的热点和难点。寻找到可更加有效控制呼吸道黏膜慢性炎症性疾病炎症反应的治疗方法和治疗药物是医生和科研工作者的迫切任务。
黄芩苷作为黄芩提取物中的有效成分之一,在多种疾病模型中展现出良好的抗炎作用,是中药治疗呼吸道黏膜慢性炎症性疾病的优选,如文中所述黄芩苷在慢性鼻窦炎、过敏性鼻炎和哮喘的动物模型中有良好的抗炎作用。现有的关于黄芩苷对呼吸道黏膜慢性炎症性疾病的抗炎作用研究中,黄芩苷可通过多种机制发挥其抗炎作用,但相关研究均属于临床前研究,缺乏临床试验证据,有一定的局限性。
黄芩苷应用于呼吸道黏膜慢性炎症性疾病的临床治疗还需要更加深入详细的研究,例如应多开展随机对照临床试验研究,加强对黄芩苷在此类疾病中的抗炎机制的深入研究,更好的挖掘黄芩苷在预防和治疗呼吸道黏膜慢性炎症性疾病方面的巨大潜力。本综述为黄芩苷应用于呼吸道黏膜慢性炎症性疾病的临床预防和治疗提供了扎实的理论依据。
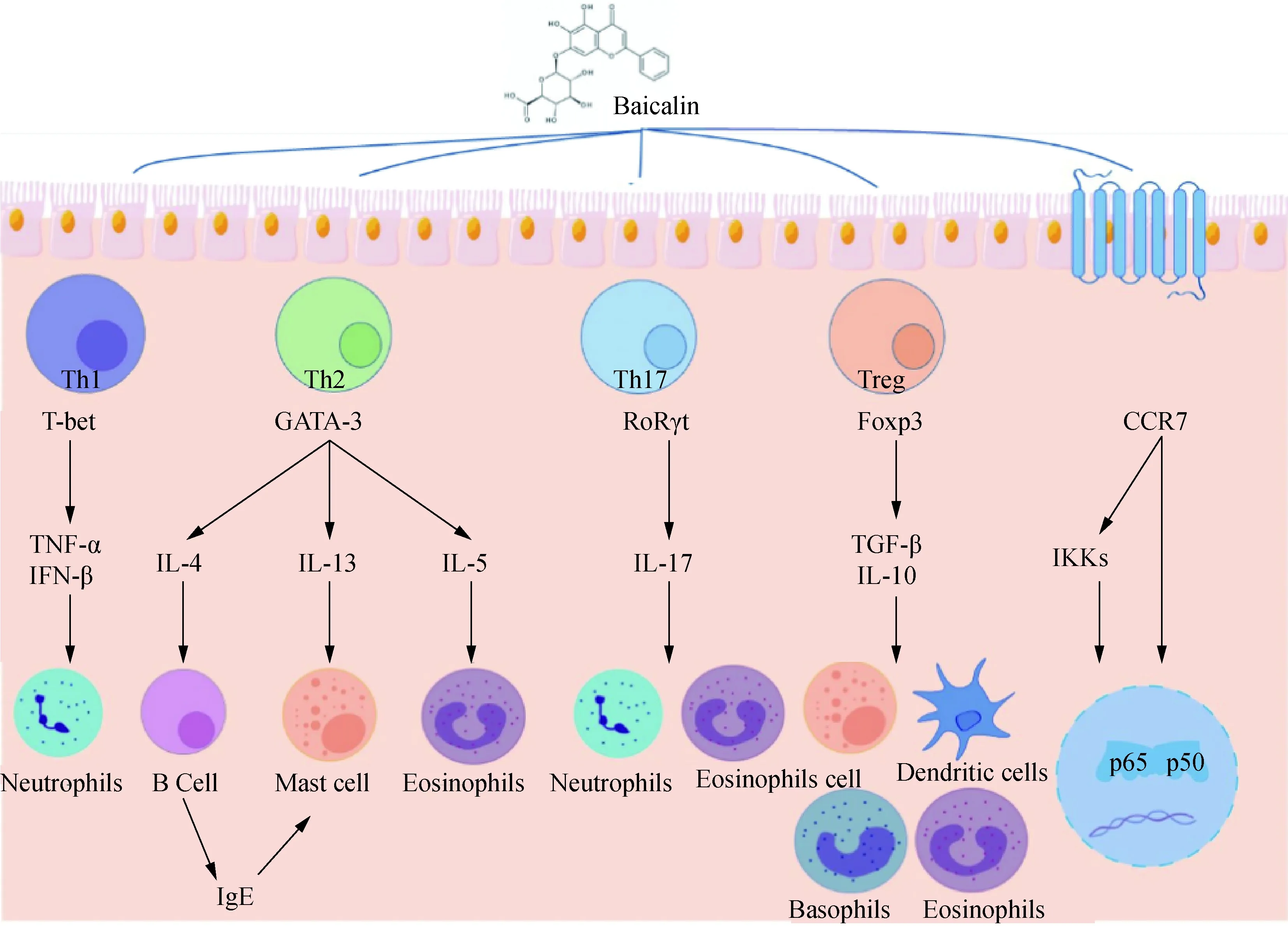
图1 黄芩苷参与调控呼吸道黏膜慢性炎症的机制Fig.1 Mechanism of baicalin involved in regulating chronic inflammation of respiratory mucosa
利益冲突所有作者均声明不存在利益冲突。
作者贡献声明杨婧兴:提出论文思路,撰写论文;蔡超、王向东:审定论文;赵妍:提出论文思路,审定论文;张罗:总体把关,审定论文。
