基于微量热技术合成1D Cu-MOF及对甲基紫染料的吸附
2022-11-29平学豪张皓然解凤霞
平学豪,罗 洋,张皓然,李 威,解凤霞
(1.西安工程大学环境与化学工程学院,陕西 西安 710600;2.中共仪陇县委党校,四川 南充 637600)
金属有机骨架化合物(MOFs)是有机配体与金属离子或者金属氧化物,通过配位共价键自组装形成的具有规整结构的多孔聚合物。改变有机配体的种类以及自组装的环境,可以设计出不同结构的MOFs。近年来,MOFs因其独特的物理化学性质而备受关注。MOFs的晶体密度低,品种多,配位不饱和度高,比表面积大,这些优点使得它们在气体吸附分离[1-2]、催化性能[3]、电磁材料[4]、有机染料吸附[5-6]等方面具有很大的应用潜力。MOFs的制备方法主要有溶剂挥发法、分层扩散法、模板法等[7],这些方法虽然能获得高质量的晶体,但存在合成周期长的缺点。水热/溶剂热法是近年来合成MOFs使用最多的技术之一,通过改变溶剂、温度、pH、反应时间等,来构筑各种尺寸、形状和形态的MOFs。所制备的MOFs是在精确控制下创建的,还可以使用溶剂清洗和真空干燥的方法,将溶剂从制备的MOF材料的孔隙中除去,这是水热/溶剂热法的显著优点[8]。但是水热/溶剂热法是在高温高压的密闭环境中进行,反应是否进行以及反应进行的程度无法在线监测。
本文使用F/μSc-1A型微反应量热仪,在线监测反应过程中的反应热随时间的变化情况,根据多种条件下反应体系的量热图谱,指导目标MOF的合成。通过改变反应物浓度、溶剂、溶液pH值以及原料配比等条件,获得反应过程的量热曲线,再根据量热曲线来准确判断,在确定的条件下反应能否进行,以及反应的时间和精确的温度范围等,从而避免了水热/溶剂热法的盲目性,提高了反应的准确性和效率。以微量热技术为指导,采用水热/溶剂热法合成了一个未见文献报道的[Cu3(Br-bdc)2(Br-Hbdc)2(Phen)2]n金属有机骨架化合物,并对其结构进行了分析,研究了该骨架化合物对甲基紫的吸附功能。
1 实验部分
1.1 仪器和药品
实验所用试剂均为市售,分析纯,使用前未进一步纯化。微反应量热仪在使用前用标准萘试剂校正。
F/μSc-1A微量热仪,UV-2450紫外分光光度计,SMART APEX CCD X射线单晶衍射仪,Nicolet Impact 410红外光谱仪,TGA/S DTA851e型热重同步热分析仪,KQ-250DA型超声波清洗器,101-0型电热鼓风干燥箱。
1.2 微量热实验
称 取0.5mmol(124.8mg)硫 酸 铜、0.5mmol(98.8mg)1,10-邻啡罗啉和0.5mmol(122.7mg)5-溴间苯二甲酸于50mL烧杯中,加入10 mL的H2O,在超声波震荡仪中震荡30min,待溶质充分分散后,用吡啶调节溶液pH=6.0~7.0。取500 μL上述混合液于微反应量热仪的反应池中,同时取500μL蒸馏水于参比池中,进行微量热实验。设置升温程序,以1.0℃·min-1由20℃升温至180℃,再以1.0℃·min-1由180℃降温至20℃。
1.3 在微量热实验指导下配合物的制备
参考1.2的微量热实验反应体系的组成,将pH=6.0~7.0的混合液转移至25mL内衬为聚四氟乙烯的不锈钢反应釜内,温度设置为154℃,反应时间72h,以10℃·min-1冷却至室温,得到蓝色的Cu-MOF晶体,产率32%。元素分析实验值(理论值):C 44.20%(44.21%),H 2.13%(2.15%),N 2.86%(2.87%)。IR(KBr,cm-1):3067,2584,1711,1606,1566,1434,1363,1256,1152,1104,726,688。
1.4 吸附实验
以Cu-MOF为吸附剂,对甲基紫染料进行吸附。采用紫外分光光度计对染料溶液的吸光度进行测定。由于吸光度与浓度成正比,因此可利用吸光度求得浓度,通过浓度的变化求得吸附量。探讨了染料的初始浓度、温度、pH值、离子强度等对吸附性能的影响,根据吸附时间与吸附量的关系做吸附平衡曲线,判断其吸附类型和吸附动力学模型。
2 结果与讨论
2.1 Cu-MOF的微量热曲线
微量热曲线如图1所示。升温过程中,反应体系在102℃以前没有出现量热峰,表明此时体系没有发生任何物理和化学变化;135~166℃之间有一个大的吸热峰,峰值为154℃,根据曲线积分法求得该过程的热量变化为307.14J·g-1,分析该峰为硫酸铜和1,10-邻啡罗啉、5-溴间苯二甲酸反应形成Cu-MOF的过程。该结论在后期用水热法合成Cu-MOF时,在设定温度154℃下得到蓝色粉末的配合物而得到验证。降温过程中,体系在130~80℃范围内有连续2个放热峰,最大峰值温度90℃,对应于Cu-MOF单晶的析出过程。为验证该峰为晶体析出峰而非配合物生成峰,将形成该MOF的反应体系于90℃烘箱中加热72h后,并没有得到预期的Cu-MOF产物,从而确定该峰是154℃生成的Cu-MOF配合物在降温过程中单晶析出的放热峰,同时得到结晶过程的结晶热为299.60 J·g-1。
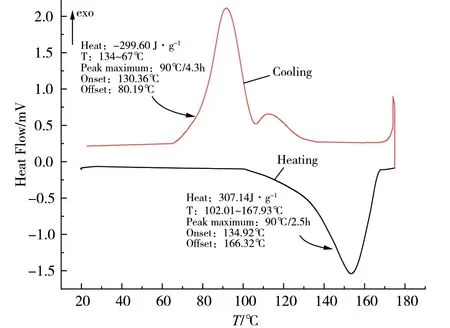
图1 20~180℃下Cu-MOF的微量热曲线
2.2 Cu-MOF的晶体结构及结构解析
挑出大小为0.37mm×0.30mm×0.24mm的Cu-MOF单晶,使用Bruker SMART APEX CCD单晶衍射仪,在296(2)K时,使用经石墨单色化的MoKα射线(λ=0.071073nm),在1.68°≤θ≤28.37°范围内,收集到衍射点9675个,其中独立衍射点6434个。晶体结构的解析和精修则通过SHELXL-97软件程序来完成。Cu-MOF单晶的主要晶体学数据见表1,主要键长、键角见表2、表3。
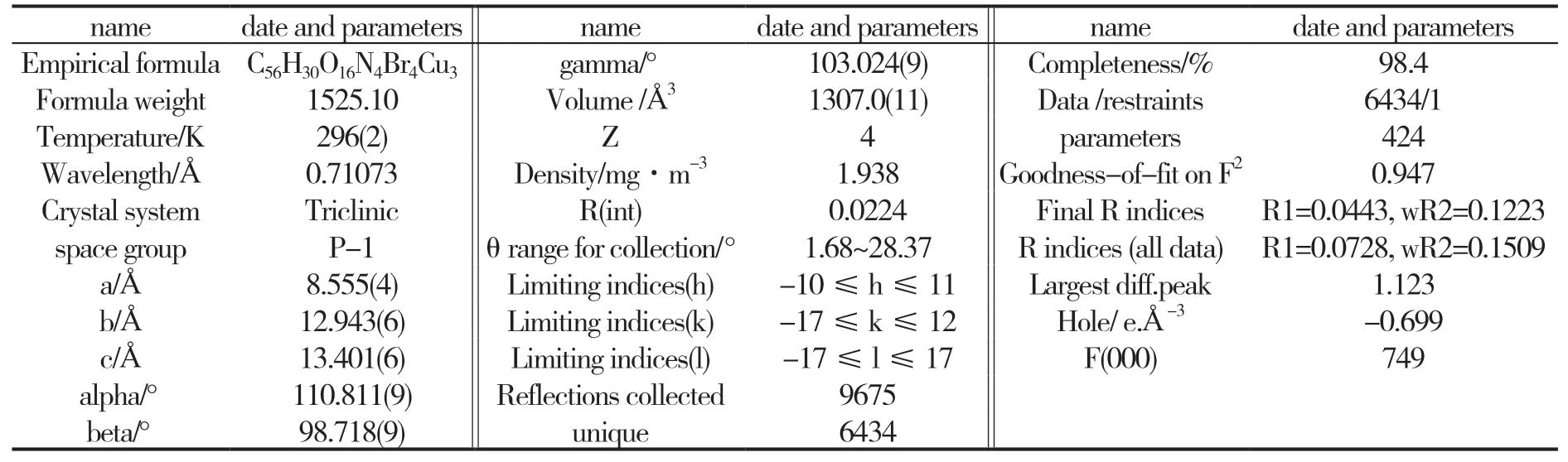
表1 Cu-MOF的晶体学数据
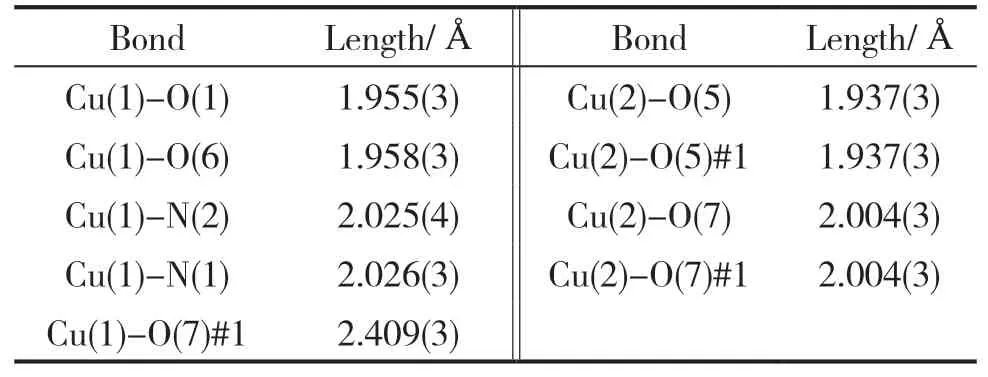
表2 Cu-MOF的主要键长

表3 Cu-MOF的主要键长
2.2.1 Cu-MOF的晶体结构
X射线单晶衍射仪的分析结果显示,Cu-MOF属三斜晶系,空间群为P-1。晶胞参数为:a=8.555Å,b=12.943(6)Å,c=13.401(6)Å;α=110.811(9)°,β=98.718(9)°,γ=103.024(9)°,晶胞体积为1307.0(11) Å3,一个晶胞中含有4个最小不对称单元。最小不对称单元见图2,最小不对称单元中包含3个Cu2+离子,4个5-溴间苯二甲酸分子和2个邻菲罗啉分子,其中2个5-溴间苯二甲酸分子中有1个羧基中的H离子未脱掉,导致其羧基中的氧原子没有参与配位。Cu1和Cu3为等效原子,配位环境为五配位的变形四棱锥构型,Cu3是Cu1经过坐标轴(-x+1,-y+2,-z)平移而得到。Cu2为四配位正方形配位构型(图3),配位原子为6个氧原子和2个氮原子。6个氧原子与Cu2+离子均为单齿桥联,2个氮原子与Cu2+离子双齿螯合配位。相邻的2个Cu2+离子通过5-溴间苯二甲酸连接成图4的“8”字状微孔一维链状结构,分子间的氢键将相邻的链结构链接为三维网状结构。
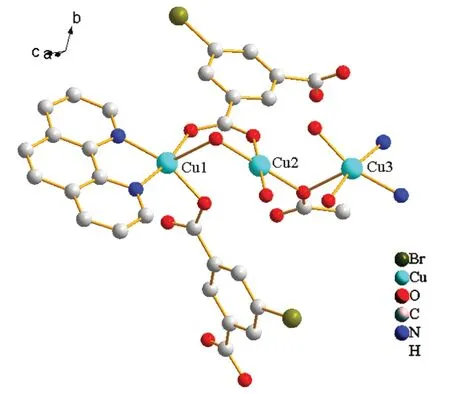
图2 Cu-MOF的最小不对称单元
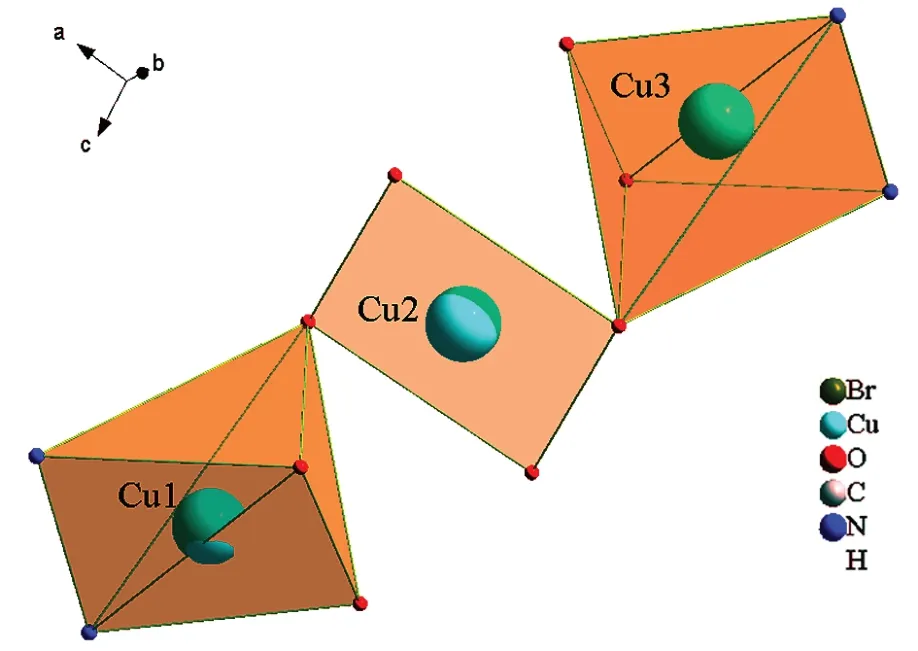
图3 Cu-MOF的配位环境图及中心原子Cu的连接方式
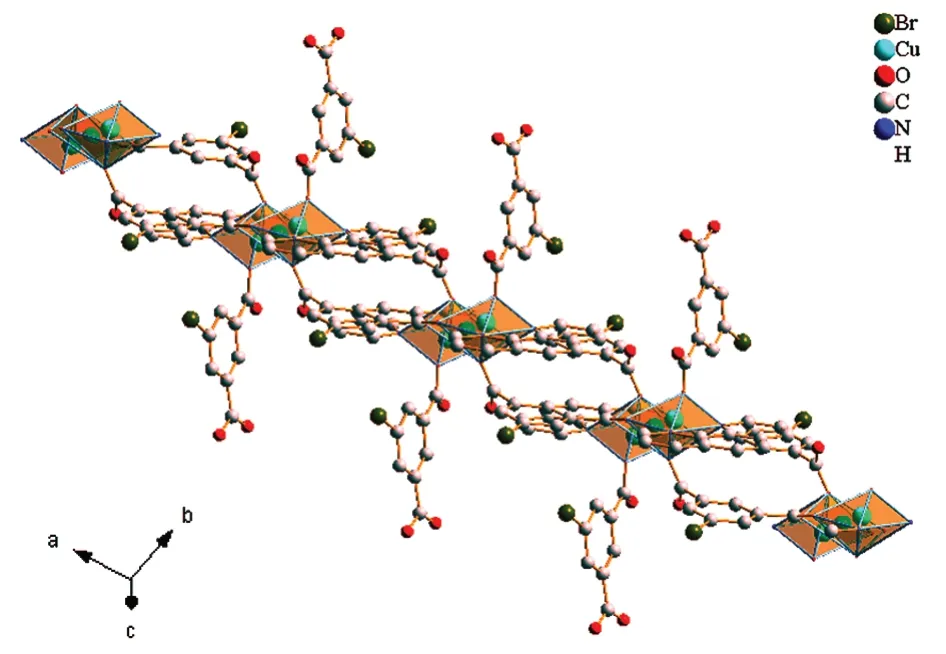
图4 Cu-MOF的一维链状图
2.2.2 Cu-MOF的热重分析结果
称取5mg Cu-MOF配合物,在高纯氮气保护下,以10℃·min-1的升温速率,在25~800℃温度范围内,检测Cu-MOF的质量随温度变化的TG曲线,结果见图5。Cu-MOF的第一次失重发生在100~130℃之间,失重率为1.72%,根据失重率推测应为少量游离水的挥发过程;200℃后,MOF骨架开始逐渐坍塌,800℃后分解过程基本完成,分解产物占总重量的35.33%,最终分解产物为CuO。热重分析结果表明,该MOF在200℃前的热稳定性较好。
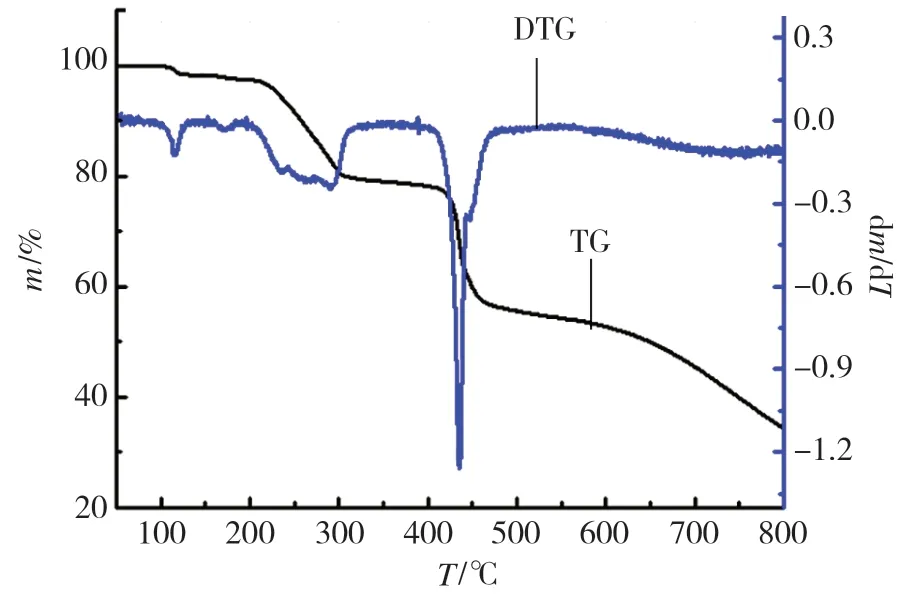
图5 Cu-MOF的TG-DTG曲线
2.3 吸附性能
在过去10年中MOFs得到了广泛的研究。它们超大的比表面积、高的孔隙率、优异的热稳定性和和快速的动力学反应等特性,使其成为极具吸引力的吸附剂材料。本文对Cu-MOF吸附甲基紫的性能进行探究。过量的甲基紫对人类和生态系统有危害,属中等毒类,在580nm附近具有特征吸收峰。将Cu-MOF与新配制的染料溶液一起置于烧杯中,室温下搅拌反应。在不同的时间间隔,收集不同的染料样品,离心分离,测其吸光度。图6的吸光度曲线中,甲基紫的特征峰随吸附时间的增加而明显下降,反应100min时,吸附率达到90%,证实了Cu-MOF对甲基紫染料有很好的吸附效果。
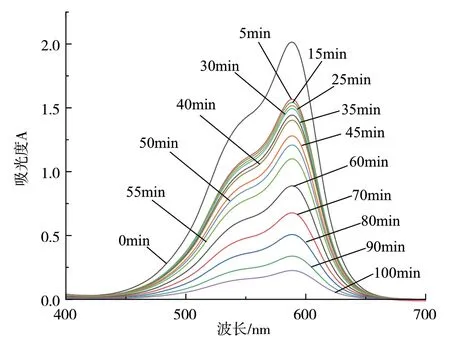
图6 Cu-MOF吸附甲基紫的吸光度随时间的变化曲线
2.3.1 吸附性能的影响因素
采用单因素实验,分别研究了甲基紫的初始浓度、温度、pH、离子强度对吸附效果的影响,结果见图7。
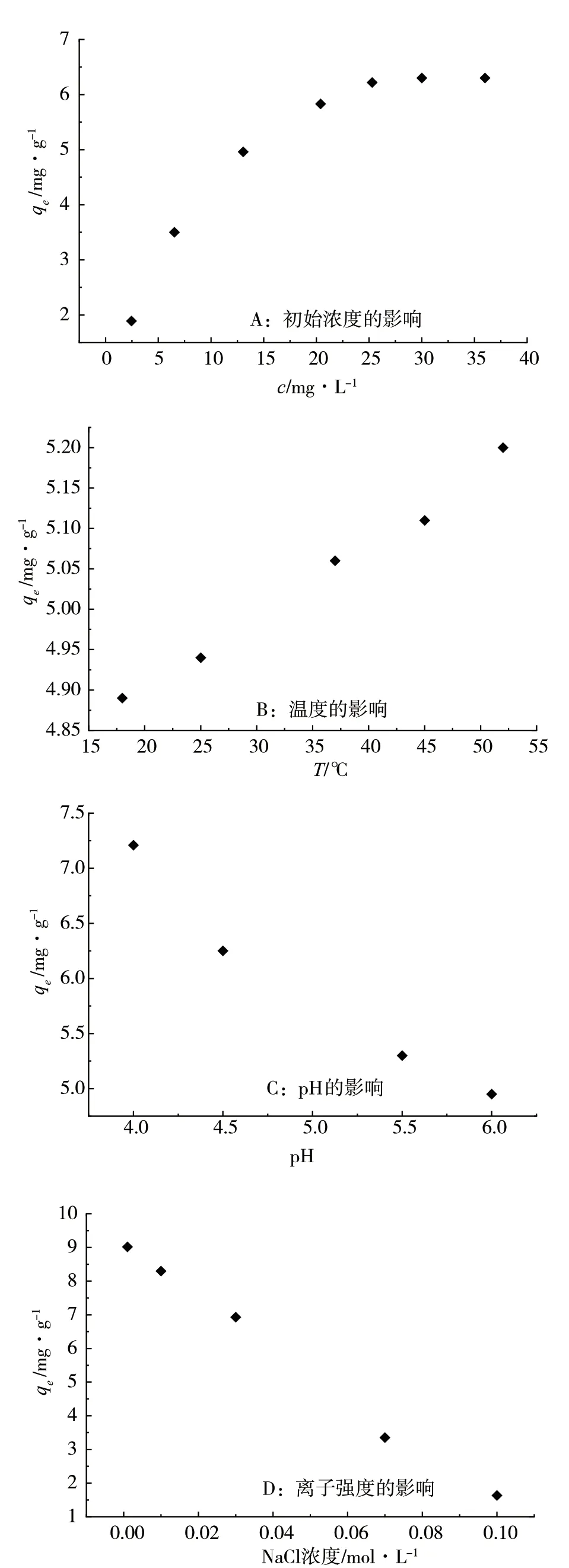
图7 吸附性能的影响因素
1)在5mL、质量浓度为2.5 ~25.30 mg·L-1的甲基紫溶液中,加入质量为1.4~1.6g的Cu-MOF吸附剂,温度25℃,考察甲基紫的初始质量浓度对吸附效果的影响,吸附曲线见图7(A)。Cu-MOF对甲基紫溶液的吸附量随着染料浓度的增大而增大,甲基紫浓度为25.3 mg·L-1时,吸附剂对甲基紫的吸附量达到最大6.30mg·g-1。
2)将5mL、浓度为13.06 mg·L-1的甲基紫溶液,分别恒温于18℃、25℃、37℃、45℃、52℃,加入1.6~2.0g的Cu-MOF吸附剂,反应2h,确认吸附达到平衡后,通过吸光度的变化计算吸附剂的吸附量,实验结果见图7(B)。随着温度的升高,Cu-MOF对甲基紫的吸附量增加,在18~52℃范围内,随着温度升高,甲基紫的分子运动更加剧烈,吸附平衡朝着吸热方向移动,使得吸附量增加。
3)甲基紫溶液遇酸呈黄绿色,遇碱析出褐紫色沉淀,其溶液在pH为4~6时无明显颜色变化,因此考察了吸附体系pH为4~6时,对吸附效果的影响,结果见图7(C)。结果表明,随着pH增加,Cu-MOF的吸附量减小。
4)在浓度为13.06 mg·L-1的甲基紫溶液中,分别加入不同浓度的(0.001~0.1mol·L-1)NaCl溶液,考察离子强度对吸附效果的影响。图7(D)显示,随着离子强度增加,Cu-MOF的吸附量减小。甲基紫属于阳离子碱性染料,加入电解质离子后,电解质离子与甲基紫之间形成了离子对,导致甲基紫的有效浓度降低,使得其在Cu-MOF上的吸附量减小,这与文献报道的离子强度对吸附体系的影响一致[9]。
2.3.2 吸附等温线和吸附动力学[10-11]
参照文献[9-10],采用Langmuir模型和Freundlich模型,对吸附等温线数据进行拟合分析,以确定Cu-MOF与甲基紫之间的关系。采用准一级动力学模型和准二级动力学模型,探究Cu-MOF对甲基紫染料的吸附机理。拟合曲线见图8,Cu-MOF吸附甲基紫溶液时,Freundlich的吸附相关系数为0.9927,大于Langmuir的吸附相关系数0.9665,因此Cu-MOF对甲基紫的吸附更符合Freundlich模型,属于物理吸附。计算得到Freundlich方程中的吸附常数n=2.10,k=1.45。同理,Cu-MOF吸附甲基紫的准二级动力学模型的相关系数为0.9989,大于准一级动力学模型的0.9481,因此Cu-MOF对甲基紫的吸附可以用准二级动力学来描述,准二级动力学的速率常数k2=0.12g·mg-1·min-1。
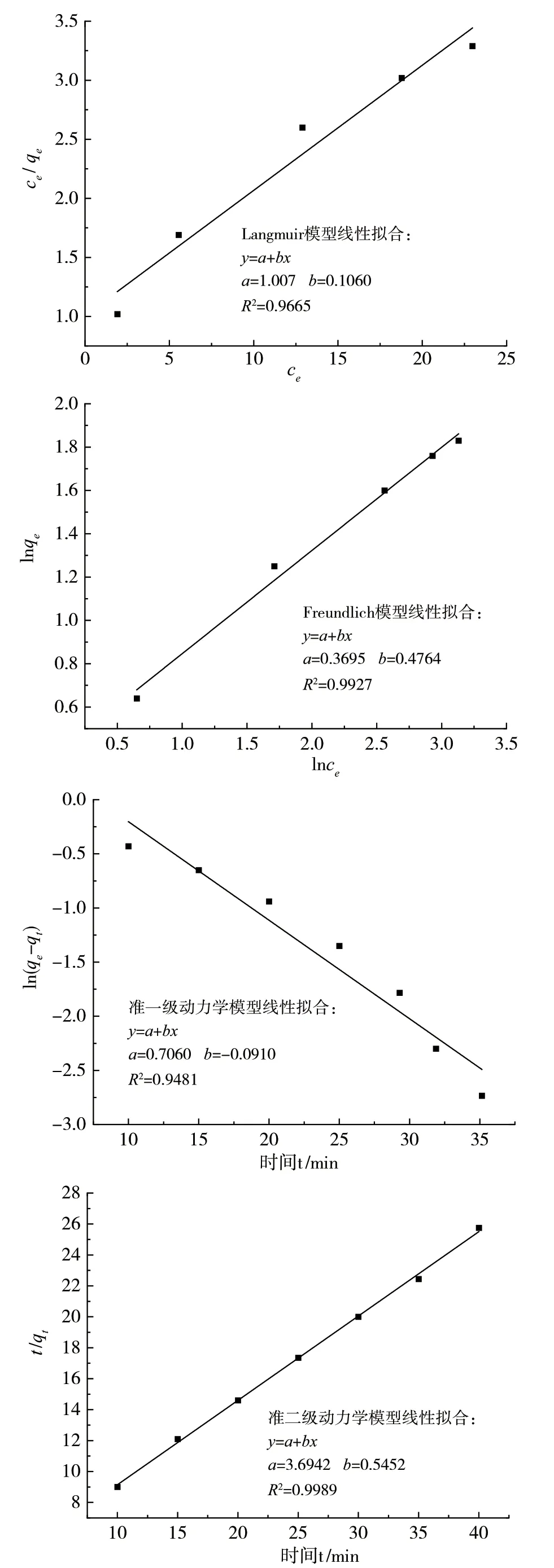
图8 吸附模型和吸附动力学拟合曲线
3 结论
以微量热技术为指导,合成了一种未见文献报道的Cu-MOF微孔材料。该微孔材料对甲基紫溶液表现出良好的吸附作用,100min内可达到90%的吸附量,是一种潜在的热稳定性较好的吸附剂材料。
1)合成Cu-MOF单晶的最佳条件:0.5mmol硫酸铜、0.5mmol邻菲罗啉、0.5mmol间苯二甲酸、10mL水、pH=6.0~7.0、温度154℃。
2)Cu-MOF为“8”字状微孔一维链结构,链与链之间通过氢键连接成三维网状结构。
3)Cu-MOF的元素分析与红外光谱的实验结果,与X单晶衍射结果一致。
4)热重结果表明,温度低于200℃时,Cu-MOF的结构稳定。
5)Cu-MOF对甲基紫的吸附效果较为理想,且随着甲基紫初始浓度的增加、温度的升高、离子强度的减小,Cu-MOF的吸附量增加,在pH=4~6范围内,随pH的增加,吸附量呈减小的趋势。
6)Cu-MOF吸附甲基紫溶液,符合Freundlich吸附模型,属于准二级动力学模型。
